艾迪注射液治疗晚期恶性肿瘤的临床疗效分析与前瞻性研究
赵景娟荣 阳
(1 辽宁省辽阳市中心医院肿瘤科,辽宁 辽阳 111000;2 辽宁省辽阳市中心医院放射科,辽宁 辽阳 111000)
艾迪注射液治疗晚期恶性肿瘤的临床疗效分析与前瞻性研究
赵景娟1荣 阳2
(1 辽宁省辽阳市中心医院肿瘤科,辽宁 辽阳 111000;2 辽宁省辽阳市中心医院放射科,辽宁 辽阳 111000)
目的研究分析艾迪注射液提高晚期恶性晚期肿瘤患者生存质量的作用与临床意义。方法将276例入选患者随机分为治疗组和对照组,对照组给予对症支持治疗,治疗组加用艾迪注射液80~100 mL,静脉滴注,qd×30 d。观察两组治疗的近期疗效,治疗前后的生存质量karnofsky评分、体质量、疼痛缓解率、免疫功能变化及不良反应。结果治疗组的近期疗效比对照组有所提高,可两组差异无显著性。治疗前后患者的生存质量karnofsky评分、体质量、疼痛缓解率、免疫功能变化方面,治疗组明显高于对照组,有着显著性差异(P<0.01)。结论艾迪注射液具有抑制肿瘤生长,提高生存质量及机体免疫功能,延长生存期作用。
艾迪注射液;肿瘤;生存质量;疗效分析
晚期恶性肿瘤患者常会出现食欲不振,进食减少和体质量下降,并多伴有疼痛,据WHO统计,大约有50%的癌症患者伴有疼痛,60%~90%的晚期癌症患者有不同程度的疼痛,其中70%以疼痛为主要症状,这些都导致了生存质量的下降[1]。本院于2012年3月至2015年12月应用艾迪注射液治疗晚期癌症患者,经三年多的临床前瞻性研究,取得一定的临床疗效,报道如下。
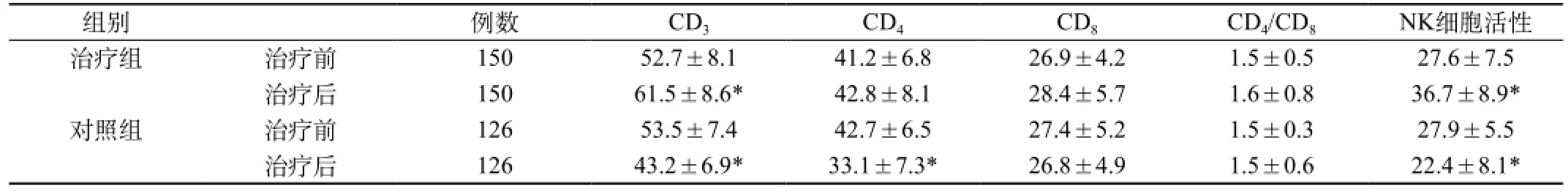
表2 两组患者治疗前后T细胞亚群及NK细胞活性测定变化
1 资料与方法
1.1 一般资料:治疗组150例,男94例,女56例。年龄25~80岁,平均年龄57.2岁。本组中肺癌36例,乳腺癌26例,肝癌20例,鼻咽癌16例,大肠癌16例,恶性淋巴瘤10例,胃癌8例,脑瘤6例,其他12例。伴癌痛90例,轻度疼痛20例,中度疼痛44例,重度疼痛26例。对照组126例,男88例,女38例。年龄26~79岁,平均年龄55.9岁。本组中肺癌24例,乳腺癌20例,肝癌18例,鼻咽癌18例,大肠癌14例,恶性淋巴瘤10例,胃癌8例,脑瘤6例,其他8例。伴癌痛84例,轻度疼痛24例,中度疼痛38例,重度疼痛22例。将本组276例晚期癌症患者随机分为两组,对照组126例,本组病例在治疗上常规对症、支持治疗,未加用增强免疫力药物。治疗组150例,在上述的基础上加用艾迪注射液。
1.2 方法:治疗组加用由贵州益佰有限公司研制生产的艾迪注射液进行治疗,80~100亳升/次加入0.9%氯化钠注射液或10%葡萄糖注射液400~500 mL中静脉滴注,1次/天,连续30 d为1个疗程。
1.3 病例入选标准:①按《中国常见恶性肿瘤诊治规范》的标准[2],本组所有病例均有病理学或细胞学确诊并有影像学证实的晚期癌症患者;②神志清楚,有客观病变可做体检或影像学疗效评价;③生存质量karnofsky评分[3]>30分,预计可生存3个月以上;④停用放化疗或其他治疗1个月以上,治疗前心、肝、肺、肾等重要器官功能正常;⑤如有疼痛与肿瘤有关,并按照WHO数字疼痛分级法(NRS)[4]评估疼痛程度。
1.4 疗效观察及评价指标:①近期疗效:根据UICC制定的实体瘤客观疗效评定标准,肿瘤原发灶及转移灶的发展情况的疗效进行评价,完全缓解(CR),部分缓解(PR),稳定(SD),进展(PD),CR+PR为有效。②体质量和生存质量karnofsky评分:体质量增加1 kg为增加,下降1 kg为下降,增加或下降<1 kg为稳定;卡氏评分增加≥10分为升高(CR),减少≥10分者为下降(NR),增加或减少<10分者为稳定(PR)。③癌症疼痛缓解程度:按照WHO数字疼痛分级法(NRS)评估疼痛程度。④免疫功能指标变化。⑤不良反应。
1.5 统计学处理:应用SPSS10.0统计软件,计量资料采用t检验,计数资料χ2检验。
2 结 果
2.1 近期疗效:对治疗前后两组患者进行影像学检查,显示治疗组中(CR+PR)54例(36.0%),对照组中(CR+PR)30例(23.8%),两组结果进行统计学χ2检验,P>0.05,无显著性差异,见表1。
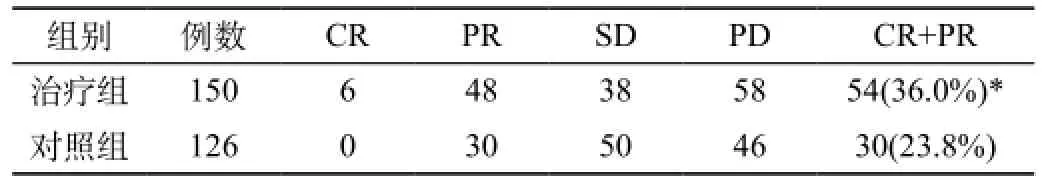
表1 两组患者近期疗效比较
2.2 治疗前后体质量和生存质量状况:治疗前后比较两组患者体质量,治疗组中增加50例,下降26例,稳定74例;对照组增加8例,下降104例,稳定14例,两组间差异有显著性(P<0.01)。生存质量karnofsky评分比较,治疗组升高54例,稳定70例,下降26例;对照组升高10例,稳定36例,下降80例,两组间差异有明显显著性(P<0.01),显示艾迪注射液能明显提高患者的生存质量。
2.3 癌症疼痛缓解程度:治疗组疼痛缓解22例,部分缓解50例,无缓解18例,缓解率为80%;对照组疼痛缓解4例,部分缓解26例,无缓解54例,缓解率为35.7%;两组间疼痛缓解率差异有显著性(P<0.01)。
2.4 免疫功能指标变化:比较两组的T细胞亚群、NK细胞活性检测变化,见表2。治疗组在治疗前后比较,CD3值、NK细胞活性均升高(P<0.05),而CD4、CD8及CD4/CD8比值差异无显著性(P>0.05)。对照组治疗前后比较,CD3、CD4、NK细胞活性值均较治疗前下降,差异有显著性(P<0.05),余数值治疗前后差异无显著性。
2.5 不良反应:治疗组中150例患者治疗前后心、肝、肾等主要器官无改变,仅有4例有一过性面潮红、低热过敏反应,经对症治疗后能继续按计划治疗。
3 讨 论
艾迪注射液为从人参、黄芪、刺五加、斑蝥等中药中应用现代科学方法精制提取的一种双相广谱抗癌药物。本临床研究发现治疗组及对照组的近期疗效无明显差异(P<0.05),但治疗组的有效率为36.0%,高于对照组23.8%。在karnofsky评分、疼痛缓解率及体质量增加程度方面,治疗组都明显高于对照组,两组资料相比有高度显著性差异(P<0.01)。两组患者T细胞亚群、NK细胞活性检测结果,治疗组提高优于对照组,差异有显著性(P<0.05)。证明艾迪注射液在提高晚期癌症患者生存质量及细胞免疫功能方面有显著疗效,并能抑制肿瘤的生长,提高近期疗效而提高生存期[5-6]。在本研究的临床观察表明艾迪注射液对心、肝、肾功能无影响,除4例有轻度的过敏反应外,余无严重的不良反应。同时艾迪注射液在放、化疗抗肿瘤治疗中有协同作用,并取得一定临床疗效。
综上所述,艾迪注射液具清热解毒,消瘀散结功能,可控制肿瘤生长,抑制转移,提高免疫功能,进而提高晚期肿瘤患者的生存质量,延长生存期的作用,值得在临床上推广应用。
[1]龙官保,江山,苏宁.艾迪治疗晚期恶性肿瘤的疗效分析与临床研究[J].中华肿瘤杂志,2015,37(2):93-96.
[2]中华人民共和国卫生部医政司编.中国常见恶性肿瘤诊断规范[M].北京:北京医科大学联合出版社,2007:2-7.
[3]孙燕,周际昌.临床肿瘤内科手册[M].北京:人民卫生出版社,2008: 24-25.
[4]王庭富,孟正木.人参皂甙Rg3对免疫功能的影响[J].中国药科大学学报,2015,55(2):133-135.
[5]王润田,单保恩,李巧霞,等.黄芪提取物免疫调节活性的体外实验研究[J].中国中医西结合杂志,2012,12(6):453-455.
[6]曹强,荣阳,荣根满.肝癌介入性化疗栓塞术后严重并发症分析研究[J].中国当代医药,2012,19(3):109-112.
R73
B
1671-8194(2017)04-0169-02

