污水中氯苯类化合物降解菌的筛选及降解特性的研究
刘建强+王银+韦秀秀+李琦+黄大林


摘要:采用传统的方法进行分离、纯化、筛选、检测,得到氯苯类化合物的降解菌,对其降解率进行研究,并通过16S rRNA进行分离鉴定。结果表明,共筛选出4株具有降解活性的菌株,在18 ℃、pH 7.2时降解率较高。初步鉴定4株菌株分别为巨大芽孢杆菌(Bacillus megaterium)、枯草芽孢杆菌(B. subtilis)、炭疽杆菌(B. anthraci)、同温层芽孢杆菌(B. stratosphericus)。
关键词:细菌;降解菌;降解率;氯苯类化合物
中图分类号:X703;Q814 文献标识码:A 文章编号:0439-8114(2017)02-0245-03
DOI:10.14088/j.cnki.issn0439-8114.2017.02.011
随着农业科技的发展,出于对防治农业害虫的需要,农药的使用也愈加普遍,有机氯农药使用量也更大,其主要成分为氯苯类化合物,一些染料厂、制药厂排放的污水中也含有氯苯类化合物。氯苯类化合物的残渣随着水土流失汇入河流湖泊,污染水源,由于它们中的大多数具有“三致”效应和难降解性,危害环境,更危害人类健康,因此被美国环保局(EPA)列为优先控制的污染物[1]。
氯苯类化合物化学性质较为稳定,在环境中普遍存在。目前针对污水中残存的氯苯类化合物,一些地区仍采用比较传统的方法处理污水,以及近年来采用氧化法、生物法以及活性污泥法等[2],不仅成本高,而且处理流程繁琐。本研究采用微生物降解氯苯类化合物的方法,将会为氯苯类化合物的高效处理提供理论基础,现将报告如下。
1 材料与方法
1.1 材料
1.1.1 供试水样 分别从桂林市制药厂、染料厂、漓江、桃花江等水域采集水样,采集样品的深度为15~20 cm,样品间相距至少2 cm。
1.1.2 试剂与仪器 主要试剂有邻二氯苯、间二氯苯、石油醚等,均为分析纯,通用引物和PCR试剂盒由上海生工公司提供。主要仪器有干热灭菌器和高压灭菌器(上海申安医疗器械厂)、5424R低温高速离心机和TG-20高速离心机(武汉中科科仪技术发展有限公司)、漩涡振荡器(上海振荣科学有限公司)、OLYMPUS生物显微镜BX41-32FL和T100 PCR仪(Bio-Rad公司)、凝胶成像仪(上海培清科技有限公司)、旋转式摇床ZHWY-211C(上海智诚分析仪器制造有限公司)。
1.1.3 培养基 无机液体培养基:KNO3 0.1 g、微量元素液(KH2PO4 0.300 g、MgSO4·7H2O 0.300 g、FeSO4·7H2O 0.005 g、CaCl2 0.050 g溶于100 mL去离子水中)10 mL,加去离子水90 mL,pH 7.0~7.4,于121.3 ℃灭菌15 min。
有机液体培养基:牛肉膏5 g、蛋白胨10 g、NaCl 5 g、去离子水1 000 mL,pH 7.2~7.4,于121.3 ℃灭菌15 min。
有机固体斜面培养基:在液体培养基中,加入琼脂粉33 g/L,配制相应的有机固体培养基,制成试管斜面。
1.2 方法
1.2.1 菌株筛选 ①初筛:用移液管移取1 mL水样加入到盛有9 mL的无机液体培养基的试管中,同时加入邻二氯苯、间二氯苯各6 μL,于25 ℃、160 r/min的摇床里培养48 h。②复筛:48 h后将基础元素培养液移接到固体培养基中,恒温箱37 ℃培养24~48 h直至长出多个菌落,观察细菌长势。
1.2.2 分离纯化 ①在上述固体培养基中,挑选出不同菌落并作好标记。②将含单个菌落的平板中的菌落接种到固体培养基中,培养24~48 h,观察细菌生长情况,以此方法直至培养得到单个菌落的平板。将单个菌落的平板中一个菌落接种到固体斜面培养基上保存。③从斜面取菌接种到含有邻二氯苯和间二氯苯各10 μL,浓度为20 μL/10 mL的无机液体培养基中,于25 ℃、160 r/min的摇床里培养48 h。
1.2.3 降解率的测定 ①制备菌悬液挑取一环菌株,接种于含有12 μL/10 mL氯苯(邻二氯苯、间二氯苯各6 μL)有机液体培养基中,于25 ℃、160 r/min的摇床里培养24 h,3 500 r/min离心5 min,用无机液体培养基洗涤菌体3次,取部分菌体悬浮于无机液体养基中,配制一定浓度的菌悬液,备用。②从上述菌悬液中吸取1 mL接种在含氯苯化合物的无机液体培养基中,25 ℃分别培养24(第一次)、48、72 h(第二次)后分别用石油醚萃取,用紫外分光光度计(UV)(λ=221 nm)检测上清液中氯苯的含量。对照组为不含菌株含氯苯化合物的同样的无机液体培养基,采用与处理相同的方法检测上清液中氯苯的含量(用吸光度表示)。降解率=(测定值-初始值)/初始值。筛选出具有降解活性的4株菌株,分别命名为GY1、GY2、GY3、GY4。
1.2.4 总DNA的提取 將5 μL的DNA提取液(5% Chelex 100 Resin)加入到1.5 mL的EP管中,从平板上取米粒大小的细菌菌落加入到EP管中,在100 ℃沸水浴中煮沸15 min。将煮沸后的EP管 12 000 r/min离心1 min,吸取上清液即得到菌株总DNA,作为PCR的模板。
1.2.5 PCR扩增 通用引物采用16S rRNA,PCR扩增:正向引物Pf:5′-AGAGTTTGATCCTGGCTCAG-3′,反向引物Pr:5′-AAGGAGGTGATCCAGCCGCA-3′[3]。PCR反应体系(50 μL)为:Taq SuperMix 25 μL,27F引物和1492R引物各2 μL,DNA模板(10~100 ng) 2 μL,去离子水19 μL。PCR反应条件:95 ℃预变性5 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸 2 min,共35个循环;72 ℃延伸10 min,4 ℃保存。
1.2.6 PCR产物电泳及测序 经PCR产物1%琼脂糖凝胶电泳、凝胶成像仪成像观察后,将PCR产物送往上海英俊生物技术有限公司进行检测。
1.2.7 序列分析和系统发育树的构建 根据测序结果,利用Blast软件对GenBank、EMBL等数据库中相似目的菌的16S rRNA序列进行搜索排序,使用ClustalW软件对2种菌株的16S rRNA进行序列比对,利用MEGA 6.2软件,采用邻接法(Neighbour-joining)进行系统发育树的构建及同源性比较。
2 结果与分析
2.1 降解率
分别于24、48、72 h测定菌株GY1、GY2、GY3、GY4残留氯苯的吸光度,结果见表4。由表4可知,第一次为培养24 h氯苯残留物的吸光度平均值,第二次为培养72 h氯苯残留物的吸光度平均值,表明随着培养时间的延长,菌株的吸光度明显降低。对比发现4株目的菌株间降解率相差不大,均超过60%,明显高于对照组。
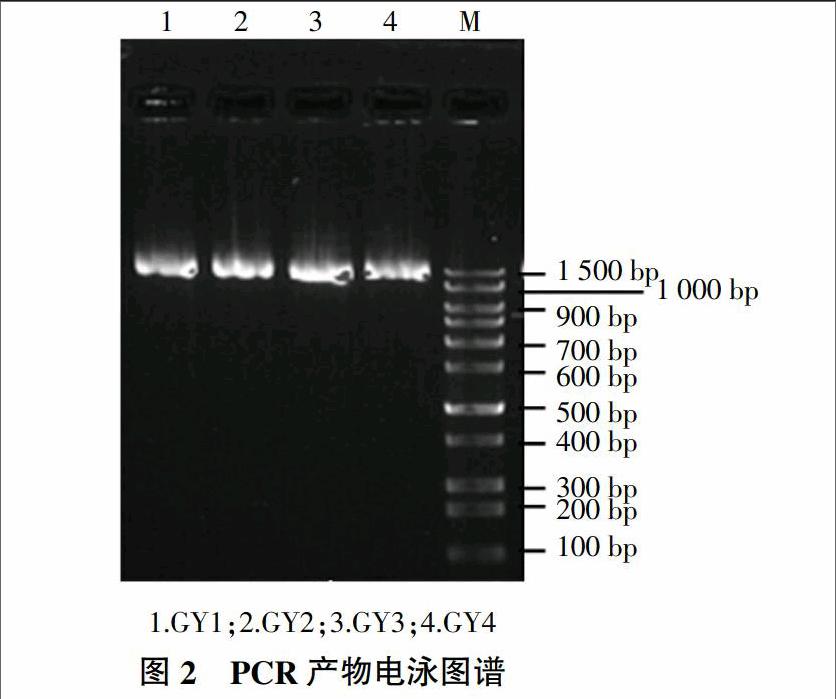
2.2 PCR产物
以16S rRNA为参比模板(M),对4株目的菌株进行电泳分析。结果(图2)表明,4株菌DNA都在1 500 bp左右。
2.3 基于16S rRNA基因序列构建的系统发育树
根据测序结果构建系统发育树(图3)。初步鉴定GY1菌株为枯草芽孢杆菌(Bacillus subtilis),GY2菌株为巨大芽孢杆菌(B. megaterium),GY3菌株为炭疽杆菌(B. anthraci),GY4菌株为同温层芽孢杆菌(B. stratosphericus)。
3 小结与讨论
国内对于筛选污水中氯苯化合物的研究已取得部分成果。杨洪江等[4]通过富集驯化的方法,从化工厂排污口的污泥中分离筛选了多株降解氯苯的菌属如链球菌属、伯克霍尔德菌属、假单胞菌属等;王芳等[5]采用同位素示踪法从氯苯污染土壤中筛选到能将1,2,4-三氯苯高效降解为CO2的细菌E3和F2,并且E3和F2能在含1,2,4-三氯苯的无机盐培养基中彻底降解1,2,4-三氯苯生成CO2,30 d降解率达到90%以上,其中58%和46%矿化为CO2,同时形成一定量的微生物生物量;王玉芬等[6]用球形红细菌降解邻二氯苯,在厌氧光照条件下球形红细菌的最佳生长和邻二氯苯的最佳降解条件为pH 7.0,温度为30 ℃,接种量10%,在该条件下,邻二氯苯的去除率可达90%以上;何耀武等[7]在好氧和厌氧两种条件下研究了1,2,4-三氯苯的降解,表明1,2,4-三氯苯的好氧降解和厌氧降解均遵循一级反应动力学,在同样水分、温度及初始浓度条件下,1,2,4-三氯苯的好氧降解比厌氧降解迅速,其半衰期分别为1.89~5.86、5.07~19.08 d;宋蕾等[8]将能够以1,2,4-三氯苯(1,2,4-TCB)为惟一碳源的混合物固着在活性炭上,考察其对土壤中1,2,4-TCB的降解效果以及活性炭对土壤中1,2,4-TCB的吸附特性,发现活性炭-微生物系统对土壤中1,2,4-TCB的降解效果优于活性炭和游离微生物;宋蕾等[9]采用批量平衡法,研究颗粒活性炭(GAB)对1,2,4-三氯苯(1,2, 4-TCB)的吸附特性,表明温度为25 ℃、pH 7.0时吸附效果最好。如今又出现新兴的细胞固定化技术,即通过化学或物理的手段将游离细胞固定在载体上来处理污水[1]。目前含有氯苯类化合物的污水降解可分为生物降解技术的探索及生物降解前预处理技术的探索。实际上这类污水的处理必须以生物降解联合一种或多种有效的预处理方法,而这项处理技术的关键问题是生物与非生物降解技术如何高效联合[10]。
本次研究主要是从桂林水系中采取水样,结果表明,桂林的水系中存在能够降解氯苯类化合物的微生物,即GY1枯草芽孢杆菌、GY2巨大芽孢杆菌、GY3炭疽杆菌、GY4同温层芽孢杆菌。利用微生物降解氯苯类化合物可以更好地减少治理污染水系的人力投入,也能够减少一些副作用,符合当今可持续发展的时代主题。相信在今后的环境污染水域的治理中,微生物将会起到越来越重要的作用。当然,值得注意的是,氯苯类化合物的浓度对微生物降解率的影响较大,若浓度过高,超过生物降解和生物修复的范围,则意味着无法从根本上解决水污染的问题[11],这也是未来污水降解研究的又一重要方向。
参考文献:
[1] 刘 云,蒋仲安,王 灿.氯代有机物生物降解研究进展[J].环境科学与技术,2008,31(2):51-55.
[2] 林振峰.城市污水处理方法及化验分析质量控制对策研究[J].资源节约与环保,2015(8):63.
[3] 李明堂,郝林琳,崔俊涛,等.好氧氯苯降解菌的分离鉴定[J].微生物学报,2010,50(5):586-592.
[4] 杨洪江,卢彦珍.氯苯降解菌的筛选鉴定及降解特性研究[J].微生物学通报,2009,36(4):575-580.
[5] 王 芳,D?魸RFLER U,SCHMID M,等. 1,2,4-三氯苯矿化菌的鉴定与功能分析[J].环境科学,2007,28(5):1082-1087.
[6] 王玉芬,張肇铭,胡筱敏,等.球形红细菌厌氧降解邻二氯苯及其机理研究[J].微生物学通报,2008,35(5):666-673.
[7] 何耀武,孙铁珩,区自清.1,2,4-三氯苯在土壤中的降解[J].应用生态学报,1996,7(4):429-434.
[8] 宋 蕾,邢 丽.活性炭-微生物对土壤中1,2,4-三氯苯的吸附降解[J].农业环境科学学报,2015,34(8):1535-1536.
[9] 宋 蕾,孙艳华.颗粒活性炭吸附1,2,4-三氯苯机理的研究[J].内蒙古农业大学学报(自然科学版),2014,35(6):152-157.
[10] 朱 洪.农药废水降解技术的比较及优化分析[J].北京农学院学报,2014,29(4):91-96.
[11] 李 威.农药污染的生物降解与生物修复分析[J].资源节约与环保,2015(8):171-172.

