力竭运动及钝挫伤对大鼠骨骼肌卫星细胞激活及AXIN/GSK-3β含量的影响
潘同斌,叶雷雷,夏素文,朱 超,仝昕炜,汪亚如
力竭运动及钝挫伤对大鼠骨骼肌卫星细胞激活及AXIN/GSK-3β含量的影响
潘同斌1,叶雷雷2,夏素文1,朱 超1,仝昕炜1,汪亚如1
目的:研究力竭运动及钝挫伤对大鼠骨骼肌卫星细胞激活及AXIN/GSK-3β含量的影响。方法:取7周龄雄性SD大鼠24只,分为4组,每组6只:对照组(Control ,C);力竭运动即刻组(Exhaustive,E0);力竭运动后24h组(E24);力竭运动后48h组(E48)。另取18只SD大鼠,分为3组,每组6只:钝挫伤即刻组(contusion,DO);钝挫伤后24h组(D24);钝挫伤后48h组(D48)。各组分别于安静状态、力竭运动后和钝挫伤后不同时间点,宰杀取血,分离血清。并取左侧股四头肌,一分为二,一份立即进行卫星细胞培养实验,另一份样本液氮保存,测定Axin、GSK-3β含量的变化。另取乳鼠3只,亦取股四头肌进行卫星细胞培养。结果:(1)体外培养结果显示:通过分离消化大鼠肌肉组织,可在体外培养获得高纯度具有成肌能力的肌卫星细胞。培养初期,新生鼠1天后即可见到梭形卫星细胞,其它各组的肌卫星细胞增长速度较慢,到第3天、第5天时各组开始大量增殖梭形细胞,且一直保持良好的增殖、传代,第13天仍长势良好,可见部分融合和微管。各组比较可见,安静对照组骨骼肌卫星细胞数量最少,增殖速度最慢;新生鼠细胞数量最高,增殖速度也最快;而钝挫伤组的骨骼肌卫星细胞数量及增殖速度明显高于力竭运动组。(2)ELISA结果显示:与安静对照组相比,力竭运动各组、钝挫伤各组骨骼肌和血清中的GSK-3β、Axin含量均明显下降(P<0.01),但力竭运动各组(E0、E24、E48)之间和钝挫伤各组(D0、D24、D48)之间无显著差异(P>0.05)。结论:(1)力竭运动及钝挫伤可使肌卫星细胞激活、增殖分化,并且钝挫伤组的骨骼肌卫星细胞激活数量明显多于力竭运动组,可能由于钝挫伤的刺激更强所致。(2)力竭运动、钝挫伤可以下调AXIN、GSK-3β的含量,可能在激活Wnt/β-catenin信号通路及骨骼肌损伤修复中发挥重要作用。
力竭运动;钝挫伤;肌卫星细胞;轴蛋白;糖原合成酶激酶
骨骼肌卫星细胞是肌组织的前体细胞,位于肌纤维的肌膜与基底膜之间,它在骨骼肌的生长、发育、损伤及修复过程中担任重要的作用[1-2]。Wnt/β-连环蛋白(β-catenin)信号通路是调控卫星细胞增殖分化和肌纤维类型形成的重要信号通路,通过激活或抑制Wnt/β-catenin信号通路能够调控卫星细胞增殖分化[3]。轴蛋白Axin是一种体轴发育抑制因子,作为构架蛋白在Wnt信号转导途径中起关键作用,它通过不同的机制调节β连环蛋白(β-catenin)的磷酸化和稳定性。作为一个肿瘤抑制因子,Axin在多种肿瘤中表达减少,是Wnt信号通路的负调控因子[4]。GSK-3β是一种在所有的真核生物中存在的多功能丝氨酸/苏氨酸激酶,是调控众多信号通路的关键因素,包括细胞对Wnt、酪氨酸激酶受体、G蛋白偶联受体的作用,以及调节从糖原代谢到细胞循环和细胞增殖的进程[5]。
离心力竭运动引起骨骼肌微损伤已为许多报道及本研究室前期研究所证实[6],钝挫伤作为显著的损伤模型,其研究机制亦有相关研究涉及[7],但二者的同步比较还未见报道。本文通过建立大鼠力竭、钝挫伤两种模型,旨在比较研究在不同模型下的骨骼肌卫星细胞激活及体外培养情况,以及Axin 、GSK-3β在损伤修复过程中的含量变化,初步比较观察不同损伤程度的体内外变化差异。 关于Wnt/β-catenin信号通路与肌卫星细胞之间的关系,已有较多研究,本文利用前人的文献,重点测定其上游因子Axin 、GSK-3β,初步探索Axin 、GSK-3β与Wnt/β-catenin信号通路及肌卫星细胞之间的关系及可能机制,为骨骼肌损伤修复提供理论依据。
1 材料和方法
1.1 动物分组与取材
选用7周龄清洁级雄性SD大鼠24只,由江苏大学实验动物中心提供,许可证号:SCXK(苏)2013-0011。随机分为4组,每组6只,即:对照组(Control ,C);力竭运动即刻组(Exhaustive,E0);力竭运动后24h组(E24);力竭运动后48h组(E48)。另取18只SD大鼠,分为3组,每组6只:钝挫伤即刻组(contusion,DO);钝挫伤后24h组(D24);钝挫伤后48h组(D48)。对照组、力竭运动组、钝挫伤组分别于安静状态、力竭运动后和钝挫伤后不同时间点,宰杀取血,分离血清。并取左侧股四头肌,一分为二,一份立即进行卫星细胞培养实验,另一份样本液氮保存,测定Axin、GSK-3β含量的变化。另取乳鼠3只,亦取股四头肌进行卫星细胞培养实验。
1.2 力竭运动模型
运动组动物均进行一次性力竭离心运动(持续下坡跑),依次进行第I级负荷(0°,8.2m/min)15min(相当于53%VO2max)、第II级负荷(-5°,15m/min)15min(相当于64%VO2max)、第III级负荷(-10°,19.3m/min)(相当于76%VO2max)直至力竭。力竭标准:大鼠已不能使用后肢的蹬力让自己跑动前进而伏地,无法跟上跑台速度总是滞留于跑台的后端,而毛刷、声、光、电刺激尾部均无效或人为驱赶都无法刺激使大鼠继续运动,此为达到了力竭。
1.3 钝挫伤模型
自制重物下砸仪,为一金属圆柱体,质量为200g。底面面积为2.25 cm2,下降高度为36cm,动能为0.7J。将大鼠左后肢置于伸膝、踝背屈90位置,以2s的间隔连续击打5次。经解剖发现,局部出现肿胀和轻度瘀血,证实了肌肉钝挫伤模型建模的成功率为100%。
1.4 细胞培养试剂及仪器
培养基(Gibco公司产品):高糖DMEM培养基占78%;胎牛血清占10%;青/链霉素占2%;标准马血清占10%。主要仪器:光学倒置显微镜,日本OLYMPUS公司;NikonE600显微照相图像采集系统,日本尼康;CO2恒温培养箱,赛默飞世尔(Thermo)科技公司。
1.5 大鼠骨骼肌卫星细胞的分离与培养方法
(1)用眼科剪刀在有少量含2%双抗的hanks液中将组织剪成1mm3大小的肉糜,缓慢将hanks倒掉。(2)加入少量消化酶(0.25%胰蛋白酶)至组织沉淀,洗涤后倒掉液体,留下沉淀。(3)加入5ml左右0.25%胰蛋白酶溶液,震荡后迅速移至离心管中,放入37℃水浴箱中,消化50~60min。(4)依次用200目、400目的筛网过滤,滤液收集后用2000r/min速度离心10min,取沉淀加入适量培养液进行培养。(5)隔60min差速贴壁1次,共两次。将第2次贴壁的培养瓶加入新鲜培养液培养。以后每隔24h更换培养基,并用倒置显微镜进行观察,拍摄图像及分析。
1.6 酶联免疫吸附法(ELISA):测定骨骼肌及血清中Axin、GSK-3β含量
Axin、GSK-3β的 ELISA试剂盒均购自上海博谷生物有限公司。采用美国ELX800型酶标仪,严格按照试剂盒说明操作,所有样本采用平行管测定。考马斯亮兰法进行定氮。
1.7 统计学分析
全部数据用Microsoft Excel处理,计算平均数和标准差。数据统计分析用SPSS 21.0软件系统完成,采用One-way ANOVA程序进行单因素方差分析,P<0.05为具有显著性差异。
2 实验结果
2.1 力竭运动组、钝挫伤组及新生鼠不同时期卫星细胞的体外培养结果
2.1.1 各组培养1天后骨骼肌卫星细胞生长状况
当各组大鼠骨骼肌卫星细胞培养1d时,对照组中未见梭形及圆形细胞,力竭运动各组、钝挫伤各组中未见梭形细胞,但可见其中含有少许的圆形细胞,新生鼠组可见少量的梭形肌卫星细胞。
2.1.2 各组培养3天及5天后骨骼肌卫星细胞生长状况
各组骨骼肌卫星细胞培养3d及5d时(见图1),除安静对照组外,均可见梭形骨骼肌卫星细胞。新生鼠的骨骼肌卫星细胞数量明显多于其它各组,而钝挫伤组的骨骼肌卫星细胞数量明显多于力竭运动组。力竭运动各组(E0、E24、E48)之间和钝挫伤各组(D0、D24、D48)之间相比较,随时间延长骨骼肌卫星细胞数量呈递增趋势。

图1 各组培养5天后骨骼肌卫星细胞生长状况
2.1.3 各组培养第13天后骨骼肌卫星细胞生长状况
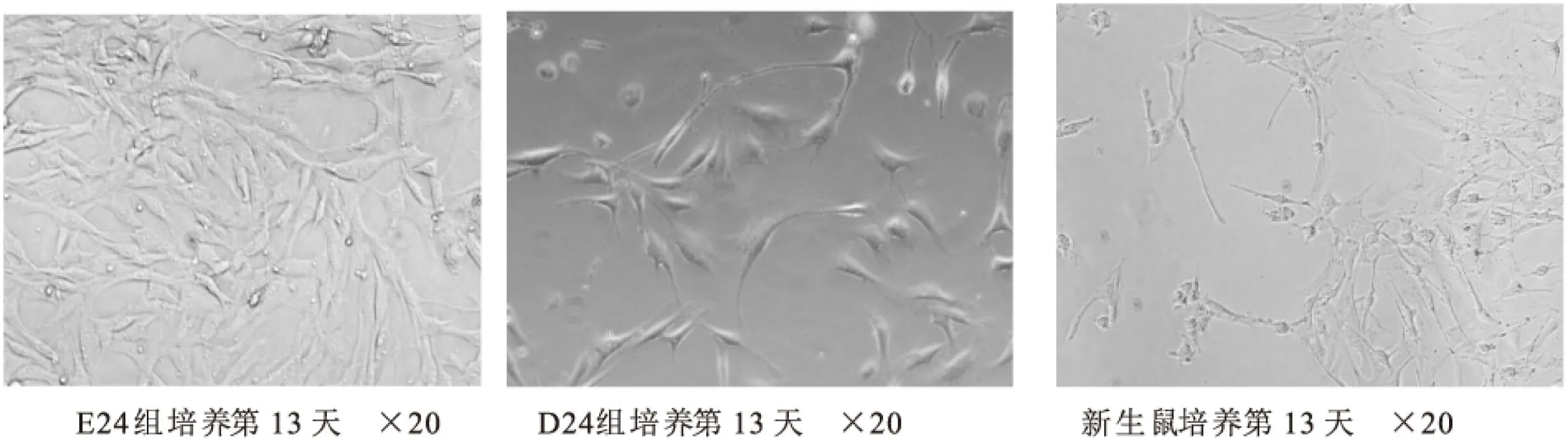
图2 各组培养第13天后骨骼肌卫星细胞生长状况
图2为骨骼肌卫星细胞培养13天的图片,除安静对照组外,各组肌卫星细胞增殖达到高峰状态,部分细胞之间开始出现融合现象,呈集落样,折光性好,其排列开始出现方向性,呈平行排列或者放射状分布,细胞体积增大,在细胞膨大处可见部分细胞融合成肌管。
2.2 力竭运动及钝挫伤不同时期大鼠骨骼肌、血清中GSK-3β、AXIN含量变化
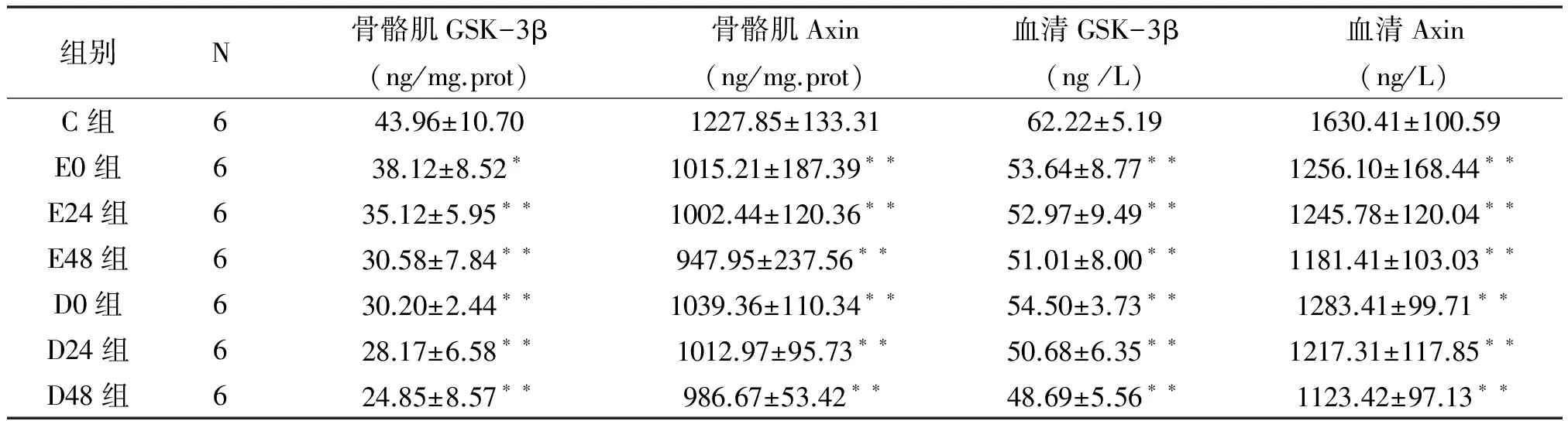
表1 力竭运动、钝挫伤及恢复期间大鼠骨骼肌、血清中GSK-3β、AXIN含量变化
ELISA结果显示(表1):与安静对照组相比,力竭运动各组、钝挫伤各组骨骼肌和血清中的GSK-3β、Axin含量均明显下降(P<0.01),但力竭运动各组(E0、E24、E48)和钝挫伤各组(D0、D24、D48)之间无显著差异(P>0.05)。
3 讨论
3.1 力竭运动、钝挫伤对卫星细胞的激活及体外培养增殖分化情况对比
骨骼肌卫星细胞是位于肌膜和基底膜之间的一些单个核细胞,是一种具有一定自我更新能力以及某种程度定向分化的成体组织内的干细胞[1],一般情况下保持不分裂、静止状态,但受到负重锻炼、牵拉、创伤等刺激后,静息的肌卫星细胞激活,胞质发生扩张,体积增大,高尔基体、内质网、核糖体和线粒体等细胞器变得清晰明显时,进入分裂、增殖期,产生肌前体细胞,并进一步分化、融合成肌管,再形成肌细胞的能力,如果用伽马射线对其进行破坏,就算再进行抗阻训练,肌肉也不会再有所增长,因此肌肉受损伤,卫星细胞激活是肌纤维修复及再生的前提,其增殖、分化也是肌细胞肥大、数目增多以及肌纤维转化的重要机制[2,8]。
有研究表明,当骨骼肌钝挫伤后,其受损伤区域便会出现大量肌卫星细胞的激活、增殖。于秋华等[7]通过建立钝挫伤模型,使用免疫组化技术测定肌卫星细胞增殖细胞核抗原(PCNA)的表达,在损伤后第1天,大鼠腓肠肌损伤组织中开始出现肌卫星细胞,PCNA阳性核出现表达;直到损伤后第14天,受损组织中仍有肌卫星细胞PCNA阳性核呈见。将培养成功并且经过荧光标记后的肌卫星细胞移植入大鼠的钝挫伤部位,在钝挫伤部位修复后,出现带有荧光的肌细胞核,并且移植的大鼠比未移植大鼠的钝挫伤修复处的肌细胞排列更加紧密,说明肌卫星细胞在骨骼肌钝挫伤修复中有重要作用。
杨辉等[9]研究显示,跑台运动训练与按摩联合治疗,能明显提高骨骼肌急性损伤的组织中NADH还原酶蛋白量, 提高肌卫星细胞中nNOS、HGF mRNA表达量,促进炎症的消退和肌卫星细胞的增殖,提高骨骼肌急性损伤修复的速度。Coffey等[10]在力量训练10周的研究中发现,被试者斜方肌中肌肉的横截面积和卫星细胞数目均增加46%,肌细胞核的数量增加70%,这表明肌卫星细胞可能通过增殖分化参与肌肉的肥大。Bickel等[11]对8位不常运动的健康男性进行离心踢膝运动后发现,4天后,肌卫星细胞的数目明显增加,而在对11名年老年男性进行14周的耐力训练后发现,股外侧肌卫星细胞的数目增加29%,这表明运动可以通过增加肌卫星细胞数目来维持老年人的肌肉质量和体积,防止肌肉的萎缩。
本实验通过对力竭运动组、钝挫伤组及新生鼠组分别进行骨骼肌卫星细胞体外培养,结果显示,不同模型刺激后的卫星细胞数量和体外增殖速度也不同。当各组大鼠骨骼肌卫星细胞培养1d后,对照组中未见梭形及圆形细胞,力竭运动各组、钝挫伤各组中未见梭形细胞,但可见其中含有少许的圆形细胞,还未明显激活;新生鼠组可见少量的梭形肌卫星细胞。各组骨骼肌卫星细胞培养3d及5d时(见图1),除安静对照组外,均可见梭形骨骼肌卫星细胞增殖。新生鼠的骨骼肌卫星细胞数量明显多于其它各组,可见新生鼠肌卫星细胞尚未进入休眠状态,活性最强,增殖、分化速度最快,有利于骨骼肌的生长发育。而钝挫伤组的骨骼肌卫星细胞数量明显多于力竭运动组,这是由于钝挫伤对骨骼肌的损伤程度较重,亦能较强地刺激卫星细胞的激活、增殖,促进骨骼肌的损伤修复。此外,力竭运动各组(E0、E24、E48)之间和钝挫伤各组(D0、D24、D48)之间相比较,随时间延长骨骼肌卫星细胞数量呈递增趋势,体现了卫星细胞激活的时间效应。关于卫星细胞在体数量的变化,还有待进一步研究。
3.2 GSK-3β、AXIN及其对Wnt/β-catenin 信号通路的调节作用
Axin是β-catenin降解复合体的重要成分之一[12], Axin可分为Axin1和Axin2, Axinl和Axin2均有a,b两个亚型编码,与APC,GSK3β和β-catenin都有相结合的区域。研究发现[4],β-catenin是经典Wnt 信号途径的核心成分,wnt 信号通路激活可使细胞质内β-catenin积累,并进入核内调节基因转录。在wnt 信号未激活状态下,轴蛋白(Axin)、大肠腺瘤样蛋白(APC)和糖原合成酶激酶(GSK-3β)形成的复合物使 GSK-3β磷酸化, GSK - 3β能将磷酸基团加到β- catenin氨基端的丝氨酸/苏氨酸残基上,形成降解复合物,使β- catenin降解,并维持较低水平;当 Wnt激活,与 Frz受体结合后,跨膜与低密度脂蛋白受体相关蛋白(LDL-receptor-related protein,LRP)形成复合物,抑制 Axin、APC、GSK-3 形成的复合物,使β-catenin 脱磷酸化,当细胞质内游离的β-catenin积累到一定程度,继而转入核内,与 T细胞因子TCF/LEF结合,可促进基因转录,调节靶基因的表达。故Axin、GSK - 3β是Wnt /β-catenin信号通路的重要负性调节因子,在降解复合体中起关键作用[13]。
GSK-3a和GSK-3β都是β-catenin降解复合物的重要调节因子,它们可以磷酸化β-catenin的氨基末端的3个保守的丝氨酸和苏氨酸残基而使其降解。在细胞内,β-catenin是GSK-3β的弱的酶作用物,GSK-3β不能直接地与其连接,GSK-3β需要与Axin和APC共同作用,来促进与β-catenin的相互作用[14]。GsK-3a/β对β-catenin的磷酸化也需要CK1的作用,Axin本身也被GSK-3a/β磷酸化,并增加其稳定性,共同形成降解复合体,使β-catenin降解。而未磷酸化的Axin与β-catenin的亲和力降低,降低了β-catenin降解复合物形成的能力,使其积聚。当人类GSK-3β失调时,可引发众多疾病,如糖尿病、阿尔茨海默病,双相性精神失调和癌症等[15]。
目前有关运动及钝挫伤对Axin及GSK-3的影响研究较少。大都研究Axin与肿瘤的关系[16-17],及GSK-3与代谢和糖尿病的关系[5]。作为一个肿瘤抑制因子,Axin在多种肿瘤中表达减少,是Wnt信号通路的负调控因子,其异常变化与肿瘤的发生、发展及预后密切相关。许绍哲等[18]探讨了长期运动训练上调骨骼肌糖原含量的可能分子机理。结果显示,糖原合酶的磷酸化失活效应是通过上游丝氨酸苏氨酸激酶——GSK-3α和GSK-3β介导的。在胰岛素的作用下, Akt磷酸化GSK-3α和GSK-3β,下调 GSK-3 的活性,降低对糖原合酶的磷酸化作用并使其活化,使糖原合成增加。张飞鹏等[19]研究显示,在去负荷条件下,PI3K/Akt/GSK-3β信号对骨骼肌蛋白分解影响较小;再负荷条件下,离心运动能加强PI3K/Akt/GSK-3β信号作用,参与骨骼肌蛋白合成。本实验模型下,与安静对照组相比,力竭运动各组、钝挫伤各组骨骼肌和血清中的GSK-3β、Axin含量均明显下降,作为负性调节因子,可能通过上调Wnt/β-catenin信号通路,而促进卫星细胞的增殖和骨骼肌的损伤修复。
3.3 Axin/GSK-3β/Wnt/β-catenin 信号通路对卫星细胞及骨骼肌损伤修复的作用
Wnt信号是哺乳动物骨骼肌形成中所必须的,是决定卫星细胞定向分化及成肌细胞终末分化的关键调控因子[3,20]。Wnt/β-catenin信号通路在早期体节形成和肌肉生成中充当重要角色, Wnt/β-catenin信号是调控肌肉发育的重要通路,是调控肌肉肌细胞增殖和分化的关键。抑制骨骼肌卫星细胞中GSK-3β活性或者超表达Wnt10b均能抑制生脂基因表达,可加强肌细胞分化潜能[21-23]。
研究发现[20,24],Notch信号通路与经典Wnt信号通路协同作用,调控卫星细胞分化,而GSK3β作为两条信号通路的平衡点,发挥重要作用。当Notch信号通路被激活时,GSK3β持续表达;但Wnt/β-catenin信号通路抑制GSK-3β的活化。因此,GSK3β的表达不仅维持Notch信号通路及Wnt/β-catenin信号通路平衡,还在卫星细胞定向分化过程中起重要作用。在成熟肌生成期间,Wnt 信号和 Notch 信号精确的时序调节在高效的肌肉修复中是必须的,Notch 信号促进卫星细胞的增殖,Wnt 信号确保终端差异分化 。在这个方案中GSK3 -β 控制细胞内信号的媒介,是细胞从一个通路到另一个通路的重要开关 。
GSK3β是Wnt /β-catenin信号通路的重要负性调节因子,Axin是降解复合体中的第二种关键成分,是wnt信号途径中重要的负性调控因子,是β-catenin降解复合体的关键成分之一,具有多个蛋白-蛋白相互作用区域,在复合体内起支架蛋白的作用,同时作为多种蛋白复合体的构建基础。Axin 使GSK3β靠拢β-catenin而促进β-catenin被GSK-3β磷酸化,并促进β-catenin 的降解。wnt/β-catenin 信号通路在卫星细胞分化及肌纤维类型形成过程中具有重要作用。
总之,骨骼肌的生长发育和再生过程中,卫星细胞发挥着至关重要的作用, Axin/GSK-3β/Wnt/β-catenin信号通路是调节这一过程的重要信号通路。本文通过建立大鼠力竭、钝挫伤两种模型,初步比较了在不同模型下的骨骼肌卫星细胞激活及体外培养情况,以及Axin 、GSK-3β在损伤修复过程中的含量变化,并对相关机理进行了初步探讨,后续研究可进行多方面比较、拓展,必将为骨骼肌卫星细胞在肌肉损伤修复中的作用及机制提供理论依据,对肌肉疾病的诊断、治疗和预后亦具有重要的理论及实际意义。
4 结论
(1)力竭运动及钝挫伤可使肌卫星细胞激活、增殖分化,且钝挫伤组的骨骼肌卫星细胞增殖数量明显多于力竭运动组,可能由于钝挫伤的刺激更强所致。
(2)力竭运动、钝挫伤可以下调AXIN、GSK-3β的含量,可能在激活Wnt/β-catenin信号通路及骨骼肌损伤修复中发挥重要作用。
5 展望
关于骨骼肌卫星细胞激活及其在骨骼肌损伤修复中作用的研究是个重大课题,本文仅对不同损伤模型作一初步探索,今后有必要进行体内、体外的同步研究;随着鉴定指标和方法的进步,此方面的研究必将向纵深发展,尤其是不同损伤模型对卫星细胞的体内、体外影响,及其分子机制,有着广阔的研究前景。
[1] Fu X, Wang H, Hu P. Stem cell activation in skeletal muscle regeneration[J]. Cell Mol Life Sci. 2015, 72(9):1663-1677.
[2] Buckingham M, Rigby PW. Gene regulatory networks and transcriptional mechanisms that control myogenesis[J]. Dev Cell,2014,28(3):225-238.
[3] Lien WH, Fuchs, E. Wnt some lose some: transcriptional governance of stem cells by Wnt/beta-catenin signaling[J]. Genes & Development, 2014,28(14): 1517-1532.
[4] Huang SMA , Mishina YM, Liu SM,et al. Tankyrase inhibition stabilizes axin and antagonizes Wnt signaling[J]. Nature, 2009,461(7264): 614-620.
[5] Zhang T ,Fang M ,Fu ZM,et al. Expression of PI3-K, PKB and GSK-3 beta in the skeletal muscle tissue of gestational diabetes mellitus[J]. Asian Pacific Journal of Tropical Medicine ,2014,7(4):309-312.
[6] 叶雷雷.力竭运动及钝挫伤对大鼠骨骼肌卫星细胞及肝细胞生长因子的影响[M] .扬州:扬州大学硕士论文,2012.
[7] 于秋华、朱道立.大鼠快肌卫星细胞移植在肌肉钝挫伤模型中的修复作用[J].江苏农业科学,2010 ,38(1) :54-57.
[8] Blaauw B,Reggiani C. The role of satellite cells in muscle hypertrophy[J]. J Muscle Res Cell Motil,2014 ,35 ( 1) : 3-10.
[9] 杨辉,常青,唐成林,等.跑台运动训练与按摩联合作用对大鼠骨骼肌急性损伤修复过程中炎症的发展及肌卫星细胞增殖的影响[J].体育科学 , 2015,35(3):51-58.
[10] Coffey VG, Hawley J. The molecular bases of training adaptation[J]. Sports medicine, 2007, 37(9): 737-763.
[11] Bickel VS, Slade J, Mahoney E, et al. Time course of molecular responses of human skeletal muscle to acute bouts of resistance exercise[J]. Journal of Applied Physiology, 2005, 98(2): 482-488.
[12] Salahshor S, Woodgett JR. The links between axin and carcinogenesis[J]. J Clin Pathol, 2005;58(3):225-36.
[13] Hoppler S, Kavanagh CL. Wnt signaling: variety at the core[J]. J Cell Sci, 2007, 120(Pt 3): 385-93.
[14] Hinoi T, Yamamoto H, Kishida M, et al.Complex formation of adenomatous polyposis coli gene product and axin facilitates glycogen synthase kinase-3 beta-dependent phosphorylation of beta-catenin and down regulates β-catenin[J].J Biol Chem, 2000,275:34399-406.
[15] Lochhead PA, Kinstrie R SibbetG, etal. A chaperone-dependent GSK3beta transitional intermediate mediates activation-loop autophosphorylation[J]. Mol Cell, 2006,24(4):627-633.
[16] Martic TN, Pecina SN, Kusec V,et al. Changes of AXIN-1 and Beta-Catenin in Neuroepithelial Brain Tumors[J]. Pathology & Oncology Research , 2010,16(1): 75-79.
[17] Yang LH, Xu HT , Li QC,et al. Abnormal hypermethylation and clinicopathological significance of Axin gene in lung cancer[J]. Tumor Biology, 2013,34(2): 749-757.
[18] 许绍哲,朱荣.长期运动训练诱导SD大鼠骨骼肌糖原含量上调的分子机制[J].中国运动医学杂志, 2015,34(1):42-49.
[19] 张飞鹏,吴金富,王晶.PI3K/Akt/GSK-3β在去负荷及再负荷大鼠腓肠肌蛋白代谢中的作用[J].北京体育大学学报,2011,34(9):48-51.
[20] Brack AS, Conboy IM, Conboy MJ, et al. A Temporal Switch from Notch to Wnt Signaling in Muscle Stem Cells Is Necessary for Normal Adult Myogenesis[J] .Cell Stem Cell, 2008, 2(1):50-59.
[21] Motohashi N, Asakura A . Muscle satellite cell heterogeneity and self - renewal [J]. Front Cell Dev Biol,2014 ,2 ( 1) : 1.
[22] Wend P , Wend K, Krum SA, et al. The role of WNT10B in physiology and disease[J]. Acta Physiologica, 2012, 204(1): 34-51.
[23] 胡丽.IGF1通过PPARγ-Axin2-Wnt信号通路促进内源性脂肪干/前体细胞成脂分化[D].武汉:华中科技大学博士论文,2014.
[24] 史冀鹏,徐红旗,张学林,等.一次性离心运动及针刺对大鼠骨骼肌Wnt/β-catenin信号通路的影响[J].北京体育大学学报 ,2012,35(10):56-62.
(编辑 孙君志)
The Effects of Exhaustive Exercise and Contusion on Satellite Cells Activation and AXIN/GSK-3 β Contents in Rat Skeletal Muscle
PAN Tongbin1,YE Leilei2,XIA Suwen1,ZHU Chao1,TONG Xinwei1,WANG Yaru1
Objective:To study the effects of exhaustive exercise and contusion on satellite cells activation and AXIN/GSK-3 β contents in ratskeletal muscle.Methods: 24 male SD rats (seven-week-old), were randomly divided into 4 groups with 6 in each group: control group (Control, C); immediately-after-exhaustive-exercise group (Exhaustive, E0); post-exhaustive exercise 24h group (E24); post-exhaustive exercise 48h group (E48). Another 18 SD rats were taken and randomly divided into 3 groups with 6 in each group: contusion immediate group (contusion, Do); post-contusion 24h group (D24); post-contusion 48h group (D48). All groups were killed respectively when at resting state and at different time points after exhaustive exercise and contusion respectively and the serum was extracted. The left quadriceps femoris was sampled and divided into two parts: one was used immediately for satellite cell culture experiment, and the other preserved in liquid nitrogen for measurement of AXIN and GSK-3β contents. The quadriceps femoris of another three neonatal rats were also takenfor satellite cell culture experiment. Results: (1) The results of culture in vitro showed that, by separating the rat muscle tissue of digestion, satellite cells with myogenic ability and high purity could be obtained in vitro. During the early stages of culture, a small amount of spindle satellite cells could be seen in the newborn rat the next day after culture, but the satellite cells of the other groups were growing slowly. On the third day and the fifth day, the spindle satellite cells of each group began to proliferate in quantity and reached the peaks. Then all the satellite cells had a good proliferation until 13th day after serial passage, and fusion and micro-tubuleswere observed in some of them. By comparing the results of each group, we concluded that the content of skeletal muscle satellite cell was lowest in control group,but highest in newborn rats. The proliferation rate was slowest in control group, but fastest in newborn rats.At the same time, the number and the proliferation rate of skeletal muscle satellite cells in contusion groups were significantly higher than that in the exhaustive exercise groups.(3) The results of Elisa showed that: The contents of AXIN, GSK-3β in skeletal muscle and serum of exhaustive groups and contusion groups, as compared with the control group, decreased significantly (P<0.01), but there was no significant difference between exhaustive groups(E0、E24、E48)and contusion groups(D0、D24、D48). Conclusions: (1) Exhaustive exercise and contusion can activate the skeletal muscle satellite cells and cause them to proliferate and differentiate. The number of skeletal muscle satellite cells activated in contusion groups was significantly larger than that in exhaustive groups. It may be caused by stronger stimulus of contusion. (3) The contents of AXIN, GSK-3β can be downregulated by exhaustive exercise and contusion, and may play an important role inactivating Wnt/beta-catenin signachannels and repairingskeletal muscle injury.
exhaustiveexercise;contusion;satellitecells;Axialprotein;glycogensynthasekinase-3β
G804.2 Document code:A Article ID:1001-9154(2017)02-0095-06
江苏省高校自然科学研究面上项目"MG53蛋白在骨骼肌运动损伤修复中的作用及分子机制"(15KJD310001)。
潘同斌,教授,博士,研究方向:骨骼肌运动损伤的修复及分子机制。E-mail:panlichina@sina.com。
1.扬州大学体育学院,江苏 扬州 225009;2.南京体育学院训练处,江苏 南京 210014 1.College of Physical Education,YangZhou University. Yangzhou;2.Training division,Nanjing Institute of Physical Education and Sports.Nanjing Jiangsu 210014
2016-09-02
2017-02-10
G804.2
A
1001-9154(2017)02-0095-06

