RECQL基因沉默对HCC细胞株体外增殖的抑制作用
张静静 赵妍妍 许雅思 黄海琇 朱鲁程 马胜林 张仕蓉
RECQL基因沉默对HCC细胞株体外增殖的抑制作用
张静静 赵妍妍 许雅思 黄海琇 朱鲁程 马胜林 张仕蓉
目的 观察RECQL基因沉默表达对人肝细胞癌 (human hepatocelullar carcinoma,HCC)细胞株体外增殖的影响,探讨RECQL作为肝癌治疗潜在靶向基因的可能性。方法 以BEL7404、SK-HEP-1、Hep3B、SNU-761 HCC细胞为研究对象,采用Western blot和免疫组化法观察解旋酶RECQL蛋白的表达情况,通过RNA干扰技术抑制RECQL表达,测定HCC细胞和正常肝细胞(THLE-2细胞)的存活率和死亡率,并采用Western blot法分析凋亡相关蛋白的变化,FACS法检测细胞周期分布。 结果RECQL蛋白在BEL7404、SK-HEP-1、Hep3B中为阳性表达,SNU-761中为阴性表达。RECQL-siRNA在阳性表达组中抑制HCC细胞的增殖,引起细胞存活率降低和死亡率增加(均P<0.01),但对阴性表达组和THLE-2细胞存活率和死亡率无影响(均P>0.05)。RECQL-siRNA处理的SK-HEP-1细胞中,剪切型凋亡相关蛋白cleaved caspase-3和cleaved PARP的表达变化不大,而G2/M期细胞的比例明显增加(P<0.05或0.01)。结论RECQL基因沉默表达可以抑制HCC细胞的增殖,且这种抑制作用依赖于RECQL的高表达,并对正常肝细胞无影响,其可能机制是阻滞细胞G2/M期,可以作为治疗肝癌的潜在靶向基因。
RECQL 人肝细胞癌 细胞凋亡 细胞周期
人肝细胞癌(human hepatocellular carcinoma,HCC)是世界范围内癌症相关死亡的第三大原因,是最常见的肝癌类型[1]。国内肝癌患者的5年生存率较低,是继肺癌之后的第二大肿瘤死因[2],目前还未鉴定出确实有效的HCC治疗靶向基因。人类RecQ解旋酶家族包括RECQL(也称为RECQ1或 RECQL1)、BLM、WRN、RecQ4和RecQ5β5个成员,其中BLM、WRN和RecQ4的遗传缺陷分别会引发面部红斑侏儒综合征、沃纳综合征、先天性血管萎缩皮肤异色病等[3-4],且RecQ相关疾病多伴基因组不稳定性增加和高风险的癌症易感性[5-6]。RECQL作为人类中表达丰度最高的RecQ蛋白,在许多肿瘤中高表达[7],参与DNA复制应激反应、端粒维持、DNA损伤修复、肿瘤发生、发展等。最近研究表明,RECQL的突变易致家族性乳腺癌,因此RECQL现在被认为是新的乳腺癌易感基因[4,8-10]。RECQL在肝癌中的研究还相对较少,本研究通过观察其在不同HCC细胞中的蛋白表达情况,采用RNA干扰技术抑制其表达,探讨RECQL对HCC细胞增殖、生长、凋亡和周期分布等的影响,为临床治疗RECQL的靶向药物潜力提供一定的依据。
1 材料和方法
1.1 材料 4种 HCC细胞 BEL7404、SK-HEP-1、Hep3B、SNU-761和正常肝细胞THLE-2均购自中科院上海细胞库,采用RPMI-1640培养基(其中含10%小牛血清、100 U/ml青霉素、100 μg/ml链霉素和2 mM谷氨酰胺,均购自美国Gibco公司),并置于5%CO2、37℃培养箱(型号3110,美国ThermoFisher公司)中培养。靶向RECQL mRNA的siRNA(21bp)和无关序列均由上海生工公司合成。所有siRNA序列在3′末端具有突出的3′-dTdT,siRNA靶向的具体序列如下[11-12]:
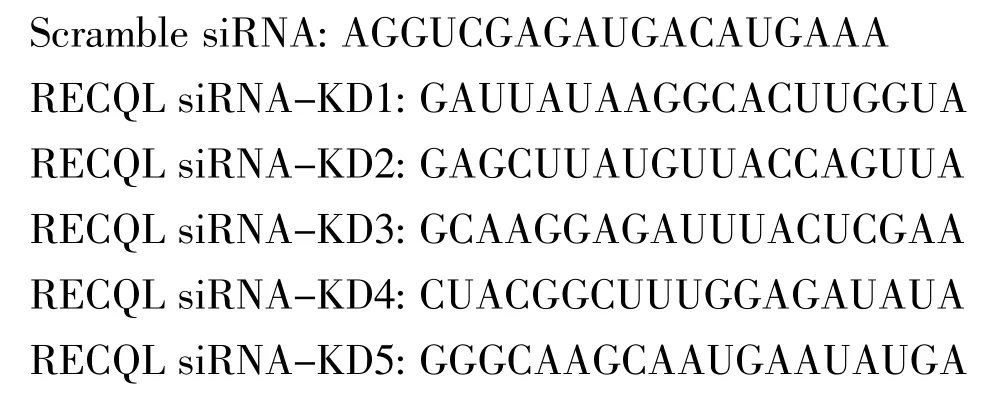
1.2 方法
1.2.1 细胞转染 根据转染序列不同将细胞分为3组,即空白对照组:不作任何处理,阴性对照组:转染无关序列(Scramble siRNA),干扰组:转染RECQL siRNA(RECQL siRNA-KD1~5)。将HCC细胞和和正常肝细胞以2× 105个/孔接种于6孔板中,继续培养至细胞生长达到约70%密度时,按照Lipofectamine ⓇRRNAiMAX(美国Invitrogen公司)制造商说明分别转染细胞,24h或48h后进行后续实验检测。
1.2.2 蛋白印迹(Western blot)法 收集细胞沉淀,用预冷PBS洗涤后加入NP-40裂解液中,提取总蛋白进行电泳,电转移至NC膜上,依次孵育一抗和对应二抗,洗膜,用Li-Cor Odyssey V3.0红外双色激光扫描成像系统(美国LICOR公司)检测蛋白信号。一抗包括RECQL(美国Santa cruz公司,75kDa,1∶1 000)、GAPDH(美国Proteintech公司,36kDa,1∶5 000),以及凋亡相关蛋白PARP、cleaved-PARP(美国Abcam公司,113 kDa,1∶1 000)、cleaved-caspase-3(美国Abcam公司,17 kDa,1∶1 000)。
1.2.3 免疫组化染色 将无菌圆形盖玻片置于12孔板中,后经0.1%明胶处理30min,接种2×104细胞进行细胞爬片,3~5d后进行组织化学染色。PBS洗涤细胞,4%多聚甲醛固定15min,PBS洗涤3次×2min;0.1%Triton-X-100通透15min,PBS洗涤3次×2min;3%H2O2孵育15min灭活内源过氧化物酶;PBS洗涤后血清封闭1h,依次孵育RECQL一抗和相应二抗,并进行DAB显色和苏木素复染,最后用中性树胶封片。实验中均设已知阳性对照和PBS作为一抗的阴性对照。
1.2.4 镜检结果评定 2位病理医师分别在高倍显微镜(型号DM3000,德国Leica公司)下观察样本,根据染色强度和阳性细胞数评定RECQL的表达情况,综合后作出最终评定意见[13]。根据半定量计分法分别对染色强度和阳性细胞数进行计分。染色强度计分:无染色或轻度染色(1分,淡黄色)、中度染色(2分,棕黄色)、强染色(3分,黄褐色);阳性细胞数计分:<5%(1分)、5%~30%(2分)、31%~65%(3分)、>65%(4分)。两项计分之和0分为阴性(-)、1~2分为弱阳性(+)、3~6分为阳性(++)、≥7分为强阳性(+++)。
1.2.5 细胞存活率和死亡率检测 转染siRNA后的细胞培养至24h或48h,收集上清液和细胞沉淀用PBS重悬,台盼蓝染色后用Countstar自动细胞计数仪(型号IC1000,上海睿钰公司生产)分析,直接读取细胞存活率,并计算细胞死亡率。
1.2.6 细胞周期检测 收集细胞,用预冷PBS洗涤后,加入预冷的70%乙醇,4℃固定过夜。离心取细胞沉淀,PBS洗涤,加入用PBS配置的含50μg/ml溴化乙锭(PI)染液4℃避光孵育30min,FACS上机检测G1、S、G2/M各期细胞比例。
1.3 统计学处理 采用GraphPad Prism 5.0统计软件,计量资料以表示,组间比较采用t检验。
2 结果
2.1 RECQL蛋白在不同HCC细胞中的表达情况 见图1。
由图1可见,Western blot法结果显示在BEL7404、SK-HEP-1、Hep3B、SNU-761 4种细胞中均能检测到RECQL的表达,但SK-HEP-1中表达最强、BEL7404次之、Hep3B稍弱,SNU-761则表达量极弱(图1a);免疫组化染色结果与Western blot法结果一致,SK-HEP-1评定为高表达(+++),SNU-761评定为低表达弱染色(+)(图1b)。根据以上结果,将BEL7404、SK-HEP-1、Hep3B作为RECQL阳性表达组,SNU-761作为RECQL阴性表达组。
2.2 不同HCC细胞中转染RECQL-siRNA后RECQL mRNA表达水平及细胞存活率和死亡率比较 见图2、表1。
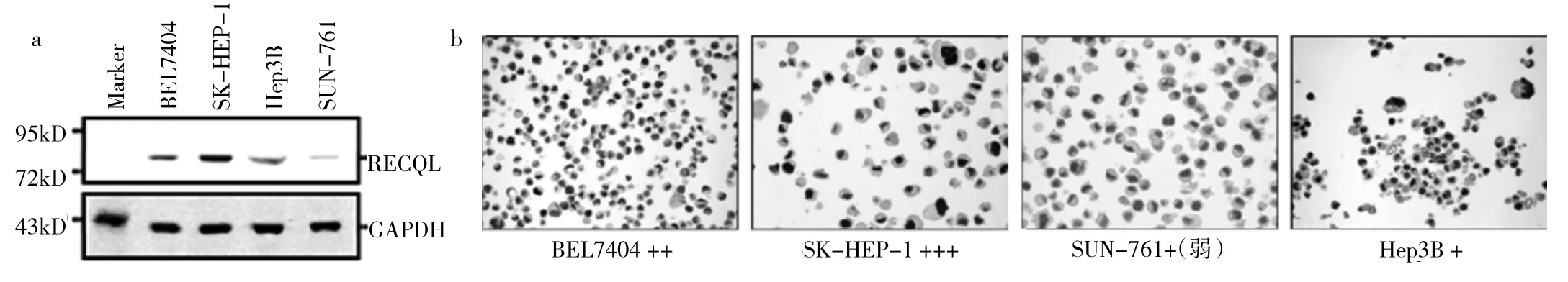
图1 RECQL蛋白在不同HCC细胞中的表达(A:Western blot法检测RECQL的表达;B:免疫组化法检测RECQL的表达,×100)

图2 不同HCC细胞转染siRNA后RECQL mRNA表达水平图(与空白对照组、阴性对照组比较,**P<0.01)
由图2、表1可见,在4种HCC细胞中转染RECQL-siRNA 24h后,与空白对照组和阴性对照组相比,干扰组RECQL mRNA表达水平均明显降低(均P<0.01)。在阳性表达组(BEL7404、SK-HEP-1、Hep3B细胞)中干扰RECQL基因的表达,细胞存活率显著下降,细胞死亡率则明显升高(P<0.05或0.01);而在阴性表达组(SNU-761细胞)中,细胞存活率和死亡率均未见明显变化(均P>0.05)。
2.3 SK-HEP-1细胞和THLE-2细胞转染siRNA后RECQL的蛋白表达水平及细胞存活率、死亡率比较见图3、表2~3。

表1 不同HCC细胞中转染RECQL-siRNA后细胞存活率和死亡率比较
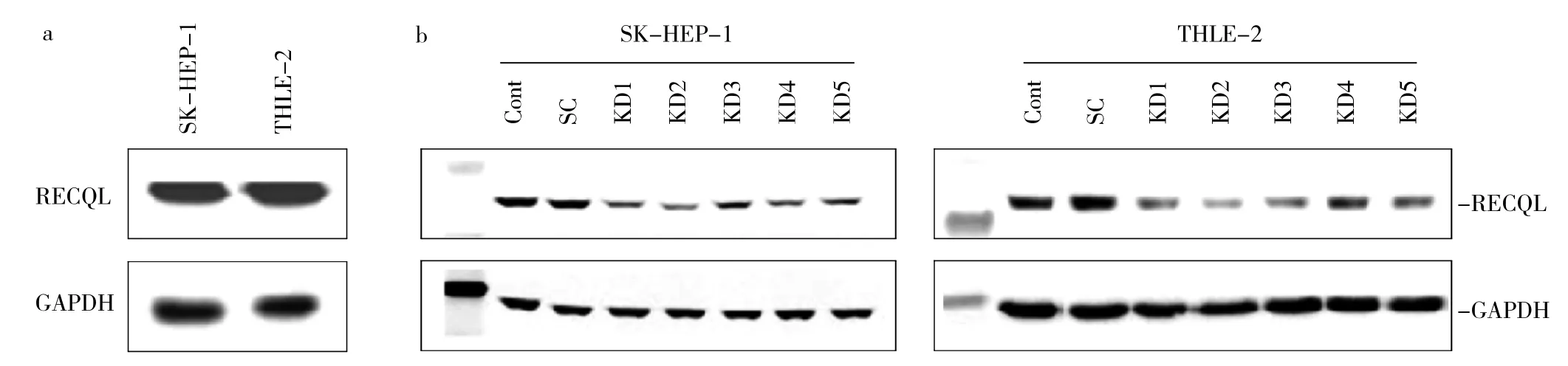
图3 SK-HEP-1细胞和THLE-2细胞转染siRNA后RECQL的蛋白表达水平图(a:RECQL在两种细胞中的本底表达比较;b:转染siRNA后,RECQL在两种细胞中的表达情况)
由图3可见,正常肝细胞THLE-2中RECQL表达水平与阳性表达组细胞SK-HEP-1中相似(图3a)。通过转染5种不同序列的siRNA,均实现了不同程度的RECQL蛋白水平抑制表达(图3b)。
由表2、3可见,转染siRNA 48h后,HCC细胞SKHEP-1细胞存活率与空白对照组、阴性对照组比较均降低,细胞死亡率均升高(均P<0.01);而正常肝细胞THLE-2细胞存活率、死亡率与空白对照组、阴性对照组比较差异均无统计学意义(均P>0.05)。
2.4 RECQL-siRNA对SK-HEP-1细胞中凋亡相关蛋白表达和周期分布的影响 见图4。
由图4可见,在RECQL阳性表达组细胞SK-HEP-中,凋亡相关蛋白PARP、cleaved-PARP和cleaved-caspase-3表达水平与空白对照组、阴性对照组相比变化不大(图4a)。干扰组与阴性对照组相比,G1、S期细胞比例变化不明显(P>0.05),而G2/M期细胞比例明显上调(P<0.05或0.01,图4b)。

表2 在SK-HEP-1和THLE-2细胞中干扰RECQL表达后细胞存活率比较(%)

表3 在SK-HEP-1和THLE-2细胞中干扰RECQL表达后细胞死亡率比较(%)
图4 RECQL-siRNA对SK-HEP-1细胞中凋亡相关蛋白表达和周期分布的影响(与阴性对照组比较,*P<0.05,**P<0.01)
3 讨论
RECQL是人类中第1个被发现的DNA解旋酶,作为RecQ家族中表达丰度最高的蛋白,与遗传性癌症易感综合征有关,通过DNA修复来维持基因组稳定性是它的主要功能。最新研究显示,RECQL有助于肿瘤的发生、发展,部分原因是其能通过调节下游基因的表达来促进癌细胞的迁移、侵袭和转移;RECQL的缺失会造成基因组不稳定、抑制癌细胞增殖[3,14]。
根据RECQL在4种HCC细胞中的蛋白表达情况,分为RECQL阳性表达组和阴性表达组。对RECQL-siRNA处理的细胞进行观察时,发现随着培养时间的延长,对照组细胞密度逐渐增加,而SK-HEP-1细胞转染siRNA后生长却受到严重影响,同样培养时间后细胞密度远远低于对照组;阳性组细胞(BEL7404、SK-HEP-1、Hep3B)的细胞存活率均显著下降,细胞死亡率则明显上升,相反阴性组(SNU-761)的细胞存活率和死亡率都没有受到明显影响。这说明,RECQL-siRNA能够抑制HCC细胞的增殖生长,具有作为治疗HCC的靶向基因潜力,并且这种抑制作用可能依赖于RECQL的高表达。据研究,大多数HCC细胞具有不完整的DNA修复系统[15],转染siRNA后,RECQL阳性HCC细胞和阴性HCC细胞在增殖上的差异,推测是因为这两类细胞的DNA修复、细胞周期等相关通路不同:阳性组细胞相关通路为RECQL依赖性,且极有可能是通过高表达RECQL此修复酶和DNA复制的良好协调来修复DNA损伤,从而保证细胞周期的正常进行,而阴性组细胞则为RECQL非依赖性。因此,在RECQL沉默后,阳性组的细胞增殖因通路受阻而被抑制,阴性组则不受影响。
目前大多数化疗药物在治疗中不仅杀死癌细胞,也会对正常组织造成不利影响,只有找到只杀伤癌细胞、对正常细胞无影响的靶向基因,才能起到更好的治疗作用。那么RECQL-siRNA的增殖抑制作用是只针对RECQL高表达的HCC细胞,还是对正常肝细胞也会产生影响?为了阐明RECQL-siRNA对正常肝细胞是否具有杀伤作用,笔者同步检测RECQL-siRNA对HCC细胞和正常肝细胞的作用,结果显示在RECQL阳性HCC细胞中,RECQ1-siRNA能够降低细胞存活率、增加细胞死亡率,而其对正常肝细胞THLE-2的细胞存活率和死亡率均无影响,这说明RECQL沉默表达对细胞增殖的抑制作用只对RECQL高表达的HCC细胞有效,而对正常肝细胞是没有抑制作用的。Thangavel[16]曾报道RECQL在DNA复制起点位置累积,RECQL的瞬时缺失会降低复制开始的概率,并进一步导致复制起始处DNA序列的减少,如果大多数复制起点失活,大量DNA只能通过极少的DNA聚合酶复合体,这会形成更大的染色体环;Popuri等[17]发现RECQL稳定缺失可以影响细胞增殖并使细胞对各种DNA损伤应激的灵敏度增强,直接或间接阻断DNA复制叉的形成,此外,还会导致未凝集染色体缺陷累积,暗示RECQL缺失细胞DNA复制后进入分裂期可能较慢,这也很好地解释了RECQL沉默表达可以诱导有丝分裂障碍并杀伤癌细胞的报道[15]。本研究中正常肝细胞耐受RECQL沉默表达,未引起增殖抑制,推测可能是正常细胞能够自动修复RECQL沉默造成的DNA损伤,从而保证细胞周期的正常进行。Furuichi等[15]对DNA修复和周期相关蛋白(TP53,Rb1, p16/INK4a和p21/WAF1)检测发现其在不同的细胞系中表达差异较大,特别是p21/WAF1基因,其在很多HCC细胞中表达极低甚至不表达,而正常细胞中表达量较高,可能正是周期检查点相关蛋白缺陷,使HCC细胞不能自动修复DNA损伤造成的有丝分裂障碍,最终导致细胞增殖受到影响。
既然转染RECQL-siRNA后,SK-HEP-1细胞的增殖受到抑制,那么与细胞增殖生长密切相关的凋亡和周期是否受到影响呢?RECQL沉默表达后,凋亡相关蛋白cleaved-PARP、cleaved-caspase-3等表达水平不受太大影响。但Matsushita[11]在上皮性卵巢癌中沉默RECQL表达,引起细胞凋亡;另外,在经RECQL-siRNA处理的HCC细胞和卵巢癌细胞中,发现代表碎片的subG1峰表达很高[11,15]。与之结果不同的是本研究检测到RECQL-siRNA处理组的G2/M期细胞比例有所升高,而在早期Futami的研究中,RECQL-siRNA增加癌细胞有丝分裂死亡,并被阻滞于M期[18]。据报道,如果转染siRNA后,癌细胞仍表达高水平DNA修复酶RECQL,那么DNA异常细胞就仍然可以进入M期,发生M期阻滞[11]。所以可能是受RECQL-siRNA表达效果、转染效率、检测时间等因素影响,没有直接诱发细胞凋亡,而是经历不均匀分裂后停止于M期,诱导有丝分裂灾难或者细胞异常分裂。
综上所述,在体外RECQL-siRNA可以抑制RECQL高表达的HCC细胞增殖生长,引起细胞存活率的降低和死亡率的升高,并对正常肝细胞没有影响,是一种针对肝癌的潜在分子靶标药物;RECQL沉默表达不诱导HCC细胞凋亡,但引起有丝分裂障碍,使细胞周期阻滞于G2/M期。除了HCC,对于其它类型的肝癌RECQL-siRNA是否具有同样的增殖抑制作用、RECQL-siRNA临床上的抑癌作用是否也依赖于RECQL的高表达都值得深入研究。今后,将通过体内实验,深入研究RECQL对肝癌发生、发展的作用机制,并探讨RECQL-siRNA作为肝癌治疗药物的可行性,还将进行临床前瞻性研究,进一步验证RECQL作为预测肝癌恶性和进展生物标志物的潜力。
[1] Yan L,Farmr R W,Yang Y,et al.Epithelial cell adhesion molecule in human hepatocellular carcinoma cell lines:a target of chemoresistence[J].Bmc Cancer,2016,16(1):1-10.
[2] 陈万青,郑荣寿,曾红梅,等.2011年中国恶性肿瘤发病和死亡分析[J].中国肿瘤,2015,24(1):1-8.
[3] Lu X S,Parvathaneni,Li X L,et al.Transcriptome guided identification of novel functions of RECQ1 helicase[J].Methods,2016, 108:111-117.
[4]Sami F,Sharma S.PROBING GENOME MAINTENANCE FUNCTIONS OF HUMAN RECQ1[J].Computational&Structural Biotechnology Journal,2013,6(7):1-10.
[5]Croteau D L,Popuri V,Opresko P L,et al.Human RecQ helicases in DNA repair,recombination,and replication[J].Annual Review of Biochemistry,2014,83(1):519-552.
[6] Jr B R.DNA helicases involved in DNA repair and their roles in cancer[J].Nature Reviews Cancer,2013,13(8):542-558.
[7]Lu X,Parvathaneni S,Hara T,et al.Replication stress induces specific enrichment of RECQ1 at common fragile sites FRA3B and FRA16D[J].Molecular Cancer,2013,12(1):1-12.
[8]Cybulski C,Jian C Z,Klu W,et al.Germline RECQL mutations are associated with breast cancer susceptibility[J].Nature Genetics, 2015,47(6):643-646.
[9]Kwong A,Shin V Y,Cheuk I W,et al.Germline RECQL mutations in high risk Chinese breast cancer patients[J].Breast Cancer Research&Treatment,2016,157(2):211-215.
[10]Sun J,Wang Y,Xia Y,et al.Mutations in RECQL Gene Are Associated with Predisposition to Breast Cancer[J].Plos Genetics, 2015,11(5):e1005228.
[11] Matsushita Y,Yokoyama Y,Yoshida H,et al.The level of RECQL1 expression is a prognostic factor for epithelial ovarian can-cer[J].Journal of Ovarian Research,2014,7(1):1-10.
[12] Mendoza-Maldonado R,Faoro V,Bajpai S,et al.The human RECQ1 helicase is highly expressed in glioblastoma and plays an important role in tumor cell proliferation[J].Molecular Cancer, 2011,10(1):1-17.
[13]周珍,李旋,倪海峰,等.VEGF、EGFR及Parkin蛋白在鼻咽癌中的表达及三者间的相关性研究[J].浙江医学,2015,37(13):1116-1120.
[14] Sharma S.An appraisal of RECQ1 expression in cancer progression[J].Frontiers in Genetics,2014,5(5):420-426.
[15]Furuichi.RecQL1 DNA repair helicase:A potential tumor marker and therapeutic target against hepatocellular carcinoma[J].International Journal of Molecular Medicine,2010,25(4):537-545.
[16] Thangavel S,Mendozamaldonado R,Tissino E,et al.Human RECQ1 and RECQ4 helicases play distinct roles in DNA replication initiation[J].Molecular&Cellular Biology,2010,30(6): 1382-1396.
[17]Popuri V,Croteau D L,Jr B R,et al.RECQ1 is required for cellular resistance to replication stress and catalyzes strand exchange on stalled replication fork structures[J].Cell Cycle,2012, 11(22):4252-4265.
[18] Futami K,Kumagai E,Makino H,et al.Anticancer activity of RecQL1 helicase siRNA in mouse xenograft models[J].Cancer Science,2008,99(6):1227-1236.
RECQL-siRNA inhibits proliferation of human hepatocellular carcinoma cell lines in vitro
Objective To investigate the effect of RECQL on proliferation of human hepatocellular carcinoma cell lines in vitro.MethodsHepatocellular carcinoma (HCC)BEL7404,SK-HEP-1,Hep3B and SNU-761 cells were transfected with RECQL-siRNA in vitro to silence RECQL.The expression of RECQL protein was detected with Western blot and immunohistochemistry.The viability of HCC and normal liver THLE-2 cells were examined,the expressions of apoptosis-related proteins were detected with Western blot and cell cycle distribution was observed using FACS.Results RECQL protein was positive in BEL7404,SK-HEP-1 and Hep3B cells,and negative in SNU-761 cells.RECQL-siRNA inhibited the proliferation of HCC cells significantly in the RECQL-positive expression HCC cells(P<0.05),but had no effect on HCC SNU-761 cells and normal liver THLE-2 cells.In SK-HEP-1 cells transfected with RECQL-siRNA,the expression of cleaved caspase-3 and cleaved PARP had no significant change,but the ratio of G2/M phase cells was significantly increased(P<0.05 or 0.01).Conclusion RECQL-siRNA can inhibit the proliferation of HCC cells with positive RECQL,indicating that RECQL may be a potential target gene for treatment of liver cancer.
RECQL Human hepatocellular carcinoma Cell apoptosis Cell cycle

2016-11-03)
(本文编辑:马雯娜)
10.12056/j.issn.1006-2785.2017.39.5.2016-1804
国家自然科学基金项目(81602671);浙江省自然科学基金项目(LQ17H160003)
310006 杭州,南京医科大学附属杭州医院、杭州市第一人民医院转化医学研究中心
张仕蓉,E-mail:shirley4444@gmail.com

