类器官模型在结直肠肿瘤研究中的作用与进展
孙家亮 综述 李大力,张学利 审校
(1. 上海市奉贤区中心医院 普通外科,上海 201499;2. 华东师范大学生命科学学院,上海 200241)
结直肠癌是当前世界上病死率第4位的恶性肿瘤,每年近70万人死于结直肠癌。在中国,随着生活水平提高,生活方式西化,中国人的结直肠癌发病率逐年递增[1]。目前,临床上对于结直肠癌通常以手术治疗为主,部分晚期结直肠癌以放化疗为主且效果不佳。为研究结直肠癌的生物学特性以及提高药物治疗的效果,当前肿瘤研究主要以结直肠癌细胞系(colorectal cancer cell lines,CCL)和患者来源的肿瘤异种移植(patientderived tumor xenografts,PDTX)模型为主来模拟肿瘤的发展情况以及对药物的反应。但由于人体内环境复杂,肿瘤发生发展机制不明确,使这两种模型的模拟效果和精准度与体内肿瘤的发展有一定的差距。从而导致许多基础研究中的药物与临床实用的效果差距较大,很多肿瘤亚型的患者没有高效的药物治疗。本文所描述的类器官模型能很好的保留肿瘤细胞的异质性以及对药物的反应。
1 CCL
肿瘤细胞系模型是一种重要的癌症研究方法。大多数CCL都是来源于其恶性肿瘤本身或转移的样本中。目前的CCL系约有30余种,其中最常用的分别为:SW480、SW620、HCT116、T84、HT29、LS174T、INT-407、HT20-MTX及NCM460等[2-3]。肿瘤细胞系具有同源性、无限增殖能力、简单培养及可应用于高通量药物筛选等大量的实验优势。阻碍CCL更广泛地应用是其存在交叉污染,基因型的不稳定性,质量控制的差异,以及容易受微生物感染等因素,因此无法全面的应用于基础和临床研究的各个方面。加之建立的肿瘤细胞系大多来源于肿瘤的转移灶或进展较快的肿瘤,因此原发性或进展缓慢的肿瘤无法得以科学准确地认识与研究[4-5]。
2 PDTX
PDTX模型是将手术切除或活检新鲜肿瘤组织直接种植于免疫缺陷小鼠的皮下原位或肾囊膜下[6]。当肿瘤进入体内的生理环境中,尽管具有异质性,但模拟原发的肿瘤的条件更优于在培养皿中,同时基因变异也越来越少[7]。移植瘤在连续传代后也能够保持它们原代肿瘤的组织特异性,此外,一些亚克隆间平行生长也能够部分保持原代肿瘤的异质性[8]。这些优势使PDTX成为一个有效的临床前模型,能够完成一系列包括药物的有效性筛查、预测新的肿瘤生物标记物等生物研究[9-10]。尽管PDTX作为肿瘤研究的临床前模型有巨大优势,但是仍有一些缺陷。首先,人源恶性肿瘤移植成功率不能达到最满意效果,而移植瘤需要长时间生长,同时受体间存在个体差异且缺乏免疫能力,这也会导致原代肿瘤的生物学行为发生变化,使其恶性程度提高及侵袭能力增加。在某些情况下,移植瘤不能很好的预测患者的无病生存率[11]。其次,尽管PDTX与原代肿瘤有相似性,但它仍不能被用于一些严格的实验指标检测。肿瘤与宿主反应不能在物种间保存,有些肿瘤的免疫反应也完全缺失[12]。最后,使用动物移植模型需要消耗大量时间、精力、成本高,且涉及伦理问题。目前在体外建立的结直肠类器官模型可以很好的与上述两中模型相为补充,为结直肠肿瘤的研究提供新的途径。
3 类器官概述
类器官模型是近年来兴起的一种新的临床前疾病研究模型。在体外用各种必要的生长因子来模拟机体内环境的条件下,提取肠干细胞加入到3D基质胶中培养从而得到了细胞团块样组织,其包含了不同组织来源的上皮细胞结构,这种能不断自我增殖及分化的细胞团被称之为类器官[13]。这种在类似生理情况下培养的类器官模型能够在体外研究模拟一系列体内的生物学行为,像组织更新、干细胞功能、细胞对药物反应、损伤性研究、以及细胞信号转导等[14-15]。尤其在结直肠肿瘤研究方面具有巨大优势:首先,无论是肠腺瘤还是肠癌均可以在体外进行肿瘤类器官的培养[16]。其次,肿瘤类器官的培养过程中仅提供给原始肿瘤细胞类似生理条件的生长环境,且一般短时间(1周左右)能扩增,故能很好的保留原代肿瘤组织固有的异质性和生物学行为[17]。最后,这种高效率的类器官培养可以用来研究肿瘤的分子信号通路转导[18]和抗肿瘤药物的研发与筛选[19]以及肿瘤患者的靶向治疗。类器官所呈现出上皮的自然生理状况优于传统的细胞系,能长期传代培养且具有稳定的表型和遗传学特征,这些是PDTX模型所无法比拟的[20]。目前已经成功建立一系列小鼠和人的正常组织及肿瘤组织的类器官,使其成为基础研究和药物研发中的重要工具[21-22]。
4 正常类器官及肿瘤类器官培养条件的探索
2009年,Clevers等[23]证实肠隐窝处富集肠上皮功能性干细胞,且由富含亮氨酸重复序列的G蛋白偶联受体(leucine-rich repeat-containing G protein-coupled receptor,Lgr5)标记的隠窝柱状细胞为肠道成体干细胞。随后,Sato等[13]在体外没有间质微环境支持下用单个Lgr5标记的干细胞来建立一个隐窝-绒毛样的微型器官样结构,即小肠类器官。这种出芽状的结构包括中间“囊样”结构的绒毛样区域和周围“芽状”结构的隠窝样区域。通过染色表明这种类器官包含4种肠道常见的分化细胞,分别为隐窝区域的潘氏细胞,绒毛区域的肠细胞,肠道内分泌细胞以及杯状细胞。结直肠类器官成功培养的关键是在无间质条件下,通过加入各种小肠生长所必须的生长因子来模拟小肠干细胞的培养微环境[24],用基质胶来代替小肠间质的支架结构成功培养出了小肠类器官。并摸索建立了小鼠小肠类器官培养的通用培养基(ENR),其包括:表皮生长因子(epidermal growth factor,EGF),骨形态发生蛋白(bone morphogenetic protein,BMP)信号通路抑制剂(noggin),Wnt信号通路激动剂(R-spondin-1),基底膜替代物人工基质胶(matrigel)[25]。人肠道类器官的培养以ENR为基础,需要添加额外的生长因子,包括:Wnt信号通路的外源性配体(Wnt3a)、TGF-β抑制剂(A83-01)、p83抑制剂(SB202190)、烟酰胺(nicotinamide)及胃素(gastrin)[16,26]。在肠干细胞的信号通路中,Wnt信号在隠窝增殖中至关重要,而Wnt配体Wnt3a及激动剂R-spondin-1可协同激活此信号通路,而BMP信号抑制肠干细胞增殖,故其抑制剂Noggin能提高类器官培养形成率,同时加快其生长速度。EGF信号通路在肠干细胞的稳态维持中保持重要的作用[27]。肠类器官的培养可以通过不同的生长因子调节来维持干细胞的活性,使类器官可以不断增殖分化,达到模拟正常肠上皮的生理状态。
结直肠肿瘤类器官培养与正常组织类器官则有所不同。在APCmin/+小鼠肿瘤模型中,其肿瘤类器官的培养中只需要EGF+noggin(EN)生长因子的培养基,因为在小鼠小肠腺瘤中包含明确的APC基因突变从而导致Wnt信号通路的异常持续激活,故不需额外加入Wnt的激动剂[28]。而在人的肿瘤类器官培养中则根据肿瘤的类型不同,其突变的信号通路不同,需要加入不同的生长因子:如为APC基因的突变而导致Wnt信号通路的异常激活则不需加入Wnt3a,若为RAS/MAPK信号通路突变则不需要加入EGF生长因子,当肿瘤中有TGF-b信号通路突变后其功能受到抑制时则不需要加入A83-01来维持生长[16-17,29]。Matano等[18]用CRISPR-Cas9基因编辑技术在正常上皮类器官中突变了一系列抑癌基因APC、SMAD4、TP53和致癌基因KRAS、PI3K,这些突变类器官需要用去除相应生长因子的选择培养基来进行培养,才能产生相应的肿瘤性增长。同时将这些通过基因编辑修饰的类器官移植入裸鼠的肾囊膜下和脾脏中,发现其有不同的成瘤和侵袭转移能力,表明可在体外重现结直肠肿瘤的发生发展过程[30](图1)。Fujii等[17]于2016年建立第一个结直肠肿瘤类器官库(Colorectal Tumor Organoid Library,CTOL)包含55个肿瘤类器官,其来源于43例患者中的52个肿瘤,且包含各种不同的肿瘤亚型。相比于van de Wetering等[29]从结肠腺瘤患者中培养出类器官生物样本库(Organoid Biobank),结直肠癌类器官的培养更为复杂,尤其对于直肠癌和晚期结肠癌。一方面,由于肿瘤细胞浸润到肠壁的深肌层即使在消化完成后依然有结缔组织连接,其剩余片段的释放需要通过额外的胰酶来裂解,这样才能将大量的肿瘤细胞从组织中分离出来。另一方面,晚期肿瘤中基因突变的复杂性以及癌细胞对于氧浓度的敏感性不同使所需的培养条件与之前的方案也有差异,需要测试多种条件下3种不同因素(Wnt激动剂Wnt3A/R-spondin1,氧浓度以及p38抑制剂SB202190)对结直肠癌类器官增殖的影响[17]。总之,结直肠肿瘤可以通过测序来检测出不同的信号通路突变,利用测序结果将原代肿瘤在体外通过生长条件的改变来培养出肿瘤类器官。这种类器官组织可以将原代肿瘤的异质性及生物学行为(包括:基因型特征,基因表达谱,移植瘤的侵袭性等)很好的保留下来。
目前也有通过胚胎干细胞(embryonic stem cell,ES)或诱导性多功能干细胞细胞(inducedpluripotent stem cell,iPS)来诱导产生肠道上皮类器官[14,31]。方法是将从胚胎中提取出来的ES细胞体外贴壁培养后,通过不同的生长因子来诱导产生不同的内胚层(在胃肠道中主要是间质细胞中的Barx1来诱导产生肠内胚层),随后将富含肠内胚层的多能干细胞移植入细胞外基质中在加入各种必需的微环境生长因子来产生微小的胃肠道样的类器官结构[32-33]。这种类器官的培养可以用于发育生物学方面研究。
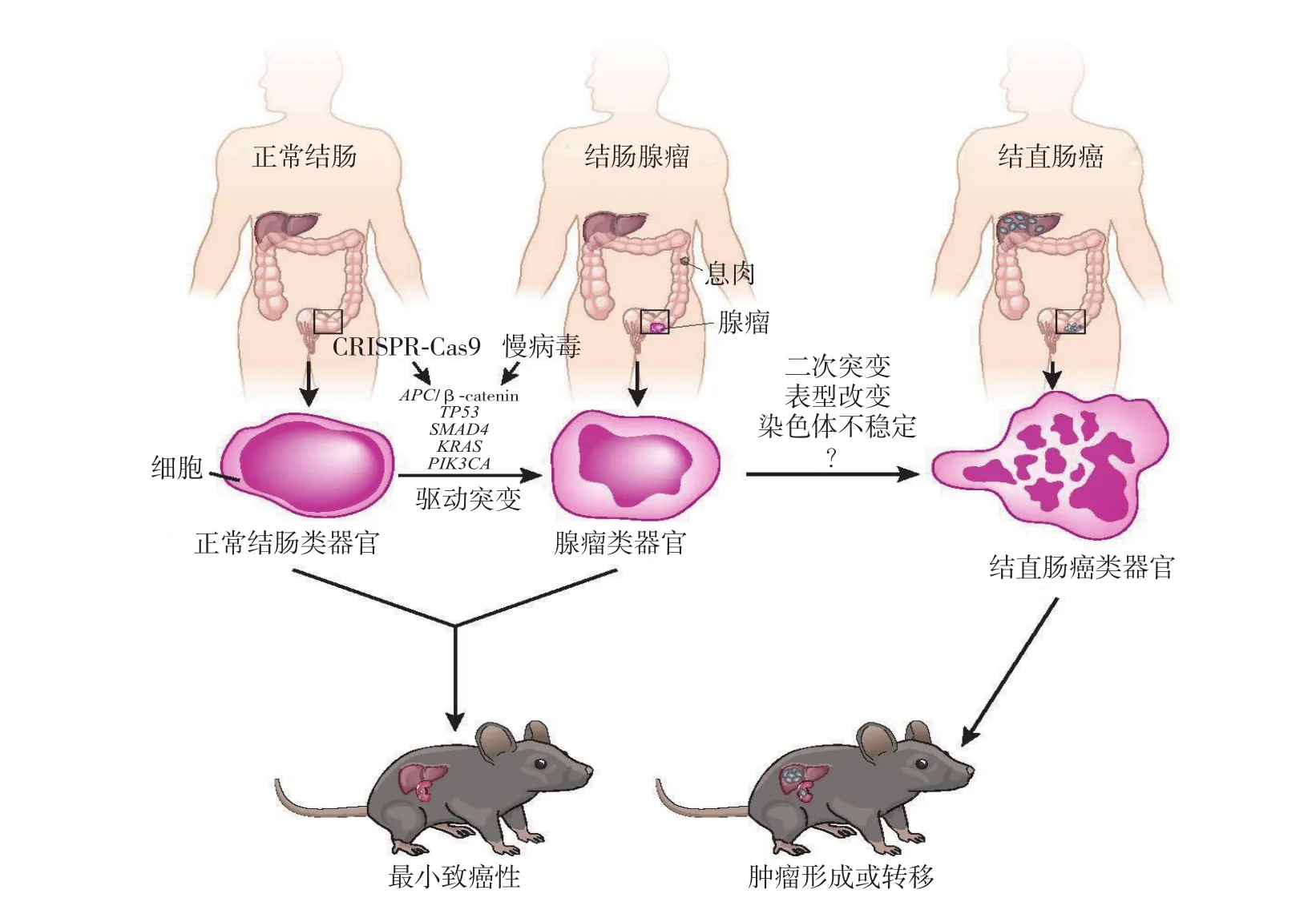
图1 评估结肠癌中联合突变的致癌作用[31]Figure 1 Assessment of the effects of joint mutations on carcinogenesis in colon cacer[31]
5 类器官在结直肠肿瘤研究中的应用
5.1 模拟肿瘤发生的机制
结直肠肿瘤类器官可以模拟肠道恶性肿瘤发生发展中的病理机制以及不同信号通路突变的作用。众所周知,结直肠癌是由正常结肠上皮细胞累积的基因突变后使其向腺瘤-腺癌-侵袭转移方向转变[34]。Matano等[18,35]用CRISPR-Cas9基因编辑技术在肠上皮类器官中突变了一系列基因来模拟肠肿瘤的演化过程。Fumagalli等[36]通过采用原位移植包含不同的CRC突变联合的人结肠类器官,来分析腺瘤-癌序列在体内演进过程,表明了Wnt、EGFR、p53和TGF-β信号积累致瘤突变有助于有效的肿瘤生长,迁移和转移灶形成(图1)。相反,van de Wetering等[29]从结肠腺瘤的患者中培养出腺瘤类器官生物样本库,而Fujii等[17]培养了包含各种不同的结肠癌肿瘤亚型的肿瘤样本库(图2)。二者从正反两方面来论证了结直肠肿瘤发生发展的病理过程,而且在肿瘤起始发生过程中Wnt信号通路过度激活至关重要,肿瘤后期的侵袭转移与RAS基因突变、TP53基因失活、染色体不稳定性(CIN)和微卫星不稳定性(MSI)等均相关。
5.2 抗肿瘤药物的研发与筛选
在肿瘤的治疗过程中抗肿瘤药物是不可或缺。传统的药物筛选只能在细胞系和小鼠模型中进行,由于细胞系的种类有限而小鼠模型不能很好的展现出人肿瘤的异质性,类器官则可以弥补二者不足[38]。Verissimo等[19]在体外利用原代肿瘤类器官库的基因多样性来研究RAS基因突变在结直肠癌中的耐药性机制。发现RAS基因突变与EGRF抑制剂有强烈的内在关联,且RAS基因突变在抵抗抑制剂方面是将细胞周期停滞而在RAS野生型肿瘤中则发生细胞死亡。Emmink等[39]研究发现在结直肠癌中ABCB1positive/ALDHlow分化肿瘤细胞能够将伊立替康(拓扑异构酶I抑制剂)泵入到类器官的腔中从而保护ALDHlow/ABCB1positive肿瘤起始细胞免受药物的杀伤,在正常肠上皮组织中也有类似抗药性机制,作者推测肠上皮干细胞是多种不同类型肿瘤细胞的起源。Walsh等[40]通过定量的光学成像在原代肿瘤类器官中药物代谢来预测乳腺癌中药物的反应,同时研究了在冻存后的肿瘤组织与新鲜肿瘤组织培养的类器官在药物反应方面的差别,发现在DMSO条件下冻存后的肿瘤类器官有更精确的药物反应[41]。
5.3 肿瘤靶向治疗与个体化医疗
靶向治疗在恶性肿瘤治疗中是针对特定致癌位点(基因片段或蛋白分子)来定向杀死肿瘤细胞,从而显著提高患者的无病生存率,靶向药物在肿瘤晚期伴远处脏器转移的患者中也有效果。今后可将手术或肠镜活组织检查的肿瘤患者中取出部分样本进行体外类器官培养,通过测序或病理检测出病变类型来选择靶向药物,最后将选定的靶向药物在肿瘤类器官中检测对肿瘤的杀伤能力以及对正常类器官中组织的影响,从而来确定患者是否适用此种药物[42]。在个体化医疗方面类器官也展现出巨大的优势。囊性纤维化患者由于囊性纤维化膜转导受体(cystic fibrosis transmembrane conductor receptor,CFTR)的转运子突变而引起铁通道离子转运蛋白障碍,使肺泡和胃肠道上皮分泌大量粘液,导致感染、咳嗽、腹泻以及体质量下降等一般儿童期发病且症状持续[43]。由于CFTR缺陷类型近2 000多种故同一药物对不同患者的疗效差异很大。Clevers实验室将1例19岁患者的肠病变类器官体外培养,用最新的药物Kalydeco(一种铁通道开放剂)作用CF类器官后,发现粘液分泌显著改善,随后患者服用药物后症状显著改善[44]。这也是目前类器官成功应用临床个体化治疗的先例。
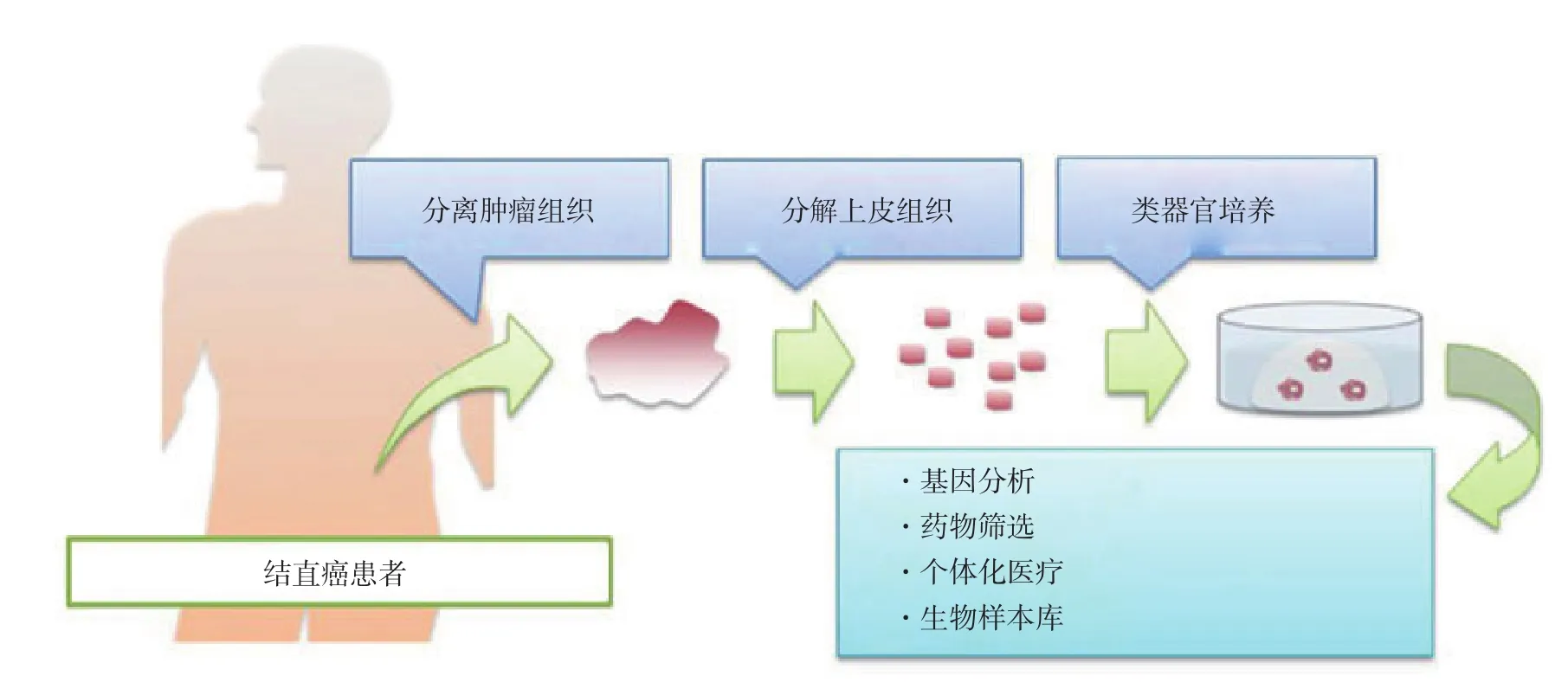
图2 结直肠癌类器官模型的应用[37]Figure 2 Application of organoid models of colorectal cancer[37]
6 肠道疾病模型建立的应用
肠类器官不仅可用于模拟肠道肿瘤的发生发展,还可用于遗传性疾病、感染性疾病、炎症性肠病等模型的建立。目前已经能够稳定培育出从患者来源的多种类器官。在微绒毛融合性疾病及多段小肠闭锁的这些患者来源的小肠上皮类器官上能呈现出混乱的细胞极性和上皮结构[45-46]。炎症性肠病典型特征是胃肠道管腔黏膜的广泛炎症发展,其发病是由于联合了基因敏感性、免疫失调、微生物群紊乱和环境因素等[47]。类器官培养可用于研究细胞死亡、黏膜整合、和炎症因子等对于炎性肠病的影响[47]。许多不同类型的微生物能导致胃肠道疾病或影响敏感个体的发展,类器官可以加深对个体敏感性、微生物感染病理及可能治疗方案的理解[48]。Nigro等[49]用细菌产物、死菌体以及与宿主共生的细菌来与肠道类器官共培养或显微注射的情况下,来连续性观察类器官以及肠干细胞对细菌的反应。在胃类器官中注射幽门螺杆菌导致核内转化因子(NF-κB)的激活,此因子可激活胃癌细胞,这一过程会导致炎症因子—白介素8(IL-8)表达增加。有些幽门螺杆菌变异后表达CagA可增加胃类器官的增殖,这些可能与胃癌发生相关[50]。因此,这些研究表明类器官能模拟和加深对胃肠道疾病的理解与认识。
7 肠道类器官的局限性及展望
尽管类器官模型能展现出诸多的优势,但仍然有一些缺陷:首先,类器官系统包含有多种分化细胞和肿瘤干细胞,但缺乏类似体内环境中肿瘤细胞与多种间质细胞(如:肠神经丛、血管内皮、免疫细胞以及平滑肌等)共存体系,无法在体外模拟肿瘤中的上皮-间质转化(epithelialmesenchymal transitions,EMT)等现象,故类器官模型仍然不能完全代表体内的肿瘤发生发展情况。其次,实验室间培养方法存在差异。不同实验室用于建立肠道类器官的组织来源,生长因子不同,导致类器官之间存在异质性。最后,由于商业性生长因子价格较高,大批量研究成本较大。这些局限性限制了类器官的大批量研究与应用。
通过类器官培养体系可以建立多种胃肠到微型器官模型。这种体系是多细胞性类似于体内模型,能很好保留个体本身异质性,且在体外培养中对生长条件的改变具有灵活性,能够模拟不同疾病的发生发展情况。将基因编辑技术引入类器官模型中,使类器官在结直肠肿瘤发病机制研究与个体化治疗方面展现出巨大优势。未来可优化培养流程,建立标准化培养模式,进一步探索间质细胞与类器官同时在体外培养时相互作用,来模拟与研究更多的肠道疾病。总之,类器官作为第三种临床前肿瘤疾病研究模型可以与前两种模型互为补充,为更好的结直肠肿瘤及其相关的疾病研究服务。
[1]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115–132.doi:10.3322/caac.21338.
[2]Pereira JF,Awatade NT,Loureiro CA,et al.The third dimension:new developments in cell culture models for colorectal research[J].Cell Mol Life Sci,2016,73(21):3971–3989.doi:10.1007/s00018–016–2258–2.
[3]Ahmed D,Eide PW,Eilertsen IA,et al.Epigenetic and genetic features of 24 colon cancer cell lines[J].Oncogenesis,2013,2:e71.doi:10.1038/oncsis.2013.35.
[4]Masters JR.Human cancer cell lines:fact and fantasy[J].Nat Rev Mol Cell Biol,2000,1(3):233–236.
[5]Masters JR.False cell lines:The problem and a solution[J].Cytotechnology,2002,39(2):69–74.doi:10.1023/A:1022908930937.
[6]Jin K,Teng L,Shen Y,et al.Patient-derived human tumour tissue xenografts in immunode fi cient mice:a systematic review[J].Clin Transl Oncol,2010,12(7):473–480.doi:10.1007/s12094–010–0540–6.
[7]Daniel VC,Marchionni L,Hierman JS,et al.A primary xenograft model of small-cell lung cancer reveals irreversible changes in gene expression imposed by culture in vitro [J].Cancer Res,2009,69(8):3364–3373.doi:10.1158/0008–5472.CAN–08–4210.
[8]Guenot D,Guérin E,Aguillon-Romain S,et al.Primary tumour genetic alterations and intra-tumoral heterogeneity are maintained in xenografts of human colon cancers showing chromosome instability[J].J Pathol,2006,208(5):643–652.
[9]Tentler JJ,Tan AC,Weekes CD,et al.Patient-derived tumour xenografts as models for oncology drug development[J].Nat Rev Clin Oncol,2012,9(6):338–350.doi:10.1038/nrclinonc.2012.61.
[10]Hidalgo M,Bruckheimer E,Rajeshkumar NV,et al.A pilot clinical study of treatment guided by personalized tumorgrafts in patients with advanced cancer[J].Mol Cancer Ther,2011,10(8):1311–1316.doi:10.1158/1535–7163.MCT–11–0233.
[11]John T,Kohler D,Pintilie M,et al.The ability to form primary tumor xenografts is predictive of increased risk of disease recurrence in early-stage non-small cell lung cancer[J].Clin Cancer Res,2011,17(1):134–141.doi:10.1158/1078–0432.CCR–10–2224.
[12]Caponigro G,Sellers WR.Advances in the preclinical testing of cancer therapeutic hypotheses[J].Nat Rev Drug Discov,2011,10(3):179–187.doi:10.1038/nrd3385.
[13]Sato T,Vries RG,Snippert HJ,et al.Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche[J].Nature,2009,459(7244):262–265.doi:10.1038/nature07935.
[14]Fatehullah A,Tan SH,Barker N.Organoids as an in vitro model of human development and disease[J].Nat Cell Biol,2016,18(3):246–254.doi:10.1038/ncb3312.
[15]Sato T,Clevers H.SnapShot:Growing Organoids from Stem Cells[J].Cell,2015,161(7):1700.doi:10.1016/j.cell.2015.06.028.
[16]Sato T,Stange DE,Ferrante M,et al.Long-term expansion of epithelial organoids from human colon,adenoma,adenocarcinoma,and Barrett's epithelium[J].Gastroenterology,2011,141(5):1762–1772.doi:10.1053/j.gastro.2011.07.050.
[17]Fujii M,Shimokawa M,Date S,et al.A Colorectal Tumor Organoid Library Demonstrates Progressive Loss of Niche Factor Requirements during Tumorigenesis[J].Cell Stem Cell,2016,18(6):827–838.doi:10.1016/j.stem.2016.04.003.
[18]Matano M,Date S,Shimokawa M,et al.Modeling colorectal cancer using CRISPR-Cas9-mediated engineering of human intestinal organoids[J].Nat Med,2015,21(3):256–262.doi:10.1038/nm.3802.
[19]Verissimo CS,Overmeer RM,Ponsioen B,et al.Targeting mutant RAS in patient-derived colorectal cancer organoids by combinatorial drug screening[J].Elife,2016,5.pii:e18489.doi:10.7554/eLife.18489.
[20]Sachs N,Clevers H.Organoid cultures for the analysis of cancer phenotypes[J].Curr Opin Genet Dev,2014,24:68–73.doi:10.1016/j.gde.2013.11.012.
[21]Yin X,Mead BE,Safaee H,et al.Engineering Stem Cell Organoids[J].Cell Stem Cell,2016,18(1):25–38.doi:10.1016/j.stem.2015.12.005.
[22]Clevers H.Modeling development and disease with organoids[J].Cell,2016,165(7):1586–1597.doi:10.1016/j.cell.2016.05.082.
[23]Clevers H.Searching for adult stem cells in the intestine[J].EMBO Mol Med,2009,1(5):255–259.doi:10.1002/emmm.200900034.
[24]Clevers H.The intestinal crypt,a prototype stem cell compartment[J].Cell,2013,154(2):274–284.doi:10.1016/j.cell.2013.07.004.
[25]Mahe MM,Aihara E,Schumacher MA,et al.Establishment of Gastrointestinal Epithelial Organoids[J].Curr Protoc Mouse Biol,2013,3(4):217–240.doi:10.1002/9780470942390.mo130179.
[26]Mahe MM,Sundaram N,Watson CL,et al.Establishment of human epithelial enteroids and colonoids from whole tissue and biopsy[J].J Vis Exp,2015,(97).doi:10.3791/52483.
[27]Sato T,Clevers H.Growing self-organizing mini-guts from a single intestinal stem cell:mechanism and applications[J].Science,2013,340(6137):1190–1194.doi:10.1126/science.1234852.
[28]Xue X,Shah YM.In vitro organoid culture of primary mouse colon tumors[J].J Vis Exp,2013,(75):e50210.doi:10.3791/50210.
[29]van de Wetering M,Francies HE,Francis JM,et al.Prospective derivation of a living organoid biobank of colorectal cancer patients[J].Cell,2015,161(4):933–945.doi:10.1016/j.cell.2015.03.053.
[30]Salahudeen AA,Kuo CJ1.Toward recreating colon cancer in human organoids[J].Nat Med,2015,21(3):215–216.doi:10.1038/nm.3818.
[31]Finkbeiner SR,Freeman JJ,Wieck MM,et al.Generation of tissueengineered small intestine using embryonic stem cell-derived human intestinal organoids[J].Biol Open,2015,4(11):1462–1472.doi:10.1242/bio.013235.
[32]Spence JR,Mayhew CN,Rankin SA,et al.Directed differentiation of human pluripotent stem cells into intestinal tissue in vitro[J].Nature,2011,470(7332):105–109.doi:10.1038/nature09691.
[33]Noguchi TK,Ninomiya N,Sekine M,et al.Generation of stomach tissue from mouse embryonic stem cells[J].Nat Cell Biol,2015,17(8):984–993.doi:10.1038/ncb3200.
[34]Fearon ER.Molecular genetics of colorectal cancer[J].Annu Rev Pathol,2011,6:479–507.doi:10.1146/annurevpathol–011110–130235.
[35]Drost J,van Jaarsveld RH,Ponsioen B,et al.Sequential cancer mutations in cultured human intestinal stem cells[J].Nature,2015,521(7550):43–47.doi:10.1038/nature14415.
[36]Fumagalli A,Drost J,Suijkerbuijk SJ,et al.Genetic dissection of colorectal cancer progression by orthotopic transplantation of engineered cancer organoids [J].Proc Natl Acad Sci U S A,2017,114(12):E2357–2364.doi:10.1073/pnas.1701219114.
[37]Ohta Y,Sato T.Intestinal tumor in a dish[J].Front Med (Lausanne),2014,1:14.doi:10.3389/fmed.2014.00014.
[38]Golovko D,Kedrin D,Yilmaz ÖH,et al.Colorectal cancer models for novel drug discovery[J].Expert Opin Drug Discov,2015,10(11):1217–1229.doi:10.1517/17460441.2015.1079618.
[39]Emmink BL,Van Houdt WJ,Vries RG,et al.Differentiated human colorectal cancer cells protect tumor-initiating cells from irinotecan[J].Gastroenterology,2011,141(1):269–278.doi:10.1053/j.gastro.2011.03.052.
[40]Walsh AJ,Cook RS,Sanders ME,et al.Quantitative optical imaging of primary tumor organoid metabolism predicts drug response in breast cancer[J].Cancer Res,2014,74(18):5184–5194.doi:10.1158/0008–5472.CAN–14–0663.
[41]Walsh AJ,Cook RS,Sanders ME,et al.Drug response in organoids generated from frozen primary tumor tissues[J].Sci Rep,2016,6:18889.doi:10.1038/srep18889.
[42]Brody H.Colorectal cancer[J].Nature,2015,521(7551):S1.doi:10.1038/521S1a.
[43]Ratjen F,Döring G.Cystic fi brosis[J].Lancet,2003,361(9358):681–689.
[44]Saini A.Cystic Fibrosis Patients Benefit from Mini Guts[J].Cell Stem Cell,2016,19(4):425–427.doi:http://dx.doi.org/10.1016/j.stem.2016.09.001.
[45]Wiegerinck CL,Janecke AR,Schneeberger K,et al.Loss of syntaxin 3 causes variant microvillus inclusion disease[J].Gastroenterology,2014,147(1):65–68.doi:10.1053/j.gastro.2014.04.002.
[46]Bigorgne AE,Farin HF,Lemoine R,et al.TTC7A mutations disrupt intestinal epithelial apicobasal polarity[J].J Clin Invest,2014,124(1):328–337.
[47]Okamoto R,Watanabe M.Perspectives for Regenerative Medicine in the Treatment of Inflammatory Bowel Diseases[J].Digestion,2015,92(2):73–77.doi:10.1159/000438663.
[48]Schumacher MA,Aihara E,Feng R,et al.The use of murine-derived fundic organoids in studies of gastric physiology[J].J Physiol,2015,593(8):1809–1827.doi:10.1113/jphysiol.2014.283028.
[49]Nigro G,Hanson M,Fevre C,et al.Intestinal Organoids as a Novel Tool to Study Microbes-Epithelium Interactions[J].Methods Mol Biol,2016.[Epub ahead of print]
[50]Bartfeld S,Bayram T,van de Wetering M,et al.In vitro expansion of human gastric epithelial stem cells and their responses to bacterial infection[J].Gastroenterology,2015,148(1):126–136.doi:10.1053/j.gastro.2014.09.042.

