酸碱处理对鱼肉蛋白凝胶特性影响的研究进展
邵俊杰++张美琴++吴光红++黄鸿兵
摘 要:我国鱼肉产量巨大,消费量也持续快速增长,但目前国内鱼肉精深加工技术落后,资源浪费严重。与传统加工处理相比,酸碱处理作为一种新型的肌肉蛋白提取和加工技术,不仅能提高蛋白回收率,还能改变蛋白构象,改善蛋白加工特性,提高产品附加值。本文概述酸碱处理对热诱导的鱼肉蛋白凝胶的强度、颜色和保水性等加工特性的影响,探讨了经过酸碱处理后肌球蛋白构象的变化,展望了酸碱处理在鱼肉精深加工领域的应用前景,为鱼肉制品品质改善和新产品研发提供科学依据。
关键词:酸碱处理;凝胶强度;颜色;保水性;蛋白构象
Recent Progress in Understanding the Effects of Isoelectric Solubilization Precipitation (ISP) on
Gel Properties of Fish Proteins
SHAO Junjie1, ZHANG Meiqin1,*, WU Guanghong1, HUANG Hongbing1, XU Xinglian2
(1.Freshwater Fisheries Research Institute of Jiangsu Province, Nanjing 210017, China;
2.College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Abstract: The fish production is huge and fish consumption continues to grow rapidly in China. However, backward deep processing technologies result in a serious waste of fish resources. Compared to the conventional process, isoelectric solubilization/precipitation (ISP) as a new approach for the extraction and processing of muscle proteins, could increase protein recovery and change protein conformations to improve processing characteristics and to develop high value-added products. The effects of ISP on the gel strength, color and water-holding capability of heat-induced gels made from fish proteins are summarized in this article. Then the conformational changes of myosin treated by ISP are discussed. Finally, we conclude with some discussions on the future prospects of ISP for applications in fish deep processing. This review will hopefully provide guidance on improving the quality of fish products and developing new products.
Key words: isoelectric solubilization precipitation (ISP); gel strength; color; water-holding capability; protein conformation
DOI:10.7506/rlyj1001-8123-201703011
中圖分类号:TS201.1 文献标志码:A 文章编号:1001-8123(2017)03-0056-06
引文格式:
邵俊杰, 张美琴, 吴光红, 等. 酸碱处理对鱼肉蛋白凝胶特性影响的研究进展[J]. 肉类研究, 2017, 31(3): 56-61. DOI:10.7506/rlyj1001-8123-201703011. http://www.rlyj.pub
SHAO Junjie, ZHANG Meiqin, WU Guanghong, et al. Recent progress in understanding the effects of isoelectric solubilization precipitation (ISP) on gel properties of fish proteins[J]. Meat Research, 2017, 31(3): 56-61. (in Chinese with English abstract) DOI:10.7506/rlyj1001-8123-201703011. http://www.rlyj.pub
我国鱼肉资源丰富,产量逐年提高,但鱼肉加工率低,仍以鲜食为主,价值低廉。同时,鱼骨架复杂,腥味较重,使用传统加工方法(机械分离、水洗等)很难将肌肉与骨骼、色素等完全分离,易造成蛋白质利用率低和功能特性变差[1]。因此,如何改善鱼肉蛋白的功能特性,提高其经济价值和利用率,是水产品加工行业亟待解决的问题。相对于传统加工技术,酸碱处理能够显著提高蛋白质得率,改善蛋白加工特性,提高产品附加值[2-3]。
凝胶特性是评价鱼糜制品质量的关键因素,直接决定了鱼糜制品的出品率、黏结性、保水性和组织特性等,能显著影响产品的商业价值[4]。目前,国内外的研究重点主要集中在利用酸碱处理分离肌肉蛋白,而关于酸碱处理对鱼肉蛋白凝胶特性影响的研究较少。因此,本研究着重介绍酸碱处理对鱼肉蛋白凝胶特性的影响,并对酸碱处理在鱼肉加工领域的应用前景作了展望,为提高鱼肉的精深加工水平提供理论支持。
1 鱼肉蛋白凝胶特性
形成凝胶的能力是肌肉蛋白在加工过程中最重要的物理化学特性之一[5-6]。鱼糜凝胶化的方法主要包括热诱导凝胶化、压力诱导凝胶化和超声波辅助凝胶化,而加热是鱼糜加工最常见和最重要的加工方式,对鱼糜凝胶特性有重要影响。热诱导的蛋白质凝胶形成需要2 步,一是蛋白质受热发生变性、展开;二是蛋白质展开后,疏水基团暴露出来,蛋白分子间相互作用增加,蛋白发生交联,形成集聚体,当集聚体达到一定程度后,形成稳定、连续的网络结构,该网络结构能够保持大量的水分。在加热条件下,蛋白分子间的相互作用不仅得到加强,而且内部的巯基也暴露出来,促使二硫键形成和交换,增强了网络结构稳定性。肌肉蛋白凝胶的微细结构与碎肉制品的切片性、质构、保水性和外观等紧密相关[7]。鱼糜制品凝胶特性除了与鱼的种类、肌肉类型[8]有关之外,还与加工条件(温度[9]、pH值[10]、
离子强度[11]等)、添加剂(淀粉[12]、壳聚糖[13]、转谷氨酰胺酶[14]等)以及贮藏条件[15]密切相关。
2 酸碱处理方法
漂洗是最常见的鱼糜加工方法,目前较常用的漂洗工艺是清水漂洗2 次后盐水漂洗1 次或者清水漂洗1次后盐水漂洗2 次。漂洗能够除去鱼肉中不良风味物质、色素等[16],但易造成蛋白功能特性降低和水溶性蛋白流失,同时需消耗大量的水,造成生产成本增加[1]。酸碱处理是一种简单高效的蛋白提取方法,根据肌肉蛋白在不同pH值条件下的溶解度不同,先将肌肉蛋白在极端pH值条件(小于3.5或大于10.5)下溶解,除去不溶杂质(皮、骨和鳞等),再将溶解液的pH值调至蛋白质等电点,蛋白质分子发生聚集,然后通过离心回收蛋白沉淀,最后将蛋白质的pH值调至中性。根据不同的pH值溶解條件,将酸碱处理分为酸处理和碱处理[17]。
与传统漂洗处理相比,酸碱处理具有以下几个优势:首先,酸碱处理不需机械剔骨分离出肉糜,而是通过离心或重力作用除去固体杂质,操作简单。其次,酸碱处理能显著提高蛋白回收率[2]。在传统漂洗过程中,鱼糜需要经过2~3 次水洗,导致大部分肌浆蛋白损失,而在酸碱处理过程中,大量肌浆蛋白在等电点pH值条件下沉淀回收。第三,酸碱处理能除去鱼糜中大部分膜脂、中性脂类等,同时能显著降低鱼腥味[18-19]。最后,酸碱处理后的废水中固体颗粒、氮含量和化学需氧量更低,对环境污染小[20-21]。
3 酸碱处理对鱼肉蛋白凝胶特性的影响
3.1 酸碱处理对鱼肉蛋白凝胶强度的影响
凝胶强度是衡量肉制品品质的重要指标之一,直接影响了肉制品的质构特性和感官接受度。在酸碱处理过程中,蛋白在极端pH值条件下溶解,肌原纤维结构被破坏,蛋白质发生变性,导致其凝胶的质构特性发生明显变化[3]。碱处理鲶鱼蛋白的凝胶硬度显著高于传统水洗组,但弹性更低[22-23]。这说明经过碱处理,蛋白发生变性,加热后聚集,蛋白分子间交联增多,形成高强度凝胶,但是蛋白分子与水分子间的相互作用减弱,蛋白形变能力下降,弹性降低[23]。Undeland等[24]认为由于碱处理蛋白保留更多的肌球蛋白重链(myosin heavy chains,MHC),而酸处理使部分MHC发生水解,因此与酸处理相比,碱处理提取的青鱼蛋白的凝胶强度更高。此外,与碱处理和传统水洗处理相比,酸处理引起的巯基氧化程度更高,导致酸处理蛋白中巯基含量最少,所以在凝胶形成过程中酸处理蛋白形成二硫键的能力减弱,同样导致凝胶强度下降。其他研究也发现,碱处理鱼肉蛋白的凝胶强度与传统水洗组更加接近,并且都显著高于酸处理组[25-28]。
与不添加NaCl的碱处理鲶鱼蛋白凝胶相比,添加2% NaCl的碱处理组的凝胶硬度更低,但弹性更高。这可能是由于钠离子和氯离子结合碱处理蛋白分子表面的相反电荷,形成双分子层,增加蛋白分子与水分子的亲和性,水分子结合增多,导致硬度降低,弹性增加[22-23]。然而,随着NaCl含量增加,酸处理或碱处理阿拉斯加鳕鱼蛋白凝胶的硬度和弹性均下降[29];Choi等[30]发现加盐后碱处理竹夹鱼和黄花鱼蛋白凝胶的硬度降低,但弹性保持不变。因此,NaCl对酸碱处理蛋白凝胶的影响与鱼的品种、肌球蛋白异构体等因素有关[23,30]。与传统加工处理相比,酸碱处理改变了肌肉蛋白的功能特性[27],直接导致了在凝胶网络形成过程中NaCl含量对凝胶质构特性的影响发生改变。
3.2 酸碱处理对鱼肉蛋白凝胶颜色的影响
利用酸碱处理和传统水洗处理对斑点叉尾鮰、黄花鱼、岩鱼、胭脂鱼和西班牙马鲛鱼等5 种鱼肉蛋白凝胶的颜色进行了测定,发现在相同处理条件下鱼的种类对凝胶颜色存在一定的影响。斑点叉尾鮰和黄花鱼蛋白凝胶的L*(亮度值)由高到低依次是碱处理组、传统水洗组和酸处理组;岩鱼、胭脂鱼和西班牙马鲛鱼蛋白凝胶的L*由高到低是传统处理组、碱处理组和酸处理组[3,22]。与酸碱处理相比,传统水洗(3 次)处理能够除去更多的肌红蛋白;在碱处理过程中,肌肉蛋白经过在等电点pH值条件下沉淀和第2次离心后,其中大量的血红素蛋白溶解在上清液中被除去;然而,在酸处理过程中,血红素蛋白在等电点pH值条件下被沉淀回收[31]。因此,鲱鱼蛋白凝胶的白度值由高到低依次是传统水洗处理组、碱处理组和酸处理组[22]。
水洗脱能够除去鱼糜中的大部分脂肪和血红蛋白[3]。
与正常酸处理相比,酸处理之前先将青鱼肉糜用3 倍体积的水洗脱,然后进行酸处理,最终得到青鱼蛋白的
黄度值(b*)显著降低,但红度值(a*)与正常酸处理组相比没有明显变化[32]。故推测在正常酸处理过程中,血红蛋白分子被完全氧化,导致a*与酸处理前水洗组没有明显差异,通过检测也发现有大量的高铁血红蛋白和高铁肌红蛋白形成。由于在酸处理过程中未添加抗氧化剂,最终酸处理蛋白都略呈浅灰色[33]。
通常沙丁鱼糜和马鲛鱼糜通过水洗脱或盐水(0.5% NaCl)洗脱制备。在碱处理之前将鱼糜进行水洗,结果发现,沙丁鱼蛋白凝胶的白度值由高到低依次是碱处理前水洗组、正常碱处理组、传统水洗处理组和传统盐水处理组,马鲛鱼蛋白凝胶的白度值由高到低依次是传统水洗处理组、碱处理前水洗处理组、传统盐水处理组和正常碱处理组。沙丁鱼和马鲛鱼的传统盐水处理组和马鲛鱼正常碱处理组的白度值较低可能是因为在处理过程中肌红蛋白发生部分氧化[34]。
3.3 酸碱处理对鱼肉蛋白凝胶保水性的影响
保水性是蛋白凝胶最重要的功能性质之一,能显著影响最终产品的成本和风味。在传统肉制品加工过程中,肌原纤维在NaCl的作用下被解离成为小片段,粗丝和细丝结构被破坏,肌原纤维蛋白溶出,并且其表面结合大量氯离子,导致蛋白分子间的静电斥力增加,肌原纤维发生溶胀,促使更多的水分子与蛋白分子(主要是肌球蛋白分子)相互作用。溶解的肌原纤维蛋白在肉糜表面受热发生交联,形成蛋白矩阵网络,以此来束缚水分子的移
动[35-36]。因此,热诱导的蛋白凝胶通过形成三维网络、增加蛋白分子与水分子间的相互作用达到保水目的。
在酸碱处理过程中,蛋白发生部分变性。为使鱼肉蛋白具有更好的功能特性,需将酸碱处理蛋白最终的pH值调至中性,中性pH值(远离等电点)能够增强蛋白分子间的静电斥力,促进蛋白分子与水分子之间的结合。因此,在不添加NaCl的条件下,酸碱处理蛋白就具有较低的离心损失[37-38]。随着NaCl添加量的增加,酸碱处理鱼肉蛋白凝胶的保水性反而出现明显的下降。Kim等[29]指出在传统加工过程中,NaCl促进肌原纤维蛋白溶解,发生盐溶效应,但酸碱处理鱼肉蛋白在低盐条件(1%~2% NaCl)下就可能发生盐析效应,肌原纤维蛋白不溶解,导致保水性下降。de Witt等[39]也发现在添加2% NaCl条件下,酸碱处理鲶鱼蛋白凝胶的保水能力低于传统水洗处理组。然而,在无NaCl存在时,其保水能力显著高于传统水洗处理组(添加2% NaCl)[38]。酸堿处理蛋白的凝胶特性与天然蛋白存在较大差异,导致NaCl在酸碱处理蛋白热诱导凝胶形成过程中发挥的保水作用显著减弱,上述研究结果也证明,酸碱处理蛋白凝胶在无NaCl或低NaCl含量条件下具有更高的保水能力。目前我国居民每天钠摄入量过高,这容易引发高血压等心脑血管疾病,因此酸碱处理为研发低钠凝胶类肉制品提供了新思路[37]。
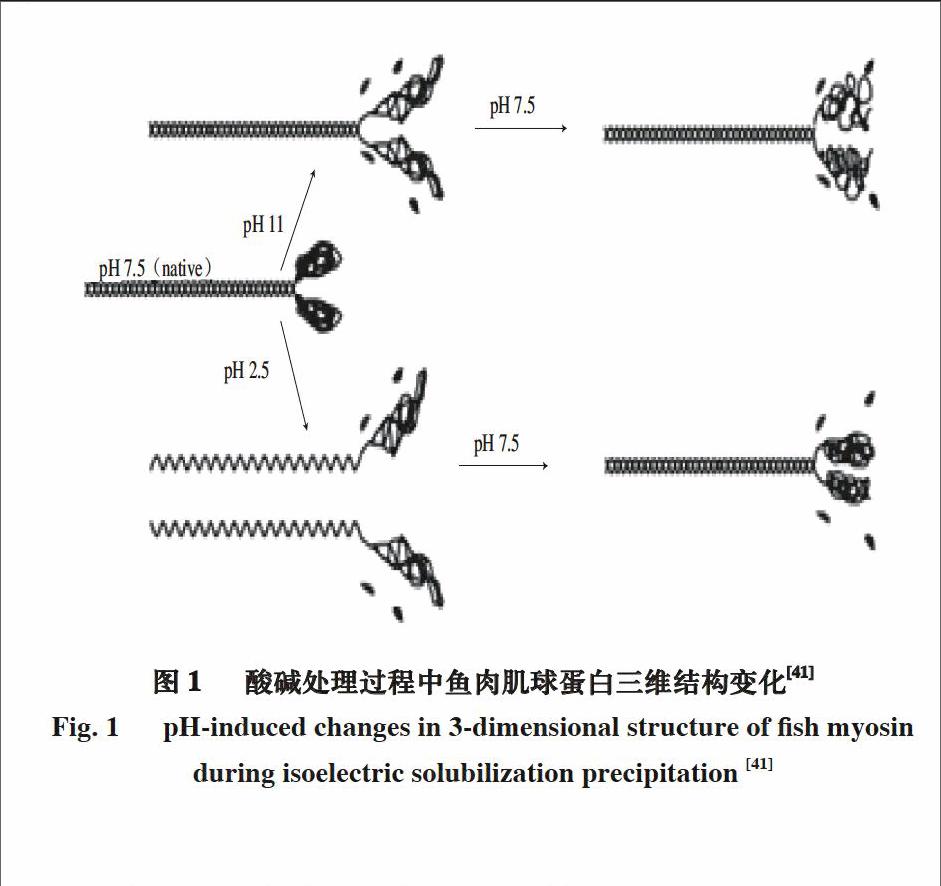
4 酸碱处理对肌球蛋白构象的影响
肌球蛋白是肌肉中最重要也是含量最高的蛋白质,约占肌肉总蛋白质的1/3,占肌原纤维蛋白的50%~60%,它由2 条分子质量为220 kD的MHC和4条轻链(18~25 kD)组成。每条MHC由球状头部结构和杆状尾部结构构成,MHC对肌肉蛋白的功能特性(保水性、凝胶形成能力和乳化稳定性等)具有显著影响[40]。酸碱处理通过改变MHC的构象(图1),使肌球蛋白的功能特性发生变化[41]。在酸性或碱性pH值条件下溶解时,肌球蛋白发生解折叠,三级结构被破坏,约70%的轻链丢失。在酸处理过程中,肌球蛋白杆状尾部结构完全解离;当pH值调至中性后,尾部结构又重新结合,恢复成天然状态,而球状头部结构发生重新折叠,大量疏水基团暴露在表面,最终呈“熔融态”球体。在碱处理过程中,MHC尾部结构也没有发生变化,但其头部结构发生明显的错误折叠,最终形成一个不完整的、不规则的三级结构[42-43]。因此,传统加工处理、酸处理和碱处理对肌球蛋白三级结构的影响不同,最终导致肌肉蛋白功能特性存在差异[44]。
传统水洗处理不会影响肌肉蛋白的二级结构[45],但酸碱处理引起肌肉蛋白中α-螺旋含量降低,β-折叠含量增加[29]。α-螺旋减少有利于降低肌肉蛋白的黏性;β-折叠增多能增强蛋白分子间的相互作用,减弱肌球蛋白分子间的流动性,提高弹性,促使酸碱处理蛋白在低温或低盐条件下就能形成凝胶[46-47]。此外拉曼光谱结果显示,与传统水洗处理相比,酸碱处理蛋白的氨基酸侧链和肽链骨架暴露的更多,导致蛋白分子间交联增多,同样有利于凝胶形成[48]。
图 1 酸碱处理过程中鱼肉肌球蛋白三维结构变化[41]
Fig. 1 pH-induced changes in 3-dimensional structure of fish myosin during isoelectric solubilization precipitation [41]
5 酸碱处理在肉制品加工领域的应用
酸碱处理技术最初是用于鱼下脚料蛋白质的回收利用,随着研究深入,酸碱处理蛋白作为食品添加剂被应用在提高肉制品的品质上。酸碱处理蛋白可作为油炸食品的裹料、注射或滚揉的腌泡汁(提高肉制品的嫩度、保水性)、蛋白酶的作用底物以及具有抗氧化性、生物活性的功能食品添加剂。Proteus公司使用酸处理工艺生产出一种粉末状水溶性肌肉蛋白,该蛋白粉末可以作为油炸制品的表层涂料,能有效限制在烹饪过程中脂肪的进入和水分的流失,结果表明,该酸处理蛋白粉末能够降低50%的脂肪含量和提高13%的水分含量[3]。比较磷酸盐注射液和酸处理鱼肉蛋白注射液对肌肉嫩度的影响,结果表明,酸处理蛋白注射液能够提高肌肉的嫩度,并且与磷酸盐的作用效果差异不显著[49]。将碱处理罗非鱼蛋白用5 种酶酶解,酶解液加入到鳕鱼肉糜中可以起到抗氧化作用[50]。此外,酸处理鳕鱼蛋白可作为乳化剂,用于食品乳化体系[51]。
酸碱处理也可作为一种脱腥技术,在水产品去腥方面发挥重要作用。与传统水洗脱腥相比,酸碱处理能够更有效除去鲫鱼脂肪中的土臭素和2-甲基异冰片,达到脱腥目的[52]。付湘晋等[53]研究发现碱处理能够显著降低鲢鱼腥味,并且碱处理蛋白加酵母脱腥可以得到完全无腥味的鱼肉蛋白。张乾元[54]发现碱处理提取的厚壳贻贝蛋白呈褐色,异味较重,而酸处理组没有异味,并且腥味显著降低。这可能是由于在酸性条件下,产生腥味和异味的物质发生水解,从而降低了厚壳贻贝的腥味和异味。总之,酸碱处理技术已经被应用于肉制品加工领域,可极大提高未被充分利用的肌肉蛋白价值。
尽管如此,国内外酸碱处理技术的发展仍存在不足[3]。首先,目前的研究成果更多的局限于實验室研究阶段,仅少部分成果转化为产品,并投放于市场;其次,缺少大型酸碱处理加工设备,自动化水平低。
6 结 语
我国是鱼类肉制品的生产和消费大国,但与发达国家相比,我国的鱼肉精深加工技术明显落后。酸碱处理技术在充分利用鱼肉资源、提高鱼肉蛋白加工特性和生产高附加值鱼肉制品等方面具有明显优势。酸碱处理蛋白作为功能食品添加剂,能显著改善产品品质,具有极大市场潜力。利用酸碱处理生产低钠凝胶类肉制品,是未来改善居民饮食结构、实现健康生活的新方向。除此之外,关于酸碱处理蛋白的食用安全性、冻藏稳定性、风味和氧化特性等还需深入研究。
参考文献:
[1] 秦影, 欧昌荣, 汤海青, 等. 鱼糜制品凝胶特性研究进展[J]. 核农学报, 2015, 29(9): 1766-1773. DOI:10.11869/j.issn.100-8551.2015.09.1766.
[2] 陈二生, 许学勤, 许艳顺, 等. 鲢鱼鱼糜采肉下脚料碱溶蛋白的制备工艺研究[J]. 食品工业科技, 2014, 35(18): 264-267. DOI:10.13386/j.issn1002-0306.2014.18.050.
[3] NOLS?E H, UNDELAND I. The acid and alkaline solubilization process for the isolation of muscle proteins: state of the art[J]. Food and Bioprocess Technology, 2009, 2(1): 1-27. DOI:10.1007/s11947-008-0088-4.
[4] 姜国庆, 刘英丽, 张慧娟, 等. 肌原纤维蛋白热诱导凝胶特性研究进展[J]. 肉类研究, 2013, 27(12): 19-22.
[5] 王嵬, 仪淑敏, 李学鹏, 等. 鱼糜凝胶的形成机制及混合鱼糜研究进展[J]. 食品安全质量检测学报, 2016, 7(1): 231-237.
[6] 曹莹莹, 张亮, 王鹏, 等. 超高压结合热处理对肌球蛋白凝胶特性及蛋白二级结构的影响[J]. 肉类研究, 2013, 27(1): 1-7.
[7] ZHAO Y Y, WANG P, ZOU Y F, et al. Effect of pre-emulsification of plant lipid treated by pulsed ultrasound on the functional properties of chicken breast myofibrillar protein composite gel[J]. Food Research International, 2014, 58: 98-104. DOI:10.1016/j.foodres.2014.01.024.
[8] YUAN C, FUKUDA Y, KANENIWA M, et al. Comparison of gel-forming properties of silver carp (Hypophthalmichthys molitrix) surimi prepared in different seasons[J]. Journal of Food Science, 2005, 70(5): C326-C331. DOI:10.1111/j.1365-2621.2005.tb09961.x.
[9] 潘丽华, 冯美琴, 孙健, 等. 不同温度下亚麻籽胶对肌原纤维蛋白凝胶特性的影响及机制[J]. 食品科学, 2016, 37(9): 1-6. DOI:10.7506/spkx1002-6630-201609001.
[10] 缪进, 邹玉峰, 王鹏, 等. 水洗结合pH值调整对鸡肉糜低盐热凝胶特性的影响[J]. 农业工程学报, 2013, 28(24): 287-292. DOI:10.3969/j.issn.1002-6819.2012.24.039.
[11] 赵晓阳, 李可, 邹玉峰, 等. 组氨酸与氯化钾混合液对兔肉肌球蛋白特性的影响[J]. 食品科学, 2014, 35(9): 6-10. DOI:10.7506/spkx1002-6630-201409002.
[12] 曹立伟, 熊善柏, 李莎莎, 等. 变性淀粉对鲢鱼糜冻结速率及凝胶特性的影响[J]. 水产学报, 2014, 38(9): 1592-1599. DOI:10.3724/SP.J.1231.2014.49228.
[13] 张茜, 夏文水. 壳聚糖对鲢鱼糜凝胶特性的影响[J]. 水产学报, 2010, 34(3): 342-348. DOI:10.3724/SP.J.1231.2010.06489.
[14] 夏秀芳, 王博, 伊东, 等. 转谷氨酰胺酶和淀粉复配对肌原纤维蛋白凝胶特性的影响[J]. 中国食品学报, 2016, 16(6): 51-56. DOI:10.16429/j.1009-7848.2016.06.008.
[15] 刘寿春, 钟赛意, 李平兰, 等. 蛋白质降解指示冷藏罗非鱼片品质劣变研究[J]. 食品科学, 2013, 34(2): 241-245.
[16] 王玉凤, 李八方, 张朝辉. 漂洗对鲢鱼鱼糜凝胶和质构特性的影响[J]. 食品科学, 2013, 34(14): 122-125. DOI:10.7506/spkx1002-6630-201314025.
[17] TAHERGORABI R, BEAMER S K, MATAK K E, et al. Chemical properties of omega-3 fortified gels made of protein isolate recovered with isoelectric solubilisation/precipitation from whole fish[J]. Food Chemistry, 2013, 139(1): 777-785. DOI:10.1016/j.foodchem.2013.01.077.
[18] CHANG T, WANG C, YANG H, et al. Effects of the acid-and alkali-aided processes on bighead carp (Aristichthys nobilis) muscle proteins[J]. International Journal of Food Properties, 2016, 19(8): 1863-1873. DOI:10.1080/10942912.2015.1085395.
[19] TIAN J, WANG Y, ZHU Z, et al. Recovery of tilapia (Oreochromis niloticus) protein isolate by high-intensity ultrasound-aided alkaline isoelectric solubilization/precipitation process[J]. Food and Bioprocess Technology, 2015, 8(4): 758-769. DOI:10.1007/s11947-014-1431-6.
[20] MATAK K E, TAHERGORABI R, JACZYNSKI J. A review: protein isolates recovered by isoelectric solubilization/precipitation processing from muscle food by-products as a component of nutraceutical foods[J]. Food Research International, 2015, 77: 697-703. DOI:10.1016/j.foodres.2015.05.048.
[21] ZHAO X, CHEN X, HAN M, et al. Application of isoelectric solubilization/precipitation processing to improve gelation properties of protein isolated from pale, soft, exudative (PSE)-like chicken breast meat[J]. LWT-Food Science and Technology, 2016, 72: 141-148. DOI:10.1016/j.lwt.2016.04.045.
[22] P?REZ-MATEOS M, LANIER T C. Comparison of Atlantic menhaden gels from surimi processed by acid or alkaline solubilization[J]. Food Chemistry, 2007, 101(3): 1223-1229. DOI:10.1016/j.foodchem.2006.03.026.
[23] TADPITCHAYANGKOON P, YONGSAWATDIGUL J. Comparative study of washing treatments and alkali extraction on gelation characteristics of striped catfish (Pangasius hypophthalmus) muscle protein[J]. Journal of Food Science, 2009, 74(3): C284-C291. DOI:10.1111/j.1750-3841.2009.01110.x.
[24] UNDELAND I, KELLEHER S D, HULTIN H O. Recovery of functional proteins from herring (Clupea harengus) light muscle by an acid or alkaline solubilization process[J]. Journal of Agricultural and Food Chemistry, 2002, 50(25): 7371-7379. DOI:10.1021/jf020199u.
[25] YONGSAWATDIGUL J, PARK J. Effects of alkali and acid solubilization on gelation characteristics of rockfish muscle proteins[J]. Journal of Food Science, 2004, 69(7): 499-505. DOI:10.1111/j.1365-2621.2004.tb13642.x.
[26] TAHERGORABI R, IBRAHIM S. Functional food product development from fish processing by-products using isoelectric solubilization/precipitation[C]//Proceedings of the 2013 National Conference on Advances in Environmental Science and Technology. Springer International Publishing, 2016: 179-183.
[27] KRISTINSSON H G, HULTIN H O. Effect of low and high pH treatment on the functional properties of cod muscle proteins[J]. Journal of Agricultural and Food Chemistry, 2003, 51(17): 5103-5110. DOI:10.1021/jf026138d.
[28] PAKER I, BEAMER S, JACZYNSKI J, et al. The effect of organic acids on gelation characteristics of protein gels made from silver carp (Hypophthalmichthys molitrix) protein recovered by isoelectric solubilization and precipitation[J]. LWT-Food Science and Technology, 2013, 53(1): 37-43. DOI:10.1016/j.lwt.2013.02.003.
[29] KIM Y S, PARK J W. Negative roles of salt in gelation properties of fish protein isolate[J]. Journal of Food Science, 2008, 73(8): C585-C588. DOI:10.1111/j.1750-3841.2008.00900.x.
[30] CHOI J Y, KIM J S. Fish protein recovered using pH shifting method and its physicochemical properties[J]. Journal of Ocean University of China, 2005, 4(3): 224-228. DOI:10.1007/s11802-005-0037-z.
[31] CHOI Y J, PARK J W. Acid-aided protein recovery from enzyme - rich pacific whiting[J]. Journal of Food Science, 2002, 67(8): 2962-2967. DOI:10.1111/j.1365-2621.2002.tb08846.x.
[32] UNDELAND I, HALL G, WENDIN K, et al. Preventing lipid oxidation during recovery of functional proteins from herring (Clupea harengus) fillets by an acid solubilization process[J]. Journal of Agricultural and Food Chemistry, 2005, 53(14): 5625-5634. DOI:10.1021/jf0404445.
[33] ZHONG S, LIU S, CAO J, et al. Fish protein isolates recovered from silver carp (Hypophthalmichthys molitrix) by-products using alkaline pH solubilization and precipitation[J]. Journal of Aquatic Food Product Technology, 2016, 25(3): 400-413. DOI:10.1080/10498850.2013.865282.
[34] CHAIJAN M, BENJAKUL S, VISESSANGUAN W, et al. Physicochemical properties, gel-forming ability and myoglobin content of sardine (Sardinella gibbosa) and mackerel (Rastrelliger kanagurta) surimi produced by conventional method and alkaline solubilisation process[J]. European Food Research and Technology, 2006, 222(1): 58-63. DOI:10.1007/s00217-005-0091-1.
[35] KANG Z L, ZOU Y F, XU X L, et al. Effect of a beating process, as a means of reducing salt content in Chinese-style meatballs (kung-wan): a physico-chemical and textural study[J]. Meat Science, 2014, 96(1): 147-152. DOI:10.1016/j.meatsci.2013.06.019.
[36] LI K, KANG Z L, ZHAO Y Y, et al. Use of high-intensity ultrasound to improve functional properties of batter suspensions prepared from PSE-like chicken breast meat[J]. Food and Bioprocess Technology, 2014, 7(12): 3466-3477. DOI:10.1007/s11947-014-1358-y.
[37] SHAO J J, ZOU Y F, XU X L, et al. Effects of NaCl on water characteristics of heat-induced gels made from chicken breast proteins treated by isoelectric solubilization/precipitation[J]. CyTA-Journal of Food, 2016, 14(1): 145-153. DOI:10.1080/19476337.2015.1071432.
[38] JAMES J M, de WITT C A. Gel attributes of beef heart when treated by acid solubilization isoelectric precipitation[J]. Journal of Food Science, 2004, 69(6): C473-C479. DOI:10.1111/j.1365-2621.2004.tb10991.x.
[39] de WITT C A M, NABORS R L, KLEINHOLZ C W. Pilot plant scale production of protein from catfish treated by acid solubilization/isoelectric precipitation[J]. Journal of Food Science, 2007, 72(6): E351-E355. DOI:10.1111/j.1750-3841.2007.00407.x.
[40] 劉建华, 徐秋红, 赵培城, 等. 肌肉蛋白热诱导凝胶特性的影响因素及其机制[J]. 食品与发酵工业, 2014, 40(8): 238-245. DOI:10.13995/j.cnki.11-1802/ts.2014.08.044.
[41] KRISTINSSON H G, HULTIN H O. Changes in conformation and subunit assembly of cod myosin at low and high pH and after subsequent refolding[J]. Journal of Agricultural and Food Chemistry, 2003, 51(24): 7187-7196. DOI:10.1021/jf026193m.
[42] GEHRING C K, GIGLIOTTI J C, MORITZ J S, et al. Functional and nutritional characteristics of proteins and lipids recovered by isoelectric processing of fish by-products and low-value fish: a review[J]. Food Chemistry, 2011, 124(2): 422-431. DOI:10.1016/j.foodchem.2010.06.078.
[43] JIANG J, XIONG Y L. Extreme pH treatments enhance the structure-reinforcement role of soy protein isolate and its emulsions in pork myofibrillar protein gels in the presence of microbial transglutaminase[J]. Meat Science, 2013, 93(3): 469-476. DOI:10.1016/j.meatsci.2012.11.002.
[44] SUN L C, KANEKO K, OKAZAKI E, et al. Comparative study of proteins recovered from whole North Pacific krill Euphausia pacifica by acidic and alkaline treatment during isoelectric solubilization/precipitation[J]. Fisheries Science, 2013, 79(3): 537-546. DOI:10.1007/s12562-013-0625-6.
[45] HERRERO A M, CARMONA P, LO?PEZ-LO?PEZ I, et al. Raman spectroscopic evaluation of meat batter structural changes induced by thermal treatment and salt addition[J]. Journal of Agricultural and Food Chemistry, 2008, 56(16): 7119-7124. DOI:10.1021/jf800925s.
[46] LIU R, ZHAO S, XIONG S, et al. Role of secondary structures in the gelation of porcine myosin at different pH values[J]. Meat Science, 2008, 80(3): 632-639. DOI:10.1016/j.meatsci.2008.02.014.
[47] HERRERO A M. Raman spectroscopy a promising technique for quality assessment of meat and fish: a review[J]. Food Chemistry, 2008, 107(4): 1642-1651. DOI:10.1016/j.foodchem.2007.10.014.
[48] THAWORNCHINSOMBUT S, PARK J W, Meng G, et al. Raman spectroscopy determines structural changes associated with gelation properties of fish proteins recovered at alkaline pH[J]. Journal of Agricultural and Food Chemistry, 2006, 54(6): 2178-2187. DOI:10.1021/jf0518958.
[49] VANN D G, de WITT C A M. Evaluation of solubilized proteins as an alternative to phosphates for meat enhancement[J]. Journal of Food Science, 2007, 72(1): C072-C077. DOI:10.1111/j.1750-3841.2006.00238.x.
[50] RAGHAVAN S, KRISTINSSON H G. Antioxidative efficacy of alkali-treated tilapia protein hydrolysates: a comparative study of five enzymes[J]. Journal of Agricultural and Food Chemistry, 2008, 56(4): 1434-1441. DOI:10.1021/jf0733160.
[51] ?ZYURT G, ?IM?EK A, KARAKAYA B T, et al. Functional, physicochemical and nutritional properties of protein from klunzinger?s ponyfish extracted by the pH shifting method[J]. Journal of Food Processing and Preservation, 2015, 39(6): 1934-1943. DOI:10.1111/jfpp.12432.
[52] 王方. 酸碱处理对鲫鱼糜腥味脱除效果及凝胶特性影响的研究[D]. 武汉: 华中农业大学, 2014.
[53] 付湘晋, 许时婴, KIM J. 酸碱法提取鲢鱼蛋白脱腥及酵母脱腥机理[J]. 食品与生物技术学报, 2009, 28(1): 57-62. DOI:10.3321/j.issn:1673-1689.2009.01.012.
[54] 张乾元. 厚壳贻贝脱脂粉蛋白提取, 脱腥及其降血压活性肽制备研究[D]. 杭州: 浙江大学, 2013.

