灵发素(LFS)对诱导半夏体细胞胚胎发生过程中内源激素含量的影响
梁琼月++周凤珏++许鸿源++覃柳兰++何丽珊++何冰
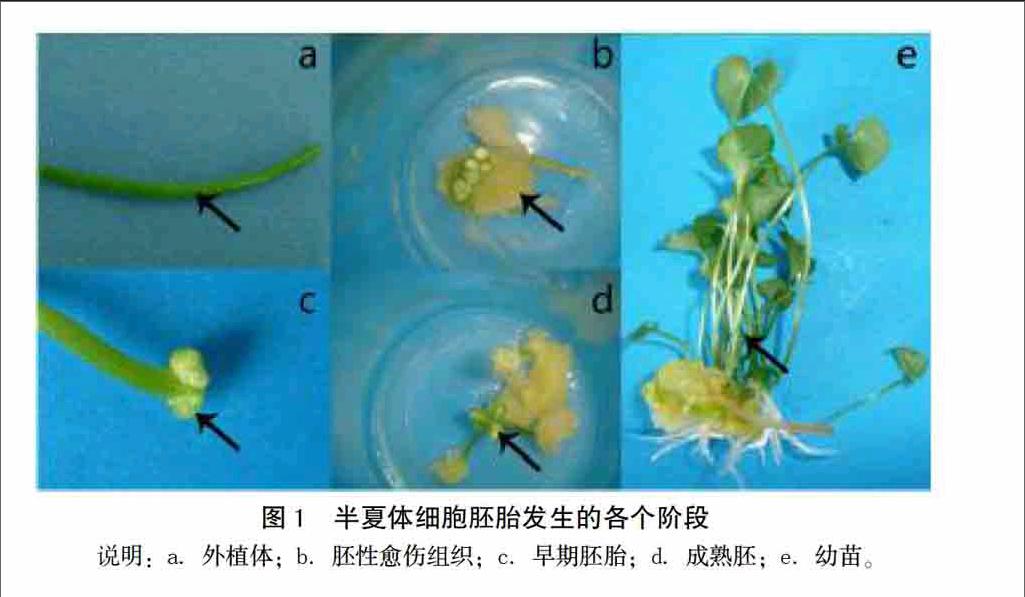
摘 要 以半夏叶柄为材料,比较MS+BA 2.0 mg/L+NAA 0.1 mg/L(CK)和MS+LFS 0.3 mg/L(Lingfasu,LFS,灵发素)2种培养基在诱导体细胞胚胎发生和发育过程中内源激素的变化差异。结果表明:在半夏体细胞胚胎发生和发育过程中,2个处理组内源激素变化趋势,除ABA大致呈“M”状外,IAA、GA3和ZR激素大致呈“∧”状;在半夏体胚发生的重要时期(胚性愈伤组织时期和早期胚时期),LFS处理组中IAA和ABA的含量显著高于CK组,ZR在早期胚时期高于对照29.0%,GA3含量以CK组含量较高。此结果表明,LFS对半夏体细胞胚胎的发生和发育过程中内源激素IAA、ZR、ABA和GA3的调控起着重要作用。
关键词 半夏 ;灵发素(LFS) ;体细胞胚胎 ;内源激素
中图分类号 Q945 ;R282 文献标识码 A Doi:10.12008/j.issn.1009-2196.2017.02.010
Effects of Angustmycin A on Endogenous Hormone Content of
Pinellia ternata(Thunb)Briet during Somatic Embryogenesis
LIANG Qiongyue ZHOU Fengjue XU Hongyuan QIN Liulan HE Lishan HE Bing
(Agricultural Collage, Guangxi University, Nanning, Guangxi 530005)
Abstract The petiole of Pinellia ternata was cultured on the MS+BA 2.0+NAA 0.1(CK) and MS+Angustmycin A 0.3, respectively to observe difference in the change of the endogenous hormones during somatic embryogenesis and embryo development. The result showed that during the somatic embryogenesis and embryo development of P. ternata Briet the endogenous hormones in the two treatment groups tended to showed a "∧" curve for IAA, GA3 and ZR but a "M" curve for ABA. During the important stage of embryogenesis (embryonic callus stage and early embryo development stage), the treatment with the presence of Angustmycin A in the MS had higher IAA and ABA content, higher ZR content (29.0% higher), and higher GA3 content than the control. This indicated that Angustmycin A played an important role in regulating the endogenous hormones IAA, ZR, ABA and GA3 in the process of somatic embryogenesis and embryo development of P. ternata.
Keywords Pinellia ternata Briet ; Angutmycin A ; somatic embryo ; endogenous hormone
半夏[Pinellia ternata(Thunb)Briet]是天南星科半夏屬的一种多年生草本植物,为中国传统中药材,以块茎入药,主要功效为润燥化痰、降逆止呕等[1]。因市场需求不断扩大,野生半夏被过度采摘,资源匮乏,而人工栽培效率不高,因此,组织培养成为扩大半夏繁殖、解决半夏资源紧缺问题的有效途径。植物体细胞胚胎是获得人工种子和再生植株,并进行植物快繁的重要材料。因此,高效优质地获得植物体细胞胚胎已成为近年植物生物学研究的热点和前沿[2-3]。植物生长调节剂是影响植物体组织培养细胞胚胎发生的关键因素。但前人都是以6-BA、NAA、2,4-D等数种常用植物生长调节剂复配而成的多种类、多因素的诱导培养基,经过复杂的生产程序,才能获得体细胞胚胎,生产效率较低。LFS为(Lingfasu,灵发素,代号PGR-08,亦称狭霉素)同时具有细胞分裂素(Cytokinin,CTK)和生长素(Auxin)2大类植物激素生物活性的植物生长调节剂[4-5],在植物体细胞胚胎的诱导中表现出其特有的优势。许鸿源等[6]利用LFS的这一特性建立了简单高效生产半夏体细胞胚胎和再生组培苗技术。同时,LFS单一培养基,已经成功建立了三七[7]、翅子罗汉果[8]和罗汉果[9-11]等名贵中药材组培再生苗简单高效的生产方法。而有关LFS对诱导植物体细胞胚胎发生过程中外植体内源激素含量的影响机制尚未见报道。本研究以LFS简单高效诱导半夏体细胞胚胎发生,并结合其发育过程中激素含量的动态变化情况,探讨半夏培养物体细胞胚胎发生的机理,为有效指导半夏体细胞胚胎的形成提供理论参考,同时为中草药、林木和花卉等植物组织培养繁殖再生苗提供新的技术支持,在学术理论和农业生产实践上都具有积极的意义。
1 材料与方法
1.1 材料
LFS为本实验室自备重结晶品,纯度≥98%。半夏原始外植体为广西药用植物园提供,经钟仕强主任中药师鉴定为Pinellia ternata(Thunb)Briet。参考许鸿源等[6]的方法,用其球茎获得无菌苗,在超净工作台上切取2 cm左右的无菌叶柄段,作为外植体材料进行体细胞胚胎的培养。
1.2 方法
1.2.1 培养基的配制及外植体培养条件
MS为基本培养基,以添加许鸿源等[6]优选出的诱导半夏体细胞胚胎最佳浓度LFS 0.3 mg/L(单位下同)为处理,并以张爱民等[12]和薛建平等[13]研究的常规诱导半夏体细胞胚胎的培养基MS+BA 2.0 mg/L+NAA 0.1 mg/L为对照(CK)进行研究。处理和对照均添加蔗糖30 g/L和琼脂4.5 g/L,调节pH 5.8~6.0,常规灭菌20 min,备用。培养条件:昼/夜温度[(28 ~22℃)±2]℃;光照强度为1 500 lx,10 h/d。共进行3次重复,每次重复接种50瓶,每瓶5个叶柄。
1.2.2 取样
在诱导体细胞胚胎发生期间,分别取外植体、胚性愈伤组织、早期胚、成熟胚和幼苗5个阶段的鲜样各0.8 g左右(图1),并立即用液氮处理, 贮存于-80℃冰箱中,用于激素含量的测定。
1.2.3 内源激素的提取、纯化和测定
采用酶联免疫吸附法(ELISA)分别测定吲哚乙酸(IAA)、玉米素核苷(ZR)、赤霉素(GA3)、脱落酸(ABA)4种激素的含量(以鲜重表示),测定方法参照何钟佩[14]的方法,略有修改,激素测定试剂盒购自中国农业大学作物化学控制实验室。在4℃低温室内用80%甲醇(内含1 mmol/L二叔丁基对甲苯酚BHT)研磨成匀浆, 4℃提取4 h,8 000 r/min离心15 min,沉淀再用80%甲醇提取液提取1 h,再次离心,然后合并上清液,并过C18固相萃取柱。氮气吹干,样品稀释液(NaCl、KH2PO4、Na2HPO4·12H2O、明胶、Tween-20)定容,用ELISA法测定。
2 結果与分析
2.1 IAA含量的变化
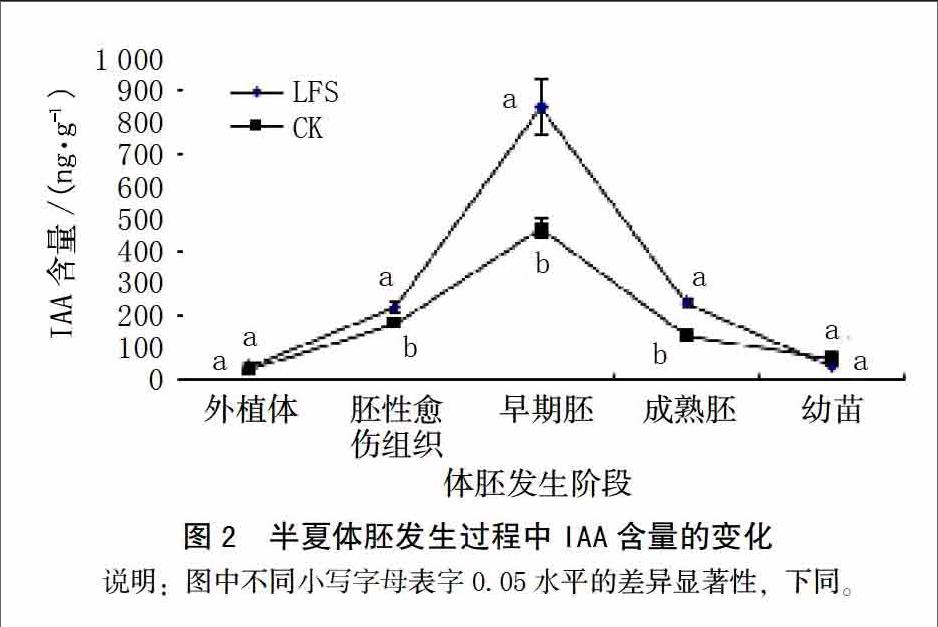
IAA含量的高低直接影响到体细胞胚的诱导。本试验IAA含量的变化情况见图2,CK组与LFS组,由外植体至早期体胚形成,IAA含量圴逐渐升高,之后随着体胚的成熟和萌发成苗,IAA含量又逐渐下降。在整个过程中,除幼苗阶段外,LFS组中的IAA含量均高于CK组,尤其是早期胚阶段LFS组中的IAA含量高出CK组80.7%。这说明LFS处理对IAA的积累具有显著影响,对胚性细胞的启动与早期发育具有重要的意义。
2.2 ZR含量的变化
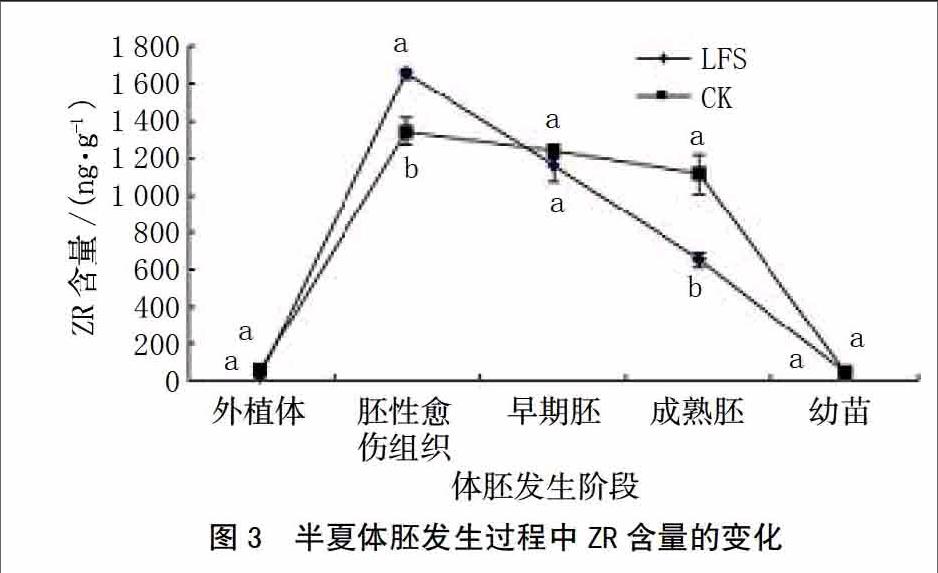
由图3可知,在体胚发生和发育过程中,从外植体分化至胚性愈伤组织时期,2个试验组ZR含量均急剧上升至峰值,然后LFS组中的ZR含量呈直线下降,CK组下降缓慢,直至成熟胚时期急剧下降。在峰值时期LFS组中的ZR含量高于CK组29.0%,这说明外植体在脱分化形成胚性愈伤组织时,合成并积累了大量的ZR,利于细胞的增值和分裂,从而诱导体胚的正常发育,增加单个外植体体胚发生的数量,这对高效获得体细胞胚胎极其重要。
2.3 ABA含量的变化
由图4可知,在体胚发生和发育过程中,ABA含量呈波浪形变化,先是胚性愈伤组织升高到一峰值,接着早期胚时期降到一低谷,然后成熟胚时期又急剧上升到一最高峰,幼苗时期再降低。除成熟胚时期外,整个发育过程中LFS组中的ABA含量均高于CK组。这对抑制体胚早期萌发和畸形胚的形成,防止裂生多胚的现象,从而保证体胚的健康发育及萌发成苗。
2.4 GA3含量的变化
由图5可知,各时期GA3含量呈对称分布。在体胚发生过程中,GA3含量逐渐上升,到早期胚时期达到最大值,再逐渐降低。在整个体胚发生过程中,除了外植体和幼苗时期外,CK组中的GA3含量均高于LFS组,尤其是早期胚时期,高出63.4%。低水平的GA3含量利于体胚的发育[15],无疑LFS组对有效诱导半夏体胚更优于CK组。
3 讨论
植物体细胞分化为胚性细胞必须具备相应的诱导因子,诸多因素中植物激素的诱导与调节是最重要的调节因素之一[16]。众多研究结果报道表明,不同的植物所使用的激素种类大不相同,有的植物必须通过生长素与细胞分裂素联合使用,而有的植物只使用生长素或细胞分裂素便可形成体细胞胚。如苜蓿的分化诱导须同时具备生长素和细胞分裂素的作用[2];红豆草则仅需适量BA即可分化诱导[17]。本课题组采用LFS单一培养基相继直接成功地诱导了名贵中药材半夏[6]、三七[18]等植物体细胞胚胎的发生及发育,而且实现了高效优质。本课题组前期研究结果表明,以半夏为材料,LFS比传统的BA+NAA配比能更高效地诱导体细胞胚胎的发生和发育,本研究验证了这一结果是因为它对体胚发生发育过程中内源激素的有效调节,利于细胞的分裂增值及体胚的早期发育,抑制畸形胚的形成,防止裂生多胚的不利现象,从而促进体胚的健康发育及萌发成苗[6]。
本研究结果证明,LFS单一培养基与常规诱导体细胞胚胎培养基BA+NAA复配相比,在体细胞胚胎发生发育至成苗整个过程中,内源IAA、ZR、ABA和GA3的含量变化与前人[19-20]在不同植物上采用不同调节剂诱导的结果相似。水稻(Oryza sativa)胚性细胞出现时伴随有较高的内源IAA水平[2];龙眼(Dimocarpus longan)胚性细胞发生过程中IAA含量在球形胚时期达到最大值,随后显著下降[19];黄姜(Dioscorea zingiberensis Wright)胚性细胞产生的高峰期IAA达最大值,随后下降[20]。 ZR和GA3的含量变化与前人对皇冠草(Echinodorus orisis)胚性细胞的诱导结果一致,即球形胚时期和早期胚时期最大[2]。铁皮石斛(Dendrobium officinale Kimura et Migo)体细胚发生早期ABA含量增加,体胚整齐一致,长势较好,与本研究结果一致[21];ABA对枸杞体细胞胚发生后期影响较大,促进体胚的成熟[22]。内源激素通过调节和控制体细胞胚胎发育的相关基因的开启和闭合而影响体胚一系列代谢过程,最终影响到细胞胚性潜力的诱导、维持和表达[23],因此,内源激素含量的高低是影响植物体细胞胚胎发生的关键因素。内源激素的含量可通过外源因子进行诱导调节,而外源诱导因子可是单一化合物,也可是不同化合物组成的复杂体。因此,在诱导体细胞胚胎发生时,选择一个适合的外源诱导因子是一项极其重要而复杂的工作。
综上所述,LFS能较体细胞胚胎常规诱导培养基MS+BA 2.0 mg/L+NAA 0.1 mg/L更优质高效地诱导半夏体细胞胚胎的发生和发育,LFS对体胚发生和发育过程中的关键时期内源激素IAA、ABA和ZR的调节诱导效果更显著,其机理可能是通过调控内源激素间接的调控相关基因的活动,从而影响一系列代谢过程,保证了半夏体胚的诱导与萌发,为人工种子的研究制作奠定基础。
参考文献
[1] 中国医科学院药物研究所. 中药志(第2册第2版)[M]. 北京:人民卫生出版社,1993:38-42.
[2] 李 明,王树香,冯大领. 植物体细胞胚胎发生及发育研究进展[J]. 中国农学通报,2011,27(3):237-241.
[3] 何承忠,许昌慧,孟 瑜,等. 植物体细胞胚胎发生的生理生化研究进展[J]. 西南林学院学报,2009,29(3):78-82.
[4] 许鸿源. 狭霉素在植物学和农学上的应用[J]. 中华人民共和国知识产权局发明专利公报,2003,19(34):6.
[5] 许鸿源,许鸿章,杨美纯,等. PGR-08理化性质及生物活性的研究[J]. 广西植物,2003,23(5):461-463.
[6] 许鸿源,梁琼月,解云英,等. 用灵发素建立简单高效生产半夏胚状体与组培苗的方法[J]. 种子,2010,29(9):79-81.
[7] 许鸿源,蒙爱东,何 冰,等. 三七叶器官获得胚状体和再生植株的研究[J]. 中国中药杂志,2007,3(6):481-483.
[8] 宋 磊,许鸿源,周凤珏,等. 用灵发素(LFS)建立翅子罗汉果组织培养技术[J]. 种子,2008,27(12):12-14.
[9] 许鸿源,周凤珏,何 冰,等. LFS,N6-BA和KT在罗汉果组织培养中不同的生物效应[J]. 种子,2006,25(8):4-6.
[10] 刘晓燕,许鸿源,陈 亮,等. LFS和CPPU在罗汉果组培中生物效应的对比研究[J]. 种子,2007,26(9):15-17.
[11] Lan T J, Xu H Y, He B. Effects of cytokin ins on tissue culture of Siraitia grosvenorii(Swingle) C. Jeffrey, asweetening plant[J]. Sugartech, 2009, 11(3):311-314.
[12] 张爱民,杨生玉,薛建平,等. 多种因素对半夏外植体直接诱导形成试管小块茎的影响[J]. 中国中药杂志,2005,30(8):576-579.
[13] 薛建平,张爱民,盛 玮,等. 钾盐对半夏试管块茎诱导的影响[J]. 中国中药杂志,2006,31(7):546-548.
[14] 何钟佩. 农作物化学控制实验指导[M]. 北京:中国农业大学出版社,1993:60.
[15] 崔凯荣,邢更生,周功克,等. 植物激素对体细胞胚胎发生的诱导与调节[J]. 遗传,2000,22(5):349-354.
[16] 邓正正,王力华,王庆礼. 植物生长调节剂对水曲柳组培苗生长及内源激素的影响[J]. 东北林业大学学报,2009,37(12):10-13.
[17] Burrell A M, Lineberger R D, Keerti S R, et al. Genetic variation in somatic embryogenesis of rose[J]. Hortcience,2006,41(5):1 165-1 168.
[18] 许鸿源,蒙爱东,李春霞,等. 灵发素对三七胚状体发生及其成苗的影响[J]. 中药材,2004,27(10):711-712.
[19] 赖钟雄,陈春岭. 龙眼体细胞胚胎发生过程中的内源激素变化[J]. 热带作物学报,2002,23(2):41-47.
[20] 向景葵,黄 哲. 黄姜体细胞胚发生过程中内源激素含量变化的研究[J]. 岳阳职业技术学院学报,2006,21(1):62-64.
[21] 唐静仪. 蔗糖和ABA对铁皮石斛体细胞胚胎发生的影响[D]. 成都:四川农业大学,2010.
[22] 崔凯荣,裴新梧,秦 林,等. ABA对枸杞体细胞胚胎发生的调节作用[J]. 实验生物学报,1998,31(2):1995-1999.
[23] 崔凯荣,戴若兰. 植物体细胞胚发生的分子生物学[M]. 北京:科学出版社,2000:48-64.
① 基金项目:国家“重大新药创制”科技重大专项(No.2012ZX09301002-001-018); 国家“863”专项经费(No.2006AA10A213)。
收稿日期:2016-05-10;责任编辑/黄东杰;编辑部E-mail: rdnk@163.com。
② 梁琼月(1987~),女,硕士,实验师;主要研究方向为植物生理,E-mail: 132xiaoyue@163.com。
③ 通訊作者:何 冰(1974~),女,博士,副教授;主要研究方向为植物逆境生理,E-mail: bingh2000@126.com。

