肿瘤标记物CA72-4与Cyfra21-1在卵巢癌诊治中的应用价值
王芳 赵玲莉 李丽 王金凤
肿瘤标记物CA72-4与Cyfra21-1在卵巢癌诊治中的应用价值
王芳 赵玲莉 李丽 王金凤
目的 探讨联合检测肿瘤标记物CA72-4、Cyfra21-1在卵巢癌诊断及治疗中的应用价值。方法 共收集153例患者,卵巢癌组51例、良性病变组52例及健康体检组50例,均行血清CA72-4、Cyfra21-1的检测,对比分析卵巢癌不同病理结果及治疗前后血清中CA72-4、Cyfra21-1的表达水平。结果 与卵巢良性病变组及健康组相比,卵巢癌组血清CA72-4、Cyfra21-1明显高表达(P<0.05);联合检测的敏感性和特异性高于单项指标(P<0.05);血清CA72-4、Cyfra21-1检测水平随着卵巢癌患者期别增加而增高、随着组织分化级别降低而增高;术后卵巢癌患者血清CA72-4、Cyfra21-1的阳性率均低术前降低,差异有统计学意义(P<0.05)。结论 联合检测CA72-4、Cyfra21-1对卵巢癌的筛查而辅助诊断大有裨益,对卵巢癌的疗效监测及预后判断有一定的临床应用价值。
CA72-4;Cyfra21-1;卵巢癌
据全球范围内研究,目前卵巢癌发病率仅次于子宫颈癌、子宫内膜癌,居于妇科常见恶性肿瘤第三位,病死率却占首位[1]。卵巢癌患者的生存率一直不容乐观,5年生存率始终在30%左右,50%的患者在2年内复发和(或)死亡,并且发病率逐年递增[2]。研究表明,多数肿瘤在无影像学表现和出现临床症状时,血清肿瘤标志物往往开始升高,所以常用于肿瘤的早期诊断和筛查[3]。因此,卵巢癌早期诊疗的关键在于寻找灵敏性及特异性高的肿瘤标志物。CA72-4与Cyfra21-1在卵巢癌联合诊治笔者所见鲜有报道,本文就其应用价值进行探讨,报告如下。
1 资料与方法
1.1 一般资料 收集2013年4月至2016年4月来西宁市第三人民医院就诊者153例,卵巢癌组51例,平均年龄(52.1±10.3)岁。卵巢良性病变组52例,平均年龄(52.1±10.3)岁;其中浆液性囊腺瘤26例,卵巢囊肿17例,畸胎瘤9例。同期在我院健康体检患者50例,平均年龄(51.6±9.1)岁。术前均未接受放、化疗等治疗,排除心、肝、肾等严重系统性疾病。3组间其他资料(年龄、发病时限等),差异无统计学意义(P>0.05),具有可比性。见表1。
1.2 方法 所有患者采集空腹肘静脉血3~5ml。采用化学发光仪及其成套试剂(德国罗氏cobas601)对血清指标CA724及Cyfra21-1进行检测。
1.3 结果判定 两肿瘤标志物的阳性值参考试剂盒既定数值。血清CA724>7U/ml、Cyfra21-1>3.3μg/L为阳性,联合检测时,各指标均为阴性时判为阴性,余情况为阳性。
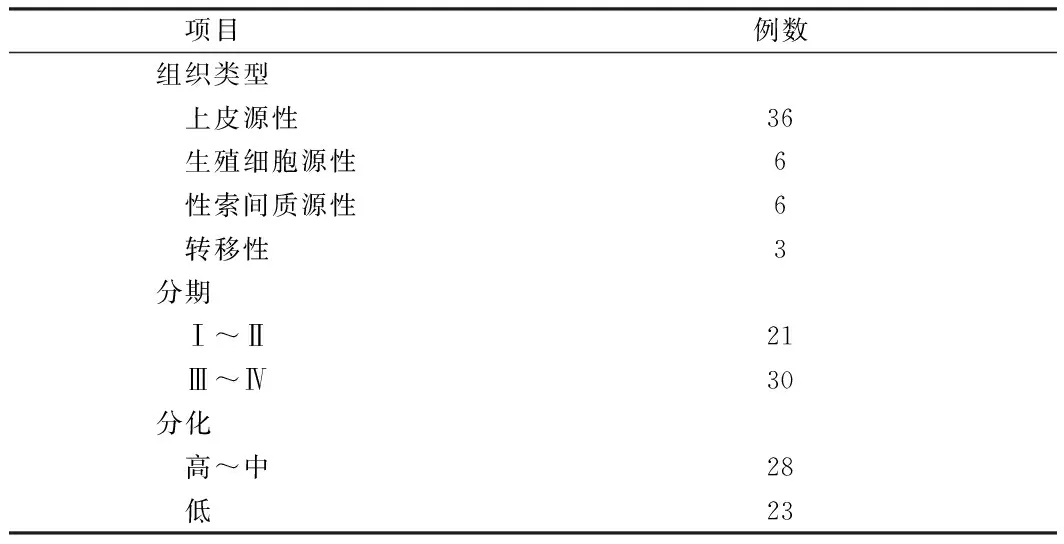
表1 卵巢癌组患者基本情况
注:按照WHO/FIGO进行组织学分类、分级及手术-病理分期
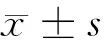
2 结果
2.1 血清CA72-4、Cyfra21-1值及与病理特征关系 卵巢癌组血清CA72-4、Cyfra21-1的水平明显高表达,与卵巢良性病变组及健康对照组差异有统计学意义(P<0.05)。在上皮性卵巢癌患者中CA72-4、Cyfra21-1值明显高于其他组织学类型者(P<0.05);血清CA72-4、Cyfra21-1检测水平随着卵巢癌患者期别增加而增高、随着组织分化级别降低而增高,差异有统计学意义(P<0.05)。见表2。
2.2 不同检测方式的阳性比较 卵巢癌组单项及联合检测指标阳性率均明显增高,与卵巢良性病变组和健康组的差异有统计学意义(P<0.05)。卵巢癌组CA72-4、Cyfra21-1检测的阳性率分别为62.75%、60.78%,联合检测为86.27%,联合检测阴性率高于2个单项检测,差异有统计学意义(P<0.05)。见表3。
2.3 卵巢癌组手术前后2指标的阳性率比较 卵巢癌患者术后血清CA724及Cyfra21-1的阳性率较术前明显较少,差异有统计学意义(P<0.05)。见图1。
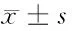

项目CA72-4(U/ml)Cyfra21-1(μg/L)卵巢良性病变组(n=52)5.17±4.83*1.35±0.56*健康对照组(n=50)2.68±1.19#1.44±0.45#卵巢癌组(n=51)14.20±10.977.31±6.24 组织类型 上皮性(n=36)24.21±12.2511.62±17.61 生殖细胞(n=6)5.58±4.16#6.31±5.72# 性索间质(n=6)5.01±2.23#2.78±1.10# 转移性(n=3)7.62±5.29#5.11±1.73# 分期 Ⅰ~Ⅱ期(n=21)8.73±3.473.12±2.54 Ⅲ~Ⅳ期(n=30)16.34±13.05△15.31±10.65△ 分级 高~中(n=28)9.21±1.528.52±15.72 低(n=23)19.48±16.62☆17.20±14.97☆
注:与卵巢癌组比较,*P<0.05;与上皮性癌比较,#P<0.05;与Ⅰ~Ⅱ期比较,△P<0.05;与高~中分化比较,☆P<0.05
3 讨论
卵巢癌是妇科恶性肿瘤的“头号杀手”,流行病学调查发现其发病率和病死率有增无减,究其原因在于卵巢癌起病隐匿,早期没有特异的临床表现,且缺乏有效临床筛查手段,临床确诊时肿瘤一般已发生转移[2,3]。提高患者的5年生存率的最佳方法是要早期发现卵巢癌,早期临床干预。因此,探寻卵巢癌特异性肿瘤标记物是目前卵巢癌研究的突破点和重点。

表3 血清CA72-4、Cyfra21-1单独及联合检测的阳性率比较 例(%)
注:与联合检测比较,*P<0.05;与卵巢癌组比较,#P<0.05

图1 血清CA72-4及Cyfra21-1术前后的阳性率
CA72-4属于一种由CC49和B72两种单克隆抗体所识别的粘蛋白类广谱肿瘤标志物。孔宪涛[4]研究证实CA72-4在成人的结直肠、胰腺、乳腺和卵巢等腺癌组织中高表达,而Siegel等[1]研究表明在正常组织中基本不表达。刘诚明[5]研究显示粘液性癌和子宫内膜样癌中CA72-4有较高的阳性率,对浆液性癌和低分化腺癌敏感性差,整体阳性率波动在44%~81%。本研究显示CA72-4对卵巢癌的诊断灵敏度和特异度分别为62.75%、88.46%,与杨英番等[6]报道的66.7%灵敏度和81.4%特异度相似,表明CA72-4对卵巢癌的诊断有一定价值,可作为一项基础指标参与联合检测。CA72-4、Cyfra21-1均属于非特异性肿瘤标志物,本研究结果显示卵巢癌组联合检测阳性率为86.0%,明显高于CA72-4、Cyfra21-1单项检测的62.75%、60.78%,差异有统计学意义(P<0.05),目前尚缺乏卵巢癌诊断的特异性指标,因此,有必要联合多项肿瘤标志物进行检测以提高诊断的灵敏度和特异度[7-9]。本研究结果显示,在上皮性卵巢癌患者中CA72-4值明显高于其他组织学类型者;血清CA72-4检测值随着卵巢癌患者期别增高而增加、随着组织分化级别降低而增加,差异有统计学意义(P<0.05),表明CA72-4可能更适于上皮性卵巢癌患者的早期诊断。
本-周(Bence-Jones)蛋白是最早被发现的一种肿瘤标志物,早在1846年由Bence-Jones在多发性骨髓瘤患者尿中发现,如今可辅助多发性骨髓的诊断。存在于体液(血液、组织液)和组织中可检测到的蛋白质(上皮粘蛋白、胚胎蛋白、糖蛋白等)、激素、酶、糖决定簇、病毒和肿瘤相关基因等物质被称为肿瘤标志物,它们可能仅存在于胚胎组织而在正常人中不存在,或在肿瘤组织中的含量远远大于常量,与肿瘤的发生、发展有关,从而可从肿瘤标志物中了解肿瘤的演变,可辅助肿瘤的诊断、治疗、预后及复发的判断。敏感性高的标志物有助于肿瘤的早期检出,特异性好的有助于肿瘤与非肿瘤的鉴别,组织器官特异性高者,有助于肿瘤的定位,肿瘤标志物的水平与肿瘤的体积、分期存在相关性,有助于预后判断。然而,目前肿瘤标志物纷繁复杂,敏感度和特异性往往不理想,造成了对肿瘤的筛查、辅助诊断的局限性,导致检出率低。近年来,随着新兴科学技术及多学科的融合发展,在恶性肿瘤的诊断方面越来越多采用联合检测多种血清肿瘤标志物法。
Cyfra21-1是Bodenmuler[10]在20世纪90年代采用杂交瘤术制备出的能特异识别细胞角蛋白19的片段抗原。研究表明,在上皮性质的癌细胞中蛋白酶被激活加速自身降解,大量可溶性细胞角蛋白19片段释放入血,使Cyfra21-1的浓度升高[11,12],而在正常人外周血、淋巴结、骨髓中几乎无或仅有少量CYFRA21-1的表达。研究表明Cyfra21-1在上皮源性肿瘤肺癌、鼻咽癌等[13,14]都有不同程度的表达,但缺乏组织特异性,是一种非特异性肿瘤标志物。本研究显示,Cyfra21-1诊断卵巢癌的敏感度和特异度分别为60.78%和92.30%,与Duroux-Richard[15]等报道的敏感度和特异度60.1%和98.5%相似。本研究也表明不同类型卵巢肿瘤血清Cyfra21-1水平差异有显著性,并且与临床分期、组织分化相关。血清Cyfra21-1检测水平随着卵巢癌患者期别增加而增高、随着组织分化级别降低而增高。术后血清Cyfra21-1阳性率较术前明显较少(P<0.05)。王建英等[14]研究也表明血清Cyfra21-1浓度分别在术后1周及术后4周内明显下降和恢复到正常水平;下降不明显或下降后反升者,提示病情进展或复发。因此,Cyfra21-1可作为卵巢癌早期诊断与治疗检测的一项新的血清标志物。
综上所述,CA72-4、Cyfra21-1联合检测可提高卵巢癌诊断的灵敏度和特异性,简捷、无创,符合卫生经济学要求,并且卵巢癌的病理分期、组织分化与血清CA72-4、Cyfra21-1的表达相关,提示我们在卵巢癌诊治过程中,血清CA72-4、Cyfra21-1可做为辅助诊断、判断预后的一项有价值的标记物。联合检测血清CA72-4、Cyfra21-1有望提高卵巢癌的检出率。
1SiegelR,NaishadhamD,JemalA.Cancerstatistics,2013.CACancerJClin,2013,63:11-30.
2DesantisC,NaishadhamD,JemalA.CancerstatisticsforAfricanAmericans,2013.CACancerJClin,2013,63:151-166.
3 黄健林,张震宇,赵双玉,等.肿瘤筛查与肿瘤标志物.实用医技杂志,2014,21:174-175.
4 孔宪涛.肿瘤特异抗原和相关抗原的研究现状及检测.中华检验医学杂志,2000,23:56.
5 刘诚明.CA125、CA724检测在卵巢肿瘤诊断中的价值.新疆医科大学学报,2004,27:409-410.
6 杨英番,杨椿,陈涛.多指标联合检测对卵巢癌诊断意义分析.国际检验医学杂志,2015,36:3175-3177.
7BianJ,LiB,KouXJ,etal.Clinicalsignificanceofcombineddetectionofserumtumormarkersindiagnosisofpatientswithovariancancer.AsianPacJCancerPrev,2013,14:6241-6243.
8ZhangW,HuXX,YangXZ,etal.Combineddetectionofserummatrixmetalloproteinase9,acetylheparinaseandcathepsinLindiagnosisofovariancancer.ChinJCancerRes,2012,24:67-71.
9LiX,LuJ,RenH,etal.Combiningmultipleserumbiomarkersintumordiagnosis:Aclinicalassessment.MolClinOncol,2013,1:153-160.
10BodenmullerH.Technicalevaluationofanewautomatedtumormarkerassay:theenzymum-testCYFRA21-1.HapdorR.Tumorassociatedantigens,oncogenereceptors,cytokinesinTumordiagnosisandtherapyatthebeginningofthe90ths.Zuckschwenlt:Verlag,1992,48:137-147.
11DohmotoK,HojoS,FujitaJ,etal.MechanismsofthereleaseofCYFRA21-1inhumanlungcancercelllines.LungCancer,2000,30:55.
12SheardMA,VojtesekB,SimickovaM,etal.Releaseofcytokeratin-18and19fragments(TPSandCYFRA21-1)intotheextracellularspaceduringapoptosis.JCellBiochem,2002,85:670.
13 李睿,李蓉,王亚文.血清细胞角蛋白19片断检测对肺癌的临床意义.中华结核和呼吸杂志,1998,21:26-29.
14 王建英,程继新,苏杏满.Cyfra21-1诊断卵巢恶性肿瘤的研究.实用妇产科杂志,2003,19:175-177.
15Duroux-RichardI,JorgensenC,ApparaillyF.WhatdomicroRNAsmeanforrheumatoidarthritis?ArthritisRheum,2012,64:11-20.
10.3969/j.issn.1002-7386.2017.05.024 ·论著·
810005 西宁市,青海省第五人民医院检验科(王芳、李丽);青海大学附属医院检验科(赵玲莉);青海省西宁市第三人民医院检验科(王金凤)
R
A
1002-7386(2017)05-0726-03
2016-10-09)

