马铃薯M病毒生物学特性研究
张威,白艳菊,文景芝,范国权,高艳玲,吕典秋,申宇,邱彩玲,张抒,袁红梅
(1.东北农业大学农学院,哈尔滨 150030;2.黑龙江省农业科学院植物脱毒苗木研究所,哈尔滨 150086;3.黑龙江省农业科学院经济作物研究所,哈尔滨 150086)
马铃薯M病毒生物学特性研究
张威1,2,白艳菊2,文景芝1*,范国权2,高艳玲2,吕典秋2,申宇2,邱彩玲2,张抒2,袁红梅3
(1.东北农业大学农学院,哈尔滨 150030;2.黑龙江省农业科学院植物脱毒苗木研究所,哈尔滨 150086;3.黑龙江省农业科学院经济作物研究所,哈尔滨 150086)
测定马铃薯M病毒(Potato virus M,PVM)寄主范围,并作PVM接种条件优化试验。结果表明,PVM仅侵染15种指示植物中的4种,各种植物症状表现不同。苋色黎(Chenopodium amaranticolor)和千日红(Gomphrena globosa L.)接种叶片上产生枯斑,可作为PVM枯斑寄主;36号烟(Nicotiana occidentalis“pi”)系统发病,新生叶片产生皱缩、泡斑、叶边缘卷曲等症状,植株长势矮小,可作为PVM系统侵染鉴定寄主;PVM系统侵染番茄(Lycopersicon pimpinellifolium)速度快,但无症状,番茄可作为PVM繁殖寄主。PVM虽可侵染不同生育期寄主,以接种中上部叶位侵染效果最好,但在不同寄主不同叶位分布并不一致,番茄体内中部叶片病毒含量相对较高,在苋色黎上则分布较均匀。明确PVM最适培养温度为23~29℃。最高稀释度64倍时(OD405=0.201)仍可成功侵染苋色黎。为PVM纯毒源扩繁及制备该病毒抗血清提供基础数据。
马铃薯;病毒;PVM;生物学特性
马铃薯M病毒(Potato virus M,PVM)自然寄主范围较窄,主要侵染茄科植物,包括马铃薯、番茄、洋金花及人参果等[1],其中,最主要寄主是马铃薯(Solanum tuberosum L.)。PVM 1923年于美国首次分离得到[2]。自然条件下,PVM可机械传播,也可通过蚜虫以非持久性方式传播[3-5]。目前PVM在世界范围内马铃薯种植区普遍存在[6-8],造成马铃薯产量损失达15%~45%[6],如与其他病毒复合侵染将会带来更大产量损失[9-10]。因此,PVM是世界各国种薯生产过程中重要检测防控目标之一,也是马铃薯产业发达国家种薯认证严格控制有害生物[11]。
目前,尚无有效化学药剂防治PVM病毒。虽然利用茎尖分生组织培育脱毒种薯是防治PVM有效方法[12],但脱毒种薯生产需病毒检测。血清学DAS-ELISA技术是大规模马铃薯病毒检测最常用方法[13-14],其广谱性强、准确性高、操作简便。目前中国马铃薯病毒检测主要依靠进口试剂盒(美国Agdia和英国Adgen),检测成本高,试剂盒国产化势在必行。
PVM病毒提纯是试剂盒生产关键环节,快速、大量获得PVM纯毒源是PVM提纯基础。本文开展PVM对15种指示植物寄主范围测定并在此基础上研究接种条件等生物学特性,为PVM分离鉴定及PVM血清学检测,试剂盒制备奠定基础,为PVM病毒病防治提供理论依据。
1 材料与方法
1.1 材料
指示植物15种:千日红(Gomphrena globosa L.)、本氏烟(Nicotiana benthamiana)、黄苗榆烟(Nicotiana samsun)、番茄(Lycopersicon pimpinellifolium)、苋色藜(Chenopodium amaranticolor)、心叶烟(Nicotiana glutinosa)、指尖椒(Capsicum annum)、45号烟(Nicotiana occidentalis)、36号烟(Nicotiana occidentalis“pi”)、德莫尼烟(Nicotiana debneyi)、洋酸浆(Physalis floridana)、假酸浆(Nicandra physaloides)、白花刺果蔓陀萝(Datura stramonium)、茄子(Solanam melongena)和黄花烟(Nicotiana rustica)。
马铃薯毒源材料“2008-C-131”经电镜和DASELISA方法检测,确认除PVM外不含有PVX、PVY、PVS、PLRV、PVA、PVV、PMTV、PAMV、TMV、AMV和TRV 11种马铃薯病毒,DAS-ELISA检测OD值为3.654。
1.2 方法
1.2.1 指示植物种植与接种
智能温室内按照草炭:珍珠岩:炉灰=3:1:1比例配制基质,混匀后121℃湿热灭菌30 min,冷却后装在口径25 cm花盆中,灌透水后种子均匀撒播,覆土0.5~1.0 cm[15]。待苗长至2~3 cm时分苗。
待接种植株叶片上均匀撒少许碳化硅细粉,然后用棉签沾PVM病毒汁液[毒源:接种缓冲液(含10 mmol·L-1磷酸钠缓冲液,pH 7.5,32 mmol·L-1Na2SO3)=1 g:3.3 mL]摩擦接种,接种1 h后清水冲掉碳化硅细粉[16]。
1.2.2 DAS-ELISA检测
马铃薯病毒检测试剂盒(Agdia Inc.,Elkhart, ID,U.S.)对接种后指示植物叶片作DAS-ELISA检测,检测流程参考说明书。酶联仪(SpectraMax Plus384,Molecular Devices)在405 nm处读取检测样品OD值。
1.2.3 PVM寄主范围测定
将PVM病毒汁液接种到15种指示植物上,每天分别对接种叶片和新生叶片取样,连续取样20 d,样品保存于-70℃统一作PVM病毒DAS-ELISA检测。当接种叶片检测结果为阳性时,表明接种成功;当新生叶片检测结果为阳性时,表明植株开始系统侵染并处于发病初期;当新生叶片OD405达3.0以上,表明植株系统侵染达发病高峰期。每天观察记录症状,出现典型症状时拍照。
1.2.4 PVM接种条件优化
PVM最适接种时期:在26℃条件下,分别对出苗20、40和60 d枯斑寄主和系统侵染寄主接种,15 d后枯斑寄主取接种叶片、系统侵染寄主取顶叶数第4片叶作DAS-ELISA检测,确定最适接种时期。
PVM最适接种叶位:在26℃条件下,同时接种成株期枯斑寄主和系统侵染寄主每天取不同叶位叶片作DAS-ELISA检测,根据OD405确定最适接种叶位。在枯斑寄主接种15 d后和系统侵染寄主达到系统发病高峰期时,根据OD405评价不同叶位病毒浓度。
PVM最适培养温度:模拟自然环境温度变化区间,在人工气候箱中分别设定15、17、20、23、25、27、29和31℃培养条件,每天光照16 h,黑暗8 h,接种8叶期系统侵染寄主。接种液在人工气候箱中平衡3~5 min后开始接种,每隔1 d对第4片叶取样,根据OD405确定最适接种温度。
PVM稀释限点:将毒源“2008-C-131”(OD405为3.654)加3.3倍接种缓冲液研磨[16],再用接种缓冲液2n稀释(DAS-ELISA测试OD405),在26℃条件下,接种8叶期枯斑寄主,第4、8、12天取该接种叶片,根据OD405确定PVM可侵染寄主植物稀释限点。
以上试验每个处理3次重复。最适接种叶位试验接种全部叶片,其他试验接种顶叶数第2片叶。以接种缓冲液植株为阴性对照。温室温度24~31℃,每天光照16 h,黑暗8 h。于2016年6~9月开展试验。
2 结果与分析
2.1 PVM寄主范围测定
千日红接种PVM后第4天接种叶片褪绿、产生褐色大块枯斑,未发生系统侵染(见图1)。苋色黎接种PVM后第2天接种叶产生褪绿、密集微小枯斑,未发生系统侵染(见图2)。番茄接种PVM后虽无发病症状,但第3天即可在接种叶片中检测出病毒,第5天在新生叶片检测出病毒,表明病毒系统侵染,第9天新生叶片检测OD405达3.313,系统侵染达高峰期。36号烟接种PVM后第2天接种叶片检测出病毒,第12天新生叶片检测出病毒,表明病毒开始系统侵染,第16天新生叶片检测OD405达3.431,系统侵染达高峰期。发病症状明显,具体表现为接种叶片第3天枯萎,第7天死亡;新生叶片产生皱缩、泡斑、叶边缘卷曲等症状,植株长势矮小(见图3)。

图1 PVM侵染千日红症状Fig.1Symptoms of PVM infected Gomphrena globosa L.

图2 PVM侵染苋色黎症状Fig.2Symptoms of PVM infected Chenopodium amaranticolor

图3 PVM侵染36号烟症状Fig.3Symptoms of PVM infected Nicotiana occidentalis"pi"
其他11种指示植物连续取样20 d,但无论接种叶片还是新生叶片均未检测出病毒,说明PVM不侵染这些指示植物。
2.2 PVM接种条件优化
2.2.1 PVM最适接种时期
PVM接种出苗20、40和60 d苋色黎和番茄,DAS-ELISA检测OD值均呈阳性,略有差异,可见PVM可侵染不同生育期番茄和苋色黎。
2.2.2 PVM最适接种叶位
PVM接种苋色黎,从顶叶至底叶DAS-ELISA检测OD405可见,不同叶位均在第2~3天感染PVM,发病时间基本一致。接种15 d OD405显示,第1~12叶病毒浓度略有差异,第13~15叶病毒浓度有下降趋势(见图4)。PVM接种番茄,从顶叶至底叶OD405可见,不同叶位均在第3天感染PVM,感病时间一致。当达到系统侵染高峰期时,第1~6叶病毒浓度呈上升趋势,第7~12叶片是整个植株病毒浓度相对较高区域,第14和15叶OD405呈阴性,未检测出病毒。可见,对于番茄和苋色黎,PVM接种中上部叶片时效果更好。
2.2.3 PVM最适培养温度
从DAS-ELISA检测结果可看出,PVM在17~31℃温度范围内均可成功接种番茄,17和20℃条件下接种后第9天开始系统感染,23~29℃时接种第5天开始系统感染,31℃时接种第7天开始系统感染。而低于23℃和高于29℃时接种感染较慢。由此可见,23~29℃是PVM最适培养温度范围(见图5)。
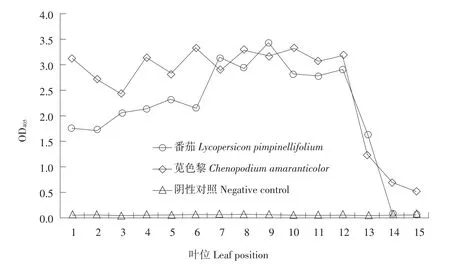
图4 PVM在寄主不同叶位OD405Fig.4OD405of PVM at the different leaf position of the host
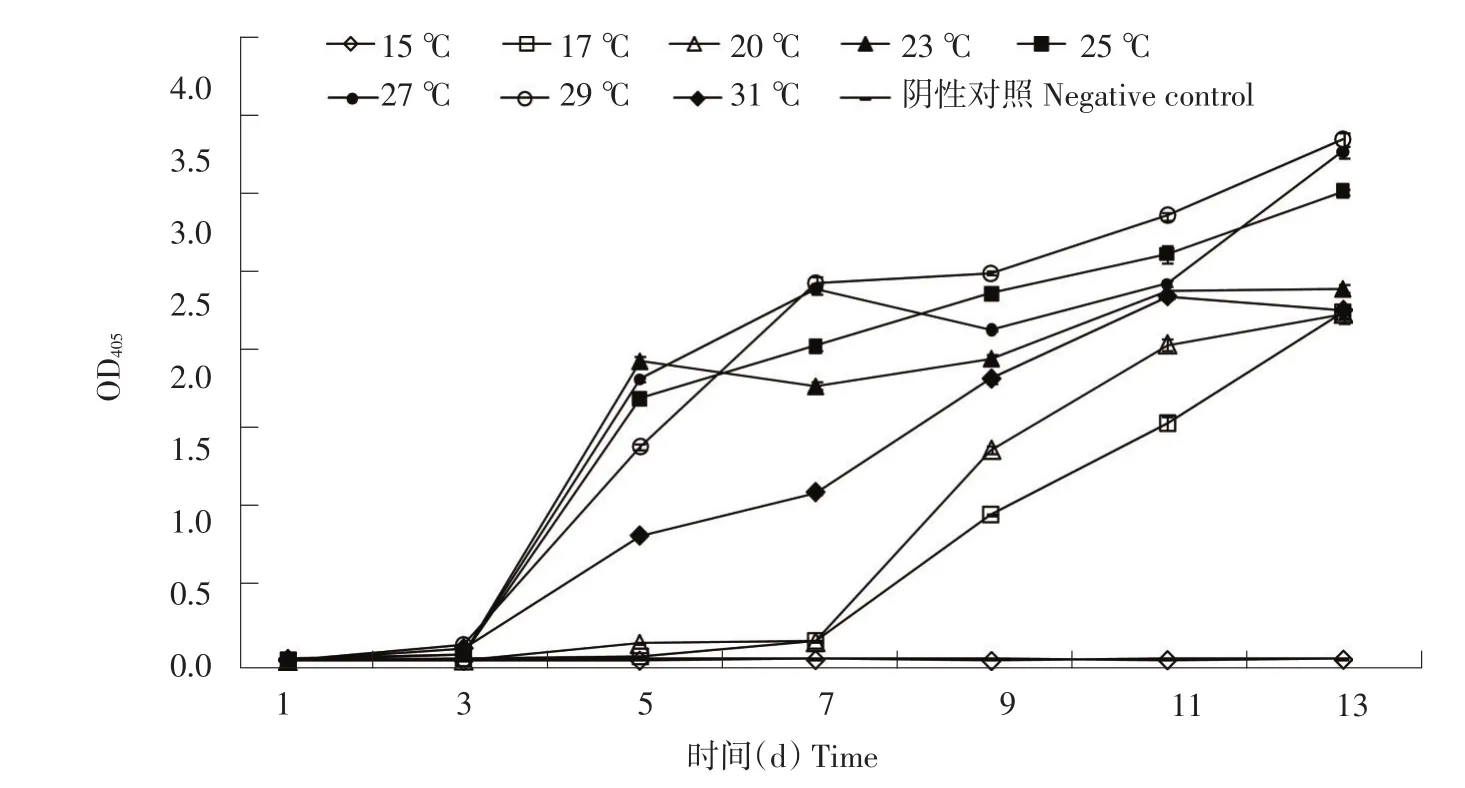
图5 PVM在不同接种温度条件下接种番茄后OD405Fig.5OD405of PVM inoculated Lycopersicon pimpinellifolium under different inoculation temperatures
2.2.4 PVM稀释限点
从DAS-ELISA检测结果可看出,毒源1、2、4、8倍稀释液接种苋色黎后第4天开始感病,而16、32、64倍稀释液接种苋色黎均在第8天开始感病,128倍稀释液接种苋色黎一直未感病。可见,PVM稀释限点为64倍(OD=0.201)(见图6)。

图6 PVM毒源不同稀释度侵染苋色黎OD405Fig.6OD405of PVM inoculated Chenopodium amaranticolor under different dilutions
3 讨论与结论
中国是世界马铃薯生产大国,总面积和总产量均居世界首位,然而单产水平却落后于发达国家,原因与病毒病关系密切[17-20]。在世界范围内侵染马铃薯病毒有40余种[21-22],其中PVM是主要病毒之一[23-25]。虽然PVM单独侵染产量损失不大,但如果与其他病毒复合侵染会加重病毒病危害。从田检普查结果可见,PVM检出率虽低于PVY和PVS,但却呈逐年上升趋势[26-27]。因此,为提高马铃薯产量和品质,马铃薯须经脱毒后才可用于生产,而茎尖脱毒不彻底,种苗、种薯携带病毒,生产过程中再感染病毒等均会影响生产。因此,病毒检测应贯穿于脱毒种薯生产全过程。
DAS-ELISA方法是病毒检测比较常用方法,主要应用试剂盒作病毒检测。其中,病毒提纯是试剂盒生产基础环节,前提条件需系统了解该病毒生物学性状。首先将该病毒接种不同寄主植物分离和纯化,得到纯病毒,将其接种到繁殖寄主上大量扩繁,再病毒提纯、制备抗血清。吴凌娟等研究指示植物鉴定及分离马铃薯X病毒(Potato virus X,PVX)方法,为PVX抗血清制备提供技术保证[28]。徐洁仅测定PVM等8种病毒寄主范围,简单介绍影响接种效果环境因素[15]。范国权等系统研究PVM提纯和抗血清制备技术,而对如何获得大量PVM纯病毒无详细阐述[29]。目前,尚缺乏PVM生物学特性系统研究。
本文系统研究PVM寄主范围和最适接种条件等生物学特性。15种指示植物中,PVM可侵染4种,在徐洁研究[15]基础上扩展了PVM寄主范围,明确不同寄主用途。PVM在苋色藜和千日红接种叶片上产生枯斑症状,可作为鉴定PVM枯斑寄主,用于分离和纯化PVM;PVM可系统侵染36号烟,症状明显,作为PVM系统侵染鉴定寄主;PVM快速系统侵染番茄,番茄植株高带毒而不表现任何症状,植株长势与阴性对照无差异,适宜作PVM繁殖寄主。中部叶片病毒含量最高,取中部叶片提纯PVM可得到较高病毒粒体浓度。PVM成功侵染不同生育期番茄和苋色黎,以接种中上部叶片效果更好。PVM最适培养温度为23~29℃,低于23℃和高于29℃时接种发病较慢,接种效率低。本试验PVM稀释限点为64倍,此时OD405仅为阳性临界值0.201,可成功侵染苋色黎,但PVM毒源浓度越高,接种发病越快,病毒含量越高。毒源稀释64~128倍是否侵染苋色黎,有待进一步试验。
综上,本文研究PVM生物学特性,明确PVM寄主范围、PVM最适接种时期、最适接种叶位、最适培养温度和稀释限点,可为分离、纯化和扩繁PVM提供基础数据,简化试验过程,提高试验效率,并为PVM遗传多样性研究奠定基础。
[参考文献]
[1]葛蓓孛.人参果病毒鉴定及种群遗传学分析[D].北京:中国农业大学,2013.
[2]Schultz E S,Folsom D.Transmission,variation,and control of certain degeneration diseases of Irish potatoes[J].J Agric Res,1923, 25:143-147.
[3]肖雅,何长征,聂先舟,等.马铃薯病毒病防治策略[J].中国马铃薯,2008,22(2):106-110.
[4]王维东.马铃薯病毒的传播途径[J].现代农村科技,2011(17): 24-24.
[5]Palukaitis P.Resistance to viruses of potato and their vectors[J]. Plant Pathol J,2012,28:248-258.
[6]Xu H M,Aubin J D,Nie J B.Genomic variability in potato virus M and the development of RT-PCR and RFLP procedures for the detection of this virus in seed potatoes[J].Virology Joumal,2010, 25(7):2-7.
[7]Ebtisam M A,Al-Hashash H,Al-Aqeel H,et al.Multiple important plant viruses are present on vegetables crops in Kuwait[J].J Clin Trials,2013(3):136.
[8]Li Y Y,Zhang R N,Xiang H Y,et al.Discovery and characterization of a novel carlavirus infecting potatoes in China[J].PLos One, 2013,8(6):1-13.
[9]王仁贵,刘丽华.PSTV与PVY的互作及其对马铃薯产量影响[J].中国马铃薯,1995(4):218-222.
[10]王晓明,金黎平,尹江.马铃薯抗病毒病育种研究进展[J].中国马铃薯,2005,19(5):285-289.
[11]张永江,刘忠梅,燕照玲,等.宁夏固原地区马铃薯M病毒的检测鉴定[J].河南农业科学,2013,42(8):79-81,85.
[12]Wang B,Ma Y L,Zhang Z B,et al.Potato viruses in China[J]. Crop Protection,2011,30:1117-1123.
[13]白艳菊,李学湛.应用DAS-ELISA法同时检测多种马铃薯病毒[J].中国马铃薯,2000(3):143-144.
[14]Singh R P,Boucher A,Somerville T H.Detection of potato viruses A,M,S,X,Y and leafroll and potato spindle tuber viroid from tissue culture plantlets using single leaf discs[J].American Potato J, 1996,73:101-112.
[15]徐洁.指示植物鉴定马铃薯病毒技术的研究与应用[J].中国马铃薯,2002,16(2):73-75.
[16]聂碧华.马铃薯Y病毒新变异株系的克隆鉴定及马铃薯-病毒互作机制研究[D].武汉:华中农业大学,2010.
[17]Jansky S,Jin L,Xie K,et al.Potato production and breeding in China[J].Potato Research,2009,52(1):57-65.
[18]Wang Q,Zhang W.An economic analysis of potato demand in China[J].American Journal of Potato Research,2010,87(3):245-252.
[19]郝艾芸,张建军,申集平.马铃薯病毒病的种类及防治方法[J].内蒙古农业科技,2007(2):62-63.
[20]Xie K Y,Qu D Y,Jin L P,et al.Potato production in China and its comparison with the World[J].World Agri,2008,349:35-41.
[21]Loebenstein G,Berger P H,Brunt A A,et al.Virus and virus-like diseases of potatoes and production of seed-potatoes[M].Lima: Kluwer Academic Publishers,2001.
[22]Chung B N,Yoon J Y,Palukaitis P.Engineered resistance in potato against potato leaf roll virus,potato virus A and potato virus Y[J]. Virus Genes,2013,47:86-92.
[23]张威,白艳菊,高艳玲,等.马铃薯主产区病毒病发生情况调查[J].黑龙江农业科学,2010(4):71-73.
[24]白艳菊,文景芝,杨明秀,等.西南地区与东北地区马铃薯主要病毒发生比较[J].东北农业大学学报,2007,38(6):733-736.
[25]吴兴泉,张慧聪,时妍,等.我国部分马铃薯产区主要病毒病发生情况调查[J].河南农业科学,2013,42(7):84-87.
[26]高艳玲,张威,白艳菊,等.马铃薯主产区病毒病发生情况调查分析[J].植物保护,2011,37(3):149-151.
[27]范国权,白艳菊,高艳玲,等.中国马铃薯主要病毒病发生情况调查与分析[J].东北农业大学学报,2013,44(7):74-79.
[28]吴凌娟,张雅奎,董传民,等.用指示植物分离鉴定马铃薯轻花叶病毒(PVX)的技术[J].中国马铃薯,2003,17(2):82-83.
[29]范国权,白艳菊,高艳玲,等.马铃薯M病毒提纯技术及抗血清制备[J].植物保护学报,2010,37(5):479-480.
Study on the biological characteristics ofpotato virus M
/ZHANG Wei1,2,BAI
Yanju2,WEN Jingzhi1,FAN Guoquan2,GAO Yanling2,LV Dianqiu2,SHEN Yu2,QIU Cailing2, ZHANG Shu2,YUAN Hongmei3(1.School of Agriculture,Northeast Agricultural University,Harbin 150030,China;2.Institute of Virus-free Seedling Research,Heilongjiang Academy of Agricultural Sciences,Harbin 150086,China;3.Institute of Industrial Crops,Heilongjiang Academy of Agricultural Sciences,Harbin 150086,China)
In this study,the host range ofpotato virus M(PVM)was determined,and on the basis of this,PVM inoculation conditions were optimized.The results showed that PVM only infected four indicator plants among the 15 species tested,and the symptoms were different.On the inoculated leaves of Chenopodium amaranticolorandGomphrena globosaL.expressed lesion,so they could be used as the lesion host of PVM.TheNicotiana occidentalis"pi"expressed systemic symptom,on the new leaves of which expressed crinkling,bubble spot,leaf curl and dwarf,so it could be used as the identification host ofsystemic infection.Lycopersicon pimpinellifoliumcould be systemically infected.The speed was fast,but did not show symptoms,so it could be used as the breeding host of PVM.Although PVM could infect the host plants of different growth stages,the leaves at mid-upper positions got the best infection result.However, the concentration of PVM was inconsistent between the leaves of different positions,with the virus content in leaves being relatively high in the middle part of theLycopersicon pimpinellifolium,while the distribution in Chenopodium amaranticolorbeing even.The optimal culture temperature of PVM was 23-29℃.The highest dilution of 64 times(OD405=0.201)could still successfully infestChenopodium amaranticolor.These results may provide the basic data for the preparation of the virus antiserum by the expansion of pure PVM.
potato;virus;PVM;biological characters
S432.41
A
1005-9369(2017)01-0001-06
2016-11-26
现代农业产业技术体系专项资金资助项目(CARS-10-P14);哈尔滨市科技创新人才专项资金项目(2015RQQYJ031)
张威(1981-),女,助理研究员,博士研究生,研究方向为植物病理学。E-mail:449254339@qq.com
*通讯作者:文景芝,教授,博士生导师,研究方向为植物病理学。E-mail:jzhwen2000@163.com
时间2017-1-9 15:46:08[URL]http://www.cnki.net/kcms/detail/23.1391.S.20170109.1546.014.html
张威,白艳菊,文景芝,等.马铃薯M病毒生物学特性研究[J].东北农业大学学报,2017,48(1):1-6.
Zhang Wei,Bai Yanju,Wen Jingzhi,et al.Study on the biological characteristics ofpotato virus M[J].Journal of Northeast Agricultural University,2017,48(1):1-6.(in Chinese with English abstract)

