云南哈尼梯田当前栽培水稻ALK基因的遗传多样性及与稻米糊化温度的关联分析
李 闯刘承晨张昌泉朱霁晖徐小颖赵福伟黄绍文金银根,*刘巧泉,*
1扬州大学江苏省作物遗传生理国家重点实验室培育建设点 / 粮食作物现代产业技术协同创新中心, 江苏扬州 225009;2扬州大学生物科学与技术学院, 江苏扬州 225009;3环境保护部南京环境科学研究所, 江苏南京 210042;4云南红河学院, 云南蒙自 661100
云南哈尼梯田当前栽培水稻ALK基因的遗传多样性及与稻米糊化温度的关联分析
李 闯1,2,**刘承晨1,2,**张昌泉1朱霁晖1徐小颖2赵福伟3黄绍文4金银根2,*刘巧泉1,*
1扬州大学江苏省作物遗传生理国家重点实验室培育建设点 / 粮食作物现代产业技术协同创新中心, 江苏扬州 225009;2扬州大学生物科学与技术学院, 江苏扬州 225009;3环境保护部南京环境科学研究所, 江苏南京 210042;4云南红河学院, 云南蒙自 661100
云南是世界公认的亚洲栽培稻遗传多样性和起源中心之一。利用51对 SSR分子标记对云南哈尼梯田当前栽培的111份水稻材料进行多态性检测, 并分析其群体结构。聚类分析表明, 供试材料主要分为偏粳类群(group I)及偏籼类群(group II)两大类群, 其中以偏籼类群居多, 占83%, 这两类群并未完全按地理来源聚类。所选材料稻米的糊化温度变异较广, 可以分为低(<66℃)、中低(66~70℃)、中高(70~74℃)和高(>74℃) 4类。通过基因测序, 分析了稻米糊化温度控制基因ALK的序列多样性, 发现其可以分为10种单倍型。关联分析结果表明, 所选水稻样品稻米的糊化温度主要由ALK基因3个SNP位点组合控制。其中, A-GC和G-TT两种组合主要控制低(<66℃)和中低(66~70℃)糊化温度, G-GC组合主要控制中高(70~74℃)和高(>74℃)糊化温度。SNP3402T类型与高、中高糊化温度有关。绝大多数偏籼类品种的ALK基因含有G-GC组合, 因此都倾向于高糊化温度。上述研究结果为水稻分子育种和种质资源保护研究提供了一定的参考价值。
水稻; ALK基因; 遗传多样性; 哈尼梯田; 糊化温度
水稻(Oryza sativa L.)是世界上最重要粮食作物,也是适应性最广的栽培作物之一[1]。云南是世界上公认的亚洲栽培稻遗传多样性和起源中心之一, 拥有中国全部野生稻种、籼粳两个栽培稻亚种以及六大生态群, 是中国稻种资源最大的遗传和生态多样性中心及天然宝库[2-3]。因此, 利用现代分子生物学技术手段研究云南当前栽培水稻品种, 对于保护稻种资源多样性以及栽培稻的遗传改良具有重要的意义[4]。云南哈尼梯田分布于红河州内哀牢山区红河南岸元阳、红河、绿春和金平四县, 总面积5.47万公顷。其中, 位于北纬23°04′~23°12′、东经102°40′~102°48′的红河州元阳县中部地区的梯田面积广大、分布集中, 代表性最强。
近年来, 利用SSR分子标记分析云南水稻群体遗传结构的报道较多。董超等[5]利用48个SSR标记分析了哈尼梯田的98份月亮谷种质, 将其分成5个居群, 这5个居群与其村寨间地理位置的距离相关。董树斌等[6]利用24个SSR标记对云南660份样本遗传多样性和遗传关系的分析, 表明云南水稻传统品种具有较高水平的遗传多样性。我们对收集自云南哈尼梯田的47份栽培水稻的分析证明, 可将其分为偏籼和偏粳两大类群; 偏籼类群又可分为籼稻亚群、偏籼糯稻亚群及红米亚群; 偏粳类群又可分为粳稻亚群及偏粳糯稻亚群[1]。
稻米的食用方法多种多样, 对其品质的要求随用途而异[7]。糊化温度(gelatinization temperature, GT)是评价稻米蒸煮与食味品质的重要指标之一[8]。已有研究表明, 糊化温度受胚乳淀粉结构如支链淀粉链长分布、不同生育期环境温度等因素的影响[9]。支链淀粉的合成受众多酶催化, 其中可溶性淀粉合酶(soluble starch synthase, SSS)是较重要的一种。水稻中的SSS可分为SSSI、SSSII、SSSIII和SSSIV 4类, 而 SSSII又含有 SSSIIa (SSSII-3)、SSSIIb (SSSII-2)和 SSSIIc (SSSII-1) 3个同工型[10]。其中, SSSIIa主要负责延伸支链淀粉的短支链(A链+B1链), 同时还负责合成中等长度的葡聚糖进而形成中等长度的分支(B2+B3链), 从而影响淀粉颗粒的形态结构[11]。该酶的编码基因ALK (又称为SSSIIa)是控制稻米糊化温度的主效基因[12]。
本研究以近年来从云南哈尼梯田直接采集的111份栽培水稻品种为材料, 选取均匀覆盖水稻全基因组的51对SSR标记进行遗传多样性和群体结构分析。在此基础上, 对111份水稻种质中ALK基因全长序列测序并分析其核酸多态性, 以期探析云南哈尼梯田当前栽培水稻中ALK基因多态性及其对稻米糊化温度的影响。
1 材料与方法
1.1 供试材料
分别于2012年9月底和2013年10月上旬分两次在云南省元阳县10个代表性村寨的自然梯田内采集水稻成熟种子, 共111份(附表1)。这10个共村寨分别是下新城、小新街、爱春村、全福庄、箐口村、黄草岭、大鱼塘、阿党寨、核桃寨及上主鲁村。为进行比较分析, 在试验同时选择 8份常规水稻品种作为对照, 包括南粳46、武运 29154、武运粳8号和日本晴4份粳稻品种, 以及明恢63、龙特甫、黄花占和9311共4份籼稻品种。2013年11月将所有种质种于海南省陵水县扬州大学南繁基地, 于 2014年4月收获成熟种子供品质分析用。
1.2 DNA提取与SSR标记分析
参照 CTAB法[13]从水稻叶片中提取基因组总DNA, 20°C下保存备用。参考刘承晨等[1]的标记, 选取均匀分布于水稻全基因组且在9311和日本晴均有多态性的51对SSR标记。按常规PCR方法进行SSR检测, 在扩增图谱上与9311迁移率相同的记为“1/1”,与日本晴相同的记为“2/2”, 如果两者都不同则重新编号(如“3/3”), 无带记为“?/?”。利用PowerMarker V 3.25软件按非加权配对法(Unweighted Pair-Group Method With Arithmetic Means, UPGMA)及Nei 1983遗传距离对SSR检测结果聚类, 并在MEGA 6.0中编辑。
1.3 ALK基因扩增及序列测定
以粳稻品种日本晴 ALK基因序列(GenBank登录号为 NC_029261.1)为参考, 选取从起始密码子ATG到终止密码子TGA共4422 bp的序列。利用引物设计软件 Primer 5.0设计 ALK-a1/ALK-a2、ALK-b1/ALK-b2、ALK-c1/ALK-c2和ALK-d1/ALK-d2 (表1) 4对引物扩增目的基因, 把目的基因分为4段(a、b、c、d)分段扩增。PCR程序为95°C预变性2 min; 98°C, 变性 12 s; 49~54°C (各个片段扩增时的温度稍有差异), 退火10 s; 72°C, 延伸2 min, 35个循环;最后72°C延伸5 min; 18°C保温。PCR产物经1%的琼脂糖凝胶电泳分离, 然后在 Bio-Rad ΜV 1000核酸成像仪上观察并切胶送南京金斯瑞生物科技有限公司(http://www.genscript.com.cn/)测序。
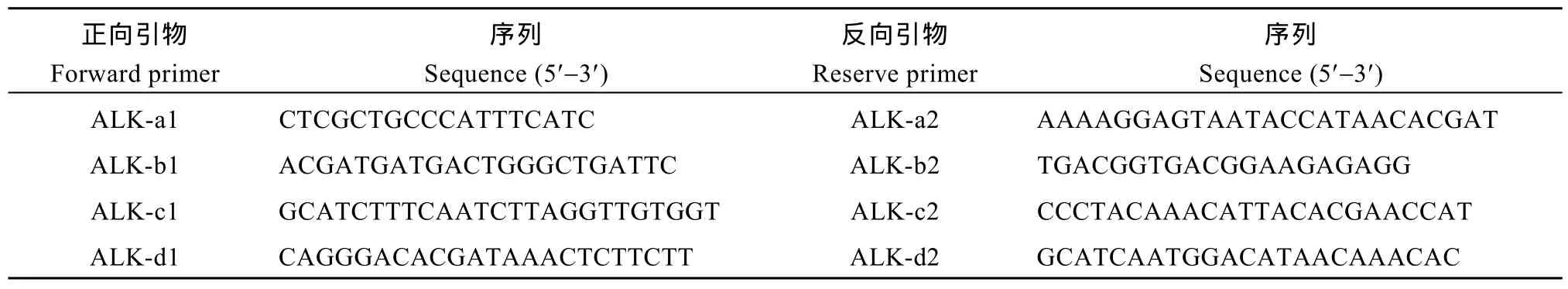
表1 ALK基因扩增用引物及其序列Table 1 Primers used for amplification of ALK gene
1.4 稻米糊化温度的测定
水稻种子完全成熟后混收, 自然晾干 2个月后,用砻谷机(Model SY88-TH, 韩国)出糙, Kett 精米机(Tokyo, 日本)磨成精米, FOSS旋风式磨粉机(FOSS,瑞典)磨成粉。过100目筛后于40°C烘箱烘干2 d, 室温下平衡2 d后装入小塑封袋中密封。利用DSC 200 F3差示扫描量热仪(德国耐驰公司)测量供试米粉的热力学特性, 参照 Yan等[14]的方法用配套的分析软件分析其特征参数米粉糊化时的热焓(ΔH)变化、起始温度(To)及峰值温度(Tp)等。
1.5 数据分析
采用Microsoft Excel软件格式整理与统计分析数据, 采用DNASP5.10分析ALK基因核酸多态性,采用Structure 3.0与Tassel 3.0软件分析其与稻米糊化温度的关联[15-16]。利用Structure 3.0软件计算其最佳群体值K = 4, 后利用Tassel 3.0软件采取GLM模型进行关联分析。
2 结果与分析
2.1 基于SSR标记的品种聚类分析
根据与 8份籼粳稻对照品种聚类关系的远近,可将供试材料分为偏粳(group I)和偏籼(group II)两大类群(图1)。其中偏粳类群有19份, 占总数的17%,又可分为4个亚类。偏籼类群92份, 占供试材料的83%, 又可分为7个亚类。上述聚类结果说明111份采集自哈尼梯田的水稻材料尽管在地理位置上很集中, 但在遗传上存在很大的分化, 以籼型为主, 但有明显的籼粳稻分化。这可能与其独特的气候和纬度条件有关。
2.2 供试稻米的糊化温度
图2表明, 所测定材料稻米起始糊化温度To变异范围为62~77°C, 其中以71~73°C间的居多。按起始糊化温度 To, 可分为 4档, 即低糊化温度( <66°C)、中低糊化温度(66~70°C)、中高糊化温度(70~74°C)和高糊化温度( >74°C)。糊化的峰值温度Tp变异范围在66~81°C之间, 以75~78°C间的分布较多, 与To分布规律较为相似。热焓值ΔH在5.5~12.0 J g–1之间, 且呈近似正态分布, 平均值为8.21 J g–1。糊化温度特征值参数ΔH和Tp在0.05水平上呈正显著性相关, 相关系数为0.243; Tp和To在0.01水平上呈正显著性相关, 相关系数达0.947。
2.3 ALK基因序列多态性分析
在111份云南稻中共发现32处变异位点, 包括2处InDel (Insert/Delet)类型和30个SNP类型(表2)。32个变异位点中, 9个SNP位于外显子区域, 其中6个为有义突变, 包括: (1)第1外显子185 G/A突变位点导致一个精氨酸到组氨酸的变化; (2)第 1外显子264 C/G突变位点导致一个天冬氨酸到谷氨酸的变化; (3)第2外显子613 G/C突变位点导致一个天冬氨酸到组氨酸的变化; (4)第8外显子3799 A/G突变位点导致一个丝氨酸到甘氨酸的变化; (5)第 8外显子4198 G/A突变位点导致蛋氨酸到缬氨酸的变化; (6)第8外显子4330 C/T突变位点导致一个亮氨酸到苯丙氨酸变化。
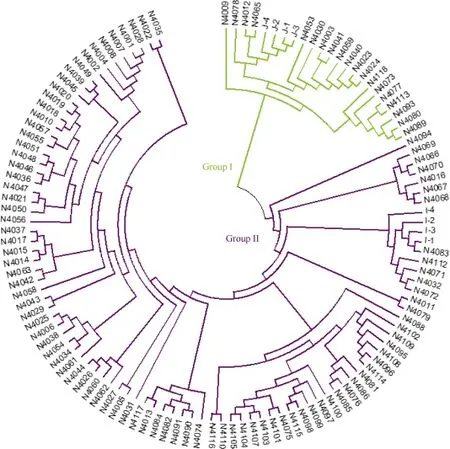
图1 供试品种基于Nei’s遗传距离的系统聚类图Fig. 1 Dendrogram of rice landrace in this study based on Nei’s genetic distance
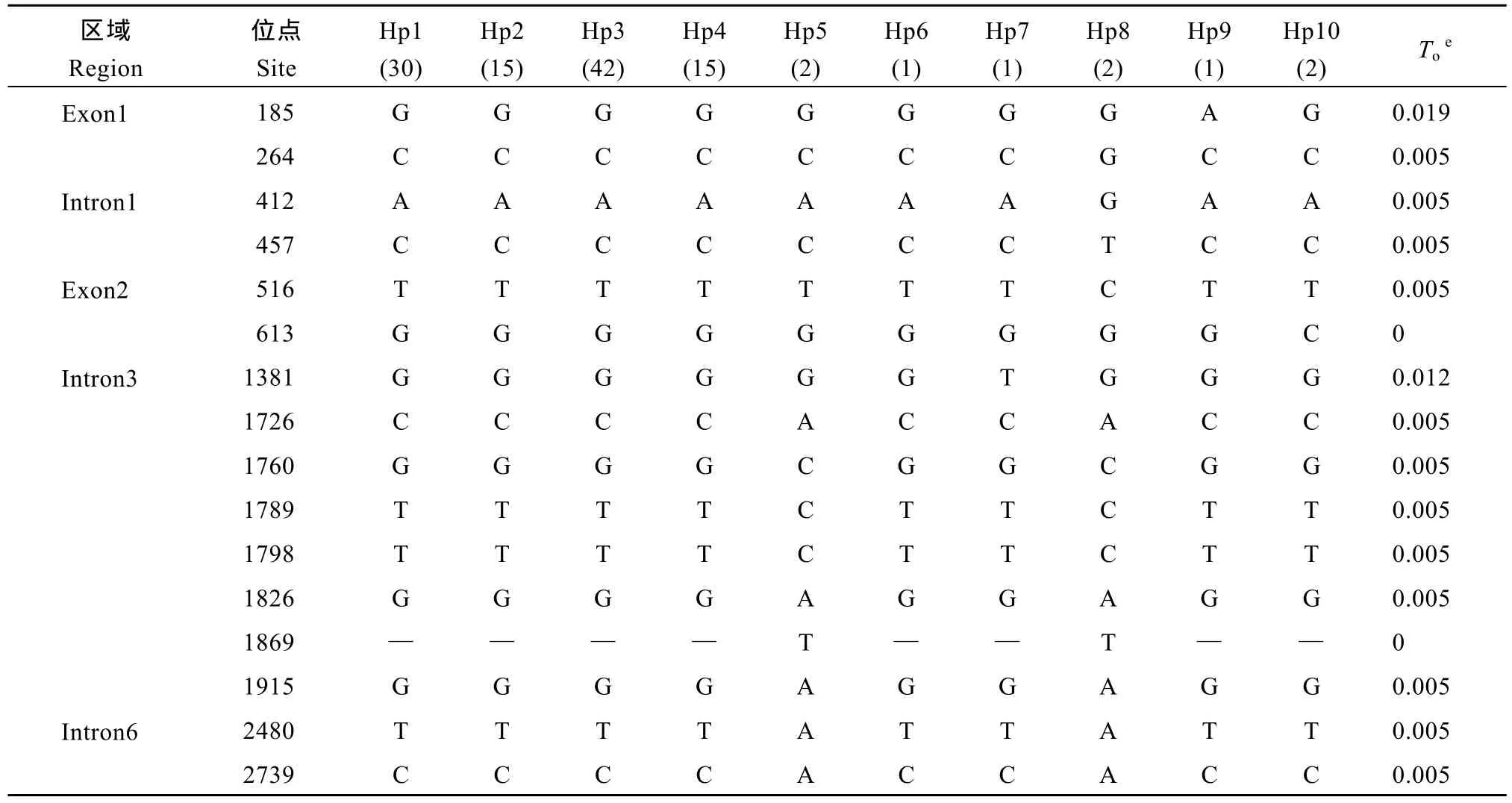
表2 ALK基因核苷酸多态性及其与起始糊化温度(To)的关联分析Table 2 DNA polymorphisms of ALK gene and their association with gelatinization temperature To
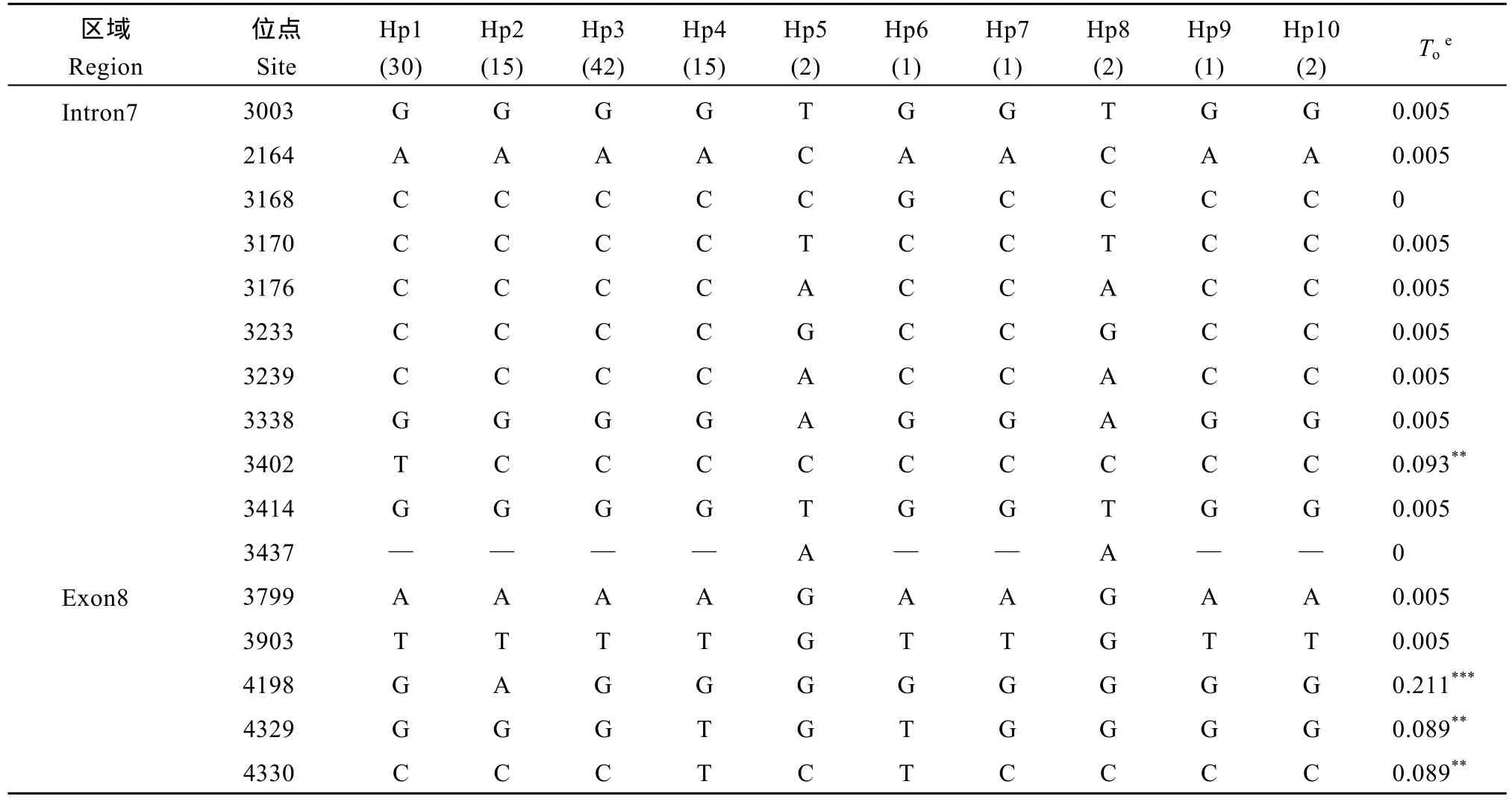
(续表2)
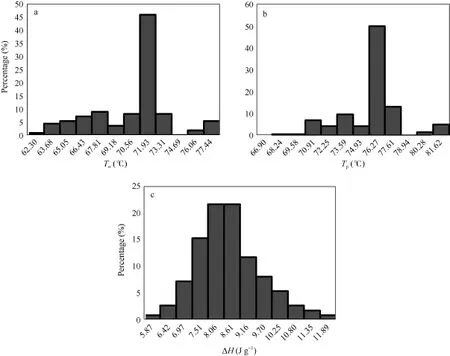
图2 供试样品稻米的糊化温度分布Fig. 2 Distribution of gelatinization temperature among tested samplesa~c分别为起始糊化温度(To)、最高糊化温度(Tp)和热焓值(ΔH)。a–c are onset temperature (To), peak temperature (Tp), and enthalpy of gelatinization (ΔH), respectively.
据多态性分析结果, 可将供试材料中ALK基因分为 10种单倍型(Hp1~Hp10)(图 3), 其单倍型多样性为 0.748, 单倍型多样性方差为 0.000 59, 单倍型多样性标准差为 0.024, 平均核酸多态性 π为0.000 59, 多态性参值θw为0.001 28。
对ALK基因不同单倍型的分析显示, 第8外显子内的3个SNP (4198 G/A、4329 G/T和4330 C/T)呈一定规律的组合形式, 在111份云南稻中共出现A-GC、G-GC和G-TT三种组合类型。其中, 主要以G-GC类型为主(占72%), G-TT与A-GC各占总材料的14%。含G-GC类型的水稻以籼型为主, 其中仅有4份材料属于粳稻(占G-GC类型总数的5%); G-TT类型以籼稻为主, 占75%, A-GC类型以粳稻为主, 约占73%。
2.4 ALK序列变异与糊化温度的关联分析
供试云南栽培水稻稻米糊化温度的变异主要是与第8外显子中3个SNP (4198 G/A、4329 G/T和4330 C/T)有关, 其中与4198 G/A位点呈极显著关联(P < 0.0001, R2= 0.211), 4198处为碱基A的类型与低和中低糊化温度有关; 而其余 2个 SNP位点4329G/T和 4330C/T也达显著关联(P < 0.01, R2= 0.089)。由这3个SNP组成的3种组合类型(A-GC、G-GC和G-TT)中, A-GC和G-TT两种组合主要控制低( < 66°C)和中低(66~70°C)糊化温度, 而G-GC组合则主要控制中高(70~74°C)和高( > 74°C)糊化温度。此外, 第7内含子3402 C/T对稻米糊化温度的变异也有显著关联(P < 0.01, R2= 0.093), 3402 T类型与高和中高糊化温度有关(表2和表3)。
由ALK基因的10种单倍型与糊化温度间的相关分析可知(表3), Hp2与对照粳稻品种日本晴属同一单倍型, 控制低糊化温度; 单倍型 Hp1、Hp3、Hp8和Hp10主要控制中高和高档糊化温度; 其余 5种单倍型主要控制低和中低档糊化温度。从群体结构分析发现, 偏籼类群以高和中高糊化温度为主(G-GC和G-TT类型), G-GC类型中95%的材料属于籼稻, G-TT类型中75%为籼稻。偏粳类群以低和中低糊化温度为主(A-GC类型), A-GC类型中约73%为粳稻(图3和表3)。
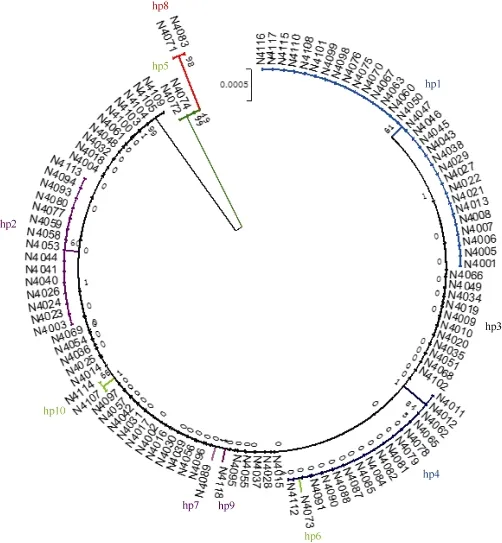
图3 供试云南栽培水稻依ALK基因的系统发育树Fig. 3 System evolutionary tree analysis of ALK gene among tested Yunnan cultivars
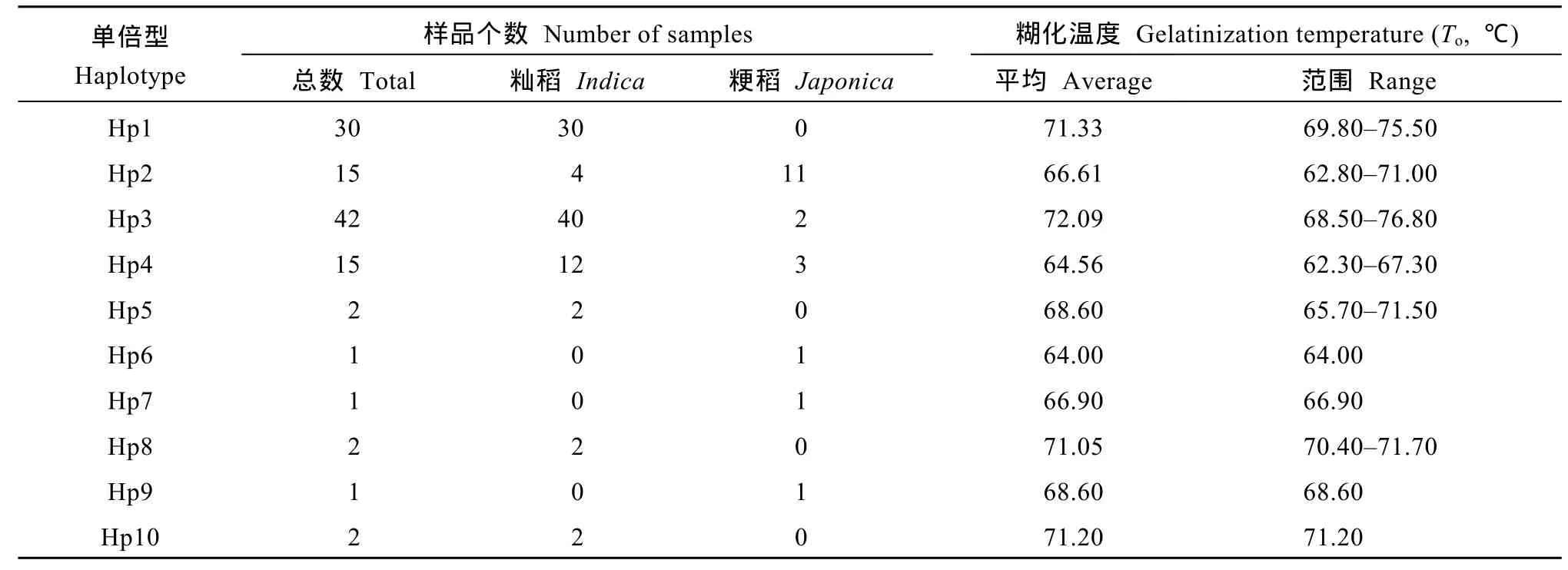
表3 选取材料单倍型籼粳分布及理化性状分布Table 3 Distribution of physical and chemical traits and haploid type of indica or japonica
3 讨论
SSR标记分析表明, 本研究所检测的云南栽培水稻的遗传多样性低于前人报道的。供试材料主要分为偏粳(group I)及偏籼(group II)两大类群, 但并未完全按地理来源聚类, 其中以偏籼类群居多(占83%)。偏粳类群(group I)糊化温度中等, 偏籼类群(group II)糊化温度较高。说明在主要理化品质方面当地人对籼稻具有一定偏好性。分析其原因可能是: (1)由于自然条件等的影响, 对栽培水稻的选择具有一定偏向性; (2)本研究供试材料来源于元阳中部具有代表性的哈尼族人村寨, 因此所选材料可能与哈尼族人的喜好有一定的关系。总体而言, 元阳哈尼梯田现有栽培水稻的遗传多样性较之前的报道有所降低, 这些水稻的主要农艺性状和品质性状均具有趋同的趋势, 这可能是杂交水稻等育成品种的推广、当地农民的选择偏好、以及传统文化习俗的淡化所致。从自然资源保护角度出发, 建议进一步加强对云南元阳哈尼梯田地方水稻品种和传统稻作文化的保护力度。
稻米的蒸煮与食味品质主要由淀粉的物化特性决定[19]。已有研究表明, 糊化温度并非单基因控制, 其他种类淀粉合酶基因也会影响糊化温度的高低[20-21,23]。由群体籼粳分化与ALK基因的系统进化关系结果可知, 单倍型Hp1、Hp5、Hp8、Hp10全部来自籼稻品种; Hp6、Hp7、Hp9全部来自粳稻品种; Hp3、Hp4中多数为籼稻, 分别占95%和80%; Hp2多数为粳稻, 约占 73%。从群体结构与品质比较来看, 偏籼类群稻米糊化温度总体上明显高于偏粳类群。由ALK基因 10种单倍型与稻米糊化温度的关联分析可见, 单倍型Hp1、Hp3、Hp8、Hp10主要控制中高和高档糊化温度, 其余单倍型主要控制低和中低档糊化温度。Hp1单倍型的第7内含子3402C/T位点呈显著关联(P<0.01), 3402T类型与高、中高糊化温度有关, 可能为新的单倍型, 未曾见有报道; 在Hp2 (NIP型)中检测到4198 A/G位点与糊化温度也呈极显著关联(P<0.0001), 4198A类型与低和中低糊化温度有关。
本研究供试材料中的ALK基因共有32个序列变异位点, 其中外显子中有9个。Bao等就曾在30份水稻品种的ALK序列2705~4755位点间的2051 bp区间内就发现25个SNP, 其中9个SNP位于外显子区域。高振宇等[17]曾报道ALK基因在籼稻双科早和粳稻日本晴内含子中存在19个SNP位点, 外显子中发现4个SNP位点。本研究共发现有义突变6个, 其中SNP185和SNP613未曾有人报道, 其余位点均已被报道。可能功能位点 SNP4198、SNP4329、SNP4330前人均有报道, 而SNP3402位点前人未曾报道。前人报道的可能功能位点 SNP264在本研究中也检测到, 但与糊化温度并未达到显著关联, 与前人报道有所不同[7]。从本研究对所选种质ALK基因序列变异及其与糊化温度的关联分析来看, 糊化温度主要由该基因3个SNP位点控制。含A-GC和G-TT两种序列组合的稻米表现为低( < 66°C)或中低(66~70°C)糊化温度, 而含 G-GC序列组合的水稻则具有中高(70~74°C)或高( > 74°C)糊化温度, 这些结果与前人报道相似。综上, 通过测序和关联分析, 本研究鉴定了ALK基因的10种单倍型, 为进一步揭示该基因的遗传变异及育种利用提供了有用的遗传信息, 但关于各单倍型的具体功能尚需通过构建近等基因系或转基因系等来具体地验证分析。
4 结论
云南哈尼梯田当前栽培水稻可分为偏粳(group I)及偏籼(group II)两大类群, 其中以偏籼类群居多,占 83%; 稻米糊化温度变异较广, 其控制基因 ALK可分为10种单倍型。所选水稻样品稻米糊化温度主要由ALK基因3个SNP位点组合控制, 其中A-GC和 G-TT两种组合主要控制低(<66°C)和中低(66~70°C)糊化温度, G-GC 组合主要控制中高(70~74°C)和高(>74°C)糊化温度。绝大多数偏籼类品种的ALK基因含有G-GC组合, 因此都倾向于高糊化温度。
[1] 刘承晨, 赵富伟, 吴晓霞, 张昌泉, 朱孔志, 薛达元, 武建勇,
黄绍文, 徐小颖, 金银根, 刘巧泉. 云南哈尼梯田当前栽培水稻遗传多样性及群体结构分析. 中国水稻科学, 2015, 29: 28–34
Liu C C, Zhao F W, Wu X X, Zhang C Q, Zhu K Z, Xue D Y, Wu J Y, Huang S W, Xu X Y, Jin Y G, Liu Q Q. Genetic diversity and population structure analysis of currently cultivated rice landraces from Hani’s terraced fields in Yunnan Province. Chin J Rice Sci, 2015, 29: 28–34 (in Chinese with English abstract)
[2] Zeng Y W, Shen S Q, Li Z C, Yang Z Y, Wang X K, Zhang H L, Wen G S. Ecogeographic and genetic diversity based on morphological characters of indigenous rice (Oryza sativa L.) in Yunnan, China. Gen Res Crop Evol, 2003, 50: 567–577
[3] 王象坤, 孙传清. 中国栽培稻的起源与演化研究专集. 北京:
中国农业大学出版社, 1996. pp 1–233
Wang X K, Sun C Q. Collections of the Origins and Evolution of Cultivated Rice in China. Beijing: China Agricultural University Press, 1996. pp 1–233 (in Chinese)
[4] Manish K P, Rani N S, Madhav M S, Sundaram R M, Varaprasad G S, Sivaranjani A K P, Abhishek B, Kumar G R, Kumar A. Different isoforms of starch-synthesizing enzymes controlling amylose and amylopectin content in rice (Oryza sativa L.). Biotech Adv, 2012, 30: 1697–1706
[5] 董超, 徐福荣, 杨文毅, 汤翠凤, 张恩来, 杨雅云, 阿新祥, 张斐斐, 卢光德, 王艳, 戴陆园. 云南元阳哈尼梯田水稻地方品种月亮谷的遗传变异分析. 中国水稻科学, 2013, 27: 137–144 Dong C, Xu F R, Yang W Y, Tang C F, Zhang E L, Yang Y Y, A X X, Zhang F F, Lu G D, Wang Y, Dai L Y. Genetic variation analysis of paddy rice landrace of Yuelianggu from Yuanyang Hani’s terraced fields in Yunnan province. Chin J Rice Sci, 2013, 27: 137–144 (in Chinese with English abstract)
[6] 董树斌, 卢宝荣, 王云月, 杨慧, 涂敏, 李林. 云南水稻传统
品种内的遗传多样性及其维持机制初探. 云南农业大学学报, 2010, 25: 1–9 Dong S B, Lu B R, Wang Y Y, Yang H, Tu M, Li L. Preliminary studies on the within-varietal genetic diversity and its maintenance of traditional rice from Yunnan. J Yunnan Agric Univ, 2010, 25: 1–9 (in Chinese with English abstract)
[7] Gao Z Y, Zeng D L, Cui X, Zhou Y H, Yan M X, Huang D N, Li J Y, Qian Q. Map-based cloning of the ALK gene, which controls the gelatinization temperature of rice. Sci China C (Life Sci), 2003, 46: 661–668
[8] Bao J S, Corke H, Sun M. Nucleotide diversity in starch synthase IIa and validation of single nucleotide polymorphisms in relation to starch gelatinization temperature and other physicochemical properties in rice (Oryza sativa L.). Theor Appl Genet, 2006, 113: 1113–1171
[9] Nakamura Y, Francisco P B, Hosaka Y, Sato A, Sawada T, Kubo A, Fujita N. Essential amino acid of starch synthase IIa differentiate amylopectin structure and starch quality between japonica and indica rice varieties. Plant Mol Biol Rep, 2005, 58: 213–227
[10] Jeon J S, Ryoo N, Hahn T R, Walia H, Nakamura Y. Starch biosynthesis in cereal endosperm. Plant Physiol Biochem, 2010, 48: 383–392
[11] Umemoto T, Yano M, Satoh H, Shomura A, Nakamura Y. Mapping of a gene responsible for the difference in amylopectin structure between japonica-type and indica-type rice varieties. Theor Appl Genet, 2002, 104: 1–8
[12] Li Z Y, Li D H, Du X H, Wang H, Larroque O, Jenkins C L D, Jobling S A, Morell M K. The barley amo1 locus is tightly linked to the starch synthase IIIa gene and negatively regulates expression of granule-bound starch synthetic genes. J Exp Bot, 2011, 62: 5217–5231
[13] 孙川, 陈刚, 饶玉春, 张光恒, 高振宇, 刘坚, 鞠培娜, 胡江,郭龙彪, 钱前, 曾大力. 水稻基因组DNA简易制备方法. 中国水稻科学, 2010, 24: 677–680 Sun C, Chen G, Rao Y C, Zhang G H, Gao Z Y, Liu J, Ju P N, Hu J, Guo L B, Qian Q, Zeng D L. A simple method for rapid preparation of rice genomic DNA. Chin J Rice Sci, 2010, 24: 677–680 (in Chinese with English abstract)
[14] Zhang C Q, Zhu L J, Shao K, Gu M H, Liu Q Q. Toward underlying reasons for rice starches having low viscosity and high amylose: physiochemical and structural characteristics. J Sci Food Agric, 2013, 93: 1543–1551
[15] Wei X, Wang R S, Cao L R, Yuan N N, Huang J, Qiao W G, Zhang W X, Zeng H L, Yang Q W. Origin of Oryza sativa in China inferred by nucleotide polymorphisms of organelle DNA. PLoS One, 2012, 7: e49546
[16] Yang F, Chen Y L, Tong C, Huang Y, Xu F F, Li K H, Corke H, Sun M, Bao J S. Association mapping of starch physicochemical properties with starch synthesis-related gene markers in nonwaxy rice (Oryza sativa L.). Mol Breed, 2014, 34: 1747–1763
[17] Gao Z Y, Zeng D L, Cheng F M, Tian Z X, Guo L B, Su Y, Yan M X, Jiang H, Dong G J, Huang Y C, Han B, Li J Y, Qian Q. ALK, the key gene for gelatinization temperature, is a modifier gene for gel consistency in rice. J Integr Plant Biol, 2011, 53: 756–765
[18] Zhou Y, Zheng H Y, Wei G C, Zhou H, Han Y N, Bai X F, Xing Y Z, Han Y P. Nucleotide diversity and molecular evolution of the ALK gene in cultivated rice and its wild relatives. Plant Mol Biol Rep, 2016,DOI: 10.1007/s11105-016-0975-1
[19] Kharabian-Masouleh A, Waters D L, Reinke R F, Ward R, Henry R J. SNP in starch biosynthesis genes associated with nutritionaland functional properties of rice. Sci Rep, 2012, 2: 557
[20] Zhang Z J, Li M, Fang Y W, Liu F C, Lu Y, Meng Q C, Peng J C, Yi X H, Gu M H, Yan C J. Diversification of the Waxy gene is closely related to variations in rice eating and cooking quality. Plant Mol Biol Rep, 2012, 30: 462–469
[21] Hori Y, Fujimoto R, Sato Y, Nishio T. A novel wx mutation caused by insertion of a retrotransposon-like sequence in a glutinous cultivar of rice (Oryza sativa). Theor Appl Genet, 2007, 115: 217–224
[22] 肖鹏, 邵雅芳, 包劲松. 稻米糊化温度的遗传与分子机理研究进展. 中国农业科技导报, 2010, 12(1): 23–30 Xiao P, Shao Y F, Bao J S. Research progress on genetics and molecular mechanism of starch gelatinization temperature of rice grain. J Agric Sci Tech, 2010, 12(1): 23–30 (in Chinese with English abstract)
[23] Hoai T T T, Matsusaka H, Toyosawa Y, Suu T D, Satoh H, Kumamaru T. Influence of single-nucleotide polymorphisms in the gene encoding granule-bound starch synthase I on amylose content in Vietnamese rice cultivars. Breed Sci, 2014, 64: 142–148
Genetic Diversity of ALK Gene and Its Association with Grain Gelatinization Temperature in Currently Cultivated Rice Landraces from Hani’s Terraced Fields in Yunnan Province
LI Chuang1,2,**, LIU Cheng-Chen1,2,**, ZHANG Chang-Quan1, ZHU Ji-Hui1, XU Xiao-Ying2, ZHAO Fu-Wei3, HUANG Shao-Wen4, JIN Yin-Gen2,*, and LIU Qiao-Quan1,*
1Jiangsu Key Laboratory of Crop Genetics and Physiology / Co-Innovation Center for Modern Production Technology of Grain Crops, Yangzhou University, Yangzhou 225009, China;2College of Biological Science and Technology, Yangzhou University, Yangzhou 225009, China;3Nanjing Institute of Environmental Sciences of Ministry of Environmental Protection, Nanjing 210042, China;4Yunnan Honghe University, Mengzi 661100, China
Yunnan province is one of the centers for genetic diversity of cultivated rice in Asia. A total of 111 rice landraces were collected from Hani’s rice terraces of Yunnan, and their population structure was analyzed by using 51 SSR markers. The 111 rice landraces were divided into japonica group (group I) and indica group (group II); however, each of the two groups was not completely clustered according to its geographical origin. Most collected landraces, accounting for 83%, belonged to indica group. Gelatinization temperature (GT) is an important parameter affecting rice cooking and eating quality. The GT of rice flour wasmeasured, which was widely different among the collected rice varieties, showing four classes in very low ( <66°C), low (66-70°C), high (70-74°C) and very high ( >74°C) GT. Meanwhile, ALK gene, also known as SSSIIa and controlling GT, was sequenced and compared, showing ten haploid types of the ALK gene among tested samples. Association analysis, revealed that GT is mainly controlled by the combination of three SNPs of ALK gene. Among them, the A-GC or G-TT combination type controls the very low and low GT, while the combination of G-GC controls high and very high GT. SNP3402type T is associated with high and very high GT. It was also noticed that most of the varieties from indica group tended to contain the G-GC mutation and thus showed a relative high GT compared with those from the japonica group. These results are meaningful for rice molecular breeding and germplasm resources protection.
Oryza sativa L.; ALK gene; Genetic diversity; Hani’s terrace; Gelatinization temperature

附表1 供试材料名称及来源Supplementary table 1 Name and collecting sites of rice varieties in this study

(续附表1)

(续附表1)
10.3724/SP.J.1006.2017.00343
本研究由国家重点基础研究发展计划项目(2013CBA01402), 国家自然科学基金项目(31561143008, 31300324)和江苏省高校自然科学研究面上项目(13KJB180028)资助。
This study was supported by the National Basic Research Program of China (2013CBA01402), the National Natural Science Foundation of China (31561143008, 31300324), and the Natural Sciences Research Project of Higher Learning Institution in Jiangsu Province (13KJB180028).
*通讯作者(Corresponding authors): 刘巧泉, E-mail: qqliu@yzu.edu.cn; 金银根, E-mail: ygenjin@hotmail.com
**同等贡献(Contributed equally to this work)
联系方式: 李闯, E-mail: chuangli163@yeah.net; 刘承晨, E-mail: 731064949@qq.com
稿日期): 2016-06-14; Accepted(接受日期): 2016-09-18; Published online(
日期): 2016-09-29.
URL: http://www.cnki.net/kcms/detail/11.1809.S.20160929.1451.008.html

