转CP4-EPSPs基因大豆杂交后代对草甘膦的抗性水平与遗传背景的相关性
孙如建孙宾成张 琪胡兴国郭荣起郭兵福马岩松,4于 平张晓莉柴 燊张万海,*邱丽娟,*
1呼伦贝尔市农业科学研究所 / 国家大豆改良中心呼伦贝尔分中心, 内蒙古扎兰屯 162650;2中国农业科学院作物科学研究所 / 国家农作物基因资源与遗传改良重大科学工程 / 农业部北京大豆生物学重点实验室, 北京100081;3东北农业大学, 黑龙江哈尔滨150030;4黑龙江省农业科学院大豆研究所, 黑龙江哈尔滨 150086
转CP4-EPSPs基因大豆杂交后代对草甘膦的抗性水平与遗传背景的相关性
孙如建1,2,3孙宾成1张 琪1胡兴国1郭荣起1郭兵福2马岩松2,4于 平1张晓莉1柴 燊1张万海1,*邱丽娟2,*
1呼伦贝尔市农业科学研究所 / 国家大豆改良中心呼伦贝尔分中心, 内蒙古扎兰屯 162650;2中国农业科学院作物科学研究所 / 国家农作物基因资源与遗传改良重大科学工程 / 农业部北京大豆生物学重点实验室, 北京100081;3东北农业大学, 黑龙江哈尔滨150030;4黑龙江省农业科学院大豆研究所, 黑龙江哈尔滨 150086
第一代抗草甘膦转CP4-EPSPs基因大豆GTS40-3-2是国际上应用时间最长、种植面积最大的转基因作物。本文以6份GTS40-3-2衍生的抗草甘膦转基因大豆新品系为亲本, 配制4个杂交组合, 利用抗性分级法和相对株高法鉴定杂交亲本及其F2:3子代对草甘膦的耐受性差异, 分析其抗性水平与遗传背景的相关性。结果表明, 以1230 g a.i. hm–2草甘膦喷施处理时, 转基因亲本及其F2:3子代的苗期生长受草甘膦抑制不显著, 而当喷施浓度提高至3690 g a.i. hm–2和4920 g a.i. hm–2时则抑制作用显著。供试的6个杂交亲本中以ZLHJ06-1568、ZLHJ10-713和ZLHJ06-698对草甘膦的耐受性相对较强, 而4个F2:3组合中以ZLHJ10-713 × ZLHJ06-698后代在草甘膦喷施后株高受抑制最小, 对草甘膦耐受性最强。不同组合后代对草甘膦的耐受性普遍优于其双亲, 呈现出杂种优势。各组合后代与亲本之间对草甘膦的耐受性均呈正相关, 但由于亲本间互作效应的不同, 导致后代抗性水平产生差异。本研究表明草甘膦抗性基因CP4-EPSPs在大豆中的表达水平与其遗传背景相关联, 为利用转基因大豆新种质培育转基因大豆新品种过程中目标基因的定向选择提供了参考依据。
转基因大豆; 抗草甘膦特性; 遗传规律
大豆[Glycine max (L.) Merr.]是重要的粮油作物,在全世界广为种植, 仅2014年全球大豆种植面积就高达1.185亿公顷[1]。随着人们生活水平的日渐提高,我国大豆消费需求逐年攀升, 但大豆种植面积和年总产量却在逐年缩减, 其中种植成本高、经济效益低是造成我国大豆生产不景气, 供不应求的主要原因。为满足市场需要只能从国外进口大豆, 2015年进口总量高达8169万吨, 其中主要为抗草甘膦转基因大豆。抗草甘膦转基因大豆是世界上商品化最早、应用最广的转基因作物[2], 自1996年获得商业化生产许可以来, 其种植面积逐年扩大[3-5], 而我国虽已开展转基因大豆生物技术研究, 但仍未批准转基因大豆的商业化种植, 因此加速我国转基因大豆的研究进程具有重要的实践意义。
草甘膦是一种有机磷类除草剂, 具有低毒低残留、广谱灭生、内吸传导等特点[6-7]。大豆对草甘膦的耐受性鉴定方法主要有田间喷洒法[8]、种子浸泡法、生物测定法[9]、和定量点施法[11]等, 其中又以田间喷洒法最为常用, 鉴定结果最为准确可靠[8]。草甘膦处理后的作用效果虽因植物种类、喷施剂量等的不同而存在差异, 但在植株茎顶端及叶片上出现的“yellow flashing”现象是最显著的标志性药害症状,该现象在常规大豆中不可恢复, 但在抗草甘膦转基因大豆中是暂时的, 施药后期可恢复[12-14], 而高浓度的草甘膦则会抑制大豆早期(V1和 V2)的株高生长[15]。
我国抗草甘膦转基因大豆仍处于研发阶段, 尚未产业化, 关于转 EPSPs基因大豆杂交后代对草甘膦抗性的相关研究较少。刘文娟等[16]利用抗草甘膦转基因大豆GTS40-3-2, 在V2期茎叶喷施不同浓度的草甘膦, 收获的种子于第 2年种植, 茎叶喷施相同浓度草甘膦后检测抗性, 结果表明成熟籽粒中外源基因的相对含量没有显著变化, 可见抗草甘膦特性可以在子代中稳定遗传。刘敏等[17]用抗除草剂转基因大豆与常规大豆杂交, 对杂种后代 F1、F2、F3和BC1植株在2~3叶期喷施草甘膦, 遗传分析证实抗除草剂基因受一对显性核基因控制, 为杂交育种提供了理论依据。然而, 利用草甘膦抗性基因进行抗草甘膦转基因大豆新品种培育时, 其杂交后代对草甘膦的耐受性是否存在差异尚未见报道。
本试验利用抗草甘膦转基因大豆新品系进行有性杂交, 对亲本、F2和F2:3喷施不同剂量草甘膦, 调查植株叶片及株高的变化情况, 系统分析后代对草甘膦的抗性水平及其与亲本的相关性, 旨在明确转基因供体亲本和衍生后代间的抗性遗传特点, 为抗草甘膦大豆育种提供参考。
1 材料与方法
1.1 试验材料
1.1.1 供试亲本及后代材料 抗草甘膦大豆品系中联 HJ10-625 (ZLHJ10-625)、中联 HJ11-140 (ZLHJ11-140)、中联HJ11-142 (ZLHJ11-142)、中联HJ10-713 (ZLHJ10-713)、中联 HJ06-698 (ZLHJ06-698)和中联HJ06-1568 (ZLHJ06-1568)等6个(表1),均衍生于商业化推广的抗草甘膦转CP4-EPSPs基因大豆GTS40-3-2, CP4-EPSPs表达框在GTS40-3-2中为单拷贝插入(http://gmdd.shgmo.org/event/view/ 41)。2012年配制 ZLHJ11-140 × ZLHJ10-625、ZLHJ11-142 × ZLHJ10-625、ZLHJ10-713 × ZLHJ06-698和ZLHJ10-713 × ZLHJ06-1568等4个杂交组合, 2013年种植F1, 2014年种植F2, 单株收获后从每个杂交组合随机选择10个单株(10次重复)种植F2:3株行, 每个株行20株, 同时种植各组合亲本。
1.1.2 喷雾器和除草剂 选用 3WBD-18型背负式电动喷雾器, 由台州市吉达喷雾厂生产; 喷施所用Roundup的草甘膦异丙胺盐有效剂量为41%, 由美国孟山都公司生产。
1.2 草甘膦处理
在植株生长至第一片三出复叶完全展开(V2期)时, 对亲本和 F2:3株系分别喷施清水(T1)和 1230 (T2)、3690 (T3)、4920 g a.i. hm–2(T4)的草甘膦, 即0倍、1倍、3倍和4倍的生产推荐浓度(0、3000、9000和12 000 mL hm–2), 于喷药7 d后调查株高变化及叶片药害等级。
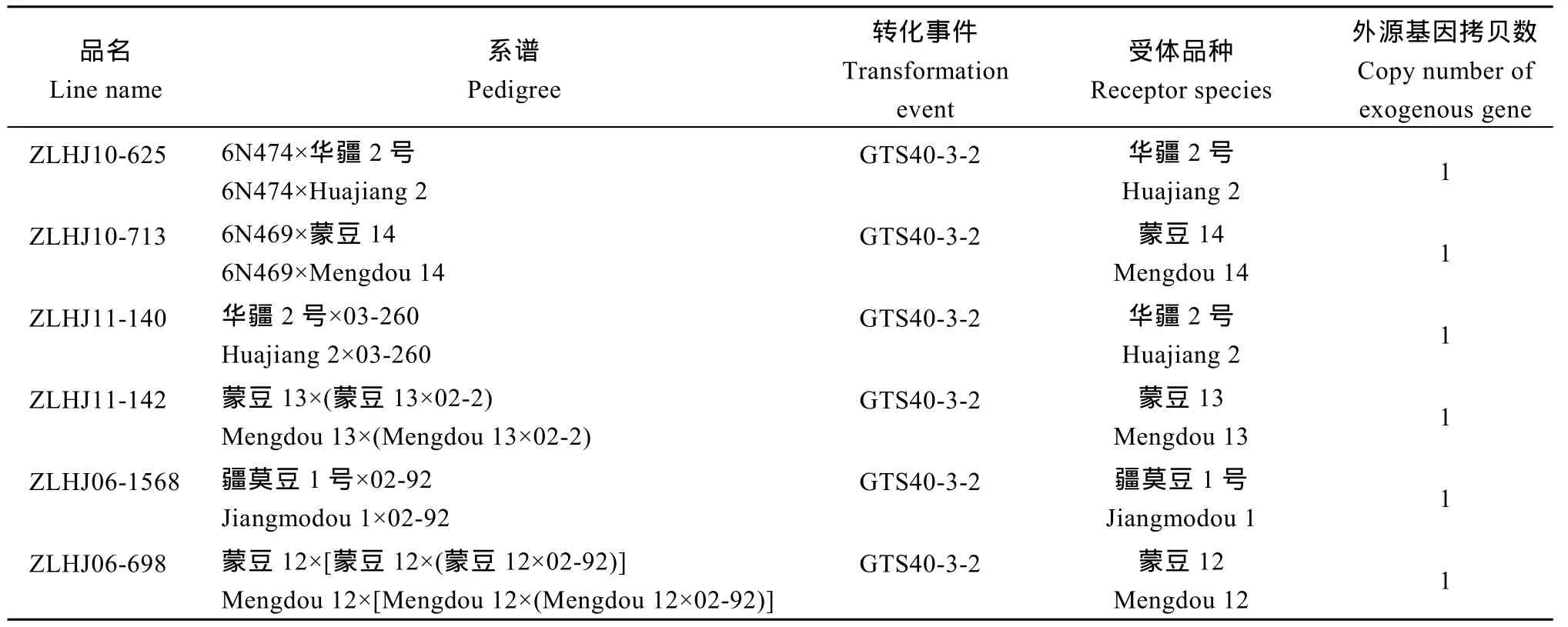
表1 杂交亲本相关信息Table 1 Information of crossing parental
1.3 抗草甘膦鉴定方法
1.3.1 相对株高法[18]调查每个单株喷药前及喷药7 d后的株高, 得到株高平均变化值Δh1、Δh2、Δh3和Δh4, 并计算T2、T3、T4与T1 (CK)的比值。
以T2为例, 相对株高变化(Hx)=Δh2/Δh1×100%,该值越大表明株高受抑制越轻, 抗性越强。
1.3.2 抗性分级法[19]X(%) = [∑(N×S) / (T×M)] ×100, 式中X为药害指数, N为同级受害株数, S为药害级别数, T为总株数, M为最高级别。
即药害指数(%) = (1×1级药害株数+2×2级药害株数+3×3级药害株数+4×4级药害株数)/(总株数×最高药害级)×100, 其中最高药害级为4。
1.3.3 药害等级划分标准[20]0级为植株生长正常, 无任何受害症状, 与对照(T1)相比, 无明显差异; 1级为 0~25%叶片产生暂时性的接触性药害斑、皱缩或生长受轻微抑制; 2级为 25%~50%叶片产生较重的连片药害斑, 褪绿、皱缩、畸形或者生长明显受抑制, 但可以恢复; 3级为 50%~75%叶片产生药害, 或造成生长点死亡, 生长严重受抑制; 4级为75%以上的叶片产生药害, 或部分或全部植株死亡。
2 结果与分析
2.1 亲本抗性鉴定
利用4种浓度草甘膦对6份亲本材料喷施。用抗性分级法测定受害程度表明, 各亲本在 T2 (1230 g a.i. hm–2)下平均药害指数为6.96%, 药害较轻, 叶片无明显变化, 而在T3 (3690 g a.i. hm–2)和T4 (4920 g a.i. hm–2)下叶片受害相对较重, 平均药害指数分别为29.63%和39.58%, 与T2差异显著(图1)。
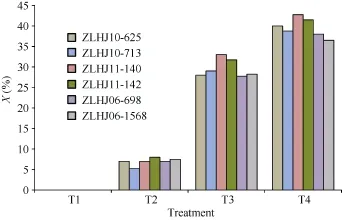
图1 6个亲本对草甘膦的药害指数Fig. 1 Glyphosate phytotoxicity index of six parents
方差分析(表2)及多重比较(表3)表明, ZLHJ06-1568、ZLHJ10-713和ZLHJ06-698的平均药害指数分别为 24.41%、24.58%和 24.64%, 显著低于ZLHJ11-140 (27.83%)和ZLHJ11-142 (27.33%), 对草甘膦表现出较强的耐受性, 但总体而言, 各亲本均表现出较强的耐受性, 植株在高浓度处理后虽有药害症状表现, 但经过一段时间均能恢复正常生长。
2.2 F2抗性鉴定
对4个组合F2群体喷施生产推荐剂量1230 g a.i. hm–2的草甘膦, 植株生长正常且未发现明显的药害症状, 表明各亲本携带的草甘膦抗性基因均已通过杂交的方法转移至F2群体中。
2.3 F2:3抗性鉴定
2.3.1 抗性分级法 在不同浓度草甘膦处理下,不同组合 F2:3株系的叶片受害程度表现出相同的变化趋势(图2)。
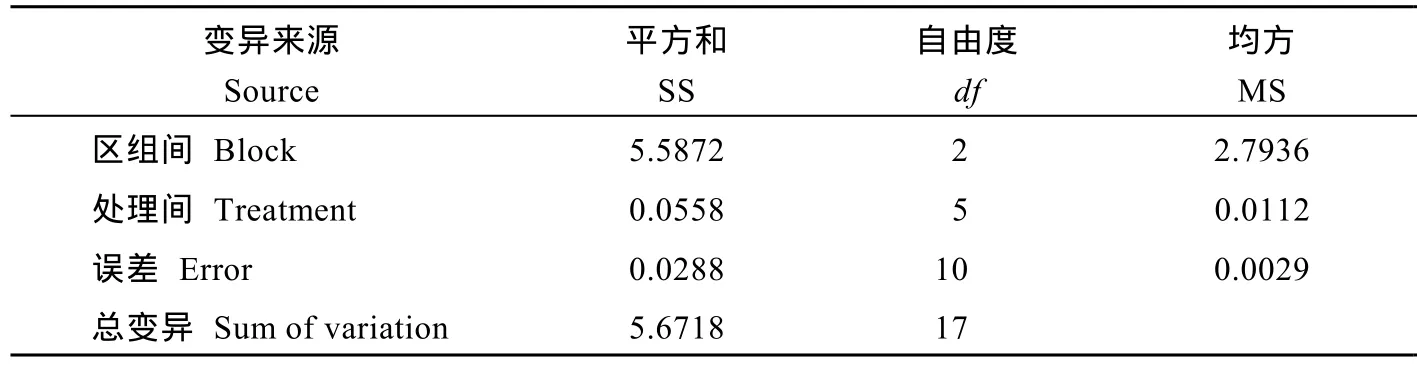
表2 亲本对草甘膦抗性的方差分析Table 2 Variance analysis of parents' resistance to glyphosate

表3 亲本对草甘膦抗性的多重比较Table 3 Multiple comparison of parents' resistance to glyphosate

图2 4个杂交组合F2:3叶片不同处理下药害表型Fig. 2 Injured phenotype of F2:3leaves of four combinations at each concentration
利用叶片受害表型鉴定转基因大豆 F2:3对草甘膦处理的抗性反应, 结果表明在相同浓度草甘膦处理下, 各组合间的抗性差异不显著, 其中 ZLHJ10-713 × ZLHJ06-698在T3和T4下的药害指数分别为24.5%和 32.0%, 对草甘膦的抗性较强, ZLHJ11-140 × ZLHJ10-625抗性较差, 药害指数分别为27.8%和34.0%。不同浓度草甘膦处理间相比, 低浓度的 T2与 T1相比药害症状不明显, 平均药害指数仅为5.0%, 而较高浓度的T3 (26.3%)和T4 (33.1%)下药害症状较重, 与T1、T2相比差异显著(图3)。
2.3.2 相对株高法 同一浓度下 F2:3群体不同组合间对草甘膦的耐药性存在差异(表 4)。T2水平下各组合间的差异不显著; 在T3水平下, ZLHJ10-713 × ZLHJ06-698的相对株高变化最大, 达到 83.28%,抗性最强, 与 ZLHJ10-713 × ZLHJ06-1568和ZLHJ11-140 × ZLHJ10-625差异达到极显著水平;在T4水平下, ZLHJ10-713 × ZLHJ06-698的抗性同样最强(76.45%), 与ZLHJ10-713 × ZLHJ06-1568及ZLHJ11-140 × ZLHJ10-625差异达到显著水平。
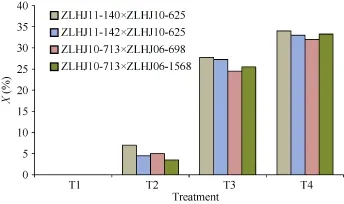
图3 4种不同草甘膦处理后4个杂交组合F2:3的药害指数比较Fig. 3 Comparison of Phytotoxicity rating in F2:3generation of four crosses treated with four glyphosate concentrations
4个组合不同处理间株高变化呈现一致的变化规律, 其中T1的相对株高值最大, 与 T2差异不显著, 但与T3、T4间差异均达到极显著水平; T2与T3、T4间除ZLHJ10-713 × ZLHJ06-698外差异均达到极显著水平, 可见生产推荐浓度的草甘膦对转基因大豆后代的苗期株高影响极小; 而T3和T4浓度下株高受抑制显著, 且两处理间差异不显著。
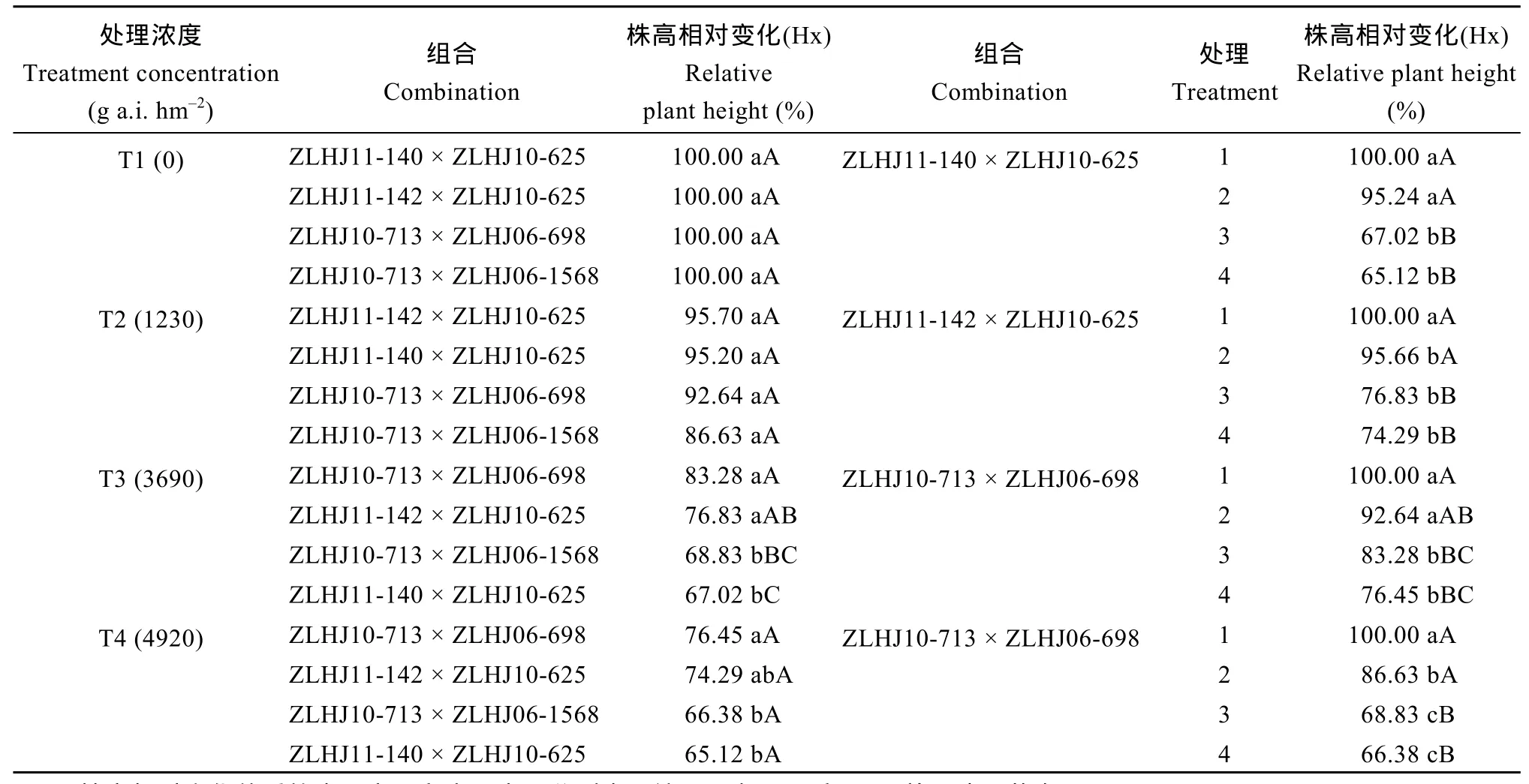
表4 不同处理、不同组合的株高相对变化Table 4 Relative variation of plant height for each treatment combination
利用 SPSS分析相对株高法和抗性分级法两种抗性测定结果, 二者相关系数为 0.821, 达到极显著相关。次年在大田种植并喷药, 用同样方法重复鉴定 F2:3抗性, 与之前结果相关系数为 0.409, 呈显著相关, 表明杂交转育后代对于草甘膦的抗性稳定性较高, 试验重复性较好。说明两种方法均可用于对大豆抗草甘膦特性的评价, 可以根据实际情况选用适宜的鉴定方法。
2.4 F2:3与亲本抗性相关分析
各组合亲本与 F2:3在不同浓度下表现出的抗性水平规律相似, F2:3抗性普遍优于双亲, 这是由于F2:3具有一定的杂种优势。亲本抗性较高的材料, 其后代大部分抗性也较高, 但由于亲本之间存在互作效应, 后代的抗性并不是双亲的简单累加, 会出现双亲高抗但杂交后代抗性相对较低的情况, 例如T4下的 ZLHJ10-713 × ZLHJ06-698和 ZLHJ10-713 × ZLHJ06-1568等(图4)。

图4 不同草甘膦处理条件下亲本与F2:3药害指数Fig. 4 Phytotoxicity index of parents and F2:3in treatments with different glyphosate concentrations
亲本与后代的抗性均呈正相关: 在亲本和 F2:3均为1230 g a.i. hm–2浓度下处理时, 亲本与F2:3的表型变化不明显, 抗性相关系数也最小(0.251)。其他浓度处理下, 亲本与 F2:3之间的抗性相关系数都大于0.5, 其中在亲本和F2:3均为3690 g a.i. hm–2浓度下处理时, 亲本与F2:3的相关性最大(0.979), 达到显著水平(表5)。

表5 不同草甘膦处理条件下亲本与F2:3对草甘膦抗性的相关系数Table 5 Correlation coefficient of glyphosate resistance between parents and F2:3
2.5 高抗F2:3株系筛选
F2:3各株系与亲本材料相比抗性普遍较强, 其中平均抗性排名前10位的, 均来源于ZLHJ10-713× ZLHJ06-698和ZLHJ11-142×ZLHJ10-625组合, 在这 2个组合后代中, 有较高机率筛选到高抗材料(表6)。
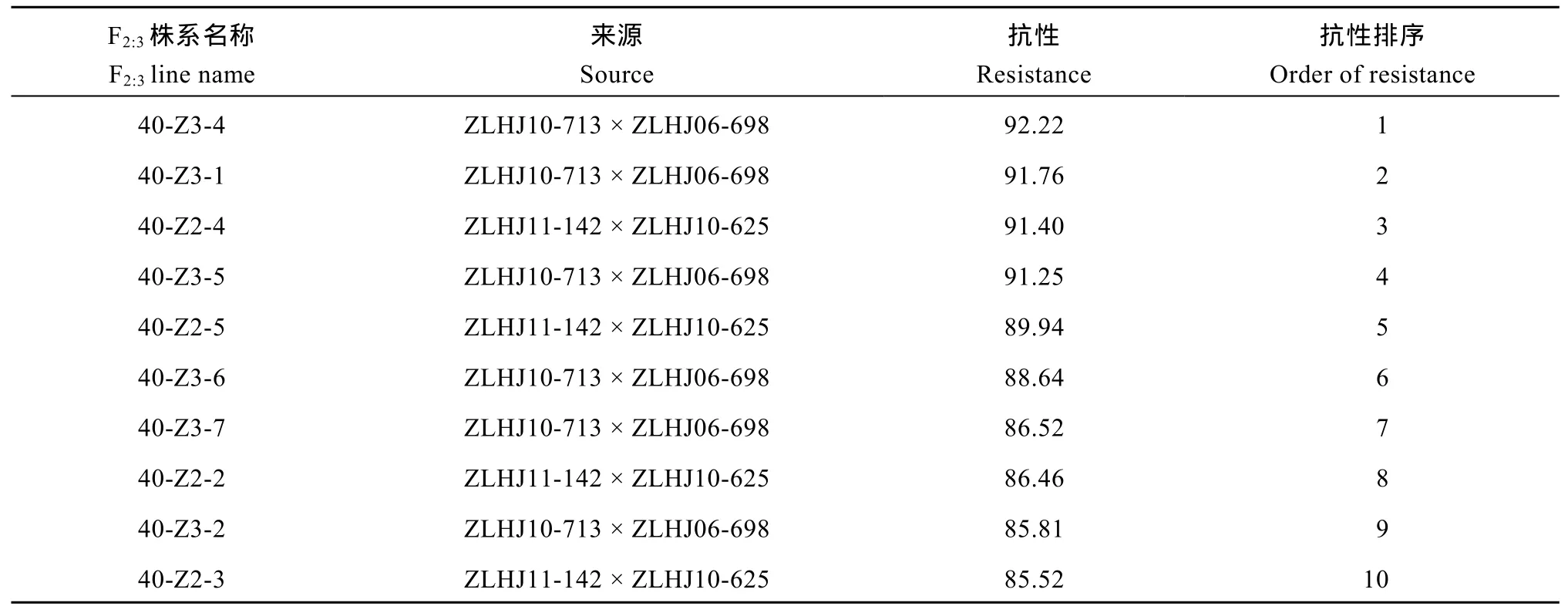
表6 基于株高相对变化的草甘膦抗性排序前10位F2:3株系Table 6 Top 10 F2:3lines with high glyphosate resistance based on the relative height change
3 讨论
为避免杂交亲本因外源基因有无对后代抗性产生影响, 本研究选择的杂交亲本均含有草甘膦抗性基因 CP4-EPSPs。抗性分级法是用于鉴定转基因材料对草甘膦耐受性最经典最常用的方法, 本试验在采用抗性分级法的同时, 以株高作为指标鉴定抗性,蒋凌雪等[21]对草甘膦处理后大豆顶芽的全基因表达分析表明, 草甘膦抑制大豆顶芽生长的分子机制为抑制莽草酸途径中色氨酸的生物合成, 只有色氨酸迅速下降并维持较低水平时才能抑制芽伸长, 而色氨酸也是唯一有效的芳香族氨基酸, 说明这一方法具有一定的理论基础。
本研究发现, 低浓度(1230 g a.i. hm–2)处理的药害不明显, 而高浓度处理(3690 g a.i. hm–2, 4920 g a.i. hm–2)与清水对照相比存在极显著差异, 证明高浓度草甘膦对转基因大豆的苗期生长有显著的抑制作用,与前人报道相同[18]。同时, F2:3对草甘膦的耐受性普遍高于亲本, 这与F2:3具有一定的杂种优势有关, 后续世代耐受性有降低的可能, 但仍需通过试验进一步验证。各亲本中 ZLHJ06-1568、ZLHJ10-713和ZLHJ06-698的抗性相对较强, 而各组合 F2:3中以ZLHJ10-713 × ZLHJ06-698对草甘膦的抗性较强,说明利用抗性较高的亲本杂交, 获得高抗后代的几率较大, 但后代抗性并不是双亲的简单累加, 表明抗草甘膦特性这一目标性状的基因表达与遗传背景密切相关, 双亲遗传背景的差异影响着后代遗传倾向, 这一发现对于杂交育种中的亲本选配具有一定的借鉴意义。
本试验中3690 g a.i. hm–2的草甘膦对大豆苗期产生明显药害, 而1230 g a.i. hm–2无明显药害。但有研究发现, 抗草甘膦大豆对1倍、2倍、4倍推荐剂量草甘膦的耐受性均较好, 不同剂量和不同施药时期对大豆产量影响不显著[18], 这可能与其利用莽草酸及产量作为主要指标进行分析、且喷药时期不同有关。草甘膦的推荐用药浓度为1230 g a.i. hm–2, 而在实际生产实践中, 农民为提高除草效率, 往往采用加倍剂量喷施, 有报道表明, 用3倍和4倍生产剂量草甘膦喷施, 对抗草甘膦大豆具有明显的抑制作用[22]。因此, 生产上为保证除草效果, 同时避免除草剂对抗草甘膦大豆造成药害, 建议将草甘磷施用剂量控制在2460 g a.i. hm–2以下。
4 结论
转基因大豆亲本及其 F2:3植株在第一片三出复叶完全展开(V2期)时喷施浓度为1230 g a.i. hm–2的草甘膦, 大豆苗受影响不显著, 而浓度为3690 g a.i. hm–2和4920 g a.i. hm–2的草甘膦则对苗期生长具有显著的抑制作用。不同组合 F2:3抗性普遍高于其双亲, 表现出一定的杂种优势。6个亲本中以ZLHJ06-1568、ZLHJ10-713和ZLHJ06-698的抗性相对较强,而4个杂交组合F2:3中以ZLHJ10-713×ZLHJ06-698对草甘膦的抗性较强。亲本与其杂交子代对草甘膦的耐受性呈正相关, 利用抗性较高的亲本进行杂交,获得高抗后代的几率较大, 但后代抗性并不是双亲的简单累加, 由于亲本间互作效应不同, 导致后代抗性水平产生差异, 表明抗草甘膦这一目标基因在大豆中的表达与其遗传背景密切相关。
[1] Retrieved June 4, 2014, http://www.chinairn.com/news/201406 04/084920804.shtml
[2] Phillip A C. RAPD analysis of seed purity in a commercial hybrid cabbage (Brassica oleracea var. Capital) cultivar. Genome, 2000, 43: 317
[3] Hungria M, Mendes I C, Nakatani A S, Reis-Junior F B, Morais J Z, Oliveira M C N, Fernandes M F. Effects of the glyphosateresistance gene and herbicides on soybean: Field trials monitoring biological nitrogen fixation and yield. Field Crops Res, 2014, 158: 43–54
[4] Norsworthy J K. Use of soybean production surveys to determine weed management needs of south carolina farmers. Weed Technol, 2003, 17: 195–201
[5] James C. Global biotechnology GM crops commercialization development trend in 2014. Chin J Biol Eng, 2015, 35: 1–14
[6] Dun B Q, Wang X J, Lu W, Chen M, Zhang W, Ping S Z, Wang Z X, Zhang B M, Lin M. Development of highly glyphosatetolerant tobacco by coexpression for glyphosate acetyltransferase gat and EPSPS G2-aroA genes. Crop J, 2014, 2: 164–169
[7] Moldes C A, Medici L O, Abrahao O S, Tsai S M, Azevedo R A. Biochemical responses of glyphosate resistant and susceptible soybean plants exposed to glyphosate. Acta Physiol Plant, 2008, 30: 469–479
[8] 王秀丽, 王留明, 王家宝, 杨静, 陈莹, 赵军胜, 高明伟. 转基因抗草甘膦棉花鉴定方法研究. 山东农业科学, 2008, (9): 79–80 Wang X L, Wang L M, Wang J B, Yang J, Chen Y, Zhao J S, Gao M W. Study on identification method of transgenic glyphosate resistant cotton. Shandong Agric Sci, 2008, (9): 79–80 (in Chinese)
[9] 张庆贺, 王斌, 蒋凌雪, 邱丽娟, 陶波. 抗草甘膦转基因大豆生物测定方法的研究. 作物杂志, 2010, (3): 20–22 Zhang Q H, Wang B, Jiang L X, Qiu L J, Tao B. The research of biological and biochemical method to detect the roundup ready soybean. Crops, 2010, (3): 20–22 (in Chinese)
[10] 吕山花, 常汝镇, 陶波, 李向华, 栾凤侠, 郭珊花, 邱丽娟. 抗草甘膦转基因大豆PCR检测方法的建立与应用. 中国农业科学, 2003, 36: 883–887 Lyu S H, Chang R Z, Tao B, Li X H, Luan F X, Guo S H, Qiu L J. Methodological research on pcr based detection of genetically modified soybean resistant to glyphosate. Sci Agric Sin, 2003, 36: 883–887 (in Chinese with English abstract)
[11] 邱丽娟, 刘明, 郭勇, 李脉泉, 张宪丽. 一种测定大豆对草甘膦耐性的方法及应用: 中国, 104280536A[P]. 2015-01-14 Qiu L J, Liu M, Guo Y, Li M Q, Zhang X L. Method for Determining Tolerance of Soybean to Glyphosate and Its Application: China, 104280536A[P]. 2015-01-14 (in Chinese)
[12] Mueller T C, Massey J H, Hayes R M, Main C L, Stewart C N. Shikimate accumulates in both glyphosate-sensitive and glyphosate-resistant horseweed. J Agric Food Chem, 2003, 51: 680–684
[13] Zobiole L H S, Kremer R J, de Oliveira Jr R S, Constantin J. Glyphosate affects photosynthesis in first and second generation of glyphosate-resistant soybeans. Plant Soil, 2010, 336: 251–265
[14] Zobiole L H S, Kremer R J, Oliveira R S, Constantin J. Glyphosate effects on photosynthesis, nutrient accumulation, and nodulation in glyphosate-resistant soybean. J Plant Nutr Soil Sci, 2012, 175: 319–330
[15] 刘文娟, 刘勇, 黄小琴, 周西全, 宋君, 尹全, 王东, 陶李, 张富丽, 常丽娟, 张蕾, 雷绍荣. 不同时期喷施草甘膦对抗草甘膦转基因大豆生长和产量构成的影响. 中国农业科学, 2012, 45: 675–684 Liu W J, Liu Y, Huang X Q, Zhou X Q, Song J, Yin Q, Wang D, Tao L, Zhang F L, Chang L J, Zhang L, Lei S R. Impact of spraying glyphosate on growth and yield component of glyphosate-tolerant soybean at different growth stages. Sci Agric Sin, 2012, 45: 675–684 (in Chinese with English abstract)
[16] 刘文娟, 刘勇, 宋君, 郭灵安, 常丽娟, 张富丽, 王东, 尹全,赵泓洋, 雷绍荣. 喷施草甘膦对转基因大豆产量构成和抗性遗传的影响. 中国油料作物学报, 2013, 35: 697–703 Liu W J, Liu Y, Song J, Guo L A, Chang L J, Zhang F L, Wang D, Yin Q, Zhao H Y, Lei S R. Impact of spraying glyphosate on
yield component and resistance genetics of glyphosate-tolerant soybean at two-trifoliolate leaf stage. Chin J Oil Crop Sci, 2013, 35: 697–703 (in Chinese with English abstract)
[17] 刘敏, 朱洪德, 高中利. 抗除草剂转基因大豆遗传分析. 大豆科学, 2010, 29(1): 33–36 Liu M, Zhu H D, Gao Z L. Inheritance analysis of herbicide-resistant transgenic soybean. Soybean Sci, 2010, 29(1): 33–36 (in Chinese with English abstract)
[18] 杨鑫浩. 大豆对草甘膦耐受性检测方法研究. 中国农业科学院硕士学位论文, 北京, 2014 Yang X H, Detecting Methods of Soybean Tolerance to Glyphosate. MS Thesis of Chinese Academy of Agricultural Sciences, Beijing, China, 2014 (in Chinese)
[19] 李儒海, 武怀恒, 褚世海, 万鹏, 黄民松, 吴金萍. 转基因抗草甘膦棉花与常规棉花对草甘膦耐受性的比较研究. 中国棉花, 2010, 37(12): 9–11 Li R H, Wu H H, Chu S H, Wan P, Huang M S, Wu J P. A comparative study of transgenic glyphosate-resistant cotton and conventional cotton glyphosate tolerance. China Cotton, 2010, 37(12): 9–11 (in Chinese)
[20] 江荣昌, 姚秉琦. 化学除草技术手册. 上海: 上海科学技术出版社, 1989 Jiang R C, Yao B Q. Chemical weed Technical Manual. Shanghai: Shanghai Scientific and Technical Publishers, 1989 (in Chinese)
[21] Jiang L X, Jin L G, Guo Y, Tao B, Qiu L J. Glyphosate effects on the gene expression of the apical bud in soybean (Glycine max). Biochem Biophys Res Commun, 2013, 437: 544–549
[22] 刘文娟, 刘勇, 宋君, 周西全, 张富丽, 尹全, 王东, 陶李. 外施草甘膦对转基因大豆生长的影响研究. 见: 粮食安全与植保科技创新. 中国植物保护学会 2009年学术年会论文集, 2009. p 1104 Liu W J, Liu Y, Song J, Zhou X Q, Zhang F L, Yin Q, Wang D, Tao L. Effect of glyphosate on the growth of transgenic soybean. In: Food Safety and Plant Protection Science and Technology Innovation. Annual conference of China Society of Plant Protection, 2009. p 1104 (in Chinese)
Correlation between Resistance to Glyphosate and Genetic Background in Transgenic CP4-EPSPs Gene Soybean Progeny
SUN Ru-Jian1,2,3, SUN Bin-Cheng1, ZHANG Qi1, HU Xing-Guo1, GUO Rong-Qi1, GUO Bing-Fu2, MA Yan-Song2,3, YU Ping1, ZHANG Xiao-Li1, CHAI Shen1, ZHANG Wan-Hai1,*, and QIU Li-Juan2,*
1Hulun Buir Institution of Agricultural Sciences, Zhalantun 162650, Inner Mongolia;2The National Key Facility for Crop Gene Resources and Genetic Improvement / Key Laboratory of Soybean Biology (Beijing) / Institute of Crop Science, Chinese Academy of Agricultural Sciences, Beijing 100081, China;3Northeast Agricultural University, Harbin 150030, China;4Soybean Research Institute, Heilongjiang Academy of Agricultural Sciences, Harbin 150086, China
The first Roundup Ready (RR) soybean (GTS40-3-2) carrying CP4-EPSPs is one of the transgenic crops that have the longest application time and largest planting acreage worldwide. However, it has not been commercialized and has less report in China. In this study, six RR soybean lines derived from GTS40-3-2 were hybridized to create four combinations. We used resistance grading and relative plant height in identifying the resistance to glyphosate of parents and F2:3progeny, to investigate the correlation between resistance of the progeny and genetic background. The growth inhibition of transgenic parents and progeny at seeding stage was not significant when the glyphosate treatment concentration was 1230 g a.i. hm–2, while it was significant when the glyphosate concentration was 3690 g a.i. hm–2and 4920 g a.i. hm–2. ZLHJ06-1568, ZLHJ10-713, and ZLHJ06-698 among thesix parents had the more glyphosate resistance relatively. The progeny of ZLHJ10-713 × ZLHJ06-698 combination had the least inhibition of plant height showing highest resistance to glyphosate in all four F2:3combinations. The progeny had better resistance to glyphosate than their parents showing better heterosis. The glyphosate resistance of progeny was positively correlated with that of parents. Difference of glyphosate resistance was found in progeny among different combinations because of the interaction between parents. Our study indicates that the expression of glyphosate resistance gene is closely related to the genetic background in soybean, providing a theoretical evidence for target gene selection in developing new varieties by using transgenic germplasm.
Transgenic soybean; Glyphosate-resistant characteristics; Inheritance
10.3724/SP.J.1006.2017.00324
本研究由国家转基因生物新品种培育重大专项(ZX2008004-001, ZX2011004-001, ZX2013004-001, ZX2014004-001)资助。
This study was supported by the Major Project of China on New Varieties of GMO Cultivation (ZX2008004-001, ZX2011004-001, ZX2013004-001, ZX2014004-001).
*通讯作者(Corresponding authors): 邱丽娟, E-mail: qiulijuan@caas.cn; 张万海, E-mail: zwh00001@sina.com
联系方式: E-mail: sunrujian321@126.com
稿日期): 2016-06-18; Accepted(接受日期): 2016-11-03; Published online(
日期): 2016-11-15.
URL: http://www.cnki.net/kcms/detail/11.1809.S.20161115.1618.004.html

