乳腺导管内癌的X线表现与组织病理学、分子分型的对照研究
冼少青 马捷 李亿华 曾显荣 肖云敏 刘庆玲

【摘要】 目的:探讨乳腺导管内癌(ductal carcinoma in situ,DCIS)的X线表现与组织级别、分子分型及Ki-67增殖指数的关系。方法:回顾性分析133例136侧DCIS的X线表现及组织病理学、免疫组织化学结果。结果:136侧DCIS,X线表现多为单纯钙化(32.4%)、钙化伴局灶性不对称/肿块(29.4%),钙化形态多为细小多形性49侧(58.3%)、其次为线样分支状30侧(35.7%);分布以段樣多见,
46侧(54.8%)、其次为成簇30侧(35.7%);形态分布组合以细小多形性钙化成簇分布多见23侧(27.4%),其次为细小多形性钙化段样分布22侧(26.2%)。肿块的形态多为不规则形20侧(64.5%)及椭圆形
7侧(22.6%),边缘多为模糊14侧(45.2%)、毛刺状8侧(25.8%),密度为高密度24侧(77.4%)及等密度
7侧(22.6%)。 ER/PR(+)多表现为单纯钙化(35.7%),钙化形态分布组合以细小多形性钙化成簇分布多见(29.4%),单纯肿块次之(22.8%);ER/PR(-)为钙化伴局灶性不对称/肿块多见(35.2%),单纯钙化(31.5%)次之;钙化形态分布组合以线样分支状钙化段样分布多见(45.2%)。钙化形态、分布与
ER/PR、Her-2表达有关,Ki-67增殖指数≤10%时,83.8%ER(+)、81.1%Her-2(-);增殖指数>30%时,56.4%ER(+)、48.7%Her-2(+),差异有统计学意义(P<0.05)。结论:DCIS分子分型以Luminal A型多见。X线以钙化为主要表现,形态多为细小多形性、线样分支状;分布以段样及成簇多见。钙化的形态、分布及形态分布组合与组织级别、ER、PR、Her-2及Ki-67增殖指数有关。
【关键词】 癌; 导管; 乳腺; 数字化乳腺X线摄影; 组织病理学; 激素受体; 人表皮生长因子受体; 分子分型
Control Study of Mammography Appearance and Histopathology,Molecule Subtype of Breast Ductal Carcinoma In Situ/XIAN Shao-qing,MA Jie,LI Yi-hua,et al.//Medical Innovation of China,2017,14(05):022-026
【Abstract】 Objective:To explore the relationship of X-ray appearance and histopathology,molecule subtype,proliferation index of Ki-67 of breast ductal carcinoma in situ(DCIS),in order to know more about them.Method:The main mammography appearance,histopathology and immunhistochemistry of 133 cases DCIS(all 136 latero-breast) were retrospectively analyzed.Result:The 136 side of the DCIS, X-ray shows more pure calcification(32.4%),calcification and focal asymmetry/mass(29.4%),calcification for small pleomorphic 49 sides(58.3%), second line branching 30 sides(35.7%).Distribution to sample rare, 46 sides(54.8%),followed by for clusters of 30 sides(35.7%).Distribution combined with fine pleomorphic calcifications seen clustered in 23 sides(27.4%),followed by small pleomorphic calcified segments like distribution in 22 sides(26.2%).The masses were irregular in 20 sides(64.5%) and 7 sides(22.6%),elliptical edge was vague in 14 sides(45.2%),
8 sides(25.8%) of the burr,density of high density in 24 sides(77.4%) and 7 sides(22.6%) density.ER/PR(+) were pure calcification(35.7%),calcification distribution combined with fine pleomorphic calcifications clustered mostly(29.4%),the second single mass(22.8%).ER/PR(-) for calcification with focal mass asymmetry/see(35.2%),times of pure calcification distribution (31.5%).Calcification combined with linear and branching calcification sample distribution(45.2%).The shape and distribution of calcification and ER/PR,the expression of Her-2,Ki-67 proliferation index wss less than or equal to 10%,83.8% ER (+),81.1% Her-2(-).Proliferation index>30%,56.4% ER(+),48.7% Her-2(+),the difference was statistically significant(P<0.05).Conclusion:Luminal A is the most frequent found in the molecule subtypes of DCIS.The main X-ray appearance of DCIS is calcifications,the main morphous of the calcifications are fine pleomorphic and linear branching,the main distrutions of them are segment and clustered.The morphous,distrutions,combination of the morphous and distrutions of the calcifications are relevanted with histological grade,ER,PR,Her-2 and the proliferation index of Ki-67.
【Key words】 Carcinoma; Duct; Breast; Digital mammographic screening; Histopathology; Hormone receptors; Her-2; Molecular typing
First-authors address:2nd Clinical Medical College of Jinan University Shenzhen Peoples Hospital,Shenzhen 518020,China
doi:10.3969/j.issn.1674-4985.2017.05.006
乳腺导管内癌(ductal carcinoma in situ,DCIS)为肿瘤性上皮细胞局限于导管-小叶系统,未突破基底膜的一组异质性病变。目前,随着影像技术的发展,DCIS的检出率在过去10年得以大幅提高,约占所有乳腺癌的20%[1]。乳腺X线摄影对显示乳腺癌特征性的钙化具有显著优势,尤其在DCIS的筛查中。因此,本研究主要观察DCIS的X线表现,着重于钙化方面,并探讨其与组织病理学及分子分型的关系。现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2010年1月-2013年12月本院手术病理证实的DCIS患者共133例,均為女性。其中3例双侧发病,另有2例患者过往有假体置入史。所有患者均未经放化疗,术前临床、X线片及术后病理资料完整。排除DCIS合并IDC、Paget病及其他类型恶性肿瘤。
1.2 仪器与方法 采用Siemens全数字化乳腺X线机(Mammomat Novation DR),由两位高年资乳腺诊断医师进行回顾双盲法阅片。参考2003年第四版美国放射学会的乳腺影像报告和数据系统(Breast Imaging-Reporting And Date a System,BI-RADS分类)[2]标准,将X线表现分为,(1)主要征象包括,①单纯肿块:形态——圆形、椭圆形、分叶形、不规则形;边缘——清晰、模糊、小分叶、毛刺状;密度——高、中、低、含脂肪密度。②单纯钙化:形态——线样分支状、细小多形性、中间型钙化(模糊不定形、粗糙不均质)、典型良性钙化;分布——段样、成簇、线样、其他(弥漫/散在、区域性)。③钙化伴局灶性不对称/肿块。④结构扭曲。⑤特殊征象包括不对称管状结构/单发扩张导管、球形不对称、局灶性不对称。(2)相关征象:与肿块、不对称或钙化伴随使用,无其他异常发现时,可单独出现作为影像学发现,还包括结构扭曲、血运增加、皮肤回缩、乳头回缩、皮肤增厚、小梁结构增宽、腋淋巴结肿大等。观察内容包括病变最大径;肿块的形态、边缘、密度;钙化的形态、分布、形态分布组合等。
1.3 病理学诊断 根据细胞核的异型性、核分裂、管腔内坏死程度将DCIS划分为低、中、高级别。根据雌激素受体(ER)、孕激素受体(PR)、人类上皮生长因子(Her-2)的表达情况分为四个亚型:Luminal A型、Luminal B型、Her-2过表达型及三阴性型。
1.4 统计学处理 采用SPSS 19.0软件对所得数据进行统计分析,采用 字2检验、Pearson相关性分析,以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 133例患者(136侧患乳)中,年龄25~80岁,平均46.88岁。临床扪及肿块67侧(49.3%),乳头溢液10侧(7.4%),其中血性溢液7侧,触诊阴性59侧(43.4%)。前哨淋巴结转移阳性4侧(2.9%)、腋淋巴结转移阳性7侧(5.1%)。DCISX线低、中级别28侧,高级108侧。单纯肿块31侧,单纯钙化44侧,钙化伴局灶性不对称/肿块40例,结构扭曲10例,特殊征象11例。
2.2 病理结果 低、中级别Ki-67增殖率≤10% 18侧(64.3%),高级别19侧(17.6%);>31%低、中级别3侧(10.7%)、高级别36侧(33.3%),差异有统计学意义(P=0.000),见表1。
2.3 X线表现 (1)136侧DCIS多表现为单纯钙化44侧(32.4%)、钙化伴局灶性不对称/肿块40侧(29.4%)。钙化形态多为细小多形性49侧(58.3%,49/84)、其次为线样分支状30例(35.7%,30/84);分布以段样多见,46侧(54.8%,46/84)、其次为成簇30侧(35.7%,30/84);形态分布组合以细小多形性钙化成簇分布多见23侧(27.4%,23/84),其次为细小多形性钙化段样分布22侧(26.2%,22/84)。肿块的形态多为不规则形20例(64.5%,20/31)及椭圆形7例(22.6%,7/31),边缘多为模糊14侧(45.2%,14/31)、毛刺状
8侧(25.8%,8/31),密度为高密度24侧(77.4%,24/31)及等密度7侧(22.6%,7/31)。低、中级别与高级别DCIS主要征象见表2,相关征象见表3。
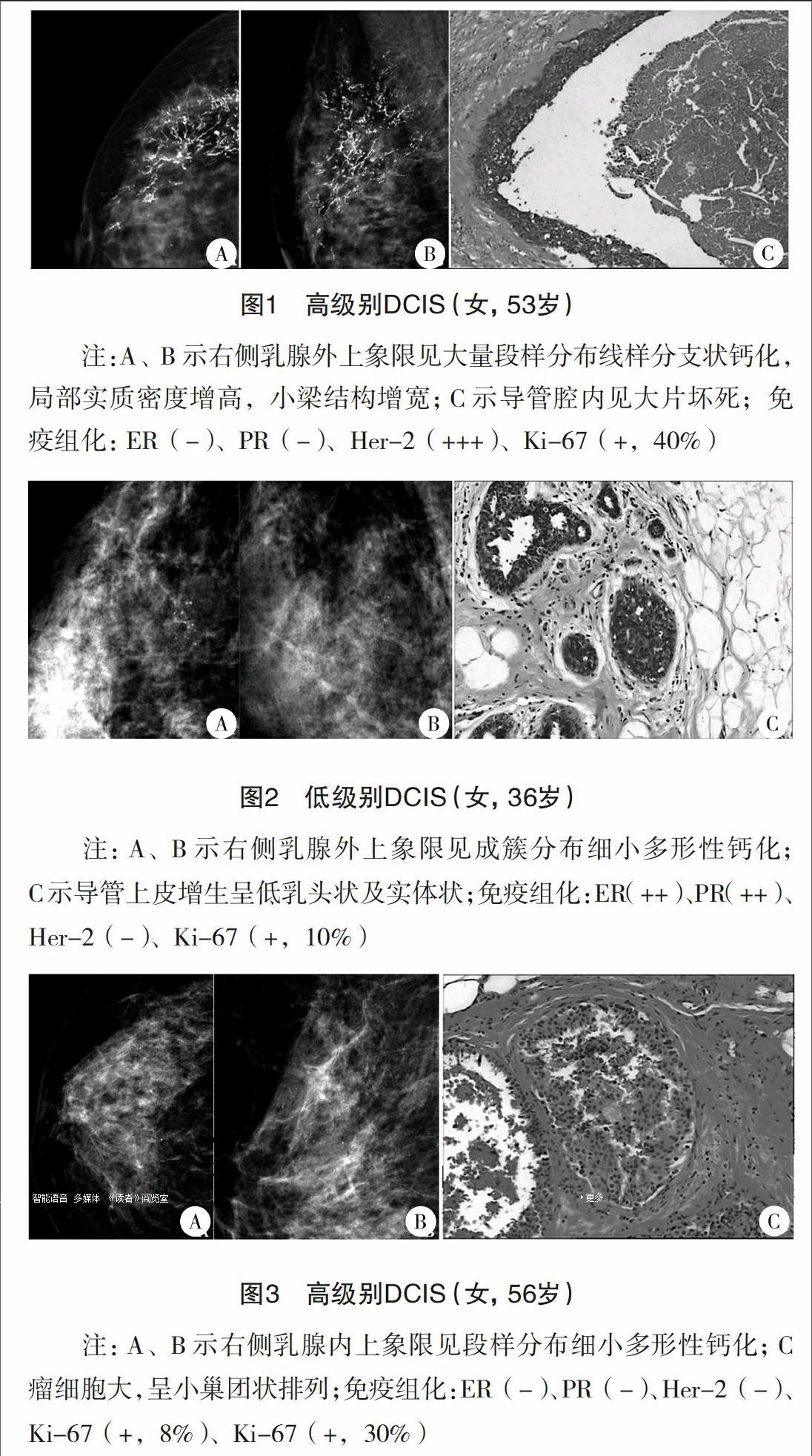
(2)Luminal A型、Luminal B型及三阴性型均以单纯钙化多见,Her-2过表达型则以钙化伴局灶性不对称/肿块为主要表现,差异无统计学意义(P>0.05)。(3)ER/PR(+)多表现为单纯钙化(35.7%,10/28),钙化形态分布组合以细小多形性钙化成簇分布多见(29.4%,40/136),单纯肿块次之(22.8%,31/136);ER/PR(-)为钙化伴局灶性不对称/肿块多见(35.2%,38/108),单纯钙化(31.5%,34/108)次之;钙化形态分布组合以线样分支状钙化段样分布多见(45.2%,38/84)。钙化形态、分布与ER/PR、Her-2表达有关,见表4、5,典型病例,见图1~3。(4)Ki-67增殖指数≤10%时,83.8%ER(+)、81.1%Her-2(-);增殖指数>30%时,56.4%ER(+)、48.7%Her-2(+),差异有统计学意义(P<0.05)。
3 讨论
2003年WHO肿瘤分类中将乳腺导管内癌(ductal carcinoma in situ,DCIS)定义为肿瘤性导管内病变,归入导管增生性病变一大类中,与普通型导管增生、非典型导管增生一样,是乳腺癌风险增加的标志。DCIS不是浸润性乳腺癌一种必有的前驱病变,对其自然病程认识并不透彻。文献[3-5]报道,14%~60%患低级别DCIS的女性进展为浸润性癌,患有高级别DCIS妇女以后发生浸润性癌的风险知之甚少,因为大多数患者采取了干预治疗。研究表明,DCIS通常以钙化为主要X线征象,尤其是细小多形性、线样或线样分支状钙化是其特征性表现[6-8]。乳腺X线摄影对微小钙化敏感性高,优于其他的影像学检查,是目前公认的诊断DCIS的首选检查方法。在进行人群筛查的国家,绝大多数DCIS(>85%)仅仅是通过影像学检查发现的,只有约10%的DCIS具有一些临床表现,约5%的患者因其他原因而进行的手术切除标本中偶然发现。DCIS可能的临床表现有:(1)可触及的异常肿块;(2)病理性的乳头溢液;(3)与Paget病相关的乳头改变。
DCIS的组织学分级被用于预测保守治疗后乳腺癌复发风险以及评估保乳治疗的有效性,与生物学特征具有明显相关性;高级别病变通常缺少ER和PR受体表达,具有高增殖活性、Her-2膜反应性等。Wang等[9]认为将乳腺癌的影像表現、分子分型及预测标志物联合分析,能够更准确地评估患者预后及作出合理的个体治疗方案。低、中级别Ki-67增殖率≤10% 18侧(64.3%),高级别19侧(17.6%);>31%低、中级别3侧(10.7%)、高级别36侧(33.3%),差异有统计学意义(P=0.000)。提示与高级别DCIS相比,低级别更易表现为ER/PR(+)、Her-2(-)。
研究表明,DCIS钙化的形成与肿瘤细胞分泌、变性和坏死后的钙盐沉积有关,其形态与病理类型有一定相关性,亦与预后有关,相对于点状钙化,线样钙化与高级别、浸润性癌关系更密切、预后较差[10-12]。钙化的分布也反映了病变的恶性程度,段样、线样分布钙化的恶性可能要高于成簇分布[13]。Muttarak等[14]认为高级别DCIS常见段样分布的线样或线样分支状钙化;中级别为单发或多发成簇分布的细小多形性钙化;低级别DCIS常见成簇分布的细点状钙化。本研究中,钙化出现率为61.8%,钙化的形态、分布与组织级别有关(P<0.05)。
136侧DCIS多表现为单纯钙化44侧(32.4%)、钙化伴局灶性不对称/肿块40侧(29.4%)。钙化形态多为细小多形性49侧(58.3%,49/84)、其次为线样分支状30侧(35.7%);分布以段样多见,46侧(54.8%)、其次为成簇30侧(35.7%);形态分布组合以细小多形性钙化成簇分布多见23侧(27.4%),其次为细小多形性钙化段样分布22侧(26.2%)。肿块的形态多为不规则形20侧(64.5%)及椭圆形7侧(22.6%),边缘多为模糊14侧(45.2%)、毛刺状8侧(25.8%),密度为高密度24侧(77.4%)及等密度7侧(22.6%),显示段样分布细小多形性钙化及线样分支状钙化的出现,预示高组织级别的风险增加。钙化的形态、分布及形态分布组合与ER/PR、Her-2表达有关(P<0.05)。Luminal A型、Luminal B型及三阴性型均以单纯钙化多见,Her-2过表达型则以钙化伴局灶性不对称/肿块为主要表现,差异无统计学意义(P>0.05)。ER/PR(+)多表现为单纯钙化(35.7%),钙化形态分布组合以细小多形性钙化成簇分布多见(29.4%),单纯肿块次之(22.8%);ER/PR(-)为钙化伴局灶性不对称/肿块多见(35.2%),单纯钙化(31.5%)次之;钙化形态分布组合以线样分支状钙化段样分布多见(45.2%)。差异有统计学意义(P<0.05)。钙化形态、分布与ER/PR、Her-2表达有关, Ki-67增殖指数≤10%时,83.8%ER(+)、81.1%Her-2(-);增殖指数>30%时,56.4%ER(+)、48.7%Her-2(+),差异有统计学意义(P<0.05)。提示段样分布线样分支状钙化的出现往往预示着低ER/PR(+)及Her-2的过表达;当ER/PR(-)时,线样分支状钙化与Her-2的过表达有关。
Tanei等[15]认为Ki-67与ER/PR的表达呈负相关,提示肿瘤对内分泌治疗效果不佳,Ki-67高增殖指数与较差的临床结果相关。在DCIS中,高Ki-67增殖指数与高级别的病变相关。本研究结果显示,Ki-67增殖指数与ER/PR、Her-2表达均无关(P>0.05),但与组织级别及钙化形态、分布有关(P<0.05)。当Ki-67增殖率为>30%时,56.4%ER(+)、48.7%Her-2(-),表明细小多形性钙化、ER(+)与低Ki-67增殖指数有关[16-17]。
多位学者将ER(-)/Her-2(-)与ER(-)/Her-2过表达的乳腺癌对比研究发现,后者更易出现微钙化,同时在ER阴性乳腺癌中,病灶的边界、钙化的出现及肿瘤分期与Her-2表达情况密切相关[18-20]。本研究结果显示,ER(-)/Her-2(-)与ER(-)/Her-2过表达DCIS的钙化出现率为75.0%(6/8)、63.4%(26/41),与以往文献报道结果不相符,可能与ER(-)/Her-2(-)病例过少有关。
综上所述,DCIS以细小多形性钙化为主要X线表现,不同组织级别、分子分型DCIS的X线表现存在差异。钙化的形态、分布可以反映ER、PR、Her-2及Ki-67的表达情况;当X线表现为单纯细小多形性钙化、成簇分布时提示低组织级别、
ER/PR(+)、Her-2(-)及低Ki-67增殖指数可能。线样分支状钙化、段样分布的出现预示着高Ki-67增殖指数、高组织级别、ER/PR(-)及Her-2的过表达。全面、仔细地分析影像学特征,尤其是钙化的形态、分布,对推断病理类型、制定临床治疗方案及评估预后均有很高价值。
参考文献
[1] Virnig B A,Tuttle T M,Shamliyan T,et al.Ductal carcinoma in situ of the breast:a systenatic review of incidence,treatment,and outcomes[J].J Natl Carcinoma Inst,2010,102(3):170-178.
[2] American College of Radiology(ACR).Breast imaging reporting and data system(BI-RADS)[M].4th ed.Reston,Va:American College of Radiology,2003.
[3] Burstein H J,Polyak K,Wong J S,et al.Ductal carcinoma in situ of the breast[J].N Engl J Med,2004,350(14):1430-1441.
[4] Evans A,Clements K,Maxwell A,et al.Lesion size is a major determinant of the Mammorgraphic features of ductal carcinoma in situ findings from the sloane project[J].Clin Radiol,2010,65(3):181-184.
[5]賀琰,王小燕,凌冰,等.乳腺导管内癌的超声图像及造影特征与病理对照分析[J].中国超声医学杂志,2015,31(6):494-497.
[6] Stomper P C,Geradts J,Edge S B,et al.Mammographic predictors of the presence and size of invasive carcinomas associated with malignant microcalcification lesions without a mass[J].AJR,2003,181(6):1679-1684.
[7] Tabar L,Chen H H,Duffy S W,et al.Anovel method forprediction of long-termoutcome of women with T1a,T1b and and 10-14 mm invasive breast cancers:a prospective study[J].Lancet,2000,355(9202):439-443.
[8] Berg W A,Arnoldus C L,Teferra E,et al.Biopsy of amorphous breast calcifications:pathologic outcome and yield at stereotactic biopsy[J].Radiology,2001,221(2):495-503.
[9] Wang X,Chao L,Chen L,et al.Correlation of mammographic calcifications with HER-2/neu overexperssion in primary breast carcinomas[J].Journal of Digital Imaging,2008,21(2):170-176.
[10]孙琳,杨顺实,田青青,等.乳腺导管内癌及其微浸润与乳腺浸润性导管癌的超声及病理特征[J].中国超声医学杂志,2015,31(5):394-397.
[11] Shin H J,Kim H H,Huh M O,et al.Correlationbetween mammographic and sonographic findings and prognostic factors in patients with node-negative invasive breast cancer[J].Br J Radiol,2011,84(997):19-30.
[12] Lobna A,Abdelmajid K,Habib A,et al.Correlation of HER-2
overexpression with clinico-pathological parameters in Tunisian breast carcinoma[J].World Journal of Surgical Oncology,2008,6(1):1-8.
[13] Ko E S,Lee B H,Kim H A,et al.Triple-negative breast cancer:correlation between imaging and pathological findings[J].Eur Radiol,2010,20(5):1111-1117.
[14]Muttarak M,Kongmebhol P,Sukhamwang N.Breast calcifications:which are malignant[J].Singapore Med J,2009,50(9):907-914.
[15] Tanei T,Shimomura A,Shimazu K,et al.Prognostic significance of Ki-67 indes after neoadjuvant chemotherapy in breast cancer[J].Eur J Surg Oncol,2011,37(2):155-161.
[16]吴佳玲,孙丽鹏,杨光,等.自动乳腺全容积成像在乳腺导管内癌诊断中的价值[J].医学与哲学,2016,37(14):53-55.
[17]林僖,林庆光,李程,等.超声检查对乳腺导管内癌的早期诊断价值[J].中华医学超声杂志(电子版),2016,13(4):297-301.
[18]崔志英,张桦,李颉,等.乳腺导管内癌声像图特征及超声诊断价值[J].中国妇幼保健,2015,30(11):1768-1770.
[19]张延延,王春光,孙文奎,等.乳腺导管内癌超声及乳腺X线摄影与ER表达的相关性研究[J].医学影像学杂志,2016,26(2):254-257.
[20]张硕,叶荆,王蓓,等.106例乳腺导管内原位癌与乳腺导管内原位癌伴浸润成分的临床分析[J].全科医学临床与教育,2016,14(3):284-287.
(收稿日期:2016-11-25) (本文编辑:程旭然)

