介孔硅纳米涂层制备及其载药性能
郭莉,陈明,孙争光,李草,陈学琴,江兵兵
(湖北大学材料科学与工程学院,湖北 武汉 430062)
介孔硅纳米涂层制备及其载药性能
郭莉,陈明,孙争光,李草,陈学琴,江兵兵
(湖北大学材料科学与工程学院,湖北 武汉 430062)
层层自组装(LBL)技术可以通过改变组装的构筑单元及组装层数调控多层膜表面的物理、化学性质.使用层层自组装技术对生物材料表面进行改性,构筑纳米粒子复合涂层引入药物,可改善材料表面的生物相容性和功能特性.采用十六烷基三甲基溴化铵(CTAB)为模板,通过正硅酸四乙酯(TEOS)的溶胶-凝胶法(Sol-gel)制得介孔硅(MSN);再将带负电MSN与带正电聚二烯丙基二甲基氯化铵(PDDA)交替组装,得到了介孔硅纳米涂层.研究了多层膜的层层自组装形成,并考察了涂层的载药性能;通过在介孔硅纳米涂层上表面引入PDDA-衍生层(覆盖层),增强了涂层中的药物的缓释特性.这种具有缓释功能的多层膜有望应用于医学临床.
层层自组装;介孔硅;载药涂层;缓释
0 引言
层层自组装技术(LBL)在过去的25年内被广泛运用于生物医学涂层领域.这主要是由于制备LBL涂层的选材广泛,LBL膜的性能可以通过改变组装的构筑单元精确调控[1-2].其中,以3D载体作为涂层基材制备复合型结构涂层,因其组装基元选择丰富、对涂层性能的调控精确、规整,得到了广泛研究和关注[3-6].而在众多的3D载体中,介孔硅球纳米粒子(MSN)具有有序的孔道结构和超大的比表面积,通过MSN的纳米孔道,能吸附大量的药物,因而成为生物材料涂层技术领域的研究热点[7-9].然而,如何利用MSN的介孔及与药物之间的静电/氢键等相互作用,将药物分子引入载药涂层,并利用结构设计,实现包封药物的缓释和可控释放,仍是3D载体涂层技术的难点.
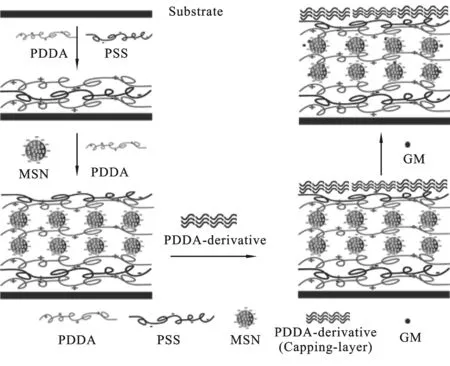
图1 介孔硅纳米涂层制备示意图
本文中采用CTAB为模板,以TEOS为原料,利用TEOS水解反应,通过Sol-gel法成功合成介孔结构的MSN.再以MSN为组装材料,与PDDA自组装,制备MSN纳米涂层.涂层的制备示意图如图1所示:首先将玻璃片用酸进行处理,随后将其交替浸入聚阳离子PDDA溶液,聚阴离子PSS溶液中,得到PDDA/PSS薄膜;交替浸润到负电纳米粒子MSN与PDDA中得到MSN/ PDDA薄膜;在此基础上继续组装不同的聚电解质得到覆盖层PDDA-OH/AA /PDDA-g-SA/PSS,最终得到含有覆盖层的MSN纳米涂层.随后,我们研究了MSN与PDDA的组装行为及其载药性能;并引入隔离层,使其达到药物缓释的效果.这种涂层技术,方法简单,易于调控,具有潜在的临床医用价值.
1 实验部分

1.3 PDDA-OH和PDDA-g-SA的制备 取PDDA的水溶液去离子水中,测得其pH为弱酸性.将PDDA水溶液通过717强碱阴离子交换树脂反复交换,使聚合物得到充分交换,交换后测得pH值稳定在强碱性之后将得到的PDDA-OH溶液.将SA溶于乙醇中,逐滴滴入等摩尔量的PDDA-OH水溶液中,50 ℃反应8 h,之后在乙醇中透析,得到PDDA-g-SA,即PDDA-derivative (capping-layer).
1.4 MSN纳米涂层的制备 将石英玻璃片浸入双氧水/浓硫酸溶液中(体积比1∶3)中,70 ℃下加热2 h, 然后用去离子水反复清洗,得到清洁后的玻璃片.MSN与PDDA采用经典的交替浸泡法[10].首先将处理后的玻璃片浸入到PDDA水溶液中(5 mg/mL,pH=7.4 PBS),随后浸入到大量的去离子水中,氮气吹干;之后浸入到PSS水溶液中(5 mg/mL,pH=7.4 PBS),大量去离子水清洗.重复上述操作,可得到(PDDA/PSS)3PDDA涂层,随后浸入到MSN水溶液中(5 mg/mL,pH=7.4 PBS),重复操作可得到(PDDA/PSS)3(PDDA/MSN)5.
1.5 覆盖层(PDDA-OH/AA /PDDA-g-SA/PSS)2的制备 (PDDA-OH/AA /PDDA-g-SA/PSS)2纳米涂层的制备方法采用静电自组装法,所有物质均配置成5 mg/mL.首先将玻璃片浸入到PDDA-OH水溶液中(5 mg/mL),清洗;之后浸入到AA(5 mg/mL)水溶液中10 min,并在AA水溶液中添加2%的光引发剂HMPF,经紫外照射30 min后,取出玻璃片,经大量水冲洗5 min;再浸入PDDA-g-SA水溶液中(5 mg/mL),大量去离子水清洗,之后再浸入到PSS水溶液中(5 mg/mL).重复上述操作,可得(PDDA-OH/AA /PDDA-g-SA/PSS)2纳米涂层.
1.6 含有覆盖层的MSN纳米涂层的制备 参考1.3,先制备含有(PDDA/PSS)3(PDDA/MSN)5涂层的玻璃片,依据1.4节所述,将样片依次放入到PDDA-OH,AA溶液,紫外灯引发反应后,再浸入PDDA-g-SA和PSS溶液,重复操作,最后获得(PDDA/PSS)3(PDDA/MSN)5(PDDA-OH/AA /PDDA-g-SA/PSS)2纳米涂层.
1.7 MSN的表征 采用动态光散射(DLS)对MSN的分布进行表征;采用透射电镜对MSN的形貌进行表征;采用BET对MSN的比表面积进行表征.
1.8 MSN纳米涂层的表征 采用扫描电镜对MSN纳米涂层的形貌进行表征.
1.9 覆盖层的表征 采用接触角仪器对纳米涂层进行接触角检测:用微量进样器吸取微量蒸馏水,垂直悬空滴加在纳米涂层表面.
1.10 MSN纳米涂层的载药性能 考察不同层数MSN纳米涂层载药量:将所制备纳米涂层(PDDA/PSS)3(PDDA/MSN)n(n=1, 3, 5),以及对照组(PDDA/PSS)8浸入到FITC-庆大霉素溶液20 min(2.5 mg/mL,pH=5.4);随后取出在去离子水中清洗5 min,空气吹干.然后将玻璃片浸入到3%的稀硝酸溶液中,超声并过夜,将药物解离出来.载药量采用紫外分光光度计进行检测.考察不同pH条件下MSN纳米涂层的载药性能:配置3种不同pH的FITC-庆大霉素溶液(2.5 mg/mL,pH=3.4; 2.5 mg/mL,pH=5.4; 2.5 mg/mL,pH=7.4).药物负载、释放及检测同上.
1.11 含有覆盖层的MSN纳米涂层的缓释性能 将载上庆大霉素的(PDDA/PSS)3(PDDA/MSN)5(PDDA-OH/AA/PDDA-g-SA/PSS)n纳米涂层置于装有2 mL pH=7.4的PBS溶液的离心管中,室温下缓释,每隔一段时间取出1 mL缓释后的溶液,再补加1 mL新的PBS溶液.缓释间隔为0、2、5、10、15、30、45、60、90、120 min.
2 结果与讨论
2.1 MSN的分布及形貌 如表1所示,经动态光散射表征MSN的粒径为150 nm左右,电位约为-40mV.通过透射电镜图片图2可以看出,MSN呈现球形结构,其平均尺寸约为140 nm,与动态光散射的检测结果接近.从高清倍率图片中,观察MSN为多孔结构.通过BET(图3)对MSN进行表征,MSN的孔径约为2.6 nm,其中MSN的比表面积经检测约为980 m2/g.
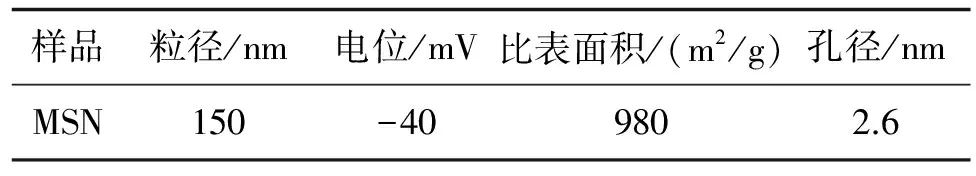
表1 MSN粒径,电位,比表面积和孔径的表征
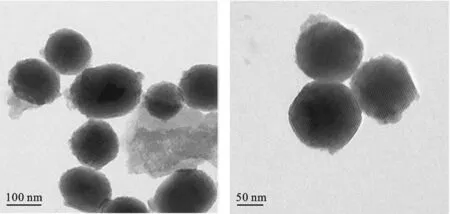
图2 MSN的透射电镜图

图4 (PDDA/PSS)3(PDDA/MSN)n纳米涂层的扫描电镜图(n=0,1,5)
2.2 MSN纳米涂层的制备 由于所得到的MSN带负电,可以与聚阳离子PDDA进行层层自组装.将已制备的MSN用pH=7.4的PBS分散进行调节,与PDDA交替沉积,得到MSN纳米涂层.图4为不同同层数MSN纳米涂层的扫描电镜图,图中MSN约为140 nm左右,组装一层MSN时就覆盖了平面的50%,部分MSN有团聚现象(图4中);而随着组装的进行,5个双层后玻璃片上的MSN几乎已满屏覆盖,并成梯度的堆叠在一起(图4右一);而对照组(图4左一)显示均较为光滑,说明大量的MSN在组装过程中与PSS自组装.
2.3 覆盖层(PDDA-OH/AA /PDDA-g-SA/PSS)2的制备 覆盖层的制备采用静电自组装法,对所得到的纳米涂层进行相关测试表征.表2和图5为纳米涂层接触角测试结果.由表可知组装一层PDDA-OH,接触角仪器显示薄膜的接触角为33°,利用AA表面的羧基与PDDA的羟基之间的反应可得到一层AA.我们使用紫外光对表层的AA进行光照,可以使AA的双键打进而交联.此时的纳米涂层变得更加致密,交联后的接触角经检测为25°,利用交联后的表面与PDDA-g-SA在水中继续组装,可以得到PDDA-g-SA,其接触角为68°,其接触角相对之前有了很大的提高,接触角测试组装第二层,其接触角变化趋势与第一层相似,在组装二层PDDA-g-SA,其接触角仍为65°,证明纳米涂层在层层组装.

表2 (PDDA-OH/AA /PDDA-g-SA/PSS)n的接触角表征(n=1, n=2)
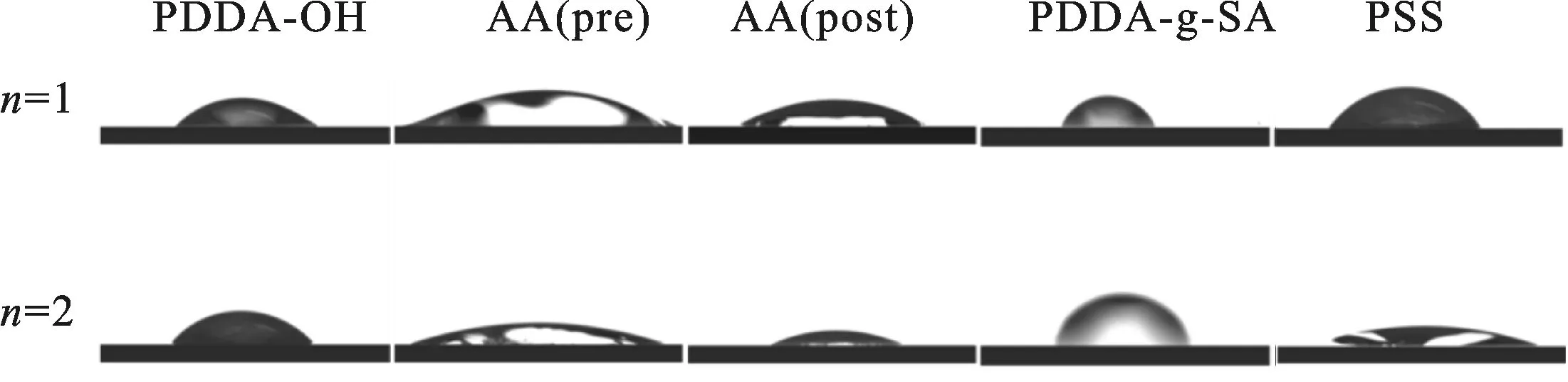
图5 覆盖层接触角的表征
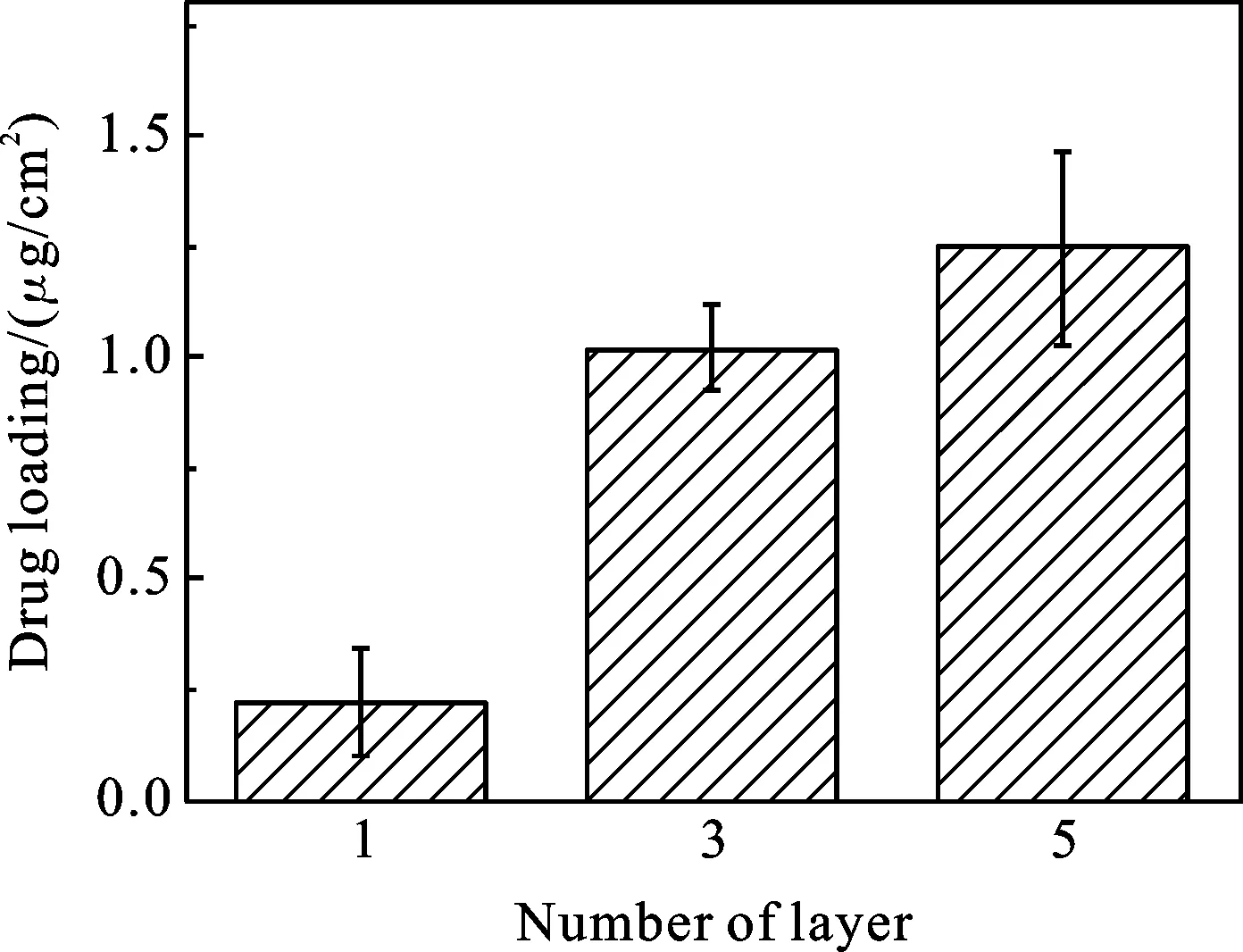
图6 (PDDA/PSS)3(PDDA/MSN)n纳米涂层的载药(n=1,3,5)
2.4 MSN纳米涂层的载药性能 如图6所示,改变MSN组装层数可以改变MSN纳米涂层的载药性能,在pH=3.4条件下,1层,3层,5层MSN的载药量分别为0.2,1.0,1.25 μg/cm2,实验表明随着层数增加载药量提高.载药量与组装层数不是完全线性关系,这可能是因为组装微球量并不一定与组装层数成正比,有时会成其他函数关系的缘故[3,4].在不同pH下进行载药,溶液酸性对MSN纳米涂层载药量的有较大影响,由图7可知,随着pH的降低,载药量呈明显增高趋势.MSN纳米涂层在pH为3.4、5.4、7.4下的载药量分别为1.25、0.78、0.58 μg/cm2,MSN纳米涂层在pH=3.4时的载药量是pH=7.4条件下的2倍.这可能是因为低pH下,MSN纳米涂层中聚电解质PDDA溶胀,原本被大分子封闭的硅球孔道被打开,药物被吸入MSN中,载药量提高.
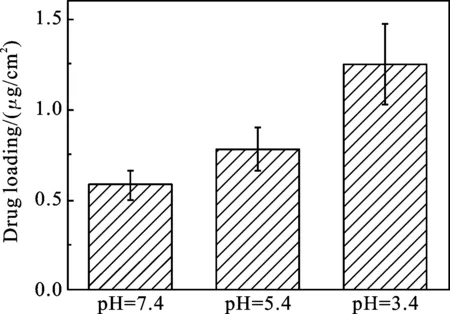
图7 (PDDA/PSS)3(PDDA/MSN)5纳米涂层在不同pH下的载药
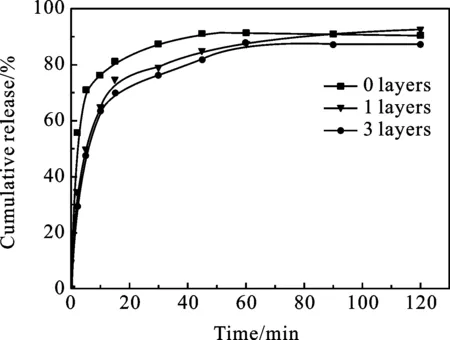
图8 不同覆盖层下(PDDA/PSS)3 (PDDA/MSN)5 (PDDA-OH/AA /PDDA-g-SA/PSS)n的药物释放(n=0,1,3)
2.5 含有覆盖层的MSN纳米涂层的缓释性能 如图8所示,添加覆盖层后的MSN纳米涂层,药物缓释时间更长,释放量也有少量提升.组装1层覆盖层后,8 min后累计释放药物总药量的50%.组装3层覆盖层,可以发现释放总时间可以长达半小时.在释放过程中,未加覆盖层薄膜的存在短期爆释,而添加覆盖层的药物释放趋于平缓.这说明覆盖层在药物释放过程起到了一定的缓释作用.这是由于,该多层膜一方面由PDDA-g-SA的疏水作用减缓药物释放,另一方面覆盖层中的AA层经交联变得更加致密可以对硅球的孔道进行封堵,药物的释放得到了缓释.
3 结论
本工作成功制备了介孔结构的MSN和含有MSN的载药涂层.实验结果显示,MSN为多孔的球形结构;MSN与聚电解质PDDA进行纳米涂层组装,随着MSN层数增加涂层不断增厚.利用MSN的介孔性能,能吸附庆大霉素-FITC到MSN涂层中;覆盖层的引入,MSN纳米涂层的药物释放具有缓释效果.此类多层膜在药物涂层领域具有潜在的应用价值.
[1] Tang Z, Wang Y, Paul P, et al. Biomedical applications of layer-by-layer assembly: from biomimetics to tissue engineering &dagger[J].Adv Mat, 2006, 18(24): 3203-3204.
[2] 张万喜,孙国恩,姚卫国, 等. 利用层层组装的方法制备有机超薄膜的研究进展[J].高分子材料科学与工程, 2009, 25(2): 167-170.
[3] Michel M, Arntz Y, Fleith G, et al. Layer-by-layer self-assembled polyelectrolyte multilayers with embedded liposomes: immobilized submicronic reactors for mineralization[J].Langmuir, 2006, 22(5): 2358-2364.
[4] Jiang B B, Elizabeth D, Li B Y. Polypeptide multilayer film co-delivers oppositely-charged drug molecules in sustained manners[J].Biomacromolecules, 2010, 11(12): 3630-3637.
[5] Saibom P, Suk Ho B, Wan-Geun L, et al. Dual roles of hyaluronic acids in multilayer films capturing nanocarriers for drug-eluting coatings[J].Biomaterials, 2012, 33(21): 5468-5477.
[6] Lin X, Renata V, Miloslav S, et al. Planar multilayer assemblies containing block copolymer aggregates[J].Langmuir, 2014, 30(3): 891-899.
[7] Zhao Y L, Li Z, Kabehie S, et al. pH-operated nanopistons on the surfaces of mesoporous silica nanoparticles[J].J Am Chem Soc, 2010, 132(37):13016-13025.
[8] Zhang J, Zhang X Z, Wang Y, et al. Multifunctional envelope-type mesoporous silica nanoparticles for tumor-triggered targeting drug delivery[J].J Am Chem Soc, 2013, 135(13): 5068-5073.
[9] Li Z Y, Liu Y, Wang X Q, et al. One-pot construction of functional mesoporous silica nanoparticles for the tumor-acidity-activated synergistic chemotherapy of glioblastoma[J].ACS Appl Mater Interfaces, 2013, 5(16): 7995-8001.
[10] 李草.基于聚氨基酸的层层自组装多孔膜及微胶囊药物载体的制备与应用[D].武汉:武汉大学,2012.
(责任编辑 胡小洋)
Fabrication and drug loading capacity of mesoporous-silica-particle -based multilayered coatings
GUO Li, CHEN Ming, SUN Zhengguang, LI Cao, CHEN Xueqin, JIANG Bingbing
(Faculty of Materials Science & Engineering,Hubei University, Wuhan 430062,China)
Layer-by-layer assembly (LBL) technology can control and endow the surface of multilayer films special physical and chemical properties by changing the building compounds and the numbers of layer. Using LBL technology, nanoparticles-embedded multilayer films with incorporated drugs can be deposited onto the surface of biomaterials, which enhances material biocompatibility and functionality.Mesoporous silica particles (MSN) were synthesized through sol-gel method of tetraethyl orthosilicate(TEOS) with hexadecyl trimethyl ammonium bromide(CTAB) as templet. MSN-embedded multilayer films were then built via alternative assembly of negatively-charged MSN and positively-charged poly(dimethyl-diallylammonium chloride) (PDDA). The LBL assembly formation of the MSN and PDDA were investigated and the drug loading capacities of the films were also determined. By introducing PDDA-derivative layers (cover layers) on the uppermost surface of MSN-embedded multilayer film, the drug sustained property was significantly improved. The developed multilayer films with sustained release property have great potential in clinic medical treatment.
layer-by-layer; mesoporous silica particles; drug-loaded coating; sustained release
2016-06-19
国家自然科学基金(51523060)和湖北省自然科学基金(2015CFB522)资助
郭莉(1993-),女,硕士生;陈学琴,通信作者,博士,讲师,从事生物医用高分子材料及能源材料研究,E-mail:chenxueqin@hubu.edu.cn
1000-2375(2017)02-0147-05
O631.1+1;TQ630.1
A
10.3969/j.issn.1000-2375.2017.02.008

