接种菌根真菌对华顶杜鹃幼苗光合特性的影响
汤梦娴,施 霞,顾锦霞,胡瑜瑶,毛梦玲,边才苗
(台州学院 生命科学学院,浙江 椒江 318000)
丛枝菌根(Arbuscular Mycorrhiza,AM)是真菌与植物形成的最为广泛的共生体[1],能改善植物养分吸收和植株生长状况,提高植物的光合速率[2-7]。杜鹃花科Ericaceae植物分布广泛,其根系普遍能与真菌形成一类特殊的菌根——杜鹃花类菌根,也称欧石楠类菌根(Ericoid Mycorrhiza,ERM)。ERM主要有盘菌类Hymenoscyphus ericae,树粉孢属Oidiodendron和砖隔腔菌Capronia sp.,具有腐生营养能力,并能降解难分解的物质,对于杜鹃花科植物提高对恶劣环境的抵抗能力、增强水分与营养吸收和促进生长等方面起着重要作用[8-12];但有关ERM对杜鹃花科植物光合生理的影响目前报道不多[12]。
华顶杜鹃Rhododendron huadingense为浙江特有的杜鹃属Rhododendron植物[13-16],分布于海拔750~950 m,花色艳丽,花期4-5月,是一种开发潜力很大的园林绿化树种。华顶杜鹃最初发现于天台县华顶山[13]而命名,磐安县大盘山是最近发现的自然分布地[17]。华顶杜鹃数量稀少,属极小种群[17],已被列入浙江省珍稀濒危植物名录加以保护[18]。研究接种菌根真菌对华顶杜鹃幼苗在不同光照条件下光合特性的影响,以揭示其促进幼苗生长的光合生理机制,为探索该物种与ERM共生适应性机理提供理论依据。
1 材料与方法
1.1 试验材料
供试苗木为通过种子萌发和2次移栽培育而成的1年生华顶杜鹃幼苗,育苗所用种子于2015年11月采自华顶山。种子萌发采用培养皿双层滤纸法,2016年2月中旬在光照培养箱中进行;第一次移栽在萌发后第4至第7天,所用塑料花盆的口径为26 cm,基质为JIFFY泥炭705#(荷兰),每盆3~6株;在人工气候室内控制光照(光强为100 μmol·m-2·s-1,每天光照8 h)、温度(25℃)和相对湿度(75%~80%)条件下培育2个月。第二次移栽的基质为腐殖质土,采自华顶主峰西侧归云洞(海拔900 m)杜鹃林,在分检出树根、石粒等杂物后,风干、磨碎;土壤理化性质:pH 4.37,有机质 54.33 g·kg-1,全氮 1.81 g·kg-1,全磷 0.95 g·kg-1,全钾 0.78 g·kg-1。在5月初第二次移栽时接种ERM,对照苗不接种,各50盆,每盆1株;接种的ERM是从华顶杜鹃根部分离得到的,经初步鉴定为树粉孢属Oidiodendron sp.,采用单层基质接种法,基质为MMN培养基和栽培基质混合,每盆的接种量为3 mm菌块4块。移栽后,在光照强度为140 μmol·m-2·s-1,每天光照10 h条件下再培育3个月,形成高24~30 cm,具5~7片叶的1年生苗(实龄为6个月)。
1.2 菌根侵染状况测定
2016年7 月中旬,随机选取在人工气候室培育的华顶杜鹃接种苗和对照苗各5株,取其鲜根剪成长约1.0 cm的根段,采用酸性品红染色法,经透明、软化、酸化、染色和脱色后,制片镜检,统计菌根侵染率。
1.3 试验设计
2016年7 月下旬,选择生长良好、大小一致的幼苗40株,接种苗和对照苗各20株,均分为4组,每组各5株,从人工气候室分别转移到以下4种光照条件下培养:全光照、一层黑色遮荫网(相对光强为全光照的55%)、双层遮荫网(相对光强为23%)和三层遮荫网(相对光强为11%)。45 d后,选择在相应光强下新成熟的叶片,于9月上旬测定其光合参数。设5个重复;摘取测定气体交换的叶片按照Wellburn的方法[19]测定其叶绿素含量。
1.4 气体交换参数的测定与计算
采用Li-6400XT便携式光合测定系统(Li-COR,Inc,USA)于每天9:00-11:00进行测定。采用人工光源,光照强度设为1 000 μmol·m-2·s-1,使用开放气路,空气流速为0.5 L·min-1,叶温28℃,相对湿度70%~75%,CO2浓度为360 μmol·mol-1。测定的参数包括:净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)和胞间CO2浓度(Ci)。水分利用效率(WUE)和光能利用效率(LUE)根据以下公式计算:

最大净光合速率(Pnmax)、表观量子效率(AQY)、光饱和点(LSP)、光补偿点(LCP)和暗呼吸速率(Rd)等参数经光响应测定后用Photosyn Assistant软件拟合统计得到。
1.5 统计分析
以上数据用SPSS 11.0软件进行统计分析,采用单因素方差分析(One-way ANOVA)和最小显著差异(LSD)法进行多重比较。
2 结果与分析
2.1 ERM接种华顶杜鹃幼苗的侵染率
由图1可知,华顶杜鹃幼苗接种菌根后,其侵染率为65.32%;对照苗为34.89%,两者间差异显著(P<0.05)。说明采用单层基质接种法可显著提高幼苗ERM的侵染率。
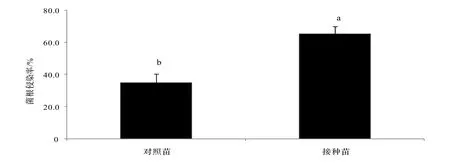
图1 华顶杜鹃幼苗的菌根侵染率Figure 1 Mycorrhizal infection rate in R.huadingense inoculated with ERM
2.2 接种对华顶杜鹃叶片光合色素的影响
叶绿素是植物光合作用过程中吸收光能的主要色素,直接影响光合作用的光能利用[19]。华顶杜鹃幼苗叶片叶绿素含量见表1。由表1可知,相同光照条件下接种苗叶片叶绿素a和叶绿素b含量均高于对照,分别比对照增加1.14~1.34倍和1.14~1.36倍;其中,三层遮荫时接种苗的叶绿素a和叶绿素b含量均与对照差异显著(P<0.05)。

表1 不同光照强度下华顶杜鹃幼苗的叶绿素含量和叶绿素a/bTable 1 Chlorophyll contents and Chlorophyll a/b of R.huadingense seedlings under different light intensities
叶绿素a/b是植物对环境光强适应性的一种指标,弱光处理会降低叶绿素a/b值[20]。本实验也有类似的结果,但在全光照和单层遮荫时接种苗的叶绿素a/b高于对照,而二层遮荫和三层遮荫时接种苗低于对照。说明接种苗以叶绿素b含量升高为主,可提高其在弱光下的捕光能力。
2.3 不同光照条件对华顶杜鹃幼苗气体交换和资源利用效率的影响
不同光照条件对华顶杜鹃幼苗气体交换和资源利用效率的影响见表2。由表2可知,只有Ci浓度接种苗低于对照苗,其他指标均为接种苗高于对照苗。随着光照强度降低,Pn和LUE均为先升后降,其中接种苗的最大值均为一层遮荫处理,而对照苗的最大值为二层遮荫处理;Gs也为先升后降,但最大值均为一层遮荫处理;Tr随着光强的降低而减小,而WUE则随着光强的减弱而提高,且接种苗的指标值大于对照苗。

表2 不同光照强度下华顶杜鹃幼苗气体交换和资源利用效率比较Table 2 Comparison on gas exchange and resource use efficiency of R.huadingense seedlings under different light intensities
2.4 不同光照条件对华顶杜鹃幼苗光合特征参数的影响
华顶杜鹃幼苗光合特征参数见表3。AQY是光合作用中光能转化最大效率的一种度量,可正确反映光合机构机能的变化,也可反映叶片对弱光的利用能力[21]。由表3可知,接种苗的AQY均比对照苗的大,大小顺序为:三层遮荫>一层遮荫>二层遮荫>全光照,对照苗的AQY随着光强的减弱而增大。另外,相对于对照苗,接种苗的AQY随光强变化的幅度较小。表明接种苗更适应于中强光照环境,对光强具有较大的适应能力。
植物光合作用的LSP和LCP显示植物叶片对强光和弱光的利用能力,代表植物的需光特性和需光量[20]。随着光强的减弱,接种苗和对照的LSP和LCP均依次下降;在三层遮荫时,LSP比全光照分别下降44.36%和46.85%,LCP分别下降51.28%和55.28%;且接种苗的指标值均低于对照苗。表明接种ERM的华顶杜鹃幼苗可显著提高对弱光的利用能力,表现出对弱光较强的适应能力。
Pnmax也称为光合能力,华顶杜鹃接种苗的Pnmax明显高于对照,且单层遮荫的最大,双层遮荫的其次,三层遮荫的第三,全光照的最小;Rd随着光强的减弱而下降,接种苗的比对照苗的低。表明接种ERM可增强幼苗在中强光照条件下的光合能力,同时降低其暗呼吸。

表3 不同光照强度下华顶杜鹃幼苗的光合-光响应Table 3 The responses of photosynthesis to light in R.huadingense seedlings under different light intensities
3 讨论
华顶杜鹃为浙江特有的杜鹃花属植物,资源稀少,尤其是幼苗,在天台华顶山和磐安县大盘山的分布区内几乎很难找到实生苗,其主要原因是幼苗的成活率很低。ERM可促进杜鹃花科植物的营养吸收,增强植物对干旱和高温等逆境因子的抗性;人工接种ERM对杜鹃花科植物的生长有明显的促进作用。本试验采用单层基质接种法,对种子萌发苗进行辅助接种树粉孢属的ERM,结果其浸染率显著提高,目前已培育了300多株生长良好的华顶杜鹃1年生接种苗。
叶绿素是高等植物进行光合作用最重要的色素,其含量影响植物对光能的吸收、传递,是反映光合强度的重要指标[20-22]。本试验结果显示,接种苗叶片叶绿素含量显著高于对照苗,尤其是在三层遮荫时,差异均达到显著水平;同时,叶绿素a/b随着光强的减弱而减小,且二层遮荫和三层遮荫时接种苗的比对照苗低。这与桃叶杜鹃幼苗接种ERM后的研究结果[12]相一致,表明接种ERM有利于华顶杜鹃幼苗捕获光能和对弱光的利用。
光合作用是判断植物生长和抗逆性强弱的重要指标。本试验结果显示,接种苗的Pn,Tr和Gs等指标均比对照苗高,接种苗的WUE与LUE也比对照苗高,只有Ci比对照低;且接种苗的Pn,Tr和Gs等指标的最大值均为一层遮荫。表明接种ERM可提高幼苗对弱光的利用能力,并增强对强光的抵抗能力。再者,接种苗的AQY和Pnmax等指标均比对照苗的大,而接种苗的LSP,LCP和Rd等指标均比对照苗的低(表3),表明接种ERM可提高幼苗的光合能力,同时降低其暗呼吸。
4 结论
(1)采用单层基质接种法,可显著提高华顶杜鹃1年生苗树粉孢属ERM的浸染率。
(2)在接种ERM后,1年生苗叶绿素含量提高,同时降低在二层和三层遮荫条件下的叶绿素a/b;
(3)接种苗的气体交换参数(除Ci外)和资源利用效率提高,且接种苗的AQY和Pnmax等指标值也提高,而LSP,LCP和Rd等指标值降低。因此,接种EMR有利于华顶杜鹃幼苗捕获光能,增强其对强光照和弱光照环境的适应能力。
[1]Strack D,Fester T,Hause B,et al.Arbuscular mycorrhiza:biological,chemical,and molecular aspects[J].J Chem Ecol,2003,29(9):1955-1979.
[2]Rai M,Acharya D,Singh A,et al.Positive growth responses of the medicinal plants Spilanthes calva and Withania somnifera to inoculation by Piriformospora indica in a field trial[J].Mycorrhiza,2001,11(3):123-128.
[3]陈应龙,弓明钦,陈羽,等.外生菌根菌接种对红椎生长及光合作用的影响[J].林业科学研究,2001,14(5):515-522.
[4]何跃军,钟章成,刘锦春,等.石灰岩土壤基质上构树幼苗接种丛枝菌根(AM)真菌的光合特征[J].植物研究,2008,28(4):452-457.
[5]赵昕,宋瑞清,阎秀峰.接种AM 真菌对喜树幼苗生长及光合特征的影响[J].植物生态学报,2009,33(4):783-790.
[6]龙海燕,欧静,谌端玉,等.干旱胁迫下接种ERM真菌对桃叶杜鹃幼苗光合特性的影响[J].种子,2017,36(6):14-19.
[7]谌端玉.干旱胁迫下接种ERM真菌对桃叶杜鹃幼苗光合特性的影响[D].贵阳:贵州大学,2016.
[8]于芳,张春英,尹丽娟,等.云锦杜鹃菌根真菌接种技术及其效应[J].福建农林大学学报(自然科学版),2008,37(4):360-364
[9]张春英,陈真,于芳,等.云锦杜鹃ERM真菌接种效应及优良菌株筛选[J].上海农业学报,2010,26(2):38-41.
[10]郑 钰,高博,孙立夫 等.银叶杜鹃和繁花杜鹃根部真菌的多样性[J].生物多样性,2010,18(1):76-82.
[11]陈真,杨兵,张春英,等.锦绣杜鹃菌根真菌rDNA ITS序列分析及接种效应研究[J].菌物学报,2011,30(5):729-737.
[12]欧静,何跃军,刘仁阳,等.杜鹃花类菌根真菌对桃叶杜鹃幼苗光合性能及叶绿素荧光参数的影响[J].微生物学通报,2013,40(8):1423-1436.
[13]丁炳扬,方云亿.浙江杜鹃花属一新种[J].植物研究,1990,10(1):31-33.
[14]章绍尧,丁炳扬.浙江植物志(总论卷)[M].杭州:浙江科学技术出版社,1993:261.
[15]丁炳扬,吴欢笑.浙江杜鹃花属植物种子形态及其分类学意义[J].西北植物学报,1995,15(6):36-42.
[16]丁炳扬,缪晶,盛束军,等.浙江12种杜鹃花属植物的果实形态、种子数及其相关性研究[J].林业科学,2000,36(4):102-105.
[17]周莹莹,孙莉,陈子林,等.珍稀特有植物华顶杜鹃的群落基本特征分析[J].杭州师范大学学报(自然科学版),2012,11:211-216.
[18]孙孟军,邱瑶德.浙江林业自然资源:野生植物卷[M].北京:中国农业科学技术出版社,2002:111-112.
[19]Wellburn A R.The spectral determination of chlorophylls a and b,as well total carotenoids,using various solvents with spectrophotometers of different resolution[J].J Plant Physiol,1994,144(3):307-313.
[20]刘鹏,康华靖,张志详,等.香果树(Emmenopterys henryi)幼苗生长特性和叶绿素荧光对不同光强的响应[J].生态学报,2008,28(11):5656-5664.
[21]张永霞,李国旗,张琦,等.不同遮荫条件下罗布麻光合特性的初步研究[J].西北植物学报,2007,27(12):2555-2558.
[22]刘悦秋,孙向阳,王勇,等.遮荫对异株荨麻光合特性和荧光参数的影响[J].生态学报,2007,27(8):3457-3464.

