鱼组织中双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素含量的超高效液相色谱法测定
刘永涛,李 乐,王赛赛,余琳雪,杨秋红,杨移斌,艾晓辉*
(1.中国水产科学研究院 长江水产研究所,湖北 武汉 430223;2.淡水水产健康养殖湖北省协同创新中心,湖北 武汉 430223;3.中国水产科学研究院,北京 100141;4.上海海洋大学 水产与生命学院,上海 201306)
鱼组织中双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素含量的超高效液相色谱法测定
刘永涛1,2,李 乐3,王赛赛4,余琳雪4,杨秋红1,杨移斌1,2,艾晓辉1,2*
(1.中国水产科学研究院 长江水产研究所,湖北 武汉 430223;2.淡水水产健康养殖湖北省协同创新中心,湖北 武汉 430223;3.中国水产科学研究院,北京 100141;4.上海海洋大学 水产与生命学院,上海 201306)
建立了黄颡鱼、团头鲂和草鱼血浆、肌肉、肝脏、肾脏中双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素同时测定的超高效液相色谱紫外检测法(UPLC-UV)。样品经乙腈(含0.01%乙酸)提取,无水硫酸钠除水,正己烷去脂等样品处理,在ACQUIT UPLC BEH C18色谱柱上分离,428 nm波长处测定。双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素在0.01~5.00 mg/L浓度范围内呈良好的线性关系,相关系数(r2)分别为0.998 7,0.999 8和0.999 6。在空白鱼组织中进行0.025,0.05,0.50,1.00 mg/kg 4个水平的加标回收实验,3种待测组分的平均回收率为64.7% ~ 102.2%,相对标准偏差为0.69% ~ 10.8%。鱼组织中3种待测组分的检出限(LOD)均为0.010 mg/kg,定量下限(LOQ)均为0.025 mg/kg。应用该方法研究了姜黄素在团头鲂体内的药代动力学规律。
鱼组织;双去甲氧基姜黄素;去甲氧基姜黄素;姜黄素;超高效液相色谱
姜黄素类化合物主要包括双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素[1],其中姜黄素约占70%,去甲氧基姜黄素约占15%,双去甲氧基姜黄素约占10%。姜黄素在提高鱼类消化酶活性,促进鱼类生长,增强鱼体免疫功能及改善肌肉品质和色泽等方面具有一定作用[1]。研究表明,饲料中添加姜黄素可以显著提高草鱼肠道中蛋白酶和淀粉酶的活性,促进鱼体对营养物质的吸收[2]。王进波等[3]报道姜黄素不仅可以促进大黄鱼(Pseudosdaenacrocea)的生长,还可促进大黄鱼皮肤和肌肉的着色。姜黄素可以显著提高虹鳟(Salmogairdneri)、草鱼(Ctenopharyngodonidellus)和罗非鱼(Oreochromisspp)等鱼体的抗氧化能力[4-5]。牛生洋等[6]报道了姜黄素添加到饲料中还能够预防鱼小瓜虫病、肠炎病和赤皮病等疾病。鉴于姜黄素在水产动物体内表现出的优良药理活性,其在水产养殖业中被广泛应用,2014年我国农业部也批准姜黄素作为新饲料添加剂使用。
目前,尚未见鱼组织中双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素含量测定的方法。已报道的分析方法多是对姜黄提取物中姜黄素类化合物含量的测定,使用的仪器有荧光分光光度计[7]、高效液相色谱仪[8-12]、高效毛细管电泳仪[13]、高效液相色谱串联质谱仪[14]。张盼盼等[15]和杨方等[16]分别采用高效液相色谱建立了食品和淀粉类食品中姜黄类化合物的分析方法,顾吉普等[17]采用高效液相色谱法测定了大鼠血浆中姜黄素的含量。由于姜黄素对水产动物生理和疾病预防方面的作用明显,为更好地研究姜黄素在鱼体内的药理作用和组织分布情况,有必要对鱼体组织中姜黄素类化合物含量进行分析。本文建立了黄颡鱼、团头鲂和草鱼体内组织中双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素含量的超高效液相色谱分析方法,优化了前处理和色谱条件,进行了方法学验证,并将该方法用于姜黄素在团头鲂体内的药动学研究。
1 实验部分
1.1 仪器与试剂
Waters ACQUITY超高效液相色谱带紫外(UV)检测器(美国Waters公司);Agilent 1260 高效液相色谱仪带二极管阵列检测器(DAD);Mettler-TOLEDO AE-240电子天平(梅特勒-托利多公司);HITACHI 20PR-520型自动高速冷冻离心机(日本日立公司);FS-1高速匀浆机(华普达教学仪器有限公司);HQ-60-Ⅱ旋涡混合器(北京北方同正生物技术发展有限公司);HGC-12氮吹仪(HENGAO T&D公司)。
双去甲氧基姜黄素和去甲氧基姜黄素标准品(纯度≥98%,成都克洛玛生物科技有限公司);姜黄素标准品(纯度≥98.9%,中国食品药品检定研究院);乙腈、乙酸、乙酸乙酯、正己烷(色谱纯,美国J.T.Baker公司);Milli-Q Advantage A10超纯水机。
1.2 标准溶液的配制
分别准确称取0.1 g(精确至0.001 g)双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素对照品,用乙腈溶解并定容至100 mL,分别配制成1.0 mg/mL标准储备液,于-20 ℃冰箱中冷藏保存。分别移取5 mL 3种姜黄素类化合物的标准储备液置于同一100 mL容量瓶中,用乙腈稀释配制成混合标准中间液。
1.3 标准工作曲线的制备
用流动相稀释混合标准中间液,得到双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素的质量浓度均为0.01,0.05,0.20,1.00,5.00 mg/L的标准工作溶液,以质量浓度(x,mg/L)为横坐标,峰面积(y)为纵坐标,绘制标准工作曲线,计算回归方程和相关系数。
1.4 样品前处理
1.4.1 血浆样品 移取1 mL血浆样品于10 mL离心管中,加入4 mL提取液,涡旋30 s,再加入0.5 g无水硫酸钠,涡旋30 s,7 000 r/min离心5 min,转移提取液至另一10 mL离心管中,重复提取1次,合并提取液,置于45 ℃氮吹仪上氮吹至干,用1 mL流动相溶解残渣,过0.22 μm滤头,上UPLC分析。
1.4.2 肌肉样品 称取2 g 肌肉样品于15 mL离心管中,加入5 mL提取液,涡旋30 s,再加入1 g 无水硫酸钠,涡旋30 s,7 000 r/min离心5 min,转移提取液至另一10 mL离心管中,重复提取1次,合并提取液,置45 ℃氮吹仪上氮吹至干,用1 mL流动相溶解残渣,再加入0.5 mL正己烷,涡旋30 s,8 000 r/min离心5 min,弃去上层正己烷层,下层过0.22 μm滤头,上UPLC分析。
1.4.3 肝脏和肾脏样品 准确称取1 g 肝脏或肾脏样品,分别置于10 mL离心管中,加入5 mL提取液,涡旋30 s,再加入0.5 g无水硫酸钠,涡旋30 s,7 000 r/min离心5 min,将提取液转移至另一10 mL离心管中,重复提取1次,合并提取液,置45 ℃氮吹仪上氮吹至干,用1 mL流动相溶解残渣,再加入0.5 mL正己烷,涡旋30 s,8 000 r/min离心5 min,弃去上层正己烷层,下层过0.22 μm滤头,上UPLC分析。
1.5 色谱条件
色谱柱为Waters ACQUITY UPLC BEH C18(2.1 mm×100 mm,1.7 μm)反相色谱柱;柱温为30 ℃;流速为0.3 mL/min;进样量为5 μL。流动相为乙腈-0.1%乙酸水溶液(体积比45∶55),等度洗脱;紫外检测波长为428 nm。
2 结果与讨论
2.1 提取剂的选择
根据姜黄素类化合物的理化特性,本实验分别考察了乙酸乙酯、乙腈、乙醇、乙酸乙酯(含0.1%乙酸)、乙腈(含0.1%乙酸)、乙醇(含0.1%乙酸)、乙酸乙酯(含0.01%乙酸)、乙腈(含0.01%乙酸)、乙醇(含0.01%乙酸)作为提取溶剂时对鱼组织中姜黄素类化合物的提取效果。在团头鲂肌肉中添加0.5 mg/kg的3种姜黄素类化合物标准品,做3个平行,计算其回收率,结果发现采用乙腈(含0.01%乙酸)作为提取剂时3种姜黄素类化合物的回收率最高,因此,最终选择乙腈(含0.01%乙酸)作为鱼组织中3种姜黄素类化合物的提取溶剂。
2.2 最大吸收波长、定容溶液和稀释溶液的选择
对姜黄素、去甲氧基姜黄素和双去甲氧基姜黄素标准溶液进行最大吸收波长扫描,结果分别为428,422,418 nm。相同浓度下双去甲氧基姜黄素的响应度最高,姜黄素的响应度最低,综合考虑最终选择检测波长为428 nm。实验发现,当采用乙腈、乙腈(含0.1%乙酸)和乙腈-水(45∶55)作为标准样品定容溶液和标准工作溶液稀释液时3种姜黄素类化合物不能分离,当以流动相作为定容溶液和标准工作溶液稀释液时,3种姜黄素类化合物能够完全分离。
2.3 线性关系
将“1.3”制备的标准工作溶液进样分析,以双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素的质量浓度(x,mg/L)为横坐标,对应峰面积(y)为纵坐标,绘制标准工作曲线。结果表明,双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素均在0.01~5.00 mg/L浓度范围内呈线性相关,回归方程分别为y=143 789x-7 286.9,y=117 103x-3 441.5和y=109 407x-2 597.1,相关系数分别为0.998 7,0.999 8和0.999 6。
2.4 方法回收率、精密度、检出限与定量下限
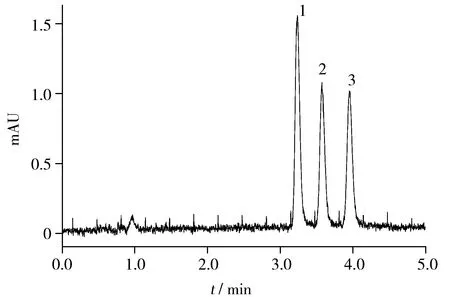
分别在黄颡鱼、团头鲂和草鱼的空白血浆、肌肉、肝脏和肾脏中添加浓度水平为0.025,0.05,0.50,1.00 mg/kg的双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素标准品,每个浓度水平6个平行样品,按照“1.4”方法下进行样品前处理,优化色谱条件下进行测定,得4个加标水平下的平均回收率分别为70.9%~99.6%,80.1%~102.2%,68.7%~81.4%,64.7%~ 86.3%;相对标准偏差(RSD)分别为0.69%~ 6.4%,2.0%~ 10.8%,1.6%~ 10.3%,4.2% ~9.2%。黄颡鱼肌肉空白样品及其加标样品的色谱图见图1。3种姜黄素类化合物在鱼组织中以大于3倍信噪比计算的检出限(LOD)均为0.010 mg/kg,以大于10倍信噪比计算的定量下限(LOQ)均为0.025 mg/kg。
2.5 方法应用
采用本文建立的分析方法研究了姜黄素在团头鲂体内的药代动力学规律,以100 mg/kg体重剂量口灌姜黄素混悬液(用乙醇溶解姜黄素后,加入可溶性淀粉用蒸馏水稀释,配制成含1%可溶性淀粉,姜黄素为20 mg/mL的混悬液),结果表明,姜黄素在团头鲂体内的最大峰浓度为(0.76±0.19) mg/kg,达峰时间为30 min。
3 结 论
本文建立了超高效液相色谱同时测定黄颡鱼、团头鲂和草鱼血浆、肌肉、肝脏和肾脏等组织中双甲氧基姜黄素、去甲氧基姜黄素和姜黄素含量的方法。本方法样品前处理简便快速、分离效果好,分析时间短,方法的线性范围、加标回收率与精密度均能满足鱼组织中3种姜黄素类化合物含量的分析要求。方法的建立为姜黄素类化合物在鱼体内药动学和组织分布研究提供了技术保障。
[1] Guan Y Y,Xie W L,Ai C X.Chin.Feed(关燕云,解文丽,艾春香.中国饲料),2015,16:11-15.
[2] Hu Z Z,Yang J F,Tan Z J,Hao J L.Cereal&FeedIndustry(胡忠泽,杨久峰,谭志静,郝结林.粮食与饲料工业),2003,(11):29-30.
[3] Wang J B,Wu T X.ReservoirFisheries(王进波,吴天星.水利渔业),2007,27(6):105-106.
[4] Shi H Q,Zhou Y K,Xie X H.FeedRes.(史合群,周永奎,谢晓晖.饲料研究),2013,(6):9-11.
[5] Zheng Q M,Chen X F,Wen X B. The 7th world Chinese Symposium on Fish and Shrimp.Beijing:Feed Research Institute of Chinese Academy(第七届华人鱼虾大会论文集.北京:中国农业科学院饲料研究所),2008.
[6] Niu S Y,Hao F G,Xu Q Y.J.Inst.Sci.Technol.:Nat.Sci.Ed.(牛生洋,郝峰鸽,许秋亚.河南科技学院学报:自然科学版),2008,36(4):58-61.
[7] Han G,Zhang Y C,Liu S Y.NorthwestPharm.J.(韩刚,张义春,刘士勇.西北药学杂志),2005,20(1):15-16.
[8] Zhao X,Yuan D,Wang Q L,Wang R J.Chin.J.Pharm.Anal.(赵欣,袁丹,王启隆,王瑞杰.药物分析杂志),2005,25(6):643-647.
[9] Zhang Y H,Zhang D,Wang Y,Cai D F,Sun J.Chin.Pharm.J.(张韻慧,张丹,王妍,蔡德富,孙杰.中国药学杂志),2009,44(18):1423-1425.
[10] Sun J,Sun Y T,Zhang Z Q.Chin.Hosp.Pharm.J.(孙静,孙艳涛,张振秋.中国医院药学杂志),2010,8:714-716.
[11] Cai Y,Song S,Xu J,Chen J W,Cui X B.Pharm.Clin.Res.(蔡颖,宋坤,徐杰,陈建伟,崔小兵.药学与临床研究),2014,22(6):502-505.
[12] Shi J J,Feng S X,Hao R,Miao Y Y,Liu Q,Wang H,Miao M S.ActaChin.Med.(史晶晶,冯素香,郝蕊,苗艳艳,刘琦,王辉,苗明三.中医学报),2015,30(6):853-855.
[13] Liu B Q,Hu X Z,Wang Y C,Zhu B C,Ding L.J.Instrum.Anal.(刘保启,胡孝忠,王玉春,朱宝成,丁良.分析测试学报),2004,23(1):109-111.
[14] Han C,Zhu Z O,Liu B,Huang F Z,Lei X X,Shen Y.Chin.J.Pharm.Anal.(韩超,朱振瓯,刘滨,黄芙珍,雷新响,沈燕.药物分析杂志),2013,33(2):185-188.
[15] Zhang P P,Qian J,Yang F,Cheng Q,Chen J,Zhang Y Y.J.Instum.Anal.(张盼盼,钱疆,杨方,程权,陈健,张玉燕.分析测试学报),2013,32(9):1127-1130.
[16] Yang F,Zhang P P,Qian J,Chen J,Zhang Y Y.Chin.J.FoodHyg.(杨方,张盼盼,钱疆,陈健,张玉燕.中国食品卫生杂志),2014,26(6):558-562.
[17] Gu J P,Deng Y J,Wang H,Zhang W M,Wang M.J.ChengduMed.Coll.(顾吉晋,邓英杰,王浩,张伟明,王敏.成都医学院学报),2009,4(4):241-244.
Simultaneous Determination of Bisdemethoxycurcumin,Demethoxycurcumin and Curcumin in Fish Tissues by UPLC
LIU Yong-tao1,2,LI Le3,Wang Sai-sai4,YU Lin-xue4,YANG Qiu-hong1,YANG Yi-bin1,2,AI Xiao-hui1,2*
(1.Yangtze River Fisheries Research Institute,Chinese Academy of Fishery Sciences,Wuhan 430223,China;2.Hubei Freshwater Aquaculture Collaborative Innovation Center,Wuhan 430223,China;3.Chinese Academy of Fishery Sciences,Beijing 100141,China;4.College of Fisheries and Life Science,Shanghai Ocean University,Shanghai 201306,China)
An original method for the simultaneous determination of bisdemethoxycurcumin,demethoxycurcumin and curcumin in plasma,muscle,liver and kidney of yellow catfish(Pelteobagrusfulvidraco),bluntnose black bream(Megalobramaamblycephala) and grass carp(Ctenopharyngodonidellus) was established by ultra high performance liquid chromatography with ultraviolet detection(UPLC-UV).The sample was extracted using acetonitrile containing 0.01% acetic acid,and the moisture of sample was removed with anhydrous sodium sulfate,thenn-hexane was used for removing fat in sample.After that,the sample prepared was separated on an ACQUIT UPLC BEH C18column and determined at 428 nm.Good linearities were observed in the range of 0.01-5.00 mg/L,and the correlation coefficients for bisdemethoxycurcumin,demethoxycurcumin and curcumin were 0.998 7,0.999 8 and 0.999 6,respectively.The average recoveries of 3 analytes in fish tissues at the spiked level of 0.025-1.00 mg/kg ranged from 64.7% to 102.2%,with relative standard deviations(RSDs) of 0.69%-10.8%.The detection limits(LODs) and quantitation limits(LOQs) for 3 analytes in fish tissues were all 0.010 mg/kg and 0.025 mg/kg,respectively.The presented method was firstly applied in the investigation on the pharmacokinetic profile of curcumin in bluntnose black bream.
fish tissues;bisdemethoxycurcumin;demethoxycurcumin;curcumin;ultra high performance liquid chromatography(UPLC)
2016-09-09;
2016-09-20
现代农业技术体系专项资金(CARS-49);中国水产科学研究院基本科研业务费资助(2016JBF0104);公益性行业(农业)科研专项资助(201503108-CC-1)
10.3969/j.issn.1004-4957.2017.02.022
O657.72;S816
A
1004-4957(2017)02-0276-04
*通讯作者:艾晓辉,博士,研究员,研究方向:水产动物药理,Tel:027-81780298,E-mail:liuyt@yfi.ac.cn

