槲皮素与桑色素ESI-MS裂解行为的比较分析
尹智慧,孙长海,方洪壮
(佳木斯大学 药学院,黑龙江 佳木斯 154007)
研究报告
槲皮素与桑色素ESI-MS裂解行为的比较分析
尹智慧,孙长海,方洪壮*
(佳木斯大学 药学院,黑龙江 佳木斯 154007)
运用量子化学方法辅助解析并比较槲皮素与桑色素在电喷雾离子阱质谱(ESI-MS)负离子模式下的裂解行为。依据密度泛函理论(Density functional theory,DFT),在B3LYP/6-31G(d)水平,对槲皮素与桑色素的分子空间构型进行优化,确定稳定的几何构型与去质子化位点,在RB3LYP/6-31+G(2d,2p)水平,计算相对碎裂电压下的二级质谱中碎片离子处于稳定状态时的能量,通过比较准分子离子稳定构型并结合基组重叠误差(Basis set superposition error,BSSE)校正后的键解离能(Bond dissociation energy,BDE),推导了质谱碎裂过程。结果显示:槲皮素的稳定构型为A,B,C环处于同一平面,桑色素上的2′-OH使得B环与AC环之间翻转一定角度,二面角D(1,2,1′,6′)为-134.662 4°。槲皮素与桑色素的质谱裂解过程主要通过C环跨环裂解产生,且具有多种开裂方式,开裂先后顺序为:1,2开裂、0,2开裂、1,3开裂、1,4开裂与0,4开裂,分别生成碎片离子1,2A-,0,2A-,1,3A-,1,4A-与0,4A-,并逐步进行后续裂解,而2′-OH的存在促进了桑色素的裂解。该研究为进一步揭示黄酮醇类化合物的质谱裂解规律提供了理论依据。
黄酮醇;量子化学;电喷雾离子阱质谱;裂解行为
槲皮素与桑色素是植物界中广泛分布的以C6-C3-C6为基本碳架的黄酮醇类化合物,常以游离态或糖苷形式存在[1-2]。两者互为同分异构体,化学结构上的区别在于B环上的二羟基取代位置不同。在药理活性方面,槲皮素与桑色素均具有抗炎、抗菌、抗肿瘤、抗氧化等作用,近几年被广泛用于药品与保健食品的研发[3-5]。电喷雾电离源(Electrospray ionization,ESI)质谱是质谱家族中的重要组成部分,虽然其在天然化合物的分析中已得到广泛的应用,但其质谱裂解机理与规律尚多有空白。质谱试验中,离子化过程非常短暂,难从实验上观察裂解过程,而将量子化学计算引入到质谱解析中,通过计算分子结构中的电荷密度、轨道、能级等各项参数,确定分子最稳定的电子态构型[6-8],模拟整个化合物的具体裂解过程[9],得到有机化合物的质谱形成机制等信息,可为谱学试验结果的解析提供理论依据。本研究从分子水平角度上出发,运用量子化学的计算方法,比较分析了槲皮素与桑色素化合物负离子模式下的电喷雾离子阱质谱裂解行为,尝试揭示槲皮素与桑色素两黄酮醇类化合物的质谱裂解机理。
1 实验部分
1.1 仪器与试剂
Agilent G6310质谱仪:美国安捷伦公司产品,配ESI源,离子阱质量分析器和Data Analysis数据处理软件等。槲皮素对照品(纯度>98%,天津一方科技有限公司);桑色素对照品(纯度>98%,大连美仑生物技术有限公司);甲醇(色谱纯,天津市科密欧化学试剂有限公司)。
1.2 质谱条件
采用ESI负离子模式检测,喷雾电压为3.5 kV,毛细管电压为13 V,毛细管温度325 ℃,鞘气和辅助气为氮气,鞘气流速10 L·min-1,辅助气流速0.15 L·min-1,氦气为碰撞气进行碰撞诱导解离分析,碎裂电压:自动1.00 V,手动0.80 V,扫描范围:m/z50~330。流动注射泵直接进样,流速0.5 mL·h-1。
1.3 量子化学计算方法
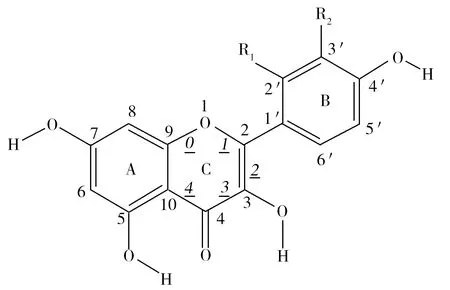
图1 槲皮素与桑色素的分子结构与原子编号Fig.1 Structures and atom numbering systems of quercetin and morin
量子化学计算采用Gaussian 03程序完成。在B3LYP/6-31G(d)水平分别进行几何结构优化及频率计算,确定优势构象与去质子化位点,且在此基础上,以同水平计算质谱碎片离子稳定构型,并在RB3LYP/6-31+G(2d,2p)水平计算碎片离子处于稳定状态时的能量,同时运用Counterpoise Corrrection方法进行基组重叠误差(Basis set superposition error,BSSE)计算。经BSSE校正的键解离能(Bond dissociation energy,BDE)根据公式进行计算:BDE=E(A)+E(B)-E(AB)+E(BSSE),式中E(AB)为母离子总能量,E(A)为产物碎片离子的能量,E(B)为中性碎片的能量,E(BSSE)为基组重叠误差值[10-12]。
2 结果与讨论
2.1 分子稳定结构
质谱真空条件下,分子主要以能量最低的形式存在,因此本研究以分子稳定的空间构型优化为前提,以保证其后的研究。槲皮素与桑色素的分子结构与原子编号及C环开裂位置编号如图1所示,其中,槲皮素:R1=H,R2=OH;桑色素:R1=OH,R2=H。图1中0,1,2,3,4 为C环开裂位置的编号,分别对应化学键C9—O1,O1—C2,C2—C3,C3—C4,C4—C10。
2.1.1 能量分析 对槲皮素与桑色素可能的初始构型分别进行结构优化、频率计算与能量计算,确定了各自分子稳定构型,如图2所示。两者经过分子结构优化及振动分析后的最终结果均符合收敛标准(Maximum Force 0.000 450;RMS Force 0.000 300;Maximum Displacement 0.001 800;RMS Displacement 0.001 200),频率计算均未出现虚频,说明计算得到的初始构型稳定,从相应的最终优化结构中得到的分子构象、能量、二面角、偶极矩等参数有效可靠,从理论上可作为两种化合物的分析比较。
2.1.2 构型分析 由表1中的数据及图2可以看出,槲皮素分子优势构象为A,C,B三环处于同一平面时的共轭结构,与文献报道一致[13-14],此时分子体系的总能量最低,结构最为稳定,分子中的原子和化学键呈自由伸展的状态。桑色素分子A环与C环仍处于同一平面,但由于B环2′-位存在羟基,使B环与C环之间存在空间位阻,由此使得桑色素的分子优势构象为非平面,其B环与AC环之间二面角D(1,2,1′,6′)为-134.662 4°。
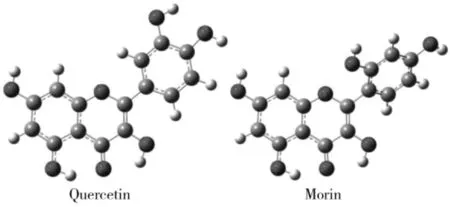
图2 槲皮素与桑色素分子的优势构象Fig. 2 The preferred conformations of quercetin and morin
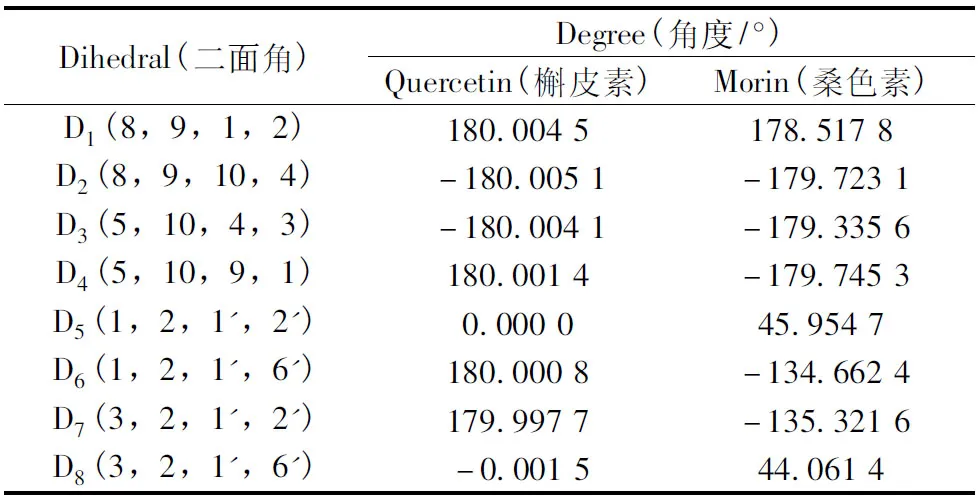
表1 槲皮素与桑色素分子优势构象的二面角参数Table 1 The dihedral parameters of the preferred conformations of quercetin and morin

表2 槲皮素与桑色素可能的[M-H]-构型的能量Table 2 Energy of [M-H]- for the probable structures of quercetin and morin
2.2 去质子化位点

2.3 质谱结果
在质谱试验过程中,槲皮素与桑色素均出现m/z301.0的准分子离子峰,分别将其作为母离子手动提取二级质谱图,得到ESI-MS2质谱图(如图3所示)。两种物质的分子在电喷雾离子阱质谱中的碎片离子基本相同,说明可能具有相同的裂解方式。分析图3发现,槲皮素的二级质谱图产生的碎片中,碎片离子m/z150.9,178.8的丰度最为明显,而桑色素则为m/z124.9,150.9最明显,两者中等质量数的碎片离子峰居多,且相对峰强度较大,推测两种黄酮醇在质谱碎裂过程中主要发生了环开裂现象,此外还经历了丢失中性H2O,CO和CO2等过程。

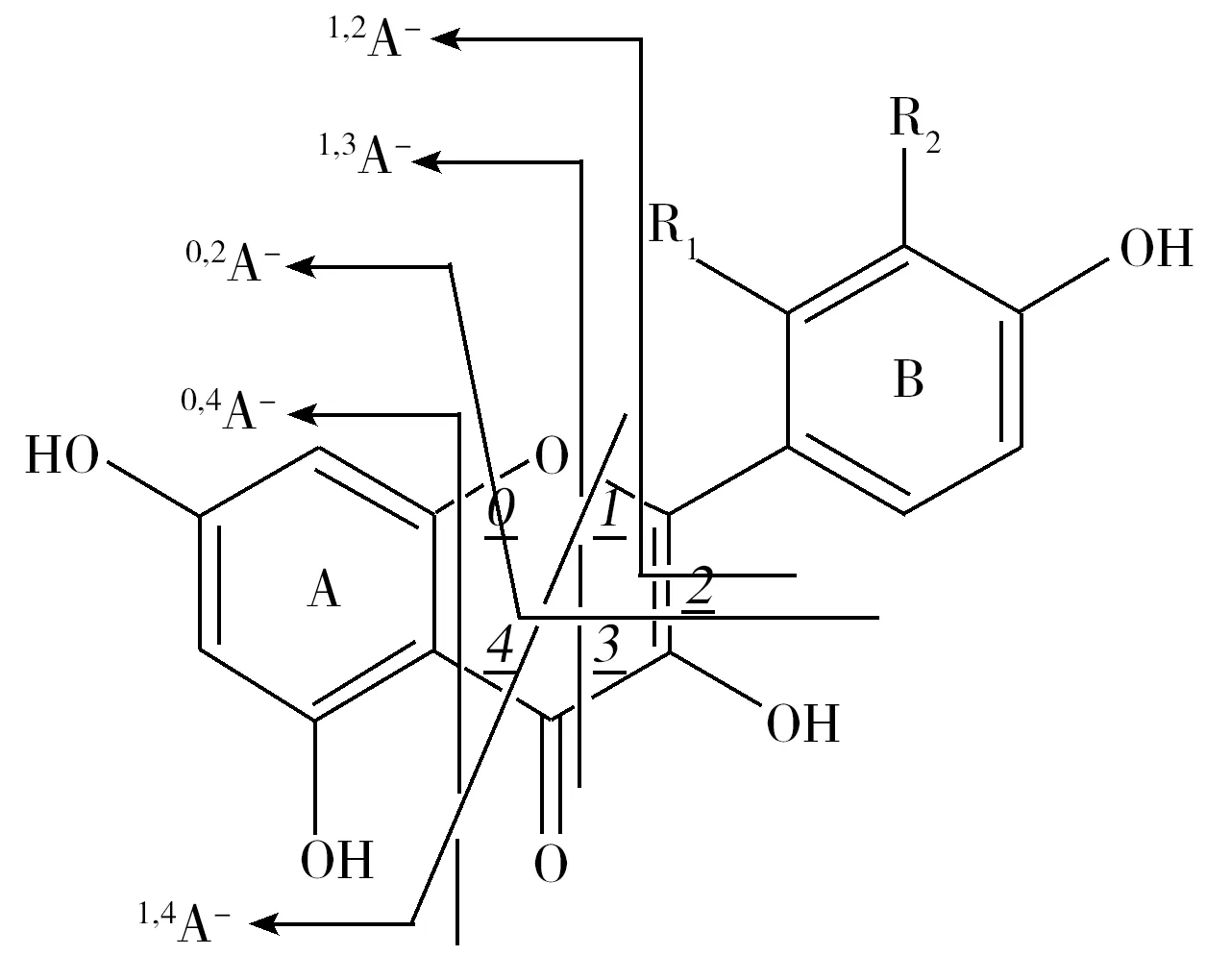
图4 槲皮素与桑色素的跨环开裂方式Fig.4 The ways of cross-ring cleavages for quercetin and morin
2.4 量化计算
黄酮醇类化合物在质谱裂解过程中由于苯环具有较大稳定性不易开裂,因此主要发生C环的retro-Diels-Alder(RDA)裂解[15-18],裂解产物为A、B环各自带有C环的一部分。几种裂解方式如图4所示,相应产物分别用A与B部分表示。经分析发现在同一裂解方式下槲皮素、桑色素跨环开裂得到的A部分碎片离子均为同一结构。
为深入探究C环裂解过程,对几种跨环裂解方式进行全面的BDE计算分析。考虑到E([M-H]-)相较于E(A-)+E(B)的降低除了来自真实的A-与B的相互作用能外,还有一部分是由于两者的基函数在[M-H]-体系中的重叠,因此加入基组重叠误差(BSSE)对BDE结果进行校正[19]。计算涉及的碎片离子均为能量达到最低时的构型。槲皮素与桑色素各跨环裂解方式下的产物示意图如图5所示,由“2.2”研究得两者的[M-H]-能量分别为-1 103.785 8 a.u.与-1 103.766 9 a.u.,相应的BDE值见表3。

Positionofcleavage(开裂位置)Quercetin(槲皮素)Morin(桑色素)E(A-)(a u.)E(B)(a u.)E(BSSE)(a u.)BDE(kJ·mol-1)E(A-)(a u.)E(B)(a u.)E(BSSE)(a u.)BDE(kJ·mol-1)Bond1,2-682 9310-420 81760 0031105 7794-682 9310-420 81070 003174 4067Bond0,2-607 6493-496 07150 0039181 1308-607 6493-496 06660 0041144 7287Bond1,3-569 5421-534 14800 0039261 7124-569 5421-534 13930 0041235 3535Bond1,4-457 4061-646 24920 0040353 4838-457 4061-646 23720 0042335 6848Bond0,4-380 7978-722 72830 0041692 7894-380 7978-722 72860 0043642 6163

图6 1,2A-离子的静电势图及电荷分布Fig.6 Electrostatic potential surface(A) and charge distribution(B) of fragment ion 1,2A-
槲皮素与桑色素计算所得的BDE能量整体上趋势相同,按能量大小由低到高依次为BDE1,2 反常的是,图3中桑色素的碎片离子1,2A-丰度较低,但其理应优先开裂且丰度最大,因此对其碎片离子结构做进一步量子化学计算。1,2A-稳定构型有两个相邻的羰基取代基,由于羰基具有较强电负性,在质谱试验中易脱去,猜测可能在碰撞过程中失去了中性CO而裂解。图6A为碎片离子1,2A-的静电势(Electrostatic potential,ESP)图,ESP图显示了碎片离子的静电势分布、形状、偶极矩等相关信息,能够直观地了解相对极性,可用于观测正负电荷的分布情况和预测反应活性位点。红色部分为负电荷分布区,蓝色部分为正电荷分布区。通过比较图6中相邻取代的两个羰基上所覆盖的颜色发现,4-位羰基周围的负电荷分布比3-位羰基更多,可以初步推断4-位羰基的电负性更强。图6B为碎片离子1,2A-的电荷分布情况,可以看到所带负电荷最多的部位在4-位羰基的氧原子上,进一步可以确证,4-位羰基的电负性更强,因此碎裂电压的驱动力使其更易脱去进行下一步裂解,生成1,3A-碎片离子。这解释了在碎裂过程中,虽然1,2A-所需BDE能量更低,但1,3A-碎片离子的相对丰度强于1,2A-的原因。另外,相对碎裂电压条件下,相较于槲皮素而言,桑色素[M-H]-生成1,2A-所需的BDE能量更低,能够更早地脱去4-位羰基进行后续裂解,表现为桑色素1,2A-碎片的离子丰度明显低于槲皮素的1,2A-。碎片离子1,3A-稳定构型上还带有1个羰基与1个氧原子,在一定程度上还可继续脱去形成0,4A-碎片离子。 同样地,碎片离子0,2A-也具有两个相邻的羰基,在失去1个羰基后,因无法形成环状稳定结构,即刻失去另一羰基生成0,4A-碎片离子。 除上述主要的C环跨环开裂外,两种黄酮醇[M-H]-还将发生同环上的中性碎片丢失,鉴于苯环的较强稳定性,均为C环脱去而产生。图7显示了槲皮素与桑色素的质谱裂解途径及各步裂解过程中失去的中性碎片,出现的碎片均为能量最低态结构。中性H2O的丢失是通过脱去羟基与氢原子而形成,C环上3-OH与附近B环C6′上的氢以H2O的形式脱去,生成m/z283碎片离子。4-位羰基的强电负性有助于脱去CO,生成m/z273碎片离子。1-位氧原子电负性虽不如4-位羰基,但造成相连的C9-O1键与O1-C2键的极性增加,也有助于脱去氧原子与3-位羟基,生成稳定的共轭碎片离子m/z229。m/z257为共同脱去1-位氧原子与4-位羰基所生成的碎片离子,可进一步脱去3-位羟基,生成上述同一碎片离子m/z229。分析发现,碎片离子m/z273与m/z257的生成存在竞争关系,通过计算得到槲皮素与桑色素生成m/z273所需能量分别为154.419 1 kJ·mol-1与146.747 5 kJ·mol-1,而m/z257分别为228.627 8 kJ·mol-1与215.690 4 kJ·mol-1,两者均为m/z273碎片离子优先生成,得以继续裂解形成m/z229,所以质谱试验结果中m/z273丰度低于m/z257。槲皮素与桑色素的分子构型中,C2-C1′键并未形成环状体系,在碎裂过程中理应易断裂而生成m/z193碎片离子,但在质谱图(图3)中桑色素的碎片离子m/z193丰度极小难以观察到,推测其原因是由于桑色素的跨环裂解程度增加,削弱了此碎片离子的生成,而槲皮素的跨环裂解程度不及桑色素,因此在质谱图中可以观察到槲皮素的m/z193碎片离子。从两者分子构型区别的角度上看,2′-OH的存在与偶极矩是造成两者碎裂途径差异的重要原因。 图7 槲皮素与桑色素的质谱裂解途径Fig.7 Fragmentation pathways of quercetin and morin 本文通过运用量子化学计算辅助的方法对槲皮素与桑色素化合物的ESI-MS质谱裂解途径进行了比较分析,依据密度泛函理论,确定了槲皮素的稳定构象为A,B,C环处于同一平面,而桑色素由于2′-OH的存在,产生了空间位阻力,结果使AC环与B环不为平面,推断出槲皮素与桑色素的去质子化位点,均为脱去4′-位羟基上的氢而形成准分子离子。通过综合分析质谱试验数据与量子化学计算结果,获得了槲皮素与桑色素碎片的离子稳定构型以及裂解方式,证明两者具有相同的质谱裂解途径,但2′-OH的存在不仅增大了桑色素分子的极性,同时促进了桑色素[M-H]-的跨环裂解。本研究不仅系统地解释了槲皮素与桑色素的质谱碎裂行为,且分析了2′-OH的存在对黄酮醇类化合物的影响,为进一步研究黄酮醇类化合物的质谱裂解途径提供了理论依据。 [1] Day A J,Bao Y,Morgan M R A,Williamson G.FreeRadicalBiol.Med.,2000,29(12):1234-1243. [2] Ablajan K,Abliz Z,Shang X Y,He J M,Zhang R P,Shi J G.J.MassSpectrom.,2006,41(3):352-360. [3] Amado N G,Fonseca B F,Cerqueira D M,Neto V M,Abreu J G.LifeSci.,2011,89(15/16):545-554. [4] Santos M C S,Goncalves C F L,Vaisman M,Ferreira A C F,Carvalho D P.FoodChem.Toxicol.,2011,49(10):2495-2502. [5] Rauha J P,Remes S,Heinonen M,Hopia A,Marja K,Kujala T,Pihlaja K,Vuorela H,Vuorela P.Int.J.FoodMicrobiol.,2000,56(1):3-12. [6] Galezowska A,Harrison M W,Herniman J M,Skylaris C K,Langley G J.RapidCommun.MassSpectrom.,2013,27(9):964-970. [7] Wright P,Alex A,Pullen F.RapidCommun.MassSpectrom.,2014,28(10):1127-1143. [8] Riahi S,Eynollahi S,Ganjali M R.Int.J.Electrochem.Sci.,2009,4(8):1128-1137. [9] Wright P,Alex A,Harvey S,Parsons T,Pullen F.Analyst,2013,138(22):6869-6880. [10] Mikulski D,Eder K,Molski M.J.Theor.Comput.Chem.,2014,13(1):1450004. [11] Chen L H,Hu D H,Wang D W,Yang S Y,Su Z M,Liu S Y.Chem.J.Chin.Univ.(陈兰慧,胡冬华,王道武,杨双阳,苏忠民,刘淑莹.高等学校化学学报),2006,27(5):905-908. [12] Li X H,Li W B,Zhang X Z.J.Chem.Sci.,2010,122(4):521-527. [13] Antonczak S.J.Mol.Struc-Theochem.,2008,856(1/3):38-45. [14] Aparicio S.Int.J.Mol.Sci.,2010,11(5):2017-2038. [15] Fabre N,Rustan I,Hoffmann E,Quetin-Leclercq J.J.Am.Soc.MassSpectrom.,2001,12(6):707-715. [16] Lewars E G,March R E.RapidCommun.MassSpectrom.,2007,21(10):1669-1679. [17] Burns D C,Ellis D A,Li H X,Lewars E G,March R E.RapidCommun.MassSpectrom.,2007,21(3):437-454. [18] March R E,Miao X S,Metcalfe C D,Stobiecki M,Marczak L.Int.J.MassSpectrom.,2004,232(2):171-183. [19] Feller D,Dixon D A,Nicholas J B.J.Phys.Chem.A,2000,104(48):11414-11419. Analysis and Comparison on Fragmentation Behavior of Quercetin and Morin by ESI-MS YIN Zhi-hui,SUN Chang-hai,FANG Hong-zhuang* (Pharmaceutical College,Jiamusi University,Jiamusi 154007,China) The fragmentation behaviors of quercetin and morin were analyzed and compared by the quantum chemistry method with electrospray ionization mass spectrometry(ESI-MS) in negative ion mode.Based on the density functional theory(DFT),at the level of B3LYP/6-31G(d),quantum chemistry calculation was carried out to optimize the molecular spatial configurations of quercetin and morin,in order to confirm the stable geometric configurations and deprotonation locations of quasi-molecular ions.The energy of fragment ions on the stable state under the relative framentation voltage in the second order mass spectrometry,was calculated at the level of RB3LYP/6-31+G(2d,2p).The fragmentation pathway was deduced by comparing the stable configurations of quasi-molecular ions and combined with basis set superposition error(BSSE)-corrected bond dissociation energy(BDE).The results indicated that the stable configuration of quercetin was that the A,B,C rings stayed in the same plane,but morin was not like this because of the 2′-OH,and the dihedral angle between B ring and AC rings was-134.662 4°.The fragmentation processes of quercetin and morin occurred mainly through the cross-ring cleavages of C ring with various of cleavage ways.The precedence order was:1,2 cleavage,0,2 cleavage,1,3 cleavage,1,4 cleavage and 0,4 cleavage,the fragment ions of1,2A-,0,2A-,1,3A-,1,4A-and0,4A-were generated,respectively.The difference between them was that the existence of 2′-OH on morin facilitated the cross-ring cleavages.Subsequently,the rest of fragment ions were produced step by step.This study provided a theoretical basis for further revealing the fragmentation pathway of flavonol compounds. flavonol;quantum chemistry;electrospray ionization mass spectrometry(ESI-MS);fragmentation behavior 2016-07-07; 2016-10-20 佳木斯大学研究生科技创新项目(LZR2015_022) 10.3969/j.issn.1004-4957.2017.02.009 O657.63;TQ460.72 6 A 1004-4957(2017)02-0205-07 *通讯作者:方洪壮,教授,研究方向:中药分析与计算药物分析,Tel:0454-8611265,E-mail:fhz-chjms@163.com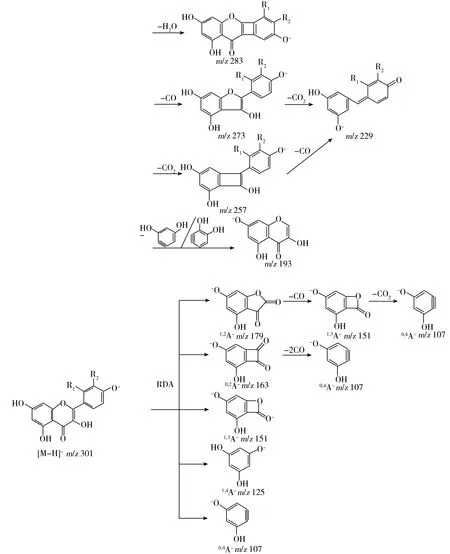
3 结 论

