脑啡肽的固相合成与LC-MS/MS分离鉴定
瑙 甘,金钰龙*,黄嫣嫣,赵 睿*
(1.中国科学院化学研究所,中国科学院活体分析化学重点实验室,北京 100190;2.中国科学院大学,北京 100049)
脑啡肽的固相合成与LC-MS/MS分离鉴定
瑙 甘1,2,金钰龙1,2*,黄嫣嫣1,2,赵 睿1,2*
(1.中国科学院化学研究所,中国科学院活体分析化学重点实验室,北京 100190;2.中国科学院大学,北京 100049)
多肽在生命过程中扮演着重要的角色,对其生理生化功能的研究与应用,离不开对单一多肽物质的需求,而化学合成法是获取目标多肽的最有效方法之一。对合成产物的分离与鉴定,是优化合成条件,以得到高产率的重要保证。以两种内源性神经肽亮氨酸脑啡肽和甲硫氨酸脑啡肽为模型,利用Fmoc固相多肽合成策略对其进行合成,并建立了HPLC-ESI-MS/MS新方法用于所制备的亮氨酸脑啡肽和甲硫氨酸脑啡肽的分离与结构鉴定。研究结果显示,主要合成产物均为目标多肽,副产物主要包括C端丢失1个氨基酸所形成的四肽,以及由于甲硫氨酸残基氧化而形成的含甲硫氨酸亚砜的多肽。该研究为高效合成含敏感氨基酸的生理活性多肽提供了新信息。
多肽固相合成;甲硫氨酸脑啡肽;亮氨酸脑啡肽;氧化;液相色谱-质谱联用
多肽是由氨基酸通过酰胺键连接形成的、大小介于氨基酸与蛋白质之间的重要生理活性物质。多肽既是蛋白质的重要组成部分,同时作为生命物质,其自身也参与生物体内众多的分子事件,并发挥着重要的生理生化功能。多肽在生物体内可作为神经递质、神经调质和激素等,通过与受体相互作用影响细胞间的信号传导与信息交流。以多肽为识别功能单元的分子探针可被应用于生命相关活性分子的检测[1-4];利用多肽特异性识别靶分子的特点,发展了基于多肽识别的靶向药物运输体系[5-6]。此外,多肽在医药、材料领域也得到越来越广泛的应用,可构建诸如纳米笼、纳米管、纳米纤维等结构的自组装体,具有催化、模拟生物分子结构等功能[7-8];多肽也因其生物相容性好、毒副作用小,被应用于抗癌、抗病毒、抗心脑血管等疾病的药物,并显示出诱人的发展前景。
无论是多肽的功能研究还是多肽的生物化学应用,均离不开对多肽纯品的需求。相比于生物制备方法,多肽的化学合成方法具有制备简单、合成效率高、易于自动化等优势。自1963年 Merrifield教授等[9-10]发展了多肽固相合成(Solid phase peptide synthesis,SPPS)这一独创性的方法以来,引起了多肽合成领域的革命性转变,Merrifield教授也因此获得了1984年诺贝尔化学奖。目前多肽的固相化学合成已成为最重要的多肽制备方法之一,SPPS除了可以合成含有天然氨基酸的多肽之外,还能够合成含有非天然氨基酸的多肽,大大增加了合成多肽的多样性和信息量。然而由于多肽的基本结构单元除20种天然氨基酸外还有众多的衍生物,其侧链基团结构差异大,且性质各异,极易造成制备过程中偶联效率低,以及氨基酸残基的消旋、敏感位点的修饰等副反应,因此多肽的高效合成与纯化鉴定仍然是亟需解决的关键问题。
高效液相色谱法(High performance liquid chromatography,HPLC)是复杂样品分离的重要手段,具有高效、快速、高灵敏度、应用范围广等特点,质谱(Mass spectrometry,MS)通过检测带电粒子的质荷比(Mass to charge ratio,m/z)而实现对化合物的结构鉴定,将HPLC与MS相结合,可充分发挥色谱对复杂样品的高效分离能力,以及质谱高选择性、高灵敏度检测及提供结构信息的能力,在多肽的分离、鉴定、纯化中发挥着越来越重要的作用[11-13]。
脑啡肽(Enkephalin)是一种分布在中枢神经系统的五肽,被称为内源性神经肽。1975年科学家研究发现有两种天然存在的内源性脑啡肽,分别为亮氨酸脑啡肽(Leucine-enkephalin,Leu-ENK)和甲硫氨酸脑啡肽(Methionine-enkephalin,Met-ENK),其区别仅在于C端第1个氨基酸。脑啡肽除镇痛作用[14]外,还可参与神经内分泌与免疫系统间的循环,免疫调节[15],感情行为的控制[16],促进伤口恢复[17],辅助抗癌作用[18]等。
本文以Leu-ENK和含敏感氨基酸的Met-ENK为模型对象,采用Fmoc多肽固相合成策略,对两种脑啡肽进行了固相化学合成。建立了脑啡肽合成产物的LC-MS/MS分离分析新方法,对多肽粗产物中的几种主要成分进行了结构鉴定,并进一步提出了合成条件的优化方法。该研究为含敏感氨基酸的生理活性多肽的高效制备以及快速LC-MS/MS鉴定提供了新方法。
1 实验部分
1.1 仪器与试剂
苯并三氮唑-N,N,N′,N′-四甲基脲六氟磷酸酯(HBTU,吉尔生化有限公司);Fmoc-AA-Wang树脂(Advanced Chemtech公司,美国);Fmoc-AA-OH与乙二硫醇(EDT)均购自美国Siam公司;三氟乙酸(TFAs,Sigma-Aldrich公司,美国);甲酸(FA,Dikma公司,中国),乙腈(色谱纯,Fisher公司,美国);N-甲基吗啡啉(NMM)、二甲基甲酰胺(DMF)、二氯甲烷(DCM)、六氢吡啶均为分析纯,购自北京化工厂;三异丙基硅烷(TIS,百灵威科技有限公司,中国);实验用水为超纯水,由美国Millipore公司的Milli-Q型超纯水系统制备。
UHPLC-ESI-IT-MS/MS为配备二极管阵列检测器(DAD-3000RS)的Ultimate 3000 UHPLC串联LCQ Fleet质谱仪(Thermo Fisher公司,美国);Halo Peptide ES-C18色谱柱(2.1 mm×150 mm,2 μm,Advanced Materials Technology公司,美国);SKY-100C恒温培养振荡器(Sukun公司,中国);分析天平(Mettler Toledo公司,瑞士)。
1.2 脑啡肽的固相合成
采用Fmoc固相肽合成法对Leu-ENK和Met-ENK进行合成,其合成过程主要包括3部分:树脂上Fmoc保护基的脱除、多肽链的延长以及多肽从树脂上的裂解。Leu-ENK的序列为YGGFL,Met-ENK的序列为YGGFM。将Fmoc-Leu-Wang Resin和Fmoc-Met-Wang Resin分别装入多肽合成管中,加入足量的DMF溶液浸泡树脂至少30 min,使其充分溶胀。采用DMF清洗3次。在磁力搅拌下加入20%六氢吡啶/DMF溶液(3 mL)以从氨基酸的N-端脱掉Fmoc-保护基,反应2次,每次10 min。采用Kaiser试剂[19]对树脂进行检测。脱保护成功后用DMF洗涤树脂6次,以除去残留的六氢吡啶。
在氨基酸偶联步骤中,使用0.4 mol/L的N-甲基吗啡啉/DMF溶液作为碱性催化剂,将3倍量Fmoc-氨基酸和3倍量HBTU加入上述N-甲基吗啡啉/DMF溶液中进行活化,将活化后的氨基酸溶液加入多肽合成管中,放入恒温培养振荡器中反应1 h(T=40 ℃,n=140 r/min)。反应结束后,进行Kaiser检测,树脂不变蓝色表明反应完全,否则延长时间或重复偶联。重复上述步骤以完成多肽的延长。合成完成后用二氯甲烷置换树脂珠上残存的DMF,再用甲醇收缩树脂,真空干燥2 h,置于冰箱保存。
在多肽裂解步骤中,取所合成的干燥多肽-树脂于玻璃瓶中,添加裂解液(20 mL/g树脂),置于冰浴中磁子搅拌反应15 min,随后在室温条件下反应2 h。对于Leu-ENK,裂解液组成为:TFA∶H2O=95∶5(体积比);对于Met-ENK,裂解液组成为:TFA∶EDT∶H2O=95∶2.5∶2.5(体积比)。裂解反应后过滤除去树脂,并用少量裂解液洗涤树脂两次,将得到的滤液用旋转蒸发仪浓缩至约1 mL,随后将预冷的乙醚加入到上述多肽/TFA溶液中,静置,使多肽析出。将此浑浊液转移至离心管内,离心,除去上清液,并用冷乙醚洗涤沉淀两次。将含有多肽固体的离心管置于真空干燥器中干燥2 h去除乙醚,得到多肽粗产品。
1.3 多肽粗品的LC-UV-MS/MS分析
UHPLC-UV-MS/MS分析,色谱系统:Thermo Fisher UHPLC-UV-LCQ-MS;色谱柱:Halo Peptide ES-C18(2.1 mm×150 mm,2 μm);流动相:A为0.1% FA/H2O,B为0.1% FA/CH3CN;流速:0.3 mL/min;梯度洗脱程序:0~10 min,5%~60% B;10~10.01 min,60%~80% B;10.01~13 min,80%B。质谱扫描模式为正离子模式;毛细管温度:300 ℃;喷雾电压:4.5 kV;二极管阵列检测器监测波长:220 nm。通过数据依赖性扫描模式(data dependent MS/MS,ddMS2)采集二级质谱信号。
2 结果与讨论
2.1 脑啡肽合成
多肽合成的基础,是氨基与羧基之间形成酰胺键的缩合反应。固相肽合成技术是使多肽合成在不溶性的固相载体上进行,其突出的特点是,可以使用过量的试剂使反应趋于完全,在反应结束后,通过简单的过滤,很容易地除掉过量的反应试剂,并将树脂洗涤干净以进行下一步反应。固相肽合成是需重复进行的多步反应。由于对多肽合成反应的深入研究,理论上每一个偶联循环几乎可以达到99%以上的产率。在经过n次偶联循环,可以获得近于[99%]n的总收率。然而,由于氨基酸结构的差异、性质的不同,以及序列的多样性,使得合成多肽的产率远不能达到预期,因此多肽的高效合成仍然成为多肽研究中亟待解决的问题。

图1 Met-ENK与Leu-ENK的化学结构式与氨基酸序列Fig.1 Chemical structures and amino acid sequences of Met-ENK and Leu-ENK
Fmoc固相肽合成[20]的基本步骤是将第一个氨基酸通过其羧基与固相载体上的羟基进行反应,以共价键连接于固相载体上。然后以六氢吡啶脱掉氨基酸的α-氨基保护基,形成游离氨基;将下一个氨基酸的游离羧基与此游离氨基在偶联试剂作用下进行反应,以形成新的酰胺键;反复进行脱保护和偶联过程,便可以不断地延长肽链;最后,将目的多肽从固相载体上裂解下来,同时脱掉侧链保护基,得到目标多肽。本研究采用Fmoc战略进行了亮氨酸脑啡肽和甲硫氨酸脑啡肽的合成,其化学结构式及氨基酸序列如图1所示。
2.2 脑啡肽粗产物的LC-UV-MS分离分析
在多肽的高效化学制备中,为了优化合成条件,减少副产物,提高多肽合成产率,需对多肽合成粗产物进行HPLC-UV分离分析及MS/MS鉴定。

图2 甲硫氨酸脑啡肽合成粗产物(a)及亮氨酸脑啡肽合成粗产物(b)的UHPLC谱图Fig.2 UHPLC chromatograms of crude product of Met-ENK(a) and Leu-ENK(b)
首先采用UHPLC-UV-MS联用的方法,对Met-ENK和Leu-ENK的合成粗产物进行分离分析,UHPLC-UV结果如图2所示,无论是Met-ENK或是Leu-ENK,除主峰外,均存在一定程度的杂峰。对于Met-ENK合成粗产物(图2a),保留时间为5.48 min的色谱峰4具有最大的峰面积,是主产物,其一级质谱图中出现质荷比分别为574.4和1 147.5的信号(表1),分别与Met-ENK的单电荷分子离子峰[M+H]+(理论m/z= 574.2)以及单电荷二聚体[2M+H]+(理论m/z=1 147.4)相吻合,因此推测粗产物中的主要成分峰4即目标五肽YGGFM,通过峰面积归一化法计算出Met-ENK的含量为79.8%。粗产物中主要存在两种副产物,色谱图中分别标记为峰2和峰3,保留时间分别为4.29 min和4.72 min,保留时间均比Met-ENK短,根据反相色谱分离理论,产物峰2和峰3具有比Met-ENK更大的极性。一级质谱表征结果显示,峰2的质荷比(m/z)为590.2([M+H]+),比Met-ENK多16 Da,可能是目标物的单加氧产物YGGFM(O),由于其极性大于目标多肽Met-ENK,因此其保留时间缩短。Met-ENK中易被氧化的位点有甲硫氨酸残基、苯丙氨酸残基和酪氨酸残基,因此,峰2可能是Met-ENK中甲硫氨酸残基被氧化为亚砜,或苯丙氨酸残基侧链被氧化为苯酚,或酪氨酸残基侧链苯酚被氧化形成邻二酚的产物。峰3的质荷比(m/z)为443.1([M+H]+),比Met-ENK少131 Da,减少的部分与甲硫氨酸残基质量相符,初步推测可能是C端丢失1个氨基酸残基而形成的四肽YGGF。
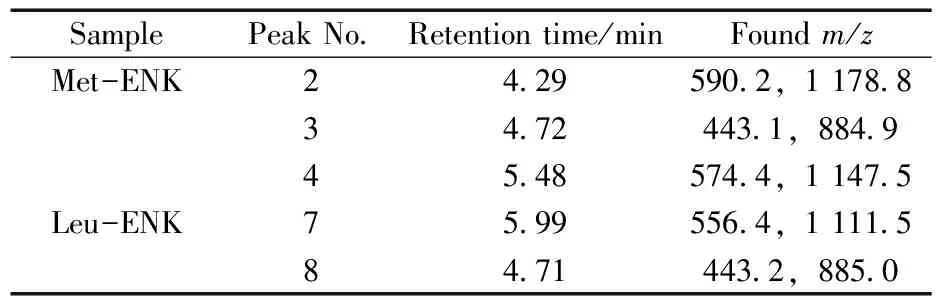
表1 脑啡肽粗产物主要色谱峰的保留时间及对应质谱信号Table 1 Retention times and signals of main peaks of crude enkephalin
对于亮氨酸脑啡肽合成粗产物,如图2b所示,样品中主要成分色谱峰8的保留时间为5.99 min,其一级质谱图中出现质荷比分别为556.4和1 111.5的信号(表1),这分别与亮氨酸脑啡肽的单电荷分子离子峰[M+H]+(理论m/z= 556.3)以及单电荷二聚体 [2M+H]+(理论m/z= 1 111.5)相吻合,推测其为目标产物Leu-ENK,通过峰面积归一化法计算Leu-ENK粗产物的含量为85.2%。从图2B中可见主要杂质色谱峰7,保留时间为4.71 min,这与Met-ENK粗产物中的峰3保留时间(4.72 min)相近,色谱峰7的一级质谱图中可见质荷比(m/z)为443.2([M+H]+)的信号,与峰3质荷比(m/z) 443.1([M+H]+)接近,初步推测该产物同样是C端丢失1个氨基酸而形成的四肽YGGF。
2.3 Met-ENK合成粗产物的LC-MS/MS分析与结构鉴定
仅通过一级质谱信号对多肽合成粗产物中的不同成分进行定性是不够的,特别是在低分辨质谱中,分子量接近的物质易引起误判。MS/MS通过对选取的母离子进行碎裂,进一步对碎片离子信号进行分析,可获得多肽序列以及丰富的氨基酸修饰信息,这已成为多肽以及蛋白质分析的重要手段。
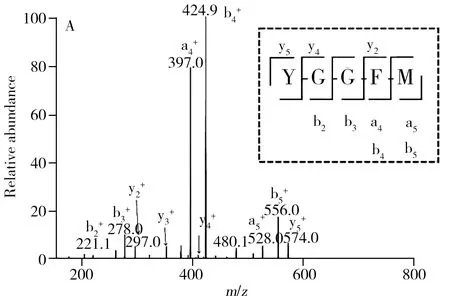
因此,为了确证脑啡肽粗产物的结构,并解释出现副产物的原因,进一步做了LC-MS/MS分析。图3(A~C)为Met-ENK各组分的二级质谱图。首先选取色谱峰4 质荷比为574.4的母离子进行碎裂,如图3A所示,主产物峰4的二级质谱信号中丰度较大的为酰胺键断裂后电荷保留于N端形成的b系列碎片离子b2(221.1),b3(278.0),b4(424.9)和b5(556.0),以及酰胺键断裂后电荷保留于C端形成的y系列碎片离子y2(297.0),y3(354.0),y4(411.1)和y5(574.0),与氨基酸残基的分子量比对后,确证主产物峰4对应于目标多肽Met-ENK。
选取色谱峰2的分子离子峰(m/z=590.2)作为母离子进行二级碎裂,碎片信号如图3B所示,碎片离子b4和b5(O)的质荷比分别为 424.9和572.1,两者之差为147 Da,恰好是甲硫氨酸亚砜残基的分子量,因此表明氧化位点发生在Met-ENK的甲硫氨酸残基上,而非酪氨酸残基或苯丙氨酸残基。进一步与色谱峰4的碎片离子信号进行比较后,发现两色谱峰对应的b2-b4碎片离子质荷比相同,而峰2的b5碎片信号比峰4的b5碎片大16,因此可以推断峰2对应的副产物氧化位点为C端甲硫氨酸残基。在单位分辨质谱的MS/MS鉴定中,往往很难区分甲硫氨酸亚砜残基与苯丙氨酸残基,因为它们的分子量均为147 Da。在本实验中,b5(O)(m/z=572.1)丢失64 Da,产生质荷比(m/z)为508.2的碎片,这种特征的中性丢失信号(64 Da)是由于甲硫氨酸残基侧链的甲次磺酸在碰撞诱导解离(CID)条件下,经过分子内重排反应脱落所致,断裂机理如图3D所示,这些碎片离子进一步证明了甲硫氨酸亚砜残基的存在。综上所述,Met-ENK中的甲硫氨酸残基易于在合成过程中发生氧化形成甲硫氨酸亚砜。因此在含敏感氨基酸甲硫氨酸残基的多肽裂解过程中,需保持无氧环境(氮气保护),多肽裂解时间尽可能缩短,这将有效降低形成氧化产物的比例。
色谱峰3的二级碎片信号如图3C所示,检测到a系列碎片离子:a1(136.0)和a4(397.0),b系列碎片离子:b2(221.0),b3(278.0),b4(425.0),以及y系列碎片离子:y2-Met(166.0),y3-Met(223.0),y4-Met(280.0),这表明氨基酸残基缺失出现在C端第一位。进一步与色谱峰4的碎片离子信号比较可发现,两色谱峰对应的y2-y4碎片离子质荷比均相差131,此为甲硫氨酸残基的分子量,表明峰3对应的副产物为C端丢失甲硫氨酸残基而形成的残缺肽。推测在偶联苯丙氨酸的过程中,苯丙氨酸活化的羧基除连接在甲硫氨酸的氨基上形成酰胺键外,还直接与树脂上的羟甲基相连形成酯键。出现这种结果的可能原因是Fmoc-aa-Wang树脂存在游离的羟甲基所致。
图2a中其他杂质色谱峰(1,5,6号峰)的含量均小于2%,进一步的MS和MS/MS分析表明,峰1为酪氨酸侧链保护基未脱去的副产物Y(tBu)GGFM,峰5和峰6分别为YGGFMM和YGGFMM(O)。

2.4 Leu-ENK合成粗产物的LC-MS/MS分析与结构鉴定
Leu-ENK主成分(峰8)的MS/MS分析结果如图4A所示,其中丰度较大的为酰胺键断裂后电荷保留于N端形成的b系列碎片离子:b2(221.0),b3(278.0),b4(425.0),b5(538.1),同时还可观察到酰胺键断裂后电荷保留于C端形成的y系列碎片离子:y2(279.1),y3(336.0),y4(393.2),y5(556.1)。综合分析这两个系列碎片离子,再根据系列碎片离子间的质量差可以确定峰8的氨基酸序列为YGGFL,即目标五肽Leu-ENK。
色谱峰7的二级碎片信号如图4B所示,检测到的碎片离子包括a系列碎片离子:a1(136.0),a2(193.0),a4(397.1),b系列碎片离子:b2(221.0),b3(278.0),b4(425.0),以及y系列碎片离子:y2-Leu(166.0),y3-Leu(223.0),y4-Leu(280.0)等,进一步与色谱峰8的碎片离子信号进行比较后,发现两色谱峰对应的b2-b4碎片离子质荷比均相同,而y2-y4碎片离子质荷比均相差113,此为亮氨酸残基的分子量,表明该副产物为目标物C端丢失亮氨基酸残基所形成,其原理与Met-ENK丢失甲硫氨酸残基形成的四肽相同。亮氨酸脑啡肽和甲硫氨酸脑啡肽合成粗品中,均检测到C端丢失1个氨基酸残基而形成的四肽副产物(YGGF),其原因可能是Wang树脂连接手臂末端存在游离的羟基所致。为克服上述问题,可提前使用乙酸酐进行封闭,以降低C端丢失1个氨基酸副产物的生成。

3 结 论
本文以两种内源性脑啡肽为模型对象,采用Fmoc固相多肽合成策略对其进行了合成,通过HPLC-MS/MS对多肽合成粗产物进行了快速分离与结构鉴定,并对主要副产物的形成原因进行了分析。结果表明,主要副产物为两类:一类是敏感氨基酸的氧化产物,另一类是由于树脂封闭不完全所导致的C端残缺肽。对其进行快速分析与结构鉴定,可为优化合成条件,提高固相多肽合成产率提供快捷的指导,同时也为其他含敏感氨基酸的生理活性多肽的高效合成提供了借鉴。
[1] Weinstain R,Savariar E N,Felsen C N,Tsien R Y.J.Am.Chem.Soc.,2014,136(3):874-877.
[2] Wu J C,Zou Y,Li C Y,Sicking W,Piantanida I,Tao Y,Schmuck C.J.Am.Chem.Soc.,2012,134(4):1958-1961.
[3] Dai N,Guo J,Teo Y N,Kool E T.Angew.Chem.Int.Ed.,2011,50(22):5105-5109.
[4] Wang W Z,Wei Z W,Zhang D,Ma H L,Wang Z H,Bu X L,Li M L,Geng L L,Lausted C,Hood L,Fang Q J,Wang H,Hu Z Y.Anal.Chem.,2014,86(23):11854-11859.
[5] Rodriguez P L,Harada T,Christian D A,Pantano D A,Tsai R K,Discher D E.Science,2013,339(6122):971-975.
[6] Pan L,He Q,Liu J,Chen Y,Ma M,Zhang L L,Shi J L.J.Am.Chem.Soc.,2012,134(13):5722-5725.
[7] Fletcher J M,Harniman R L,Barnes F R H,Boyle A L,Collins A,Mantell J,Sharp T H,Antognozzi M,Booth P J,Linden N,Miles M J,Sessions R B,Verkade P,Woolfson D N.Science,2013,340(6132):595-599.
[8] Rufo C M,Moroz Y S,Moroz O V,Stohr J,Smith T A,Hu X Z,DeGrado W F,Korendovych I V.Nat.Chem.,2014,6(4):303-309.
[9] Merrifield R B.J.Am.Chem.Soc.,1963,85(14):2149-2154.
[10] Lerner R A.Science,2006,313(5783):57.
[11] Gross J H.MassSpectrometry.2nd ed.Springer,2011.
[12] Wang M,Wang H B,Yang J H,Liu Z M,Liu X G,Lu F P.J.Instrum.Anal.(王淼,王洪彬,杨霁菡,刘子铭,刘晓光,路福平.分析测试学报),2015,34(9):1050-1054.
[13] Li J X,Zhao J Q,Yin X F,Sun C J,Chen J H,Zheng L,Wang X R.J.Instrum.Anal.(李景喜,赵金泉,尹晓斐,孙承君,陈军辉,郑立,王小如.分析测试学报),2016,35(6):668-673.
[14] Walker J M,Berntson G G,Sandman C A,Coy D H,Schally A V,Kastin A J.Science,1977,196(4285):85-87.
[15] Wybran J,Appelboom T,Famaey J P,Govaerts A.J.Immunol.,1979,123(3):1068-1070.
[16] Nieto M M,Guen S L,Kieffer B L,Roques B P,Noble F.Neuroscience,2005,135(2):305-313.
[17] Yang D J,Lee K S,Ko C M,Moh S H,Song J,Hur L C,Cheon Y W,Yang S H,Choi Y H,Kim K W.Peptides,2016,76:57-64.
[18] Srisuchart B,Fuchs B A,Sikorski E E,Munson A E,Loveless S E.Int.J.Immunopharmacol.,1989,11(5):487-500.
[19] Kaiser E,Colescot R L,Bossinge C D,Cook P I.Anal.Biochem.,1970,34(2):595-598.
[20] Chan W C,White P D.FmocSolidPhasePeptideSynthesis.Oxford University Press,2000.
Separation and Characterization of Solid Phase Synthesized Enkephalins by LC-MS/MS
NAO Gan1,2,JIN Yu-long1,2*,HUANG Yan-yan1,2,ZHAO Rui1,2*
(1.CAS Key Laboratory of Analytical Chemistry for Living Biosystems,Institute of Chemistry,Chinese Academy of Sciences,Beijing 100190,China;2.University of Chinese Academy of Sciences,Beijing 100049,China)
Peptides play an important role in life process.In this paper,two endogenous neuropeptides including methionine enkephalin and leucine enkephalin were selected as research targets.They were synthesized by Fmoc solid phase peptide synthesis strategy.An HPLC-ESI-MS/MS method was established to investigate the composition of synthetic peptides.The possible structure modifications during peptide synthesis procedures were also identified.The results showed that the main byproducts were incomplete peptides and oxidative peptides.Solutions for high efficient synthesis of methionine enkephalin and leucine encephalin were further proposed.This study provides new perspectives in rapid peptide structure identification and efficient bioactive peptide synthesis.
solid phase peptide synthesis;methionine enkephalin;leucine enkephalin;oxidation;high performance liquid chromatography tandem mass spectrometry(LC-MS/MS)
2016-09-26;
2016-10-20
国家自然科学基金资助项目(21375134,21475140)
10.3969/j.issn.1004-4957.2017.02.006
O657.63;TQ936.16
A
1004-4957(2017)02-0190-06
*通讯作者:赵 睿,博士,研究员,研究方向:肽识别与选择性分离分析,Tel:010-62557910,E-mail:zhaorui@iccas.ac.cn 金钰龙,博士,助理研究员,研究方向:肽识别与选择性分离分析,Tel:010-62557910,E-mail:jinyulong@iccas.ac.cn

