敞开式质谱成像方法的组织样品稳定性研究
罗志刚,何菁菁,3,贺玖明,再帕尔·阿不力孜,2*
(1.中国医学科学院/北京协和医学院药物研究所,天然药物活性物质与功能国家重点实验室,北京 100050;2.中央民族大学 生物成像与系统生物学研究中心,北京 100081;3.教育部高等教育教学评估中心,北京 100081)
敞开式质谱成像方法的组织样品稳定性研究
罗志刚1,何菁菁1,3,贺玖明1,再帕尔·阿不力孜1,2*
(1.中国医学科学院/北京协和医学院药物研究所,天然药物活性物质与功能国家重点实验室,北京 100050;2.中央民族大学 生物成像与系统生物学研究中心,北京 100081;3.教育部高等教育教学评估中心,北京 100081)
以添加镇静催眠候选新药N6-羟苄腺嘌呤核苷[N6-(4-hydroxybenzyl)adenine riboside,NHBA]的组织匀浆切片作为考察对象,对空气动力辅助离子化质谱成像系统(Air Flow Assisted Ionization Mass Spectrometry Imaging,AFAI-MSI)的关键参数进行考察与优化,以保证最佳条件进行样品检测。在此基础上,对预处理的整体大鼠组织切片进行平行的连续两次质谱成像分析,考察了其内源性代谢物在成像分析过程中是否发生变化。通过对采集数据中关键质谱峰的筛选等处理步骤,并采用可视化的主成分分析(PCA)方法,开展了组织样品内源性代谢物的稳定性分析,最终验证了采用该样品前处理和质谱成像方法,能够保证组织切片样品中内源性代谢物的稳定性,为质谱成像分析结果提供了可靠依据。
空气动力辅助离子化(AFAI);敞开式质谱成像(AMSI);样品稳定性;药物;内源性代谢物
在新药研发过程中,获得药物在体内的靶向分布及原位信息对于了解药物的吸收、分布、代谢和排泄情况,进行药效及毒理学的评价、药代动力学研究等均有着非常重要的意义[1]。质谱成像(Mass spectrometry imaging,MSI)技术是结合了质谱分析和影像可视化方法的分子成像技术,无需标记即可实现不同分子或多种分子、高灵敏度的同时检测,并能够直接提供目标化合物的空间分布和分子结构信息,已成为药物及体内分子原位可视化分析的强有力工具,并广泛应用于生物医药领域的研究[2-5]。另外,敞开式质谱离子化技术(Ambient mass spectrometry,AMS)的发展,为原位可视化的表面分析提供了一种新的手段,已成功地应用于药物分子[6-7]、天然产物[8]、指纹印章[9-10]等成像分析。本课题组自主开发的空气动力辅助离子化质谱成像(AFAI-MSI)技术[2,7,11-14],凸显了敞开式质谱成像技术的优势,该技术更适合于整体动物体内分子的质谱成像分析,其主要特点为无需复杂样品前处理、操作空间灵活且最大程度保持被测样品的原位信息[15]。然而,对整体大鼠切片等大体积组织样本的成像分析通常需耗时7~8 h,由于组织样品在室温和空气中暴露时间长,则在此过程中,组织中药物或内源性代谢物的稳定性能否保证,成为敞开式质谱成像技术需要关注的关键问题。
针对上述问题,本研究在优化并保证AFAI-MSI系统稳定的基础上,对质谱成像过程整体大鼠组织切片中内源性代谢物的稳定性进行了分析。通过对预处理的整体大鼠组织切片进行平行的连续两次质谱成像对比,以前后两次质谱成像内源性代谢物分子轮廓的比较为依据,结合对采集数据中关键质谱峰的筛选等处理,并采用可视化的主成分分析(PCA)方法,开展了组织样品及其内源性代谢物的稳定性分析。结果表明,该样品前处理及质谱成像方法能够保证组织切片中内源性物质的稳定性。
1 实验部分
1.1 主要仪器与材料
自主开发的AFAI-MSI系统:分别与QTRAP 5500型质谱仪和Qstar-Elite 型Q-TOF 串联质谱仪(AB SCIEX,美国)相兼容的AFAI离子源接口;离子传输管(Length 500 mm,OD 4 mm,ID 3 mm);气体流量计(0~45 L·min-1,LZB-10WB,天津流量仪表有限公司);高压电源(-10 000~10 000 V,东文高压电源(天津)股份有限公司);三维电控平移台(MTS225,北京光学仪器厂);SC100步进电机控制器(北京北光世纪仪器有限公司)。
Longer Pump注射泵(LSP01-2A,保定兰格恒流泵有限公司);莱卡冷冻切片机(莱卡CM 3600,德国)。Microtech扫描仪(MRS-2400A48U,上海中晶科技有限公司)。
甲醇、乙腈(色谱纯,Merck 公司,Darmstadt,Germany);甲酸(色谱纯,Dikma Technologies INC,CA,USA);实验用水为娃哈哈纯净水(杭州娃哈哈集团有限公司)。生理盐水(吉林科伦康乃尔制药有限公司);干冰(北京龙洁斯经贸有限公司)。镇静催眠候选新药N6-羟苄腺嘌呤核苷[N6-(4-hydroxybenzyl) adenine riboside,NHBA]由药物研究所石建功教授课题组提供。
实验动物:健康雄性Wistar大鼠3只,体重(140~160) g,购于中国医学科学院医学实验动物研究所,许可证号:SCXK(京)2009-0007。
1.2 整体动物组织切片及添加均一浓度NHBA的组织匀浆切片的制备
将3只Wistar雄性大鼠分别称重,均作为空白实验动物,腹腔注射含吐温80体积比为1∶100的生理盐水溶液。20 min后将实验动物采用CO2处死。将一只空白大鼠的皮毛用水沾湿后,右侧卧固定置于模具中,倒入冷冻液,于-80 ℃冰箱中迅速冷冻,使大鼠及冷冻液凝结成一个整体固体后移入莱卡CM3600冷冻切片机中放置,先用粗切刀将包埋的大鼠切至主要脏器组织均出现在一个层面上后,改用精细切割刀具,再根据切片厚度要求切割3次。制作切片时,先将转粘胶带压贴于待切割的模块上,使其与模块紧密接触,设定切片厚度参数,在手动模式下缓慢切下切片,然后将胶带上粘有大鼠切片组织的一面向下,平整放置于表面涂有高聚物粘合剂的载玻片上(3 in.×4 in.×1.2 mm),通过滚轴按压使大鼠切片与载玻片表面紧密接触,然后经过强紫外灯的照射后,缓慢去除转粘胶带,完成组织切片的制作。20 μm是切片机能够切出的整体组织切片的最小厚度,但在转粘贴过程中易出现器官组织丢失的问题,60 μm和80 μm厚度的切片在成像过程中,会出现大块组织被喷雾气剥离进入离子传输通道,进而堵塞质谱仪锥孔的问题,经过优化选定制作40 μm厚度的切片,将其用于内源性代谢物的稳定性考察。摘取出另外2只空白大鼠的脑组织,用生理盐水清洗后,部分脑组织用于空白组织切片的制备,余下部分加入等体积的4 ℃生理盐水后,于冰浴中对组织进行匀浆。然后在组织匀浆中加入配好的4 mg·mL-1的NHBA生理盐水混悬液,涡旋混匀,得到50 pg·mg-1的均一浓度NHBA组织匀浆液,然后将其置于液氮中迅速冷冻。将冷冻好的组织匀浆块放入用3.5%的羧甲基纤维素钠水溶液配制的冷冻液中,于-80 ℃迅速冷冻,采用上述相同步骤切割出40 μm厚度的冷冻匀浆切片,用于AFAI-MSI系统参数的优化。
1.3 AFAI-MSI系统关键参数的优化
1.3.1 考察生物组织中基质对NHBA离子化效率的影响 将等浓度的NHBA生理盐水混悬液分别滴加到空白载玻片和空白组织切片上,在相同的条件下分别对3种切片及其样品所在1 cm×1 cm的区域进行AFAI-MSI分析,获取相应的像图,并对像图中NHBA的平均离子强度进行比较。关键参数优化实验采用与QTRAP 5500型质谱仪相兼容的AFAI-MSI系统。
1.3.2 喷雾溶剂种类、流速及喷雾气压力的优化 喷雾溶剂以甲醇、乙腈和水为主要考察对象,制备6种不同配比的混合溶剂(A,B,C,D,E,F)作为电喷雾溶剂,将含均一浓度NHBA的脑组织匀浆切片作为考察对象,采用MRM的扫描模式,对组织中的NHBA特征离子对(m/z374.1→242.0)进行检测,通过比较其在不同喷雾气压力(0.4,0.5,0.6,0.7 MPa)和不同喷雾溶剂流速(5,10,15,20 μL·min-1)条件下,采用不同喷雾溶剂获得的提取离子色谱图(XIC)峰面积的差异,来选择最优溶剂条件。每个检测条件下平行检测3次,取平均值。
1.3.3 电喷雾针与样品表面和离子传输管管口的距离优化 以同样的上述组织切片为考察对象,通过比较电喷雾针与样品表面距离分别为0.4,0.5,0.7,1.0 mm,以及电喷雾针与离子传输管管口距离分别为2,3,5 mm时,获得的特征离子对XIC图上峰面积的差异,来确定最优距离参数。每个检测条件下平行检测3次,取平均值。
1.4 整体大鼠组织切片的预处理
将待测整体大鼠组织切片从-80 ℃低温冰箱取出后,立即置于真空干燥器中,干燥器底部放置硅胶颗粒,真空干燥1 h,使切片温度平衡至室温,并除尽切片表面及组织内部水分,以防止组织中内源性代谢物的进一步生化反应。
1.5 整体大鼠质谱成像数据的采集
整体大鼠质谱成像实验采用与Q-TOF型质谱仪相兼容的AFAI-MSI系统完成。为了考察组织切片中内源性物质在成像过程中的稳定性,在对切片样品进行全程成像扫描后,将此切片的位置恢复至起始点,并以此初始位置为基准,沿X轴向,从初始位置向后移动0.15 mm后作为新的起始点,再次对该切片进行相同条件下的全扫描质谱成像分析。质谱数据的采集,采用正离子全扫描模式,质谱仪参数的设置与NHBA在整体动物体内分布实验的相同[14]。数据分析采用Analyst QS 2.0 数据处理系统。
1.6 可视化的主成分分析用于组织切片样品稳定性的考察
将两次扫描获得的质谱成像原始数据,经过峰筛选、像素点筛选、归一化处理等与NHBA在整体动物体内分布实验相同的处理步骤和可视化的主成分分析(PCA)[14],通过比较连续两次成像扫描所获得的可视化的主成分分析像图的差异,来评价组织样品的稳定性。
2 结果与讨论
2.1 生物组织基质对NHBA离子化效率的影响
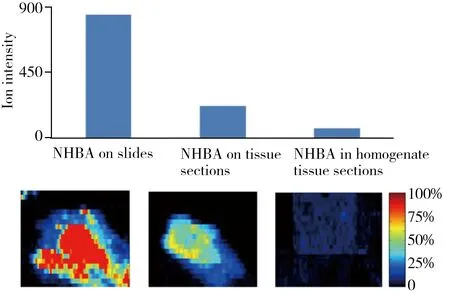
图1 空白载玻片表面喷涂NHBA、空白组织切片表面喷涂NHBA及均匀添加NHBA组织切片的AFAI-MSI像图及其平均离子强度比较,NHBA采用MRM扫描模式(m/z 374.1→242.0)Fig.1 Comparisons of the averaged ion intensity detected in MRM scan mode(m/z 374.1→242.0),among NHBA on slides,on tissue sections and in homogenate tissue sections corresponding MSI images are under the bar graph,respectively
生物组织的成分复杂,对被测物的离子化会产生抑制或竞争的基质效应,对于实际给药组织切片的AFAI-MSI分析,由于被测药物分子需在喷雾溶剂作用下从组织中解析出来,进而实现离子化,因此受基质效应影响存在一定的离子信号抑制。如图1所示,同等浓度的被测药物(NHBA)滴加在空白载玻片和空白组织切片上,以及含等浓度NHBA的组织匀浆切片,在相同条件下对其进行成像分析,所获得的离子强度在空白载玻片中最高,而在组织匀浆添加药物制得的切片中最低。因此,在考察组织切片样品稳定性之前,需针对添加药物的组织匀浆切片,在最接近给药动物组织切片的真实情况下,对AFAI-MSI方法的系统参数进行优化。
2.2 喷雾溶剂种类、流速及喷雾气压力的优化结果
喷雾溶剂的选择对于从组织切片中解析出药物分子,并实现最优的离子化效果很关键。一般,非极性溶剂不利于被测物的解析或离子化,而极性溶剂还需要有一定的挥发性和对组织样品的萃取能力,因此,以组织匀浆切片为检测对象,以AFAI-MSI分析中对NHBA检测具有较高离子化效率的溶剂(甲醇、乙腈和水),通过不同配比获得的混合溶剂作为喷雾溶剂,考察了6种条件下的离子化效果。结果如图2所示,发现在C溶剂体系:CH3OH∶H2O(80∶20)+0.1%FA下,可获得最佳的离子化效果。每个溶剂条件下进行3次平行测试,检测组织切片的不同部分,结果显示,NHBA的离子化效率相近,这在一定程度上也表明组织匀浆切片中NHBA浓度的均一性和AFAI-MSI成像系统的稳定。

图2 不同溶剂系统条件下采用MRM扫描模式获得的NHBA(m/z 374.2→242.0)XIC峰面积比较Fig.2 Comparisons of the XIC peak area of NHBA detected in MRM mode(m/z 374.2→242.0),among different spray solvent optimizing conditions three parallel experiments were done under each condition and the averaged value was used for comparison
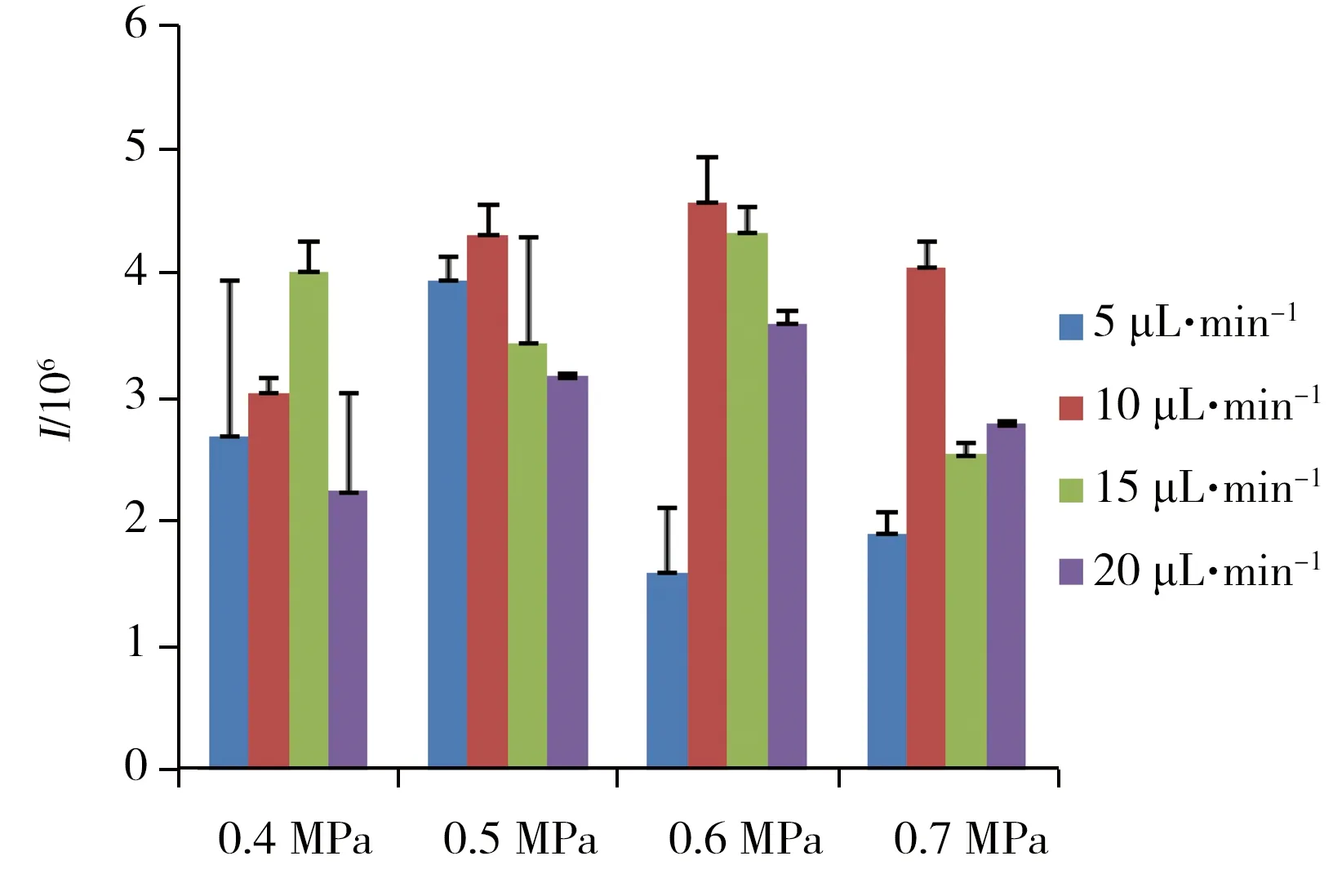
图3 不同溶剂流速与不同喷雾气压条件下,采用MRM扫描模式获得的NHBA(m/z 374.2→242.0)XIC峰面积比较Fig.3 Comparisons of the XIC peak area of NHBA detected in MRM mode(m/z 374.2→242.0),under different spray solvent rate and different spray solvent pressure three parallel experiments were done under each condition and the averaged value was used for comparison

图4 电喷雾针与样品不同表面距离,以及与不同离子传输管口距离条件下,采用MRM扫描模式获得的NHBA(m/z 374.2→242.0)XIC峰面积比较Fig.4 Comparisons of the XIC peak areas of NHBA detected in MRM mode(m/z 374.2→242.0) at different distances between sprayer tip and sample surface and between sprayer tip and inlet of transport tube three parallel experiments were done under each condition and the averaged value was used for comparison
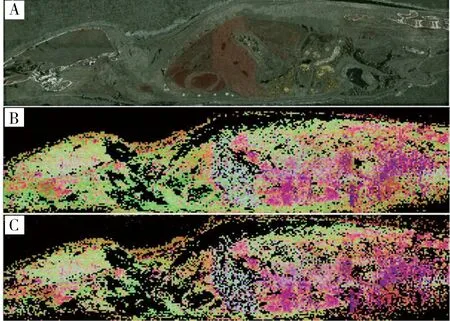
图5 全扫描模式下连续两次整体大鼠组织切片AFAI-MSI平行实验的光学像图(A)与光学像图对应的可视化PCA得分图,真空脱水后立即进行AFAI-MSI实验的可视化PCA得分图(B),在AFAI-MSI实验条件下暴露7小时后连续进行AFAI-MSI实验的可视化PCA得分图(C)Fig.5 Optical images and visualized PCA results of MSI data acquired by AFAI-MSI method in full-scan mode comparing twice parallel MSI experiments throughout one tissue section of rat (A) ,visualized PCA result of MSI data immediately obtained after dehydration(B),visualized PCA result of MSI data obtained after 7 h exposure under MSI experimental conditions for the visualized PCA result(C)the PCA score value for each pixel on each of first three components determines the intensity for red,green and blue(RGB),respectively(对于可视化PCA得分图,每个像素点都由红、绿、蓝三色的强度代表PC1、PC2、PC3的得分)
在此基础上,进一步比较了不同喷雾气压力条件下,喷雾溶剂流速对获得NHBA离子信号强度的影响(见图3)。结果表明,在喷雾溶剂流速为10 μL·min-1,喷雾气压力为0.6 MPa时,NHBA的离子化效果最佳。
2.3 电喷雾针与样品表面和离子传输管管口的最佳距离
AFAI-MSI成像系统的电喷雾针与组织样品及离子传输管的空间距离是影响被测物解析及其离子信号强度的关键参数。针对二者不同距离条件下,考察了药物NHBA分子离子强度,获得的结果如图4所示。结果表明,电喷雾针与样品表面距离为0.7 mm,以及电喷雾针与离子传输管管口距离为3 mm时,获得NHBA的离子化效果最佳。
2.4 组织切片样品中内源性代谢物的稳定性考察
在质谱成像过程中,需要关注生物组织中内源性物质的种类和含量在数据采集过程中是否发生变化,以确保获得的内源性代谢物变化与样品本身或成像过程无关。本研究以组织切片样品中内源性代谢物的分子轮廓为考察对象,通过比较连续两次质谱成像实验的可视化统计结果,考察了组织切片样品的稳定性。
根据被测物的性质,选用正离子检测的全扫描数据采集方式,以保障考察的药物及相关内源性物质能够被检测到,同时又能保证相对于负离子模式,能有更多种类和数量的内源性物质被检出。然而在获得大量离子峰的同时,也采集了很多与内源性物质无关的离子峰数据,因此需对观察到的离子峰进行筛选。本研究建立了可以保留完整分子轮廓及空间分布信息的数据降维方法,通过筛选主要内源性代谢物的质谱峰作为研究对象,排除无关离子峰的干扰,同时挖掘离子强度低的内源性代谢物信息,提高了各像素点下分子轮廓信息的可比性。
采用主成分分析(PCA)方法对来自于整体大鼠切片每个像素点的分子轮廓(降维处理后的数据阵)进行聚类运算。经计算获得每个像素点的PCA得分反映了该像素点的分子轮廓信息,分别用不同强度的红色、绿色及蓝色表示每个像素点的前3个主成分得分值(PC1,PC2,PC3)。由于具有相似分子轮廓信息的像素点应显示相似的颜色,则发生明显变化的内源性代谢物的分子轮廓会展现出显著的颜色差别[16]。
内源性代谢物在适宜的生化反应条件下会迅速发生变化,因此质谱成像实验之前的脱水处理非常必要[17]。一张整体大鼠切片的质谱成像实验需耗时7~8 h,需考察在此过程中喷雾溶剂、光照等实验条件是否会引起内源性代谢物分子轮廓的变化。由于本实验设定的AFAI-MSI成像的空间分辨率为200~300 μm,而成像实验的行间距离设定为500 μm,则在同一切片上每两个扫描行之间仍存留200~300 μm的未被剥蚀和扫描的完整组织[18],而这些组织恰好是在相同条件下被放置了相同时间,因此,选择这部分组织,对其在相同条件下再进行一次AFAI-MSI扫描实验,通过比较两次成像结果中分子轮廓的可视化PCA得分图,来判断大鼠组织切片中内源性代谢物在成像实验条件及扫描全程中是否稳定。结果如图5所示,图5A是组织切片的光学扫描图片,图5B和5C分别是对第一次和第二次质谱成像扫描获得的数据进行PCA分析获得的可视化得分图,从图中可见两次扫描结果的可视化PCA得分图颜色基本一致,提示两次扫描获得像图上对应像素点的分子轮廓基本一致。该结果表明在成像扫描过程中,大鼠切片的分子轮廓未发生变化,则所关注的内源性代谢物稳定。
3 结 论
本研究在对生物组织基质影响NHBA离子化效率考察的基础上,为了使AFAI-MSI成像系统能够获得更稳定、准确的质谱成像数据,以组织匀浆添加药物制得的切片为对象,考察了影响NHBA解析及离子化的关键参数。进一步采用AFAI-MSI成像系统,并结合可视化的主成分分析(PCA)方法,进行了大鼠组织切片中内源性代谢物的稳定性考察。研究结果表明,采用该样品前处理和质谱成像方法,能够保证组织切片样品中内源性物质的稳定性,从而为敞开式质谱成像技术的广泛应用提供了数据支持。
[1] Willmann J K,Van Bruggen N,Dinkelborg L M,Gambhir S S.Nat.Rev.DrugDiscovery,2008,7(7):591-607.
[2] Luo Z G,He J M,Liu Y Y,Li T G,He J J,Zhang S C,Zhang X R.Sci.Chin.Chem.B(罗志刚,贺玖明,刘月英,李铁钢,何菁菁,张四纯,张新荣.中国科学:化学),2014,44(5):795-800.
[3] Watrous J D,Dorrestein P C.Nat.Rev.Microbiol.,2011,9(9):683-694.
[4] Cornett D S,Reyzer M L,Chaurand P,Caprioli R M.Nat.Methods,2007,4(10):828-833.
[5] Vickerman J C.Analyst,2011,136(11):2199-2217.
[6] Wiseman J M,Ifa D R,Zhu Y,Kissinger C B,Manicke N E,Kissinger P T,Cooks R G.Proc.Natl.Acad.Sci.USA,2008,105(47):18120-18125.
[7] Luo Z G,He J M,Chen Y,He J J,Gong T,Tang F,Wang X H,Zhang R P,Huang L,Zhang L F,Lv H N,Ma S G,Fu Z D,Chen X G,Yu S S,Abliz Z.Anal.Chem.,2013,85(5):2977-2982.
[8] Esquenazi E,Dorrestein P C,Gerwick W H.Proc.Natl.Acad.Sci.USA,2009,106(18):7269-7270.
[9] Ifa D R,Manicke N E,Dill A L,Cooks R G.Science,2008,321(5890):805.
[10] Liu Y Y,Ma X X,Lin Z Q,He M J,Han G J,Yang C D,Xing Z,Zhang S C,Zhang X R.Angew.Chem.Int.Ed.,2010,49(26):4435-4437.
[11] Luo Z G,He J J,He J M,Ma S G,Yu S S,Abliz Z.J.Instrum.Anal.(罗志刚,何菁菁,贺玖明,马双刚,庾石山,再帕尔·阿不力孜.分析测试学报),2012,31(7):757-762.
[12] Li T G,He J M,Mao X X,Bi Y,Luo Z G,Guo C A,Tang F,Xu X,Wang X H,Wang M R,Chen J,Abliz Z.Sci.Rep.,2015,5:14089.
[13] He J M,Tang F,Luo Z G,Chen Y,Xu J,Zhang R P,Wang X H,Abliz Z.RapidCommun.MassSpectrom.,2011,25(7):843-850.
[14] He J J,Luo Z G,Huang L,He J M,Chen Y,Rong X F,Jia S B,Tang F,Wang X H,Zhang R P,Zhang J J,Shi J G,Abliz Z.Anal.Chem.,2015,87(10):5372-5379.
[15] Kertesz V,Van Berkel G J,Vavrek M,Koeplinger K A,Schneider B B,Covey T R.Anal.Chem.,2008,80(13):5168-5177.
[16] Fonville J M,Carter C L,Pizarro L,Steven R T,Palmer A D,Griffiths R L,Lalor P F,Lindon J C,Nicholson J K,Holmes E,Bunch J.Anal.Chem.,2013,85(3):1415-1423.
[17] Sugiura Y,Zaima N,Setou M,Ito S,Yao I.Anal.Bioanal.Chem.,2012,403(7):1851-1861.
[18] Janfelt C,Wellner N,Hansen H S,Hansen S H.J.MassSpectrom.,2013,48(3):361-366.
Investigation on Tissue Sample Stability by Ambient Mass Spectrometry Imaging Method
LUO Zhi-gang1,HE Jing-jing1,3,HE Jiu-ming1,ABLIZ Zeper1,2*
(1.State Key Laboratory of Bioactive Substance and Function of Natural Medicines,Institute of Materia Medica,Chinese Academy of Medical Sciences and Peking Union Medical College,Beijing 100050,China;2.Centre for Bioimaging & Systems Biology,Minzu University of China,Beijing 100081,China;3.Higher Education Evaluation Center,Ministry of Education,Beijing 100081,China)
Key parameters of air flow assisted ionization mass spectrometry imaging(AFAI-MSI) system were investigated and optimized by using tissue sections adding homogeneous NHBA as the target samples.The parameters,including those related with spray solvent,spray gas,as well as geometric setting of AFAI system were optimized.Based on the optimization,stability of endogenous metabolites from the tissue section was also taken into consideration during the AFAI-MSI experiment.It usually takes 7-8 h for a complete MSI experiment for a whole-body tissue section,and the stability of endogenous metabolites needs to be investigated during such a long process.Therefore,a whole-body tissue section was imaged twice consecutively,and then the data of resulted images were compared using visualized component principle analysis(PCA) after selecting main mass spectra peaks.By visualized comparing of the result,the similarity of the visualized PCA score plot demonstrated the endogenous metabolites were stable during MSI experiment.In conclusion,the optimized parameters guaranteed the stability and sensitivity of AFAI-MSI experiment.Additionally,after proper sample pretreatment,the endogenous metabolites in tissue sections were able to remain stable during the AFAI-MSI experiment,which ensured the reliability for research of the variability of endogenous metabolites.Thus the AFAI-MSI method is promising to be applied in the study of drug development.
airflow assisted ionization(AFAI);ambient mass spectrometry imaging(AMSI);sample stability;medicines;endogenous metabolites
2016-10-06;
2016-11-16
国家重大科学仪器设备开发专项资助(2011YQ170067)
10.3969/j.issn.1004-4957.2017.02.004
O657.63;Q493.2
A
1004-4957(2017)02-0178-06
*通讯作者:再帕尔·阿不力孜,博士,研究员,研究方向:质谱新技术及其新应用途径新方法的开发研究,Tel:010-63165218,E-mail:zeper@imm.ac.cn

