神经营养因子3-壳聚糖载体对大鼠运动皮层损伤后内源性神经发生和运动功能的效果
杨飞祥,张皑峰,郝鹏,尚俊奎,段红梅,杨朝阳,3,李晓光,3
·基础研究·
神经营养因子3-壳聚糖载体对大鼠运动皮层损伤后内源性神经发生和运动功能的效果
杨飞祥1,张皑峰2,郝鹏1,尚俊奎1,段红梅1,杨朝阳1,3,李晓光1,3
目的观察神经营养因子3(NT3)-壳聚糖载体对大鼠运动皮层损伤后的前肢行为学功能恢复的效果,并检测其对损伤区及侧脑室下区神经干细胞(NSCs)的增殖和分化的影响。方法65只Wistar大鼠分为正常对照组(n=7)、单纯损伤组(n=29)和NT3-壳聚糖组(n=29)。制作大鼠运动皮层吸除损伤性脑损伤模型。NT3-壳聚糖组于手术后立即植入NT3-壳聚糖载体,单纯损伤组不给予任何治疗措施。分别于术后3 d、7 d、14 d、1个月、2个月和3个月,应用食物球抓取实验观察大鼠前肢功能恢复情况,应用HE染色观察损伤区的空腔体积,应用免疫荧光染色评价NSCs的增殖和分化。结果NT3-壳聚糖组右侧前肢抓取成功率高于单纯损伤组右侧(F>6.00,P≤0.05)。NT3-壳聚糖组空腔体积均显著小于单纯损伤组(F>629.5,P<0.001)。在NSCs分化实验中,NT3-壳聚糖组各时间点损伤区BrdU细胞数均显著高于单纯损伤组(F>171.43,P<0.001)。在NSCs增殖实验中,NT3-壳聚糖组BrdU阳性细胞数显著高于正常对照组和单纯损伤组(F>155.06,P<0.001),术后7 d损伤同侧Dcx阳性细胞数显著高于单纯损伤组(F=62.367,P<0.001),BrdU/Dcx双阳性细胞数显著高于正常对照组(F=33.527,P<0.001)。结论NT3-壳聚糖载体可增加脑损伤所致的侧脑室下区NSCs的增殖,促进损伤区新生神经元的发生以及大鼠前肢运动功能恢复。
创伤性脑损伤;神经营养因子3;壳聚糖;内源性神经发生;运动功能;大鼠
[本文著录格式]杨飞祥,张皑峰,郝鹏,等.神经营养因子3-壳聚糖载体对大鼠运动皮层损伤后内源性神经发生和运动功能的效果[J].中国康复理论与实践,2017,23(2):155-161.
CITED AS:Yang FX,Zhang AF,Hao P,et al.Effect of neurotrophin 3-chitosan on endogenous neurogenesis and motor function after motor cortex injury in rats[J].Zhongguo Kangfu Lilun Yu Shijian,2017,23(2):155-161.
创伤性脑损伤(traumatic brain injury,TBI)是一种常见的外力引起的神经外科疾病,其治疗方法对神经外科医生而言是一个很大的挑战[1]。大脑受到损伤后,由于猛烈的外力撞击,损伤中心和周围脑组织会发生坏死,同时伴有重要生理功能神经元死亡,导致其所调控的运动功能障碍和意识缺失[2]。随着损伤区周围组织和细胞丢失,会引起继发性损伤,如缺血、水肿、兴奋性神经递质释放和炎症反应等[3],而损伤后兴奋性神经递质的释放、炎症因子的浸润和胶质瘢痕的形成等损伤微环境都不利于神经发生。
大脑皮层是一个包含几十种神经元类型的复杂细胞集合区,与大脑的其余区域密切联系,从而对身体形成多样化和精细的调控[4]。研究表明,成年哺乳动物脑内仍然存在持续神经发生的区域,如嗅球(olfactory bulb,OB)和海马齿状回(dentate gyrus,DG)[5]。在脑内的侧脑室下区[6]、海马齿状回下区[7]和脊髓的中央管[8]等也发现神经干细胞(neural stem cell,NSCs),在脑内发挥着重要作用。随着脑内NSCs的发现,增强内源性神经发生为治疗脑损伤提供了新的思路,成为非常有前景的一种治疗方法。
本课题组既往研究表明,神经营养因子3(neurotrophin 3,NT3)-壳聚糖载体可以在生理状态下缓慢释放NT3长达14周[9],并通过激活TrkC受体促进NSCs的增殖,提高神经元分化的比例[10]。最近研究发现,NT3-壳聚糖载体能够激活大鼠完全性脊髓横断后脊髓内源性NSCs,诱导其分化成功能性神经元并与宿主脊髓建立功能性神经环路,最终导致截瘫后功能的恢复,是迄今为止最接近临床应用的治疗脊髓损伤的方法[11]。应用加权关联网络分析方法(Weighted Gene Co-Expression Network Analysis,WGCNA)分析也显示,NT3-壳聚糖载体对增强神经发生、减少炎症反应和促进血管发生方面发挥着重要的作用[12]。
在脑损伤方面,既往研究发现,NT3-壳聚糖载体可以促进海马CA1区损伤后核因子(nuclear factor,NF)阳性细胞和轴突的产生,进而提高大鼠认知功能[13]。海马CA1区以上皮质主要包括联络皮质和一小部分次级感觉运动皮质,目前没有方法检测该皮质损伤后大鼠的运动功能恢复情况,因此制备大鼠运动皮质损伤并观察功能恢复非常重要。
本实验应用自制脑吸除装置制作成年Wistar雌性大鼠运动皮层吸除性脑损伤模型,根据在损伤区是否移植NT3-壳聚糖载体,分为单纯损伤组和NT3-壳聚糖组,同时设有正常对照组。免疫荧光染色观察损伤区和侧脑室下区NSCs的增殖和分化以研究内源性神经发生,食物抓取行为学实验评估大鼠前肢功能恢复情况。
1 材料与方法
1.1 动物和分组
65只成年Wistar大鼠,雌性,体质量220 g,SPF级,首都医科大学实验动物部提供,许可证号SYXK (京)2013-0004。所有动物分为正常对照组(n=7)、单纯损伤组(n=29)和NT3-壳聚糖组(n=29)。
所有动物实验均经伦理委员会审批,并按照首都医科大学实验动物中心和北京实验动物协会的标准执行。
1.2 模型制备
采用自制的脑吸除装置制备成年大鼠吸除性脑运动皮层损伤模型。6%水合氯醛6 ml/kg腹腔注射麻醉,大鼠俯卧位固定于脑立体定位仪上,备皮后沿中线切开皮肤及皮下组织,暴露颅骨,确定前囟位置并标记。以前囟-0.5~+1.5 mm,左旁开1~3 mm为标记,用牙科钻钻开一个2×2 mm大小的骨窗,注意不要损伤硬脑膜。手术显微镜下切开硬脑膜,应用自制的脑吸除装置吸除左侧运动皮层,吸除深度1 mm,吸除脑组织体积为2×2×1 mm。
NT3-壳聚糖组于手术后立即植入NT3-壳聚糖载体,单纯损伤组不给予任何治疗措施。术后缝合皮肤,碘伏消毒伤口,于温暖环境中待大鼠苏醒,给予食水。术后第1天腹腔注射青霉素10万U/次,每天1次,连续注射7 d。
1.3 内源性NSCs标记
单纯损伤组和NT3-壳聚糖组取各取9只大鼠分别于3 d、7 d和14 d取材3只,正常对照组取3只于7 d取材,取材前7 d开始腹腔注射5-溴脱氧尿嘧啶(5-bromo-2ʹ-deoxyuridine,BrdU)100 mg/kg,每天注射1次,连续注射7 d,来观察NSCs增殖情况。
单纯损伤组和NT3-壳聚糖组各取20只大鼠术后立即开始腹腔注射BrdU 100 mg/kg,每天注射1次,连续注射7 d,分别于7 d、14 d、1个月、2个月各取材3只,来观察NSCs分化情况。剩余大鼠备用。
1.4 动物灌流和组织标本处理
6%水合氯醛6 ml/kg腹腔注射麻醉,生理盐水冲洗血管,4%多聚甲醛灌流固定,小心取出脑组织,置于4%多聚甲醛于4℃冰箱固定过夜。30%蔗糖脱水1周。取出脱水后的大脑,可以看到皮层损伤区,应用大鼠脑模具对大脑修块,取以损伤区为中心,前后各1 mm大脑组织块,冰冻切片机连续切片,切片厚度30 μm,均匀分成六套,每套10个切片,-20℃冰箱保存。
1.5 HE染色
取出一套冰冻切片,室温复温0.5 h;蒸馏水摇床浸润2 min,共2次;苏木素10 min,蒸馏水清洗;1%盐酸酒精分化15 s,自来水返蓝8 min,蒸馏水清洗;伊红1 min,蒸馏水清洗;75%乙醇2 min,80%乙醇2 min,90%乙醇2 min,95%乙醇2 min,100%乙醇2 min,共2次;二甲苯Ⅰ2 min,二甲苯Ⅱ2 min;中性树胶封片,通风橱晾干,显微镜观察摄片,Image-Pro Plus 6.0软件分别于7 d、1个月、3个月测量损伤区空腔体积。
1.6 免疫荧光染色和试剂
选取各组术后3 d、7 d、14 d、1个月和2个月时间点的一套脑组织切片,一抗4℃孵育60 h,二抗常温避光孵育8 h,加入4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI,1∶3000),室温继续孵育5 min,50%甘油磷酸缓冲液(phosphate buffer, PB)封片,荧光显微镜下观察。Image-Pro Plus 6.0软件照相并计数。
小鼠抗BrdU(1∶200):SIGMA公司。兔抗Nestin (1∶100):SIGMA公司。兔抗Tuj-1(1∶500):MILLIPORE公司。兔抗Dcx(1∶200):SIGMA公司。Alexa Fluor 488标记山羊抗小鼠荧光二抗(1∶200)、Alexa Fluor 594标记山羊抗兔荧光二抗(1∶200):INVITROGEN。
1.7 食物球抓取行为学实验
手术前2周各组取4只大鼠进行食物抓取训练,训练开始前1 d禁食,以后定量喂食。将食物球(质量100~125 mg、直径0.2~0.3 mm)放置测试盒(无盖玻璃盒,45×18×38 cm,前端玻璃面中间有1 cm缝)前段的食物架上两个圆孔内,大鼠前肢可以通过中间缝抓取圆孔内的食物球,手动训练大鼠来抓食物球。每天每只大鼠抓取20个食物球后放回笼子,定量喂食(25~30)g/d。一般2周后,大鼠前肢抓取动作熟练,此时,测定4只正常大鼠左前肢和右前肢一次成功抓取20个食物球的成功率,作为基准。然后进行皮层损伤手术,并于3 d、7 d、14 d,1个月、2个月和3个月时间点取单纯损伤组和NT3-壳聚糖组各4只进行行为学评价。
1.8 统计学分析
采用SPSS 16.0软件进行单因素方差分析,所有的数据均以(±s)表示。显著性水平ɑ=0.05。
2 结果
2.1 食物球抓取成功率
正常对照组大鼠两侧前肢的食物抓取成功率为60%,左右侧前肢无明显差异。单纯损伤组右侧前肢术后3 d的抓取成功率小于5%,随着时间延长,抓取成功率逐渐升高,最高达18.75%。术后1个月、2个月和3个月,NT3-壳聚糖组右侧前肢抓取成功率高于单纯损伤组右侧(P≤0.05)。
2.2 空腔体积
术后7 d、1个月、3个月,NT3-壳聚糖组还能看到未降解的NT3-壳聚糖载体,且损伤区内填充有大量的再生脑组织,NT3-壳聚糖组空腔体积均显著小于单纯损伤组(P<0.001)。见图1、表2。
2.3 NSCs分化情况
NT3-壳聚糖组各时间点损伤区BrdU细胞数均显著高于单纯损伤组(P<0.001)。见图2A、2B,表3。为了明确这些增殖细胞的类型,我们进行免疫荧光双标记。术后14 d,NT3-壳聚糖组损伤区内检测到大量Nestin阳性细胞,其中有与BrdU共标记(图2C、2D)。术后1个月,相比单纯损伤组,NT3-壳聚糖组大鼠的损伤区可检测到更多的Tuj1阳性神经元,其中有与BrdU共标记(图2E、2F)。

表1 各组各时间点食物球成功抓取率比较(%)
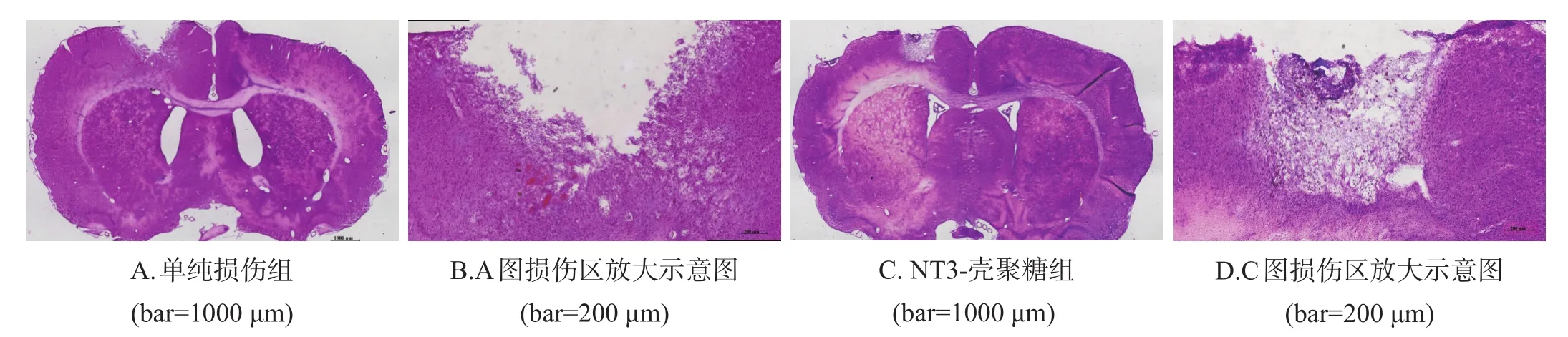
图1 术后7 d单纯损伤组和NT3-壳聚糖组损伤区空腔体积(HE染色)
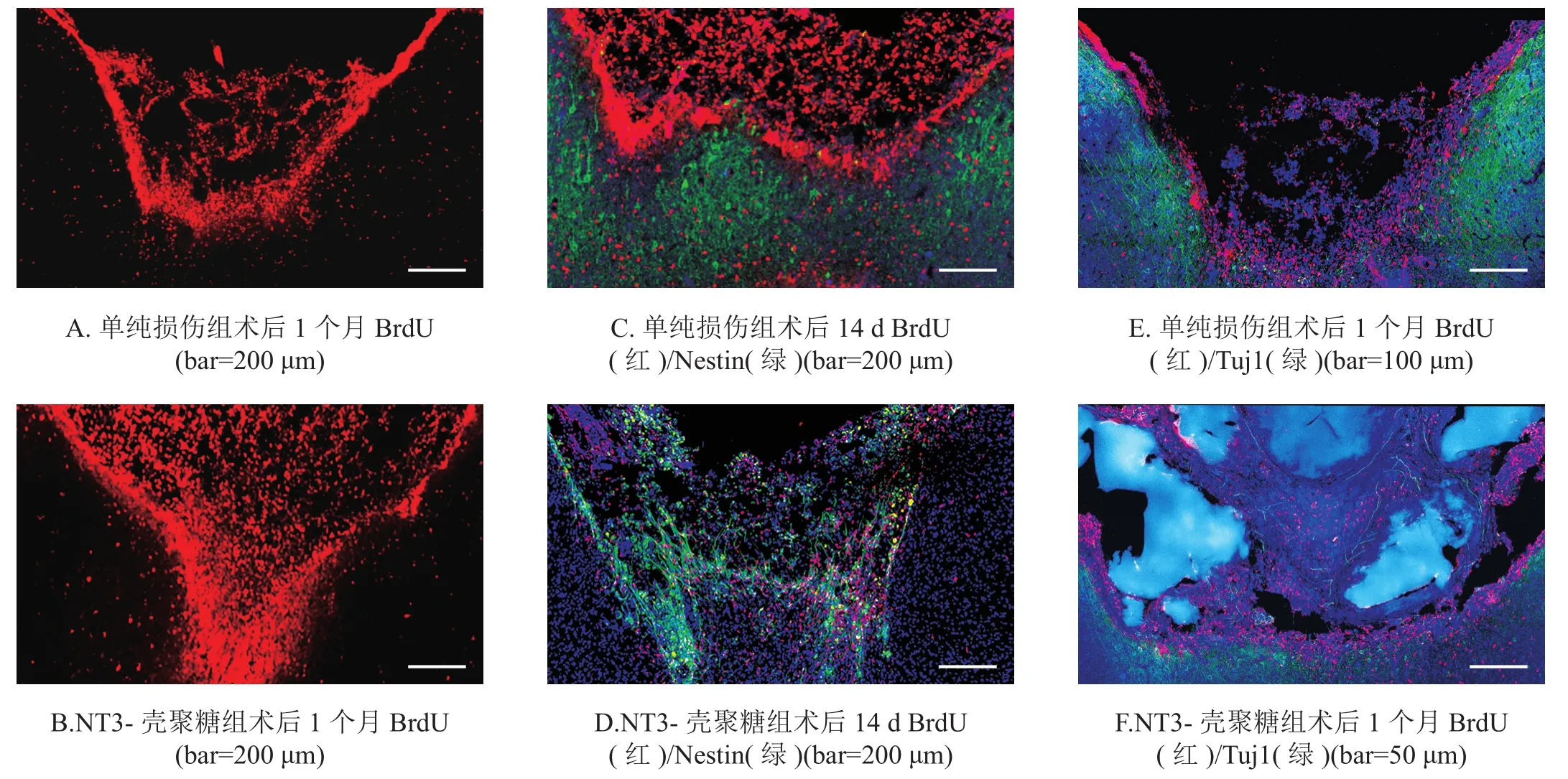
图2 各组大脑切片损伤区免疫荧光染色
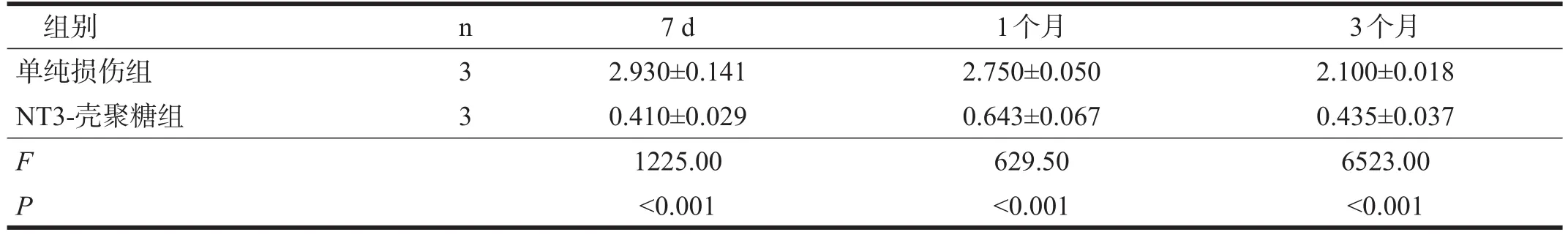
表2 各组各时间点空腔体积比较(mm3)
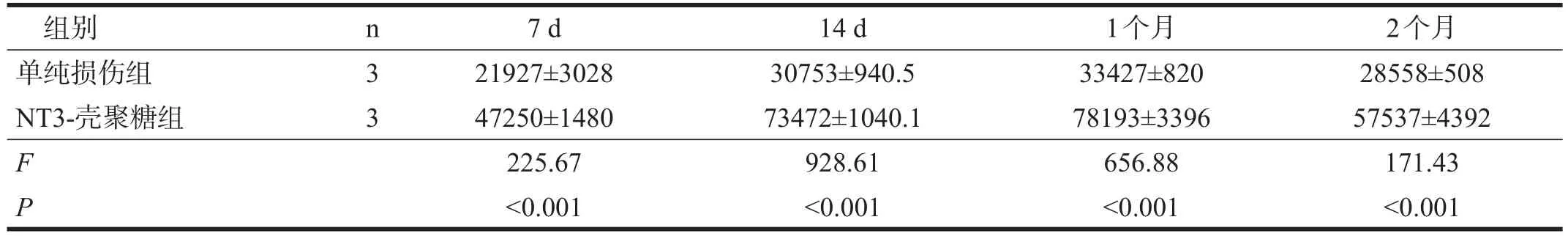
表3 各组各时间点损伤区BrdU细胞数(/mm3)
2.4 NSCs增殖情况
正常对照组BrdU阳性细胞分布比较稀疏。NT3-壳聚糖组BrdU阳性细胞于术后3 d开始增多,术后7 d达到高峰(P<0.001),且显著高于正常对照组和单纯损伤组(P<0.001)。术后14 d仍维持在较高水平(P<0.05)。见表4、图3。
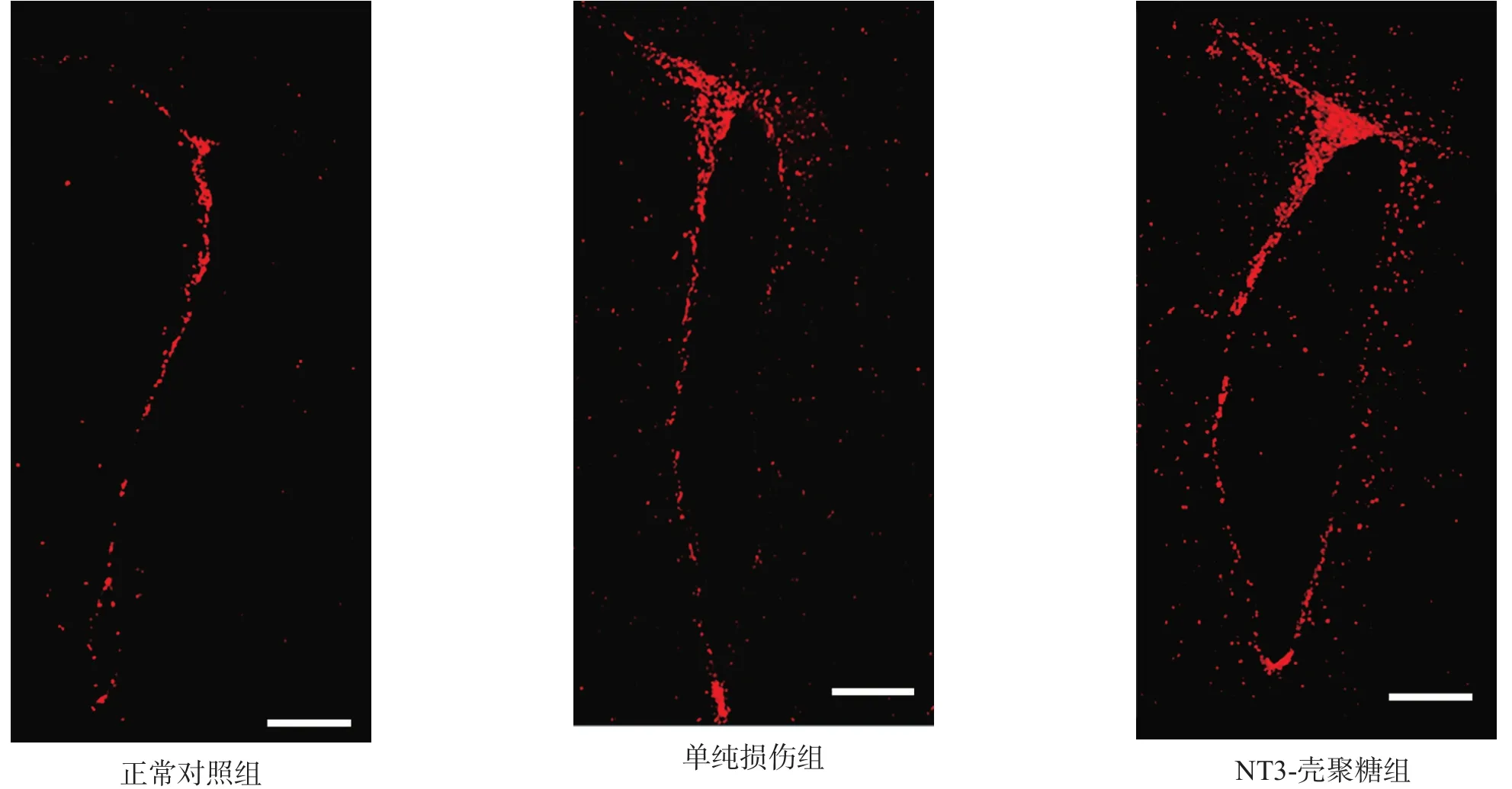
图3 各组术后7 d大脑切片侧脑室下区BrdU免疫荧光染色(bar=200 μm)

图4 各组术后7 d大脑切片侧脑室下区BrdU(红色)/Dcx(绿色)免疫荧光染色(bar=40 μm)
NT3-壳聚糖组术后7 d损伤同侧Dcx阳性细胞(168.250±14.014)/mm3显著高于单纯损伤组(98.345± 7.250)/mm3(F=62.367,P<0.001),且NT3-壳聚糖组BrdU/Dcx双阳性细胞数(104.470±17.084)相比正常对照组(30.840±2.653)显著增加(F=33.527,P<0.001)。见图4。

表4 各组各时间点损伤区BrdU细胞数(/mm3)
3 讨论
目前研究表明,脑内不仅存在NSCs,而且神经发生贯穿整个生命周期[14]。应用组织工程学方法,通过缓慢释放支持再生的神经营养因子,创造有利于自我修复的微环境,进而增强内源性神经发生,成为治疗中枢神经损伤的新策略,这种策略是修复神经损伤最理想的办法。
前期研究证明,NT3-壳聚糖载体可促进脊髓[15]和海马[16]损伤后的神经发生和功能恢复,激活内源性NSCs,促进成熟神经元产生,和宿主形成功能性的神经网络。本研究基于此治疗策略来治疗大脑皮层损伤,发现其能促进大鼠行为学恢复,并增强损伤区和侧脑室下区NSCs的增殖和分化。研究表明,运动皮层损伤会激活侧脑室下区和海马齿状回下区的NSCs增殖,部分激活的NSCs会异位迁移到损伤皮层,但大多分化成胶质细胞,很少向神经元分化[17-18]。在本研究中,将NT3和壳聚糖通过氢键作用连接一起,可实现在生理状态下的长期缓慢释放NT3,长达14周〔可溶性NT3在常温下半衰期是(1.28±0.07)min〕,从而改善损伤区局部恶劣的炎症微环境,一方面减轻继发性损伤所带来的伤害,另一方面能够保护新生的神经组织,继而促进内源性的神经发生[15]。
在食物球抓取行为学试验中,术后损伤对侧前肢抓取成功率明显降低,证明TBI手术成功,运动皮质吸除后可引起大鼠损伤对侧前肢的运动功能障碍。虽然随着术后时间的延长,单纯损伤组大鼠损伤对侧前肢的功能有自发性恢复倾向,但食物抓取成功率并未达正常对照组水平。NT3-壳聚糖组大鼠在术后短时间内前肢的运功功能无明显改善,可能与新生神经元数量较少和新生神经元尚不成熟有关。在2~3个月期间内NT3-壳聚糖组比单纯损伤组成功率高,说明NT3-壳聚糖可以改善运动皮质损伤所致的大鼠前肢运动功能下降。
本研究采用HE染色观察术后NT3-壳聚糖组和单纯损伤组空腔体积的差异。与单纯损伤组相比,NT3-壳聚糖组空腔体积明显减小,并且损伤区内填充有大量的再生脑组织。说明大鼠行为学功能的恢复可能与NT3-壳聚糖减少损伤区空腔体积,并促进脑组织再生有关。为了明确这些增殖细胞的类型,我们进行免疫荧光双标记。术后14 d,NT3-壳聚糖组损伤区内检测到大量Nestin阳性细胞,其中有与BrdU共标记,说明这些细胞是损伤后新生的,NT3-壳聚糖可以激活内源性NSCs,并促进它们向损伤区的迁移。术后1个月,NT3-壳聚糖组大鼠的损伤区可检测到Tuj1阳性神经元,其中有与BrdU共标记,说明迁移至损伤的NSCs可以分化为神经元,NT3-壳聚糖促进TBI后的神经发生。
损伤区内检测到的新生神经元可能来源于前脑神经发生区侧脑室下区的NSCs。因此我们检测损伤后NT3-壳聚糖载体对侧脑室下区NSCs的影响。正常对照组大鼠侧脑室下区检测到少量的BrdU阳性细胞,细胞分布比较稀疏。我们在NT3-壳聚糖组的损伤侧侧脑室下区观察到增生细胞增多。
Dcx是迁移细胞的标记物,应用BrdU和Dcx的免疫荧光双标记可以观察并定量迁移的NSCs。NT3-壳聚糖组术后7 d损伤同侧Dcx阳性细胞显著增多,并且NT3-壳聚糖组BrdU/Dcx双阳性细胞数相比正常对照组显著增加。这一结果说明,NT3-壳聚糖载体增加侧脑室下区新生NSCs的数量。
迁移到损伤区的NSCs可能是来自于侧脑室下区或海马齿状回下区,也可能来自于新皮层存在的NSCs[17]。研究表明,缺血性脑损伤模型中,损伤区用sox2和Nestin来标记NSCs,同时也发现表达胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)的细胞,表明这些细胞可能来自于损伤区皮层激活的星形胶质细胞[19]。在本研究中,损伤区的NSCs可能来自于侧脑室下区,因为侧脑室下区在损伤后经NT3-壳聚糖载体修复后,检测到大量新生迁移的NSCs。但新生神经元的明确来源有待于进一步探究。
TBI后通过内源性神经发生修复大脑损伤,可以避免外源性NSCs移植修复脑损伤所产生的外来细胞不可控制的增生问题;把这些再生的细胞有效整合到正常的脑组织并发挥功能,是治疗TBI的手段[20]。脑本身的原始自发恢复能力是有限的,在损伤区域NSCs很难自发神经分化,通过一些外在方法来加强内源性过程非常必要[21]。
在未来研究中,脑损伤修复问题会一直是重大的医学研究热点。而利用生物材料系统促进内源性神经发生,既不涉及伦理学问题,也不会引起免疫排斥反应。哺乳动物脑内多个区域存在NSCs,损伤区内的NSCs来源问题和如何特异性诱导分化将是我们研究的重点。未来有可能会实现神经前体细胞特异性活化为目标神经元和胶质细胞。
[1]Geddes-Klein DM,Schiffman KB,Meaney DF.Mechanisms and consequences of neuronal stretch injury in vitro differ with the model of trauma[J].J Neurotrauma,2006,23(2):193-204.
[2]Geddes-Klein DM,Serbest G,Mesfin MN,et al.Pharmacologically induced calcium oscillations protect neurons from increases in cytosolic calcium after trauma[J].J Neurochem,2006,97 (2):462-474.
[3]Zhong C,Zhao X,Van KC,et al.NAAG peptidase inhibitor increases dialysate NAAG and reduces glutamate,aspartate and GABA levels in the dorsal hippocampus following fluid percussion injury in the rat[J].J Neurochem,2006,97(4):1015-1025.
[4]Wang X,Hu J,She Y,et al.Cortical PKC inhibition promotes axonal regeneration of the corticospinal tract and forelimb functional recovery after cervical dorsal spinal hemisection in adult rats[J].Cereb Cortex,2014,24(11):3069-3079.
[5]Alvarez-Buylla A,Garcia-Verdugo JM,Tramontin AD.A unified hypothesis on the lineage of neural stem cells[J].Nat Rev Neurosci,2001,2(4):287-293.
[6]Barnabe-Heider F,Goritz C,Sabelstrom H,et al.Origin of new glial cells in intact and injured adult spinal cord[J].Cell Stem Cell,2010,7(4):470-482.
[7]Gage FH.Mammalian neural stem cells[J].Science,2000,287 (5457):1433-1438.
[8]Luo Y,Coskun V,Liang A,et al.Single-cell transcriptome analyses reveal signals to activate dormant neural stem cells[J]. Cell,2015,161(5):1175-1186.
[9]Yang Z,Duan H,Mo L,et al.The effect of the dosage of NT-3/ chitosan carriers on the proliferation and differentiation of neural stem cells[J].Biomaterials,2010,31(18):4846-4854.
[10]Li X,Yang Z,Zhang A.The effect of neurotrophin-3/chitosan carriers on the proliferation and differentiation of neural stem cells[J].Biomaterials,2009,30(28):4978-4985.
[11]Yang Z,Zhang A,Duan H,et al.NT3-chitosan elicits robust endogenous neurogenesis to enable functional recovery after spinal cord injury[J].Proc Natl Acad Sci U S A,2015,112 (43):13354-13359.
[12]Duan H,Ge W,Zhang A,et al.Transcriptome analyses reveal molecular mechanisms underlying functional recovery after spinal cord injury[J].Proc Natl Acad Sci U S A,2015,112(43): 13360-13365.
[13]Mo L,Yang Z,Zhang A,et al.The repair of the injured adult rat hippocampus with NT-3-chitosan carriers[J].Biomaterials, 2010,31(8):2184-2192.
[14]Song HJ,Stevens CF,Gage FH.Neural stem cells from adult hippocampus develop essential properties of functional CNS neurons[J].Nat Neurosci,2002,5(5):438-445.
[15]李晓光,孙毅,杨朝阳.NT3-壳聚糖支架诱导内源性神经发生修复脊髓损伤[J].前沿科学,2016,10(1):4-10.
[16]孙敏,张皑峰,杨朝阳,等.神经营养因子3壳聚糖支架诱导成年大鼠脑损伤后海马神经网络的形成[J].中国康复理论与实践,2014,20(5):428-433.
[17]Li Y,Wu D,Wu C,et al.Changes in neural stem cells in the subventricular zone in a rat model of communicating hydrocephalus[J].Neurosci Lett,2014,578:153-158.
[18]Liu Y,Tang G,Zhang Z,et al.Metformin promotes focal angiogenesis and neurogenesis in mice following middle cerebral artery occlusion[J].Neurosci Lett,2014,579:46-51.
[19]Li QQ,Qiao GQ,Ma J,et al.Cortical neurogenesis in adult rats after ischemic brain injury:most new neurons fail to mature[J].Neural Regen Res,2015,10(2):277-285.
[20]Yi X,Jin G,Zhang X,et al.Cortical endogenic neural regeneration of adult rat after traumatic brain injury[J].PLoS One, 2013,8(7):e70306.
[21]Moraga A,Pradillo JM,Garcia-Culebras A,et al.Aging increases microglial proliferation,delays cell migration,and decreases cortical neurogenesis after focal cerebral ischemia[J].J Neuroinflammation,2015,12:87.
Effect of Neurotrophin 3-chitosan on Endogenous Neurogenesis and Motor Function after Motor Cortex Injury in Rats
YANG Fei-xiang1,ZHANG Ai-feng2,HAO Peng1,SHANG Jun-kui1,DUAN Hong-mei1,YANG Zhao-yang1,3,LI Xiao-guang1,3
1.Department of Neurobiology,Capital Medical University,Beijing 100069,China;2.Beijing Friendship Hospital, Capital Medical University,Beijing 100050,China;3.Department of Biomedical Engineering,School of Biological Science and Medical Engineering,Beihang University,Beijing 100191,China
LI Xiao-guang.E-mail:lxgchina@sina.com
ObjectiveTo observe the effects of neurotrophin 3(NT3)-chitosan on motor function,and proliferation and differentiation of the neural stem cells(NSCs)in the injury area and subventricular zone(SVZ)in rats with motor cortex injury.MethodsSixty-five Wistar rats were divided into control group(n=7),injury group(n=29)and NT3-chitosan group(n=29).The motor cortex was aspirated and removed as cerebral injury model.NT3-chitosan was immediately implanted into the injured area after operation,and the control group received no intervention.Pellet reaching test was performed to detect the recovery of the forelimb function,HE staining was used to observe the lesion cavity size,and immunofluorescence staining was used to observe the proliferation and differentiation of NSCs 3 days,7 days,14 days,1 month,2 months and 3 months after operation.ResultsThe grasp success rate was higher(F>6.00,P≤0.05),and the lesion cavity size was significantly smaller(F>629.5,P<0.001)in the NT3-chitosan group than in the injury group.In the NSCs differentiation experiment,the number of BrdU cells at all the time points was significantly higher in the NT3-chitosan group than in the injury group(F>171.43,P<0.001).In the NSCs proliferation experiment,the number of BrdU positive cells was still significantly higher in the NT3-chitosan group than in the control group and in the injury group(F>155.06,P<0.001),the number of Dcx positive cells was significantly higher in theNT3-chitosan group than in the injury group(F=62.367,P<0.001),and the number of BrdU/Dcx positive cells was significantly higher in the NT3-chitosan group than in the control group(F=33.527,P<0.001).ConclusionNT3-chitosan could activate NSCs in the SVZ,and promote endogenous neurogenesis and forelimb function recovery in rats after motor cortex injury.
traumatic brain injury;neurotrophin 3;chitosan;endogenous neurogenesis;motor function;rats
10.3969/j.issn.1006-9771.2017.02.008
R651.1
A
1006-9771(2017)02-0155-07
2016-10-20
2016-12-02)
1.国家自然科学基金重点项目(No.31130022);2.国家自然科学基金国际(地区)合作与交流项目(No.31320103903);3.国家自然科学基金面上项目(No.31271037;No.31670988);4.国家自然科学基金应急管理项目(No.31650001);5.高等学校全国优秀博士学位论文作者专项资金资助项目(No.201356)。
1.首都医科大学基础医学院,北京市100069;2.首都医科大学附属北京友谊医院口腔科,北京市100050;3.北京航空航天大学生物与医学工程学院,北京市100191。作者简介:杨飞祥(1990-),男,汉族,河南开封市人,硕士研究生,主要研究方向:中枢神经系统创伤性脑损伤和修复。通讯作者:李晓光。邮箱:lxgchina@sina.com。

