改良的QuEChERS样本前处理/高效液相色谱-串联质谱法检测猪肉中四环素类兽药的残留
王 飞,宓捷波,李淑静,陈其勇,吴 华
(1.天津出入境检验检疫局 动植物与食品检测中心,天津 300461;2.安捷伦科技有限公司,北京 100102)
实验技术
改良的QuEChERS样本前处理/高效液相色谱-串联质谱法检测猪肉中四环素类兽药的残留
王 飞1*,宓捷波1,李淑静1,陈其勇1,吴 华2
(1.天津出入境检验检疫局 动植物与食品检测中心,天津 300461;2.安捷伦科技有限公司,北京 100102)
采用Agilent公司的增强型脂质去除产品Bond Elut EMR-Lipid,建立了针对猪肉中四环素类药物残留的更快更高效的QuEChERS样品前处理方法。样品经酸化乙腈提取,Bond Elut EMR-Lipid QuEChERS净化后,采用HPLC-MS/MS检测,方法检出限可达5.0 μg/kg;四环素、金霉素和强力霉素的回收率为75.6%~89.4%,土霉素的回收率为53.4%~61.0%,相对标准偏差均不大于7.7%。
EMR-Lipid;QuEChERS;四环素类;兽药残留;高效液相色谱-串联质谱
四环素类药物是畜牧饲料中常用的抗生素[1],由于动物源性食品中的四环素类抗生素残留不易降解,消费者食用后可能产生抗药性[2-3]。此外,四环素类药物能够与骨骼中的钙结合,导致骨质发育障碍甚至骨骼畸形。因此,对动物源性食品中四环素类抗生素的检测尤为重要。
目前,四环素类抗生素的检测多采用液相色谱法或液相色谱-串联质谱法[4-7],前处理大多采用EDTA-Mcllvaine 缓冲液为提取溶剂[8-9],再以固相萃取柱净化。传统方法用于含油脂较多的动物源性样品时,往往净化过柱速度缓慢,且回收率不稳定。QuEChERS前处理方法快速、简单[10-11],在兽药残留分析方面的应用日趋广泛[12-13]。本方法采用Agilent公司的Bond Elut EMR-Lipid新型除脂吸附剂对猪肉组织样品进行净化,建立了新的四环素类药物残留分析的QuEChERS前处理方法。
1 实验部分
1.1 仪器与试剂
Applied Biosystems 公司API4000 Q-trap 型质谱仪,配Shimadzu 20A 型液相色谱仪。四环素、强力霉素、金霉素、土霉素标准品均购于Dr.Ehrenstorfer试剂公司,纯度≥98%。配制标准溶液时,先以甲醇溶解标准样品,再以甲醇稀释至所需浓度。甲醇、甲酸、乙腈(色谱纯,迪马公司)。除另有说明,其他试剂均为分析纯,实验用水为Milli-Q 纯水仪净化生产的超纯水(密理博公司,美国)。QuEChERS样品制备所用增强型脂质去除吸附剂Bond Elut EMR-Lipid和盐析试剂Bond Elut EMR-Polish购于安捷伦科技有限公司。
EDTA-Mcllvaine 缓冲液:分别称取柠檬酸12.9 g,磷酸氢二钠10.9 g,乙二胺四乙酸二钠37.2 g,用去离子水溶解并定容至1 L(溶液pH值约4.0)。实验所用猪肉样品均购于超市;鸡肉阳性样品来源于养鸡场。
1.2 实验方法
1.2.1 样品前处理方法 在室温条件下,准确称取冻去骨猪肉样品2.0 g于50 mL离心管内,加入10 mL含有5%甲酸的乙腈提取液,涡旋振荡提取2 min后,在10 ℃以8 000 r/min的速度离心5 min,取上清提取液备用。EMR-Lipid吸附剂首先以5 mL水充分润湿活化,随后加入5 mL酸化乙腈提取液,涡旋振荡1 min,在10 ℃ 8 000 r/min高速低温离心5 min,取5 mL上清液加入预装有NaCl和无水Na2SO4的EMR-Polish管中,充分振摇进行盐析,在10 ℃ 8 000 r/min高速低温离心5 min,取适量上层乙腈过0.22 μm有机尼龙滤膜,过滤后上机进行液质分析。
1.2.2 仪器条件 色谱柱:Poroshell 120 SB-C18柱(2.1 mm×150 mm,2.7 μm,美国Agilent公司);柱温:25 ℃;流动相:乙腈(A)+0.1%甲酸水溶液(B);梯度洗脱程序:1~4 min,10%~50%A,至5 min时升至90%A,保持该比例至9 min,然后恢复至初始比例;进样量:10 μL;流速:0.15 mL/min。
API 4000Q-Trap质谱,离子源:电喷雾离子源;扫描方式:正离子扫描;采集模式:多反应监测模式;毛细管电压:5.5 kV;离子源温度:600 ℃;气帘气流速:15 L/h;碰撞气流速:中速;待测目标物的定性、定量离子对、去簇电压和碰撞能量见表1。

表1 4种四环素类兽药的选择离子与保留时间Table 1 Selected ions and retention time of four tetracyclines
*the daughter ion and its precursor ion were used as quantitative ion pair
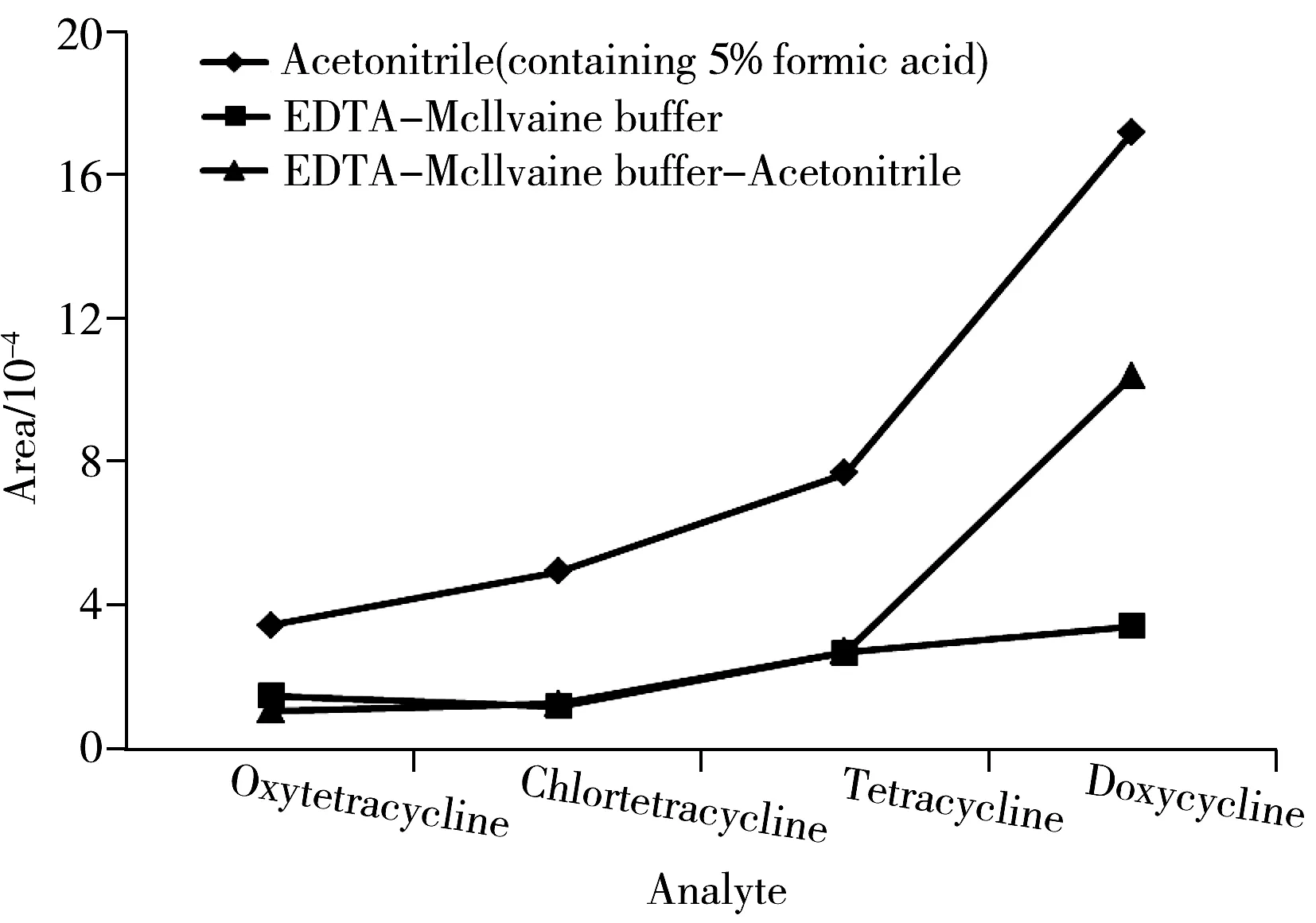
图1 不同溶剂对四环素类药物的提取效果Fig.1 Effect of different solvent on extraction efficiencies of tetracyclines

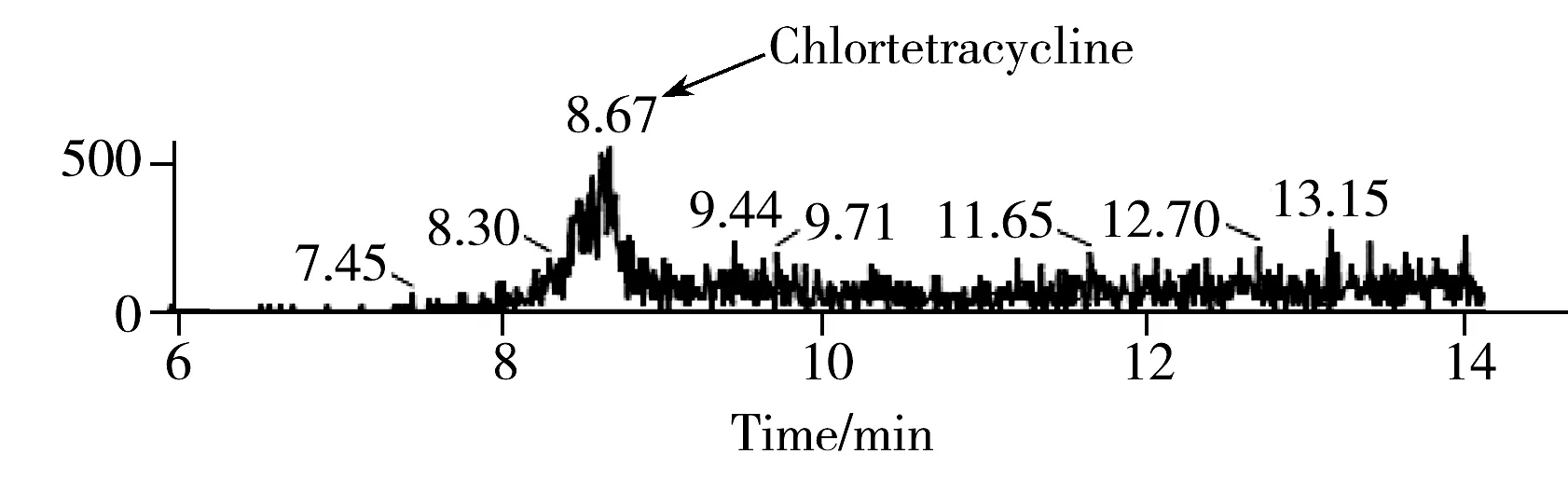
图2 四环素类药物标准混合溶液(10 μg/L,以冻去骨猪肉基质提取液配制)的多反应监测离子流色谱图Fig.2 Multiple reaction monitoring(MRM) chromatograms of four tetracyclines standard solution(10 μg/L) in pork sample
2 结果与讨论
2.1 样品前处理方法的选择
分别尝试了以含有5%甲酸的乙腈、EDTA-Mcllvaine 缓冲液以及EDTA-Mcllvaine 缓冲液-乙腈(2∶5,体积比)作为提取溶剂时对4种四环素类药物的提取和回收效果(见图1)。从图中可以观察到,酸化乙腈的效果明显优于其它两种提取液,最终选择含5%甲酸的乙腈溶液作为提取溶剂。为获得更充分的提取,采取了酸化乙腈均质提取的方式。
EMR-Lipid吸附剂除杂脱脂过程中,振荡应尽可能剧烈,以有利于吸附剂与待净化液之间充分作用。由于盐析的过程中会释放大量热,两次离心均采用低温条件,以防止过热导致残留药物分解。
2.2 仪器条件的选择
本研究选择薄壳型填料Poroshell 120SB-C18色谱柱对四环素类药物进行分离,此填料(2.7 μm)和规格(2.1 mm×150 mm)的色谱柱具有较高的分离柱效,同时具有较低的色谱压力和较高的柱载量,非常适合分析动物源样品基质中的药物残留。由于前处理过程中有盐析步骤,为了防止残留无机盐对离子化效率的影响以及对质谱离子源的污染,优化色谱条件使目标物在色谱柱上有充分的保留,并采用阀切换的方式将初始无机盐流出时间段的流动相切至废液,应用过程中检测灵敏度稳定,且质谱前端撇分器入口处未见盐结晶。为避免四环素类药物与金属离子形成螯合物,同时减弱四环素类药物在反相柱上的吸附,流动相中加入0.1%甲酸。以冻去骨猪肉基质溶液配制浓度为10 μg/L的四环素类混合标准溶液,得到的多反应监测色谱图如图2所示。
以流动注射的方式,优化4种四环素类标准溶液的质谱参数,以确定母离子、子离子及去簇电压、碰撞能量(见表1)。
2.3 线性范围与相关系数
在优化条件下,配制系列浓度的 4种四环素(0.5,5,10,20,50 μg/L)的猪肉基质加标溶液,以目标物质的质量浓度(x,μg/L)对其峰面积(y)进行线性拟合,考察其线性关系。结果显示,4种四环素在0.5 ~50 μg/L浓度范围内,其信号响应与质量浓度呈线性相关,相关系数均大于0.99(见表2)。
2.4 回收率、精密度与检出限
称取空白猪肉样品18份,分别添加25,50,100 μg/kg 3个不同浓度水平的四环素标准品,每个浓度做6个平行,按照优化方法进行前处理实验,结果显示,在上述3个浓度下,四环素、金霉素和强力霉素的平均回收率为75.6%~89.4%,土霉素的平均回收率为53.4%~61.0%,略低于其它3种药物。虽有文献[5]指出可能是由于实验中接触到的金属离子与四环素类药物的相互作用所致,但从图1可以看出,以EDTA- Mcllvaine-乙腈混合溶液为提取溶剂时,并未明显改善土霉素的提取效果。根据GB/T 27404-2008[14]的要求,在本实验添加浓度范围内,回收率需达到60%~120%,因此在检测实际样品中的土霉素时,可以通过折算回收的方式进行弥补。

表2 四环素类兽药在猪肉样品中的线性方程、相关系数与加标回收率Table 2 Regression equations,correlation coefficients(r) and average recoveries of tetracyclines residues in pork sample
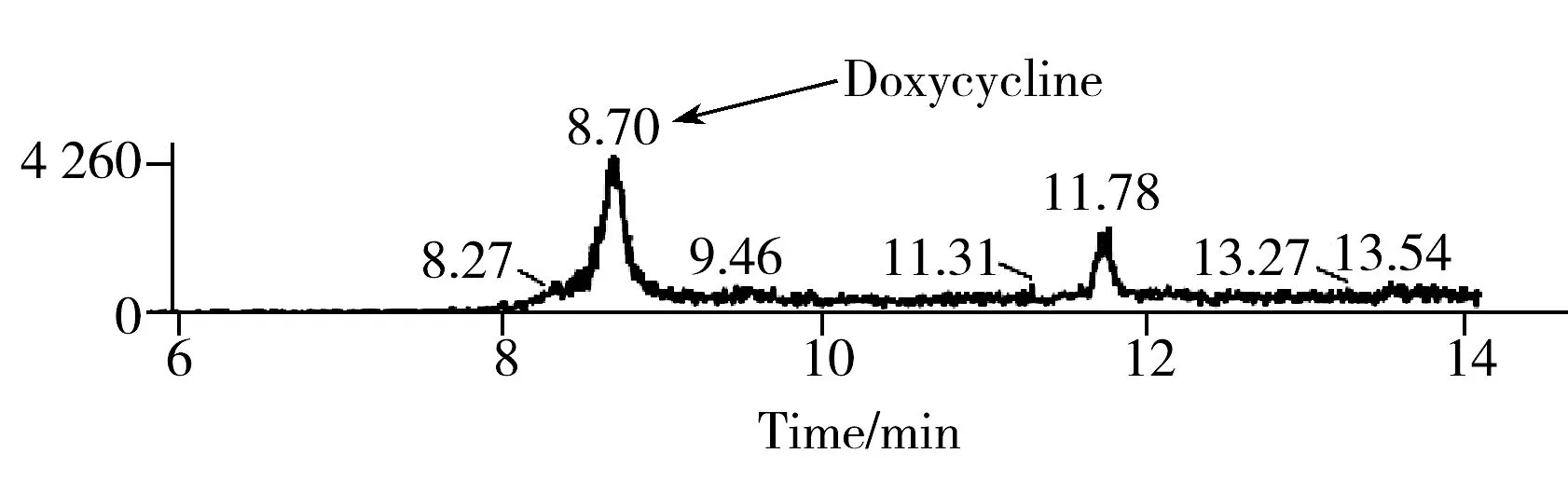
本方法的检出限采用添加回收法实际测定得到,4种四环素类药物在空白猪肉基质中的检出限为5.0 μg/kg,其定量离子的多反应监测色谱图如图3所示。
2.5 阳性样品的测定
为了进一步验证方法的可靠性,采用本方法对1个含有土霉素的鸡肉阳性样品进行实际测定,并以国标GB/T 21317-2007 法进行对照。结果显示,两种方法的检测结果分别为18.7 μg/kg和18.3 μg/kg,测定结果相当。而与国标方法相比,新的EMR-Lipid QuEChERS方法步骤简单,且无需过柱和氮吹,大大节省了样品的前处理时间。
3 结 论
本研究将新型EMR-Lipid脂质去除产品引入标准QuEChERS前处理工作流程,应用于动物源性样品获得了理想的除脂净化效果,整体方法快速易行,且简单可靠,能够满足日常检测的需要。
[1] Zhang M J,Lin F,Lin H D,Qin Y.J.Instrum.Anal.(张美金,林峰,林海丹,秦燕.分析测试学报),2007,26(6):918-920.
[2] Guo P Y,Zhao J H,Liu S,Yang K C,Chen X D.J.FoodSafe.Qual.(郭培源,赵俊华,刘硕,杨昆程,陈晓东.食品安全质量检测学报),2015,6(9):3614-3620.
[3] Zhang D W,Wang D G,Hu L F,Liao Q G,Li W H,Luo L G,Zhou Y M,Wei B H.Qual.Safe.Agro-Prod.(张大文,王冬根,胡丽芳,廖且根,李伟红,罗林广,周瑶敏,魏本华.农产品质量与安全),2014,6:34-37.
[4] Pang G F,Cao Y Z,Zhang J J,Jia G Q,Fan C L,Li X M.J.Instrum.Anal.(庞国芳,曹彦忠,张进杰,贾光群,范春林,李学民.分析测试学报),2005,24(4):61-63.
[5] Lü H T,Chen F,Jiang Y.Phys.Test.Chem.Anal.:Chem.Anal.(吕海涛,陈峰,姜悦.理化检验:化学分册),2007,43(1):18-20.
[6] Yue Z F,Qiu Y M,Lin X Y,Ji C N.Chin.J.Anal.Chem.(岳振峰,邱月明,林秀云,吉彩霓.分析化学),2006,34(9):1255-1259.
[7] Liu Y H,Zhang C P,Men L Q,Liu Z H,Wang S H.Chin.J.Chromatogr.(刘艳华,张纯萍,门立强,刘智宏,王树槐.色谱),2006,24(2):171-173.
[8] Shen H Q,Tan H R,Qi K Z,Tian C Q.J.Instrum.Anal.(沈虎琴,檀华蓉,祁克宗,田春秋.分析测试学报),2012,31(3):302-306.
[9] Liu Y D,Zhang Q,Chen W S,Hong L.J.Instrum.Anal.(刘彦东,张权,陈文生,洪亮.分析测试学报),2015,34(3):362-366.
[10] Da J,Wang G L,Cao J,Zhang Q S.Chin.J.Chromatogr.(达晶,王钢力,曹进,张庆生.色谱),2015,33(8):830-837.
[11] Feng W,Zhang D H,Zhang X,Yang L,Zhao Y H,Teng G S.Phys.Test.Chem.Anal.:Chem.Anal.(冯伟,张代辉,张勋,杨璐,赵韫慧,滕国生.理化检验:化学分册),2015,51(10):1386-1392.
[12] Xu X,Geng D D,Xiao Y C,Hu F Z.J.Instrum.Anal.(许旭,耿丹丹,肖远灿,胡风祖.分析测试学报),2015,34(7):807-812.
[13] Guo L Q,Sun J,Tian G N,Zhang J L,Wang M L,Li K.J.Instrum.Anal.(郭礼强,孙军,田国宁,张金玲,王梅玲,李凯.分析测试学报),2016,35(6):739-743.
[14] GB/T 27404-2008.Criterion on Quality Control of Laboratories-Chemical Testing of Food.National Standards of the People's Republic of China.(实验室质量控制规范 食品理化检测.中华人民共和国国家标准).
Determination of Tetracyclines Residues in Pork by High Performance Liquid Chromatography-Tandem Mass Spectrometry with Modified QuEChERS Sample Pretreatment
WANG Fei1*,MI Jie-bo1,LI Shu-jing1,CHEN Qi-yong1,WU Hua2
(1.Tianjin Entry-Exit Inspection and Quarantine Bureau,Plants Animals and Foods Inspection Center,Tianjin 300461,China;2.Agilent Technologies,Beijing 100102,China)
A modified QuEChERS sample pretreatment method was established for the determination of tetracycline residues in pork.The new method adopted a novel lipid-removal material(EMR-Lipid) in QuEChERS procedure,and provided fast and effective sample extraction and cleanup of high-fat sample such as pork.The LODs of the method were 5.0 μg/kg.The recoveries of tetracycline,chlortetracycline,doxycycline were in the range of 75.6%-89.4% and the recoveries of oxytetracycline were in the range of 53.4%-61.0%,with RSDs not more than 7.7%.
EMR-lipid;QuEChERS;tetracyclines;residue detection;high performance liquid chromatography-tandem mass spectrometry(HPLC-MS/MS)
2016-08-28;
2016-10-20
检验检疫行业标准(2014B358)
10.3969/j.issn.1004-4957.2017.02.021
O657.63;TQ460.72
A
1004-4957(2017)02-0272-04
*通讯作者:王 飞,硕士研究生,工程师,研究方向:农兽药残留及食品添加剂分析,Tel:022-66273154,E-mail:wangf@tjciq.gov.cn

