大孔树脂分离纯化麦胚黄酮研究
刘宛玲,肖建辉,黄占旺,牛丽亚,*
(1.江西农业大学食品科学与工程学院,江西南昌 330045;2.江西农业大学工学院,江西南昌 330045)
大孔树脂分离纯化麦胚黄酮研究
刘宛玲1,肖建辉1,黄占旺2,牛丽亚1,*
(1.江西农业大学食品科学与工程学院,江西南昌 330045;2.江西农业大学工学院,江西南昌 330045)
在前期研究麦胚黄酮最佳浸提工艺基础上,为探讨麦胚黄酮纯化工艺,本实验选择大孔树脂对其进行分离纯化。以吸附能力、吸附率及解吸率为考察指标,从7种型号大孔树脂中筛选出分离纯化麦胚黄酮效果优的树脂,并确定该树脂的最佳工艺条件。结果表明,H103大孔树脂的吸附率、吸附能力都较高,为麦胚黄酮最佳分离树脂,其最佳工艺条件为上样浓度约0.65 mg/mL、上样速度2.0 BV/h、解吸乙醇浓度70%、解吸速度2.0 BV/h。经H103树脂分离后的麦胚黄酮纯度大大提高,为11.77%,比浸提液中麦胚黄酮纯度0.96%提高了12.26倍。
麦胚黄酮,大孔树脂,分离纯化
麦胚是小麦籽粒的生命源泉,不仅含有丰富的脂肪、蛋白质,还含有多种微量元素和矿物质,被誉为“人类天然的营养宝库”[1]。我国是世界上最大的小麦生产和消费国,每年可以开发利用的小麦胚芽潜藏量高达280~420万吨[2-3]。但由于麦胚中含有丰富的脂肪酶和蛋白酶,影响面粉的稳定性和烘焙品质[4]。因此,传统的制粉工业一般都将表皮和胚芽作为动物饲料处理掉,使得麦胚资源未能得到充分、合理、有效的利用。
近些年随食品工业的迅猛发展,带动并促进了小麦提胚制粉技术的快速发展。小麦胚芽中丰富的营养与保健成分,也受到国内外研究学者的重视[2]。从麦胚中提取、分离纯化黄酮类化合物,可为麦胚黄酮类化合物的应用奠定理论基础,加速对麦胚资源综合利用的研究,具有较高的经济效益。
目前,麦胚中黄酮类化合物的提取工艺主要包括:溶剂浸提、超声波辅助提取、生物酶解提取等。如于长青[5]等人采用水提法、加碱浸提法、醇提法分别从麦胚中提取黄酮,通过比较,发现醇提法的提取效果最好。张燕梁[6]等人采用纤维素酶酶法提取麦胚中的黄酮,最大提取率为0.602%。上述方法,虽然实现了麦胚中黄酮类化合物的提取分离,但黄酮的得率和纯度都较低,且得到的均为粗提物,需进一步对其进行纯化。目前国内外对于麦胚黄酮分离纯化方法的研究很少,仅有杜敏华等[7]通过筛选得出AB-8大孔树脂对麦胚黄酮有较好的吸附和解吸效果,但未对其纯化效果作说明。
本文较为系统的比较了7种大孔树脂对麦胚黄酮的吸附、解吸效果,并对最佳树脂纯化工艺进行了优化,为麦胚黄酮的初步分离纯化提供理论依据,并为麦胚资源的充分利用奠定理论基础。
1 材料与方法
1.1 材料与设备
小麦胚芽 购自郑州金苑面业有限公司;AB-8、D101、HPD100、HPD300、HPD500型大孔树脂 购自沧州宝恩吸附材料科技有限公司;H103、X-5型大孔树脂 购自天津南开大学树脂有限公司;其他试剂 均为分析纯,购自天津市福晨化学试剂厂。
数显恒温磁力搅拌循环水箱 常州国华电器有限公司;TDL-5-A低速大容量离心机 上海安亭科学仪器厂;Scientz-10N冷冻干燥机 宁波新芝生物科技股份有限公司;V-5600型可见分光光度计 上海元析仪器有限公司;Milli-Q超纯水机 厦门精艺兴业科技有限公司。
1.2 实验方法
1.2.1 麦胚粗黄酮的制备 根据本课题组前期优化实验得到的麦胚粗黄酮制备方法,取一定质量的麦胚,用70%乙醇,60 ℃浸提2 h,重复两次,合并滤液,4000 r/min离心10 min,取上清液旋转蒸发浓缩至无醇味,得到浸提液,并置于4 ℃下保存备用。
1.2.2 检测方法 准确称取5 mg芦丁,用30%的乙醇溶解并定容至25 mL,分别精密吸取0、0.5、1、1.5、2、2.5 mL置于25 mL容量瓶,加入5%亚硝酸钠溶液1 mL,静置6 min,加入10%硝酸铝溶液1 mL,静置6 min,再加入4%氢氧化钠溶液10 mL,并用30%乙醇定容,混匀,静置15 min。可见分光光度计在510 nm波长下测定吸光度,绘制标准曲线[8]。根据芦丁标准曲线(y=12.45x+0.003,R2=0.9994)计算麦胚黄酮样液浓度。
1.2.3 大孔树脂预处理 先用95%乙醇浸泡24 h,使其充分溶胀,并除去杂质至流出液加水不变浑浊为止。蒸馏水洗净乙醇,再用2体积,5%NaOH水溶液浸泡3 h,蒸馏水洗至中性,2体积4% HCl水溶液浸泡3 h,蒸馏水洗至中性,保存备用[9]。
1.2.4 大孔树脂的筛选 准确称取湿树脂各1.0 g,加入25 mL样液于100 mL锥形瓶中,在水浴摇床(25 ℃、100~120 r/min)上振荡24 h,计算树脂吸附率。然后用蒸馏水洗树脂三次以除去表面残留样液,再加入50 mL,70%乙醇解吸24 h后计算解吸率[10-11]。考察大孔树脂静态吸附、解吸性能。
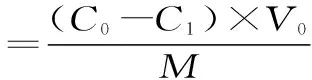
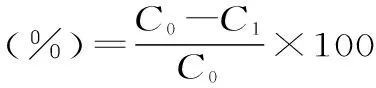
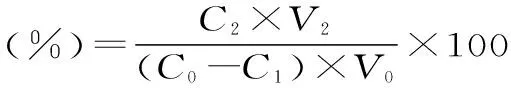
式中:C0为初始样液浓度,C1为平衡浓度,C2为洗脱液浓度,V0为初始样液体积,V2为洗脱液体积,M为树脂干重。
1.2.5 大孔树脂纯化麦胚黄酮条件优化
1.2.5.1 样液pH对吸附效果的影响 用酸碱调节样液pH分别为3.44、4.36、5.62(样液本身pH)、6.43、7.70。准确称取500 mg干树脂,加入25 mL样液于100 mL锥形瓶,在水浴摇床(25 ℃、100~120 r/min)上振荡吸附5 h,计算树脂吸附能力。考察样液pH对大孔树脂吸附效果影响。
1.2.5.2 上样浓度对吸附效果的影响 配制浓度分别为0.470、0.554、0.639、0.650、0.775、0.859、0.908、1.0 mg/mL的样液,准确称取1.0 g干树脂,加入30 mL样液于100 mL锥形瓶,在水浴摇床(25 ℃、100~120 r/min)上振荡吸附5 h,计算树脂吸附量及吸附率。考察上样浓度对大孔树脂吸附效果的影响。
1.2.5.3 上样速度对吸附效果的影响 取一定量处理好的大孔树脂湿法装柱,柱体积为30 mL,将一定浓度的样液分别以1.0、2.0、3.0、4.0 BV/h速度上样,每10 mL收集一次流出液,达到泄漏点时,停止上样,测定流出液黄酮浓度。考察不同上样速度对大孔树脂吸附效果的影响。
1.2.5.4 解吸液浓度对解吸效果的影响 准确称取500 mg干树脂,加入25 mL样液于100 mL锥形瓶,在水浴摇床(25 ℃、100~120 r/min)上振荡吸附5 h,吸附平衡后先用3 BV蒸馏水冲洗,再用50 mL浓度分别为40%、50%、60%、70%、80%、90%、95%的乙醇解吸5 h,计算解吸率[12]。考察解吸液浓度对解吸效果的影响。
1.2.5.5 解吸速度对解吸效果的影响 取一定量处理好的大孔树脂湿法装柱,柱体积为30 mL,将50 mL样液以2 BV/h速度经大孔树脂吸附完全后,先用3 BV蒸馏水冲洗,再用150 mL,70%乙醇分别以1.0、2.0、3.0、4.0 BV/h速度解吸,计算解吸率。考察解吸速度对解吸效果的影响。
1.2.5.6 麦胚黄酮纯度计算 在大孔树脂最佳工艺条件下,对麦胚黄酮进行纯化,得到的解吸液经真空冷冻干燥,计算纯度。
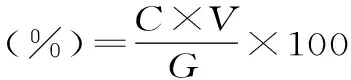
式中:C为解吸液浓度,V为解吸液体积,G为解吸液冷冻干燥后固体质量
1.3 数据处理
应用SPSS19.0进行实验数据处理。采用LSD法进行差异显著性分析。图中同一柱型的字母相同,表示差异不显著(p>0.05),字母不同则表示差异显著(p<0.05)。
2 结果与分析
2.1 不同类型大孔树脂对麦胚黄酮吸附解吸的影响
大孔树脂吸附效果主要跟树脂极性及其孔径大小有关[10]。由图1可知,X-5、H103两种非极性树脂吸附率及吸附能力相对较高,且H103树脂吸附率与其他6种树脂之间均存在显著性差异(p<0.05),这可能是因为麦胚乙醇提取液中黄酮的分子大小与X-5、H103两种树脂孔径相当。同时7种树脂解析率之间均无显著性差异,因此,综合考虑选择H103进行后续实验。
2.2 样液pH对吸附效果的影响

表1 pH对吸附效果的影响Table 1 Effect of pH on adsorption capacity
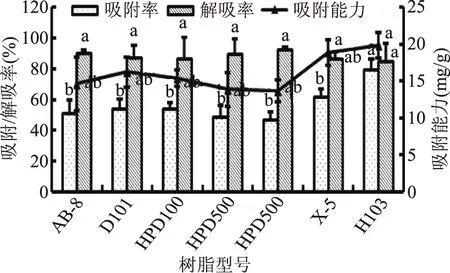
图1 7种大孔树脂静态吸附、解吸率比较Fig.1 Comparison of the static adsorption and desorption ratio of 7 different kinds of macroporous resin注:同一指标不同树脂型号间进行差异显著性分析,不同字母表示差异显著(p<0.05)。
注:字母相同,表示差异不显著(p>0.05),字母不同则表示差异显著(p<0.05);图4、图5同。由表1可知,样液pH对树脂吸附能力影响不大,调节pH为4.36、6.43及7.7时,H103树脂对麦胚黄酮的吸附能力与pH为5.62(样液自身pH)时无显著性差异,调节pH为3.44时,吸附能力明显增加,但此时样液变得浑浊。Du H等[11]在用大孔树脂分离纯化毛鸡骨草总黄酮的过程中也出现了类似的情况,这可能是因为pH过小时,强酸会使得样液中一些物质的溶解度变小,析出使得样液变浑浊。因此选择5.62即样品自身pH为最佳。
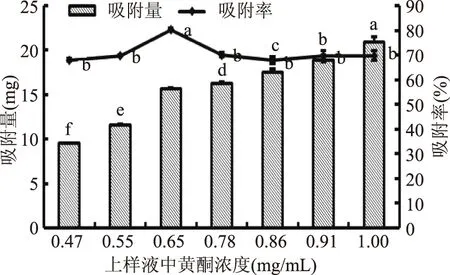
图2 上样浓度对吸附效果的影响Fig.2 Effect of sample concentration on adsorption capacity注:同一指标不同上样液中黄酮浓度进行差异显著性分析,不同字母表示差异显著(p<0.05)。
2.3 上样浓度对吸附效果的影响
由图2可知,麦胚乙醇提取液中黄酮浓度从0.47~1.00 mg/mL,树脂吸附量逐渐增大,这是因为样液中黄酮浓度越大,与树脂单位表面积接触的料液量越多,吸附量越大[12]。但在该浓度范围内,树脂的吸附率先增大后减小,且0.55~0.65 mg/mL,树脂吸附量及吸附率增幅最大,黄酮浓度为0.65 mg/mL时吸附率达到最大,且与其他浓度下的吸附率均存在显著性差异,可能是因为麦胚乙醇提取液中黄酮浓度超过0.65 mg/mL之后,浓度太大,导致在上样过程中样液还没来得急被树脂充分吸附就流出来了,使得吸附率降低。因此,从节约原料、提高效率角度考虑,确定0.65 mg/mL为最佳上样浓度。
2.4 上样速度对吸附效果的影响
由图3可知,样液上样速度为1.0、2.0 BV/h时,泄漏点均出现在第110~120 mL;上样速度为3.0、4.0 BV/h时,泄漏点均出现在第80~90 mL。因此考虑到样液的利用率及当上样速度为1.0 BV/h时,树脂对样液的分离效率较低,选择2.0 BV/h为本实验最佳的上样速度。

图3 上样速度对吸附效果的影响Fig.3 Effect of sample flow rate on adsorption capacity
2.5 解吸液浓度对解吸效果的影响
由图4可知乙醇浓度从40%~95%,对麦胚乙醇提取液中黄酮解吸效果先增大再减小,70%时最佳且与乙醇浓度为40%、50%、90%及95%时的解析效果存在显著性差异。可能因为H103树脂属于非极性树脂,乙醇溶液极性越小,对有效成分的解吸效果越好,但乙醇浓度过高,解吸出的醇溶性杂质增多,使得解吸率降低。因此,确定70%为最佳解吸乙醇浓度。
2.6 解吸速度对解吸效果的影响
由图5可知,当解吸速度为1.0、2.0 BV/h时,解吸率均高于80%,而解吸速度为3.0、4.0 BV/h时,解吸率显著降低。这是由于一定用量的乙醇解吸,当解吸速度太大时,会因为被树脂吸附的有效成分没有足够的时间完全溶于乙醇而造成解吸率较低;而当解吸速度太低时,虽然解吸率较高,但解吸所耗费时间较长,效率太低,且会因为流出的解吸液不够集中而导致拖尾现象的出现[13]。因此,选择2.0 BV/h为最佳解吸速度。
2.7 吸附透过曲线、解吸曲线
由图6可知,大孔树脂柱在连续吸附25 BV样液后,流出液中黄酮浓度基本趋于稳定,说明H103型大孔树脂在最佳分离工艺条件下可以处理约25 BV样液而不发生穿透现象,处理量较大。由图7可知,大孔树脂吸附完全之后用3 BV,70%乙醇可基本解吸完全,第4 BV解吸液中黄酮解吸量较低,之后无拖尾现象。从节省时间跟试剂方面考虑,选择3 BV为最佳解吸液用量。
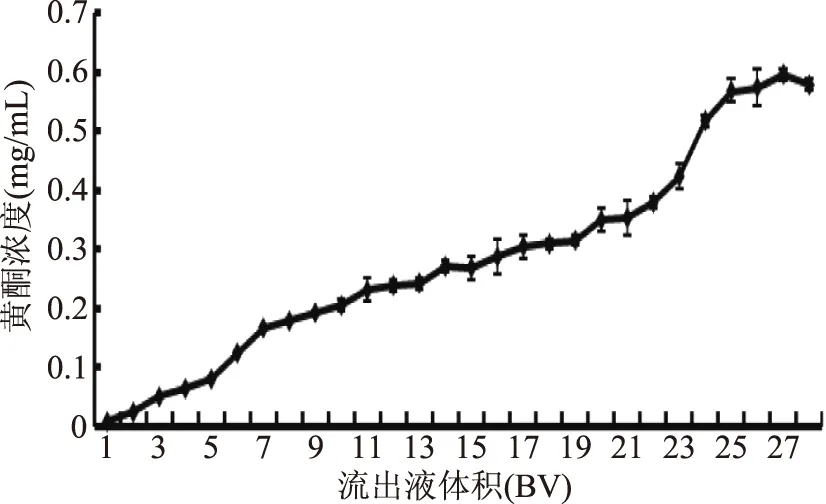
图6 吸附透过曲线Fig.6 The curve of adsorption leakage
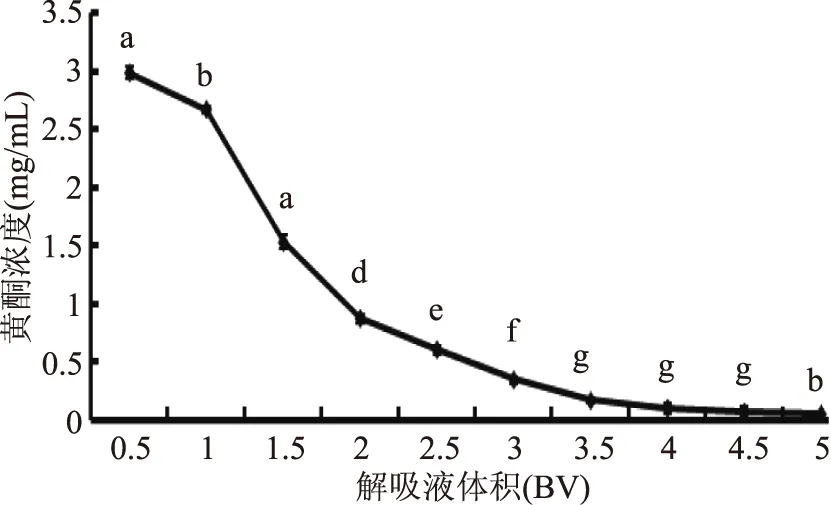
图7 解吸曲线Fig.7 The curve of desorption
2.8 麦胚黄酮经大孔树脂纯化后纯度测定
经大孔树脂最佳工艺,即上样浓度约0.65 mg/mL、上样速度2 BV/h、用3 BV 70%乙醇以2 BV/h速度解吸后得到的麦胚黄酮纯度为11.77%,相较于浸提液中麦胚总黄酮纯度0.96%,提高了12.26倍。
3 结论
H103大孔树脂对麦胚黄酮吸附量大,易解吸,适用于麦胚黄酮的分离纯化。且在最佳分离纯化工艺条件下,能处理约25 BV样液而不发生泄露,3 BV,70%乙醇能基本完全洗脱而无拖尾现象。经H103大孔树脂纯化后的麦胚黄酮纯度为11.77%,相较于浸提液中麦胚总黄酮纯度0.96%,提高了12.26倍。
[1]王学东,李庆龙,吴艳. 小麦胚资源的开发利用及研究进展[J]. 现代面粉工业,2008(4):44-50.
[2]牛丽亚.小麦胚芽油超临界C02萃取、评价及麦胚蛋白修饰改性的研究[D]. 合肥:合肥工业大学,2012.
[3]吴素萍. 小麦胚芽中生物活性物质的研究现状[J]. 食品工业科技,2009,30(1):348-351.
[4]周会会,朱科学.小麦胚芽提取物的抗肿瘤活性研究进展[J].中国粮油学报,2012,27(11):114-117.
[5]于长青,王宪华,张丽萍,王秋京,麦胚黄酮类化合物提取方法的研究[J]. 黑龙江八一农垦大学学报,14(4),62-64,2002.
[6]张燕梁,闫小彦,于长青,纤维素酶酶法提取麦胚黄酮工艺条件的优化[J]. 黑龙江八一农垦大学学报,21(2),72-76,2009.
[7]杜敏华,田龙.大孔吸附树脂分离纯化麦胚黄酮工艺研究[J].中国粮油学报,2007,22(3):126-130.
[8]于国峰,丁嘉信,王超,等.红花总黄酮大孔树脂纯化工艺[J].中国实验方剂学杂志,2012,18(3):39-42.
[9]Zhang Z F,Liu Y,Luo P,et al. Separation and purification of two flavone glucuronides fromErigeronmultiradiatus(Lindl.)Benth with macroporous resins[J]. Biomed Research International,2009(3):875629-875629.
[10]Chen L,Zheng Y,Wang X,et al. Simultaneous separation and purification of flavonoids and oleuropein fromOleaeuropaeaL.(olive)leaves using macroporous resin[J]. Journal of the Science of Food & Agriculture,2011,91(15):2826-2834.
[11]Du H,Wang H,Yu J,et al. Enrichment and Purification of Total Flavonoid C-Glycosides from Abrus mollis Extracts with Macroporous Resins[J]. Industrial & Engineering Chemistry Research,2012,51(21):7349-7354.
[12]王国军,唐辉,张淑兰,等.大孔树脂纯化核桃隔膜总黄酮的工艺研究[J].中草药,2013,44(19):2688-2692.
[13]吴海霞,吴彩娥,李婷婷,等.大孔树脂纯化银杏叶黄酮的研究[J]. 现代食品科技,2013,29(12):2964-2969.
Purification of flavonoids from wheat germ by macroporous resin
LIU Wan-ling1,XIAO Jian-hui1,HUANG Zhan-wang2,NIU Li-ya1,*
(1.School of Food Science and Engineering,Jiangxi Agricultural University,Nanchang 330045,China;2.School of Engineering,Jiangxi Agricultural University,Nanchang 330045,China)
Based on the previous study of the extraction of flavonoids from wheat germ(FWG),the purification of FWG was performed by macroporous resin. Seven kinds of macroporous resin were selected to compare their purification ability by using adsorption and desorption rate as the indicators. Furthermore,the best one was used to optimize the separation process. The data indicated that H103 had better adsorption and desorption property for purification. The optimal adsorption parameters were as follows:the sample concentrations was about 0.65 mg/mL,the flow rate was 2.0 BV/h,the desorption solution concentration was 70% ethanol,the desorption rate was 2.0 BV/h. After one run treatment with H103 resin,the extraction of FWG was increased 12.26 times,and the content of flavonoids was up to 11.77% from 0.96%.
wheat germ flavonoids;macroporous resin;purification
2016-07-25
刘宛玲(1988-),女,硕士研究生,研究方向:天然产物提取及其功能性研究,E-mail:446038874@qq.com。
*通讯作者:牛丽亚(1984-),女,博士研究生,讲师,研究方向:功能性食品,E-mail:nly8483@163.com。
国家自然科学基金资助项目(31401484);江西省青年科学基金计划(20142BAB214002)。
TS210.1
B
1002-0306(2017)02-0293-04
10.13386/j.issn1002-0306.2017.02.048

