L-茶氨酸对大鼠内脏组织抗氧化能力及相关基因表达的影响
李成舰,童海鸥,颜琼娴⋆,韩雪峰,肖文军⋆,谭支良
(1.湖南农业大学园艺园林学院,湖南农业大学茶学教育部重点实验室,湖南省植物功能成分利用协同创新中心,湖南 长沙 410128;2.中国科学院亚热带农业生态研究所,亚热带农业生态过程重点实验室,湖南省畜禽健康养殖工程技术中心,农业部中南动物营养与饲料科学观测试验站,湖南 长沙 410125;3.永州职业技术学院药学系,湖南 永州 425100)
L-茶氨酸对大鼠内脏组织抗氧化能力及相关基因表达的影响
李成舰1,2,3,童海鸥1,2,颜琼娴2,⋆,韩雪峰1,2,肖文军1,⋆,谭支良2
(1.湖南农业大学园艺园林学院,湖南农业大学茶学教育部重点实验室,湖南省植物功能成分利用协同创新中心,湖南 长沙 410128;2.中国科学院亚热带农业生态研究所,亚热带农业生态过程重点实验室,湖南省畜禽健康养殖工程技术中心,农业部中南动物营养与饲料科学观测试验站,湖南 长沙 410125;3.永州职业技术学院药学系,湖南 永州 425100)
目的:通过对大鼠灌胃L-茶氨酸溶液,观察大鼠心脏、肝脏、脾脏和肾脏中抗氧化指标的变化,探究L-茶氨酸对大鼠心、肝、脾和肾抗氧化能力及其相关酶mRNA表达量的影响。方法:64 只SD大鼠随机分为对照组、低剂量组、中剂量组和高剂量组4 组(每组16 只,雌雄各半),分别灌胃0、50、200、400 mg/(kg·d)L-茶氨酸。连续灌胃14 d后采集内脏组织,采用试剂盒检测样品中丙二醛(malondialdehyde,MDA)与一氧化氮(nitric oxide,NO)的含量,以及超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)、过氧化氢酶(catalase,CAT)和一氧化氮合成酶(nitric oxide synthase,NOS)的活性,并采用实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RT-qPCR)法测定相应抗氧化酶的mRNA表达量。结果:L-茶氨酸灌胃影响大鼠心脏组织的NO含量,以及SOD、CAT与NOS活力,其中高剂量组大鼠心脏组织中NO含量最低,SOD与CAT活力最大;同时影响大鼠肾脏中NO的含量,高剂量组最低;但对除上述指标外的肝、脾、肾、心的MDA与NO含量,以及SOD、CAT、GPX与NOS活力无显著影响。低剂量L-茶氨酸灌胃显著抑制肝脏中SOD1 mRNA的表达和脾脏中SOD1、SOD3、GPX1 mRNA的表达;高剂量L-茶氨酸则上调脾脏SOD2 mRNA的表达;同时各剂量组心脏组织中的SOD1、SOD2、SOD3、GPX1 mRNA的表达量都显著增加。结论:L-茶氨酸灌胃增强了心脏的抗氧化能力,其机制可能是通过上调了大鼠心脏中SOD2基因的mRNA的表达,从而增加心脏中SOD的活性,起到抗氧化的保护作用。同时,L-茶氨酸灌胃对大鼠内脏抗氧化功能的影响存在性别差异。
L-茶氨酸;抗氧化能力;内脏组织;基因表达;大鼠
L-茶氨酸是茶叶中特有的一种非蛋白氨基酸,是茶叶的重要活性成分,具有多种生理功能,包括抗氧化应激[1-2]、提高机体免疫功能[3-4]、抗肿瘤[5-6]、抗热应激与抗衰老[7]等。目前,关于L-茶氨酸的抗氧化应激功能的研究主要集中在两个方面,第一个方面是提高肝脏的抗氧化能力,抗氧化性肝损伤和肝细胞凋亡。汪丽伟等[8]研究发现,日粮中添加200 mg/kg的L-茶氨酸可以显著增强1 日龄仔鸡肝脏的过氧化氢酶(catalase,CAT)活性,降低丙二醛(malondialdehyde,MDA)含量;在热应激条件下,饲喂含200 mg/kg的L-茶氨酸和200 mg/kg的茶多酚的饲料,对仔鸡肝脏的抗氧化效果最佳。研究表明,腹腔注射L-茶氨酸(10 mg/(kg·d)(以体质量计,下同))能使酒精性肝损伤小鼠肝脏中的还原型谷胱甘肽(reduced glutathione,GSH)增加从而增强其抗氧化能力[9-10]。进一步的研究表明,在喂服酒精(乙醇体积分数50%,剂量3 g/kg)1 h后,颈静脉注射L-茶氨酸(100 mg/kg),小鼠血液中的酒精浓度显著降低,肝脏中的乙醇脱氢酶和乙醛脱氢酶的活性增加;服用酒精3 h后,肝脏中的脂质过氧化产物浓度增加;但是同时服用L-茶氨酸后,能够抑制脂质过氧化产物的上升直至恢复到正常水平[10]。研究表明,口服L-茶氨酸能够抑制乙醇导致的雄性ICR小鼠(6~7 周龄,18~22 g)肝脏中丙氨酸转氨酶(alanine aminotransferase,ALT)、天门冬氨酸转氨酶(aspartate aminotransferase,AST)、甘油三酸酯(triglyceride,TG)和MDA的升高,同时也可以抑制肝脏抗氧化能力的降低[11]。这一结果表明L-茶氨酸能通过提高抗氧化能力预防乙醇导致的肝细胞损伤。据报道,预先给小鼠喂服L-茶氨酸能抑制CCl4导致的肝脏氧化应激损伤[12]。进一步研究表明,L-茶氨酸还能抑制氧化应激介导的炎症反应,包含血清中肿瘤坏死因子(tumor necrosis factor,TNF)-α和白细胞介素(interleukin,IL)-1β的增加,以及肝脏中环氧合酶(cyclooxygenase,COX)-2和诱导型一氧化氮合成酶(nitric oxide synthase,NOS)的表达,从而减少肝细胞的凋亡。第二个方面是保护内脏组织,减轻心脏和肝脏氧化应激作用,并协助增强其他药物的抗氧化效果。研究表明,L-茶氨酸能够减轻小鼠体内阿霉素氧化应激造成的不良反应[13-14]。其机制是L-茶氨酸增加了心脏与肝脏中谷氨酸的浓度,抑制了阿霉素引起的GSH减少[5]。研究表明,L-茶氨酸单独处理小鼠巨噬细胞(RAW264.7)并没有显示出明显抗氧化作用;而L-茶氨酸和表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)联合使用可协同降低胞内ROS和MDA含量,增强谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)的活性,表明L-茶氨酸和EGCG对提高细胞抗氧化能力具有协同增效作用[15]。
尽管L-茶氨酸的抗氧化功效已毋庸置疑,但是具体的分子调节机制尚不完全明确,L-茶氨酸对大鼠内脏组织是否同样具有抗氧化调节作用,目前缺乏相关研究报道。鉴于幼鼠处于快速生长发育阶段,且雌雄大鼠4周内体质量变异度不是很大[16]。同时,研究表明,不同日龄断奶均使仔猪在断奶1 周内遭受严重的应激反应,SOD和GPX的活力明显下降[17]。我们推测3 周龄幼鼠存在一定的心理应激和机体抗氧化功能失调的状况。因此,本实验以3 周龄大鼠为实验对象,灌胃L-茶氨酸2 周,测定内脏组织MDA和NO含量以及SOD、CAT、GPX和NOS活力,同时测定相关抗氧化酶基因(SOD1、SOD2、SOD3和GPX1)的mRNA表达量,旨在探讨L-茶氨酸对大鼠内脏组织抗氧化能力的调节作用及其机理。
1 材料与方法
1.1 动物、材料与试剂
3 周龄清洁级SD大鼠,体质量范围为74~92 g,购自湖南斯莱克景达实验动物有限公司。S D大鼠的生产许可证号为SCXK(湘)2013-0004;合格证号为43004700008040;使用许可证号为KYNEAAM-2013-0009。
L-茶氨酸(99.2%) 雅星生物科技有限公司;CAT活性检测酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒 武汉华美生物工程有限公司;NO、MDA含量检测试剂盒、SOD、NOS与GPX活性检测试剂盒 南京建成生物工程研究所;Trizol试剂盒 美国Invitrogen公司;聚合酶链反应(polymerase chain reaction,PCR)扩增试剂盒 日本Takara公司;RevertAidTMFirst Strand cDNA Synthesis 试剂盒 美国Thermo Fisher 公司。
1.2 仪器与设备
PowerGen125高速匀浆机 赛默飞世尔科技公司;CR22GII高速冷冻离心机 日本日立公司;Allegra x-22r台式离心机 美国Beckman Coulter公司;ABI7900HT荧光定量PCR仪 美国应用生物系统公司;M2104电子天平 梅特勒-托利多国际股份有限公司。
1.3 方法
1.3.1 实验设计
3 周龄的64 只大鼠,单笼喂养,自由进食颗粒饲料和饮用纯净水,控制实验条件为温度(25±3)℃、相对湿度(70±5)%和12 h的光暗循环,适应性喂养3 d后随机分为4 组:对照组、低剂量组、中剂量组和高剂量组,每组16 只,雌雄各半。灌胃前先记录大鼠体质量,然后各组按体质量分别灌胃0、50、200、400 mg/(kg·d)L-茶氨酸溶液(L-茶氨酸溶解于生理盐水),根据大鼠体质量和灌胃用药剂量配制相应的药物浓度。每天灌胃1 次(15~17时),每只每次灌胃量约为体质量的1%(0.8~2.0 mL)。连续灌胃14 d。
1.3.2 样品采集
大鼠被L-茶氨酸灌胃14 d后,禁食不禁水24 h,装入预置乙醚的密封标本缸内麻醉4 min左右至深度昏迷,喷洒医用酒精消毒,断头处死。按照解剖学的方法,在无菌操作台内迅速采集肝脏、脾脏、肾脏和心脏,预冷生理盐水冲洗,剪碎后锡箔纸包裹,液氮速冻,-80 ℃冰箱冻存备用。
1.3.3 样品分析
1.3.3.1 抗氧化指标
样品解冻后,每500 mg样品中加入1 mL 0.01 mol/L盐酸,制成匀浆,在4 ℃以3 500 r/min离心10 min,收集上清液,进行进一步的检测。CAT活性参照武汉华美ELISA试剂盒说明书测定;NO和MDA含量,SOD、NOS和GPX活性均按照南京建成的试剂盒说明书进行测定。
1.3.3.2 RNA提取与实时荧光定量PCR
参照周笑犁等[18]的方法进行RNA提取和qPCR定量。采用Trizol法提取肝脏、脾脏和心脏的总RNA,经紫外分光光度计测得A260nm与A280nm比值在1.8~2.0之间,琼脂糖凝胶电泳法评价RNA的质量。参照Fermentas反转录试剂盒说明书分别将各样品的总RNA进行逆转录合成cDNA,并以此为模板采用实时荧光定量PCR方法测定SOD1、SOD2、SOD3和GPX1的mRNA表达量。引物采用Primer 5.0软件设计,由上海生工生物有限公司合成,序列见表1。以β-肌动蛋白(β-actin)为内参,进行PCR反应,反应体系为10 μL,其中包括:5 μL 2×SYBRPremix Ex TaqTM,0.2 μL 10 μmol/L PCR正向引物,0.2 μL 10 μmol/L PCR反向引物,0.2 μL 50×ROX参考染料,1.0 μL cDNA和3.4 μL 灭菌的ddH2O。反应采用两步法,其条件为:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,荧光检测15 s,共40 个循环。每个反应体系设置2 个重复,每次循环的最后一步收集SYBR Green荧光,循环结束时从60 ℃开始绘制熔解曲线。根据目的基因和β-actin的阈值循环(Ct),采用2-ΔΔCt法[19],计算样品中各抗氧化基因mRNA的相对表达量。

表1 荧光定量引物信息Table1 Information about the primers used for real-time quantitative PCR
1.4 数据统计分析
采用SAS 8.2软件对实验数据进行分析。以L-茶氨酸为主要因素,性别为次要因素,不同L-茶氨酸剂量的差异采用Tukey选项进行多重比较。采用系统分组设计,采用正交对比L-茶氨酸的剂量效应,以每组雌、雄性大鼠检测之和做各组之间两两比较,进行一次和二次效应分析。统计结果以±s表示,P<0.05和P<0.01分别表示差异显著和差异极显著。
2 结果与分析
2.1 L-茶氨酸灌胃对大鼠内脏组织抗氧化指标的影响
由表2可知,在肝脏组织中,L-茶氨酸灌胃对MDA含量,以及SOD、CAT、GPX、NOS活力均没有显著影响。高剂量组雌性大鼠的CAT活力低于雄性(P=0.032);对照组雌性大鼠的GPX活力高于雄性(P=0.017);中剂量组雌性大鼠的NOS活力高于雄性(P=0.047)。
由表3可知,在脾脏组织中,L-茶氨酸灌胃对MDA、 NO含量,以及SOD、CAT、GPX和NOS活性均没有显著影响。对照组(P=0.009 5)与低剂量组(P=0.046)雌性大鼠的MDA含量低于雄性。
由表4可知,在肾脏组织中,L-茶氨酸灌胃影响NO含量(二次效应,P<0.0001),中剂量组增加,高剂量组下降;对其他指标无显著影响。
由表5可知,在心脏组织中,NO含量随着L-茶氨酸灌胃剂量的增加而下降(一次效应,P=0.005);L-茶氨酸剂量对SOD活力(一次效应,P=0.004;二次效应,P=0.044)、CAT活力(二次效应,P=0.000 7)和NOS活力(二次效应,P=0.028)均有影响,高剂量组三者活力最高,中剂量组活力最低;对MDA含量和GPX活力无显著影响(P>0.05)。低剂量组雌性大鼠的MDA含量显著低于雄性(P<0.000 1);对照组雌性大鼠的CAT活性显著低于雄性(P=0.015);高剂量组雌性大鼠的CAT活性显著高于雄性(P=0.000 1);对照组雌性大鼠的GPX(P=0.044)与NOS(P=0.039)的活性显著低于雄性。
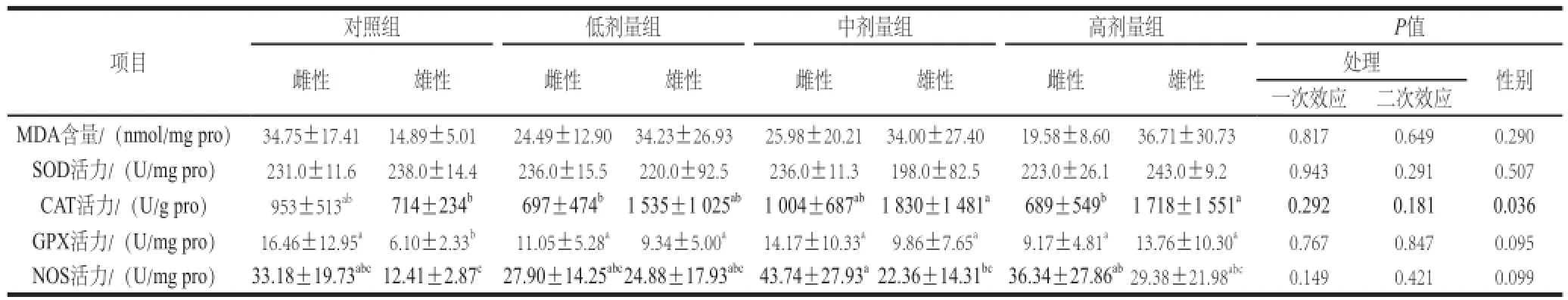
表2 L-茶氨酸给药对大鼠肝脏组织抗氧化的影响Table2 Effect o f L-theanine administration on antioxidant indexes in the rat liver
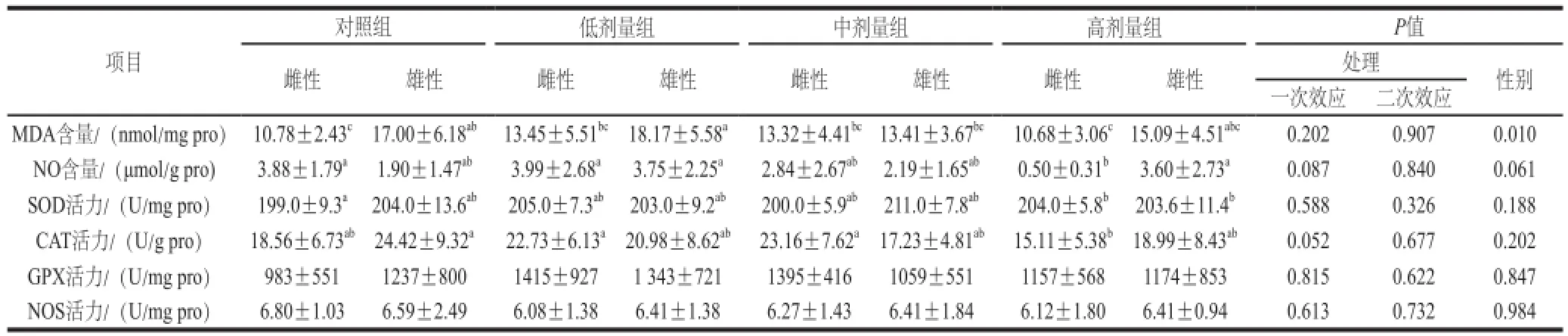
表3 L-茶氨酸给药对大鼠脾脏组织抗氧化的影响Table3 Effect of L-theanine administration on antioxidant indexes in the rat spleen
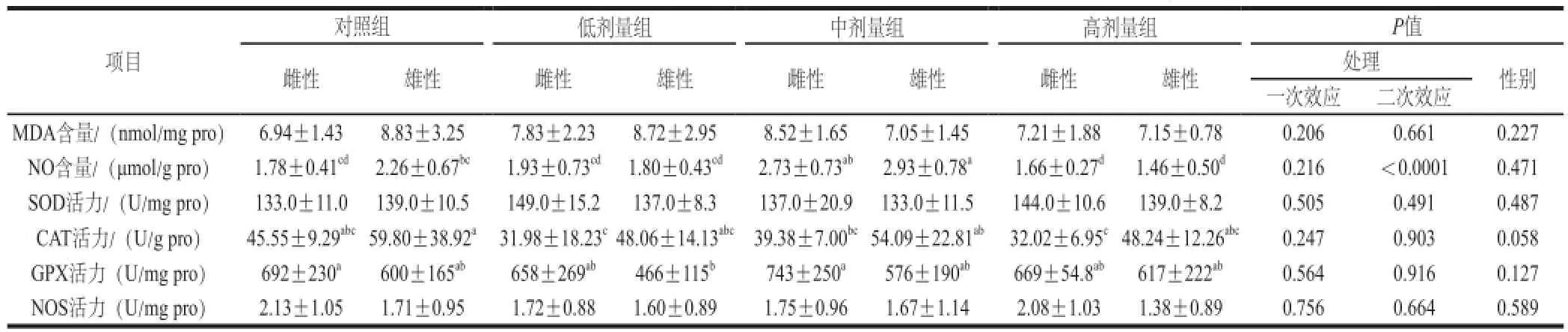
表4 L-茶氨酸给药对大鼠肾脏组织抗氧化指标的影响Table4 Effect of -theanine administration on antioxidant indexes in the rat kidney
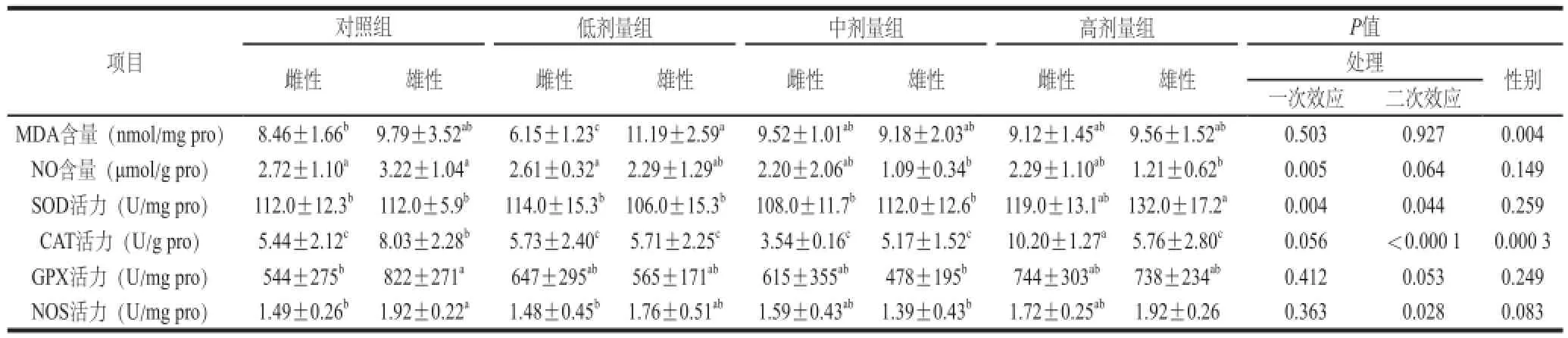
表5 L-茶氨酸给药对大鼠心脏组织抗氧化的影响Table5 Effect o f L-theanine administration on antioxidant indexes in the rat heart
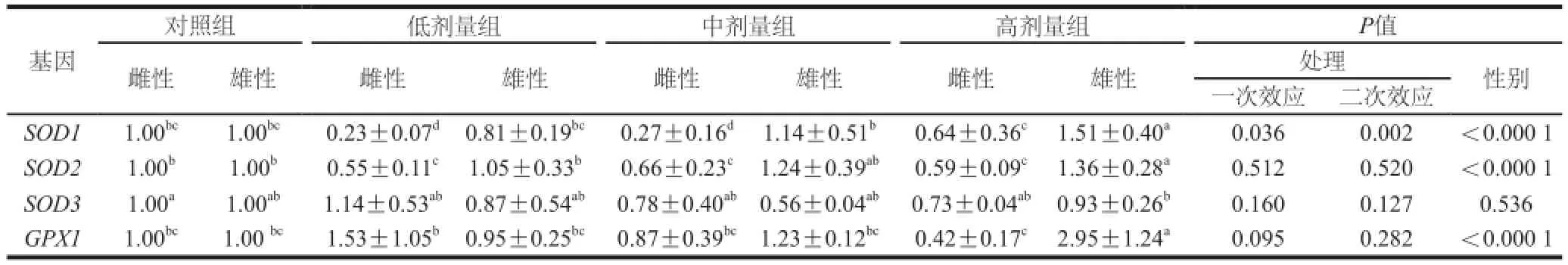
表6 L-茶氨酸给药对大鼠肝脏抗氧化基因表达量的影响Table6 Effect of L-theanine administration on the mRNA expression of antioxidant genes in the rat liver
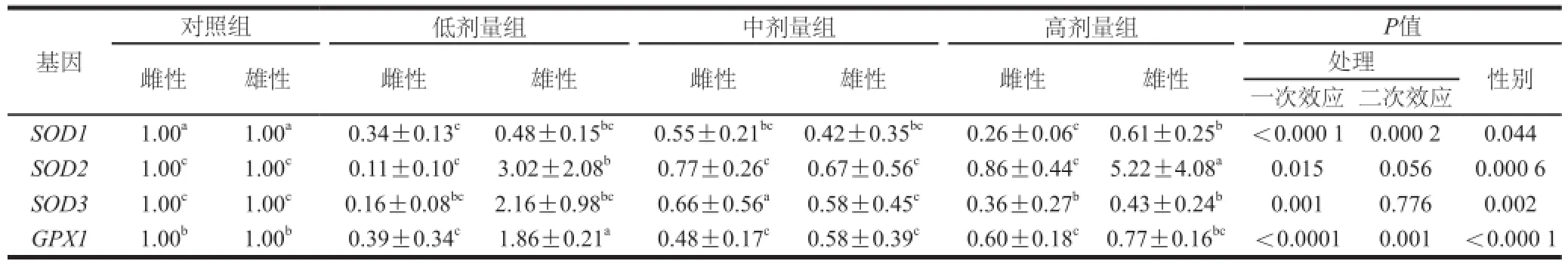
表7 L-茶氨酸给药对大鼠脾脏抗氧化基因表达量的影响Table7 Effect of -theanine administration on the mRNA expression of antioxidant genes in the rat spleen
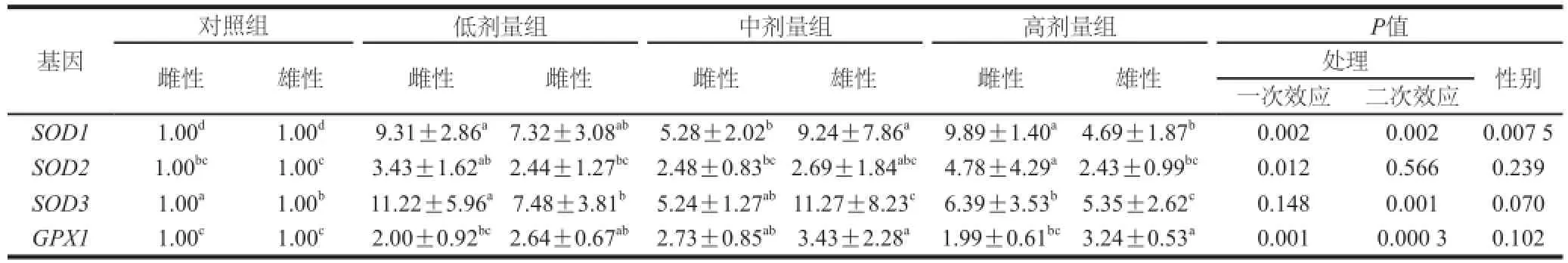
表8 L-茶氨酸给药对大鼠心脏抗氧化基因表达量的影响Table8 Effect of -theanine administration on the mRNA expression of antioxidant genes in the rat heart
2.2 L-茶氨酸灌胃对大鼠内脏组织抗氧化基因表达的影响
由表6可知,在肝脏组织中,L-茶氨酸灌胃剂量显著影响SOD1(一次效应,P=0.036;二次效应,P=0.002)的mRNA表达,低剂量抑制SOD1表达,高剂量则上调其表达量;但L-茶氨酸剂量对SOD2、SOD3和GPX1的mRNA表达没有显著影响。各处理组雌性大鼠的SOD1(分别是P=0.003、P<0.000 1、P<0.000 1)和SOD2(分别是P =0.001 3、P=0.000 1、P<0.000 1)以及高剂量组雌性大鼠的GPX1(P<0.000 1)的mRNA表达量显著低于雄性。
在脾脏组织中(表7),L-茶氨酸灌胃显著下调SOD1的mRNA的表达(一次效应,P<0.000 1;二次效应,P =0.000 2);L-茶氨酸剂量也显著影响SOD2的mRNA表达(一次效应,P=0.015),中剂量抑制SOD2表达,高剂量时则显著上调其表达(P<0.05);对SOD3的mRNA表达的影响则与SOD2正好相反(一次效应,P =0.001)。GPX1的mRNA的表达量随L-茶氨酸的剂量先降低后升高(一次效应,P<0.000 1;二次效应,P =0.01)。高剂量L-茶氨酸灌胃组雌性大鼠的SOD1(P=0.009 2)和SOD2(P =0.000 3)以及低剂量灌胃组雌性大鼠的SOD2(P =0.005 5)、SOD3(P=0.002)和GPX1(P<0.000 1)的mRNA表达都显著低于雄性。
由表8可知,在心脏组织中,L-茶氨酸灌胃剂量对SOD1(一次效应,P=0.002;二次效应P=0.002)、SOD2(一次效应,P=0.012)、SOD3(二次效应P=0.001)和GPX1(一次效应,P=0.001;二次效应,P=0.000 3)的mRNA表达有显著影响,低剂量L-茶氨酸上调了SOD1和SOD3的mRNA表达量,中剂量L-茶氨酸上调GPX1的mRNA表达量,高剂量L-茶氨酸上调了SOD2的mRNA表达量。中剂量L-茶氨酸灌胃组雌性大鼠的SOD1(P=0.031)、SOD3(P=0.015)和高剂量L-茶氨酸给药组雌性大鼠的GPX1(P=0.023)的mRNA表达量低于雄性;而高剂量L-茶氨酸灌胃组雌性大鼠的SOD1(P=0.003)和SOD2(P=0.003)的mRNA表达量显著高于雄性。
3 讨 论
本研究发现,L-茶氨酸给药除了影响大鼠肾脏中NO的含量外,对其他组织的MDA与NO含量,以及SOD、CAT、GPX与NOS活力无影响,但是对心脏组织的抗氧化指标都有一定程度的影响。尤其是高剂量L-茶氨酸给药后,心脏NO含量降至最低,SOD活力、CAT活力升至最大,表明L-茶氨酸对大鼠心脏组织具有显著的抗氧化保护作用,同时SOD与CAT在大鼠心脏中具有协同作用,这与前人的研究结果显示SOD、GPX、CAT三者之间具有协同作用基本一致[20]。本实验结果并未发现L-茶氨酸具有对肝脏的抗氧化保护作用,这与以往的研究结果并不一致,推测其原因可能是因为实验动物(仔鸡和小鼠)[8,11]、用药方式(腹腔注射)[5,10]、处理方式(乙醇与四氯化碳应激模型)[11-12]以及体内外的效应差异(LO2细胞干预处理)[11]不同而导致的。
本研究发现,低剂量L-茶氨酸给药显著抑制肝脏中SOD1与脾脏中SOD1、SOD3、GPX1的mRNA表达,高剂量L-茶氨酸则上调脾脏SOD2的mRNA表达,同时,各剂量组心脏中的SOD1、SOD2、SOD3、GPX1的mRNA表达量都显著增加。而心脏中SOD活力增大,这一结果与SOD2的mRNA表达量增加是一致的,说明心脏中的SOD活力可能是由于SOD2基因的mRNA表达起到主要调控作用。SOD1和SOD3在心脏中的mRNA表达与SOD活性不一致,且SOD亚型基因在不同的内脏组织中表达都存在一定的差异,可能由多种因素导致。一是二者半衰期不同有关。Hollander等[21]认为mRNA的半衰期要比酶蛋白的半衰期短得多,导致mRNA表达量与酶活性不一致[22]。二是由于基因从表达到成功翻译受到许多因子调控[23],在蛋白质水平上存在钝化蛋白[24]、相关降解酶对酶活性进行调控而产生差异。在肝脏和脾脏组织中,L-茶氨酸给药上调或下调了SOD的mRNA表达量,但对SOD活力并无影响,说明L-茶氨酸仅在转录水平上调控肝脏和脾脏SOD各亚型基因的表达,SOD活力还可能受其他因子调控,有待进一步的研究以阐明SOD基因的转录后调控机制。中剂量L-茶氨酸给药上调了大鼠心脏中GPX1的mRNA表达量,且脾脏中GPX1的mRNA表达量随L-茶氨酸的剂量先降低后升高,但是GPX活性不变,说明心脏和脾脏中GPX活性不受GPX1基因的调节。研究表明,GPX基因在大鼠的不同组织中广泛表达,体内硒元素的缺乏会导致GPX基因表达的显著减少[25]。本实验结果与之前的结果不一致,可能是由于GPX的数量与活性由GPX基因的其他亚型的调节引起[26];或者是体内合成GPX的硒元素不够[25]。
本研究还发现,低剂量组雌性大鼠脾脏和心脏的MDA含量低于雄性,高剂量组雌性大鼠心脏的CAT活性、SOD1和SOD2的mRNA表达量高于雄性,说明低剂量和高剂量L-茶氨酸在雌性大鼠的抗氧化效果优于雄性。低剂量灌胃组雌性大鼠脾脏的SOD3、GPX1的mRNA表达都显著低于雄性,中剂量组雌性大鼠肝脏NOS活性高于雄性,心脏SOD1和SOD3的mRNA表达量低于雄性,高剂量组雌性大鼠肝脏的CAT活力、心脏GPX1的mRNA表达量低于雄性,且各处理组雌性大鼠肝脏和脾脏的SOD1和SOD2的mRNA表达量低于雄性。由此说明中剂量L-茶氨酸对雄性大鼠内脏的抗氧化效果强于雌性。相对而言,L-茶氨酸灌胃后对大鼠的内脏组织抗氧化保护作用具有性别特异性,其原因可能是由于抗氧化基因表达的性别差异性造成,具体机制需要进一步的研究探索。
L-茶氨酸灌胃主要增加了大鼠心脏SOD和CAT活性,减少了NO含量,从而提高了心脏的抗氧化能力,其机制可能是L-茶氨酸的灌胃上调了大鼠心脏中SOD2基因的mRNA表达,从而增加心脏中SOD的活性进而起到抗氧化的保护作用。同时L-茶氨酸的灌胃对大鼠内脏抗氧化能力的影响存在性别差异。
[1] KURIHARA S, SHIBAHARA S, ARISAKA H, et al. Enhancement of antigen-specific immunoglobulin G production in mice by coadministration of L-cystine and L-theanine[J]. Journal of Veterinary Medical Science, 2007, 69(12): 1263-1270. DOI:10.1292/jvms.69.1263.
[2] LI G, YE Y, KANG J, et al. L-Theanine prevents alcoholic liver injury through enhancing the antioxidant capability of hepatocytes[J]. Food and Chemical Toxicology, 2012, 50(2): 363-372. DOI:10.1016/ j.fct.2011.10.036.
[3] KAMATH A B, WANG L, DAS H, et al. Antigens in tea-beverage prime human γδ T cells in vitro and in vivo for memory and nonmemory antibacterial cytokine responses[J]. Proceedings of the National Academy of Sciences, 2003, 100(10): 6009-6014. DOI:10.1073/pnas.1035603100.
[4] BUKOWSKI J F, PERCIVAL S S. L-theanine intervention enhances human γδ T lymphocyte function[J]. Nutrition reviews, 2008, 66(2):96-102. DOI:10.1111/j.1753-4887.2007.00013.x.
[5] SUGIYAMA T, SADZUKA Y. Theanine, a specif i c glutamate derivativein green tea, reduces the adverse reactions of doxorubicin by changing the glutathione level[J]. Cancer Letters, 2004, 212(2): 177-184. DOI:10.1016/S0304-3835(04)00272-1.
[6] KANADASWAMI C, LEE L T, LEE P P, et al. The antitumor activities of flavonoids[J]. In Vivo, 200 5, 19(5): 895-909. DOI:10.1016/ j.jocn.2006.01.018.
[7] GONG Y S, LUO Y F, HUAN G J A, et al. Theanine improves stress resistance in Caenorhabditis elegans[J]. Journal of Functional Foods, 2012, 4(4): 988-993. DOI:10.1016/j.jff.2012.04.005.
[8] 汪丽伟, 蔡海 莹. 茶多酚和L-茶氨酸对热应激下蛋用仔公鸡生长性能及抗氧化能力的影响[J]. 中国畜牧兽医, 2013, 40(12): 76-80.
[9] LOGUERCIO C, FEDERICO A. Oxidative stress in viral and alcoholic hepat itis[J]. Free Radical Biology & Medicine, 2003, 34(1):1-10. DOI:10.1016/S089 1-5849(02)01167-X.
[10] SADZUKA Y, INOUE C, HIROOKA S, et al. Effects of theanine on alcohol metabolism and hepatic toxicity[J]. Biological & Pharmaceutical Bulletin, 2005, 28(9): 1702-1706. DOI:10.1248/ bpb.28.1702.
[11] LI G L, YE Y, KANG J J, et al. L-Theanine prevents alcoholic liver injury through enhancing the antioxidant capability of hepatocytes[J]. Food and Chemical Toxicology, 2012, 50(2): 363-372. DOI:10.1016/ j.fct.2011.10.036.
[12] JIANG W, GAO M, S UN S A, et al. Protective effect of L-theanine on carbon tetrachloride-induced acute liver injury in mice[J]. Biochemical and Biophysical Research Communications, 2012, 422 (2): 344-350. DOI:10.1016/j.bbrc.2012.05.022.
[13] SUGIYAMA T, SADZU KA Y. Theanine and glutamate transporter inhibitors enhance the antitumor efficacy of chemotherapeutic agents[J]. Biochimica et Biophysica Acta (B BA)-Reviews on Cancer, 2003, 1653(2): 47-59. DOI:10.1016/S0304-419X(03)00031-3.
[14] SADZUKA Y, SUGIYAMA T, MIYAGISHIMA A, et al. The effects of theanine, as a novel biochemical modulator, on the antitumor activity of adriamycin[J]. Cancer Letters, 1996, 105(2): 203-209. DOI:10.1016/0304-3835(96)04 282-6.
[15] 刘晓慧, 揭国良, 林康,等. EGCG和茶氨酸对细胞氧化损伤的协同保护和修复作用研究[J]. 茶叶科学, 2014, 34(3): 239-247. DOI:10.13305/j.cnki.jts.2014.03.005.
[16] 项华, 章晓玲, 查捷, 等. SD大鼠生长发育指标和主要脏器正常参考值的探讨[J]. 中国卫生检验杂志, 2008, 18(2): 299-301. DOI:10.3969/j.issn.1004-8685.2008.02.043.
[17] 冷静, 朱仁俊. 不同日龄断奶应激对仔猪抗氧化酶活性的影响[J].广东农业科学, 2010, 37(2): 125-127. DOI:10.3969/j.issn.1004-874X.2010.02.043
[18] 周笑犁, 刘俊锋, 吴琛, 等. 精氨酸和N-氨甲酰谷氨酸对环江香猪脂质代谢的影响[J]. 动物营养学报, 2014, 26(4): 1055-1060. DOI:10.3969/j.issn.1006-267x.2014.04.026.
[19] 许友卿, 张青红, 李颖慧, 等. 饲料中添加杜仲叶粉对青鱼生长和组织免疫相关基因表达的影响研究[J]. 农业现代化研究, 2015, 36(6):1074-1079. DOI:10.13872/j.1000-0275.2015.00 77.
[20] 毕占英, 林彦玮, 杨锋, 等. 支气管肺炎时超氧化物歧化酶、过氧化氢酶及谷胱甘肽过氧化酶的变化及相关性[J]. 中国冶金工业医学杂志, 1998, 15(3): 131-133.
[21] HOLLANDER J, FIEBIG R, GORE M, et al. Superoxide dismutase gene expression is activated by a single bout of exercise in rat skeletal muscle. European Journal of Physiology, 2001, 442(3): 426-434. DOI:10.1007/s004240100539.
[22] CLERCH L B, WRIGHT A, CHUNG D J. Evidence that glutathione peroxidase RNA and manganese superoxide dismutase RNA bind the same protein[J]. Biochemical & Biophysical Research Communications, 1996, 222(2): 590-594. DOI:10.1006/bbrc.1996.0788.
[23] 王庭璋, 胡望雄, 徐建红, 等. 植物基因组上游开放阅读框的挖掘方法及其翻译调控[J]. 中国农业科学, 2013, 46(16): 3314-3323. DOI:10.3864/j.issn.0578-1752.2013.16.002.
[24] 刘丽, 甘志军, 王宪泽. 植物氮代谢硝酸还原酶水平调控机制的研究进展[J]. 西北植物学报, 2004, 24(7): 1355-1361. DOI:10.3321/ j.issn:1000-4025.2004.07.038.
[25] EVENSON J K, WHEELER A D, BLAKE S M, et al. Selenoprotein mRNA is expressed in blood at levels comparable to major tissues in rats[J]. Journal of Nutrition, 2004, 134 (10): 2640-2645.
[26] 张建新, 王茜, 荀文娟, 等. GPXs家族基因在山羊不同组织和睾丸不同发育时期的表达特性研究[J]. 畜牧兽医学报, 2011, 42(5):650-657.
Effect of L-Theanine on Antioxidant Capacity and Related Gene mRNA Expression in Rat Visceral Tissues
LI Chengjian1,2,3, TONG Haiou1,2, YAN Qiongxian2,⋆, HAN Xuefeng1,2, XIAO Wenjun1,⋆, TAN Zhiliang2
(1. Provincial Co-Innovation Center for Utilization of Botanical Function Ingredients, Key Laboratory of Tea Science , Ministry of Education, College of Horticultureand Landscape, Hunan Agricultural University, Changsha 410128, China; 2. Hunan Provincial Engineering Research Center for Healthy Livestock and Poultry Production, South-Central Experimental Station of Animal Nutrition and Feed Science in Ministry of Agriculture, Key Laboratory of Agro-Ecological Processes in Subtropical Region, Institute of Subtropical Agriculture, The Chinese Academy of Sciences, Changsha 410125, China; 3. Department of Pharmacy, Yongzhou Vocational Technical College, Yongzhou 425100, China)
Objective: This study aimed to explore the regulatory effect and mechanism of intragastric administration of L-theanine on antioxidant capacity and the mRNA expression of antioxidant enzymes in the heart, liver, spleen and kidney tissues of rats. Methods: Sixty-four Sprague Dawley rats were randomly divided into control group (CON), low-dose group (LT), middle-dose group (MT) and high-dose group (HT) (with 16 animals in each group, half male and half female), which were lavaged daily with L-theanine solution at doses of 0, 50, 200 and 400 mg/kg, respectively for 14 consecutive days. After the last administration, the contents of malondialdehyde (MDA) and nitric oxide (NO), the activities of superoxide dismutase (SOD), glutathioneperoxidase (GPX), catalase (CAT) and nitric oxide synthase (NOS), and the mRNA expression of SOD1, SOD2, SOD3 and GPX genes were determined in rat visceral tissues. Results: L-Theanine administration influenced the content of NO and the activities of SOD, CAT and NOS in the rat heart. The HT group presented the lowest NO content in the heart tissue among the four groups tested, and increased the activities of SOD and CAT to the highest levels. The NO content in the rat kidney was also impacted by L-theanine administration, and it was the lowest in the HT group. However, no significant effects were observed on the contents of MDA and NO, or the activities of SOD, CAT, GPX and NOS in rat liver, spleen, kidney and heart tissues except the above parameters. The mRNA expression of SOD1 in the liver, and SOD1, SOD3 and GPX1 in the spleen were significantly inhibited in the LT group, the mRNA expression of SOD2 in the spleen was up-regulated in the HT group, and the mRNA expression of SOD1, SOD2, SOD3 and GPX1 in the heart were increased significantly at all doses of L-theanine. Conclusion: L-Theanine administration could enhance antioxidant capacity in the heart, via a mechanism associated with increased SOD activity due to up-regulated mRNA expression of SOD2. At the same time, the effect of L-theanine administration on antioxidant capacity in rat visceral tissues was gender-dependent.
L-theanine; antioxidant capacity; visceral tissues; gene expression; rats
10.7506/spkx1002-6630-201703031
TS202.3
A
1002-6630(2017)03-0188-07
2016-01-25
中央驻湘科研机构技术创新发展专项(2013TF3006)
李成舰(1974—),男,副主任药师,博士,研究方向为药用植物功能成分的开发利用和作用评价。E-mail:413874272@qq.com
⋆通信作者:颜琼娴(1984—),女,助理研究员,博士,研究方向为动物营养生态学。E-mail:yanqx14@isa.ac.cn肖文军(1969—),男,教授,博士,研究方向为茶及植物功能成分利用。E-mail:xiaowenjun88@sina.com
李成舰, 童海鸥, 颜琼娴, 等. L-茶氨酸对大鼠内脏组织抗氧化能力及相关基因表达的影响[J]. 食品科学, 2017, 38(3):188-194. DOI:10.7506/spkx1002-6630-201703031. http://www.spkx.net.cn
LI Chengjian, TONG Haiou, YAN Qiongxian, et al. Effect of L-theanine on antioxidant capacity and related gene mRNA expression in rat visceral tissues[J]. Food Science, 2017, 38(3): 188-194. (in Chinese with English abstract)
10.7506/ spkx1002-6630-201703031. http://www.spkx.net.cn

