嗜酸乳杆菌胞外蛋白调控MAPK和PI3K-AKT信号途径关键蛋白活化水平
王 泳,贾 彦,任效东,明 珠,江 岩,赵 培⋆,庞广昌,阎亚丽,陈庆森⋆
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
嗜酸乳杆菌胞外蛋白调控MAPK和PI3K-AKT信号途径关键蛋白活化水平
王 泳,贾 彦,任效东,明 珠,江 岩,赵 培⋆,庞广昌,阎亚丽,陈庆森⋆
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
探讨并揭示嗜酸乳杆菌(Lactobacillus acidophilus)CICC6005分泌的相关蛋白质促进肠道健康及分子机制具有重要研究价值。本实验在确定了L. acidophilus CICC6005分泌的胞外蛋白抑制HT-29结肠癌细胞增殖的基础上,进一步探讨67 ku和37 ku的胞外蛋白通过何种途径发挥抑制结肠癌细胞增殖。研究以HT-29细胞作为靶细胞,用丝裂原激活的蛋白激酶(mitogen activated protein kinase,MAPK)和磷脂酰肌醇-3激酶-丝氨酸/苏氨酸蛋白激酶(phosphatidylinositol 3-kinase-protein kinase B,PI3K-AKT)信号通路为考察对象,以Western Blotting为手段,分析两个通路中关键的靶点蛋白p38、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)、胞外信号调节激酶(extracellular signal-regulated kinase,ERK)、磷酸化p38(phosphorylated p38,p-p38)、磷酸化c-Jun氨基末端激酶(phosphorylated c-Jun N-terminal kinase,p-JNK)、磷酸化的细胞外信号调节蛋白激酶(phosphorylated extracellular signal-regulated kinase,p-ERK)、磷酸化蛋白激酶B(phosphorylated AKT,p-AKT)、PI3K的表达水平,以探讨并阐述源于L. acidophilus CICC6005胞外蛋白调控结肠癌细胞增殖状况的分子机制。结果表明,不同质量浓度的67 ku和37 ku胞外蛋白分别作用HT-29细胞一定时间后,两种胞外蛋白均具有下调两个信号通路途径中p-ERK1/2、p-p38、p-AKT、PI3K蛋白的表达,且存在浓度依赖关系;但对p-JNK、ERK1/2、p38、JNK蛋白的表达没有影响。因此,源于L. acidophilus CICC6005分泌的37 ku和67 ku胞外蛋白表现出显著的抑制HT-29细胞增殖的功能,其机制可能与调控MAPK和PI3K-AKT两个信号通路中几个关键的靶点蛋白的活化水平相关。该研究结果提示,食用嗜酸乳杆菌其分泌的胞外蛋白质将达到维护肠道健康的目标。
嗜酸乳杆菌CICC6005;胞外蛋白;HT-29结肠癌细胞;丝裂原活化蛋白激酶(MAPK);磷脂酰肌醇-3激酶-丝氨酸-苏氨酸蛋白激酶(PI3K-AKT)
嗜酸乳杆菌(Lactobacillus acidophilus)天然存在于人和动物的胃肠道和口腔中,有益生保健特性,常与嗜热链球菌、保加利亚乳杆菌一同用于酸奶的生产[1]。已报道的L. acidophilus生物学功能主要有:耐胃酸和耐胆汁盐,可顺利通过人体胃肠道系统[2];产VK和乳糖酶,有些菌株能产生细菌素,如:嗜酸乳菌素(acidolin)、乳酸菌素(acidophilin)、乳酸杀菌素(lactocidin),抑制病原菌和腐败菌的生长,维护肠道健康[3]。美国梅奥诊所把L. acidophilus用于心脏病治疗,虽尚处于“传统或科学理论”和“未进行彻底的人体试验、安全性和有效性尚未证明”阶段[4],但已证实其有改善肠道微生态失衡以及生物拮抗作用[5-6]。近期比较热门的几种L. acidophilus菌株的研究,均与人类健康密切相关。美国营养学会上的一篇报道指出酸奶中L. acidophilus L1降低血清胆固醇浓度6%~10%,能有效降低冠心病发病率[7]。L. acidophilus LA-5菌株与肠相关淋巴组织(gutassociated lymphoid tissue,GALT)和脂代谢密切相关,主要表现为增强细胞因子表达、抗体功能以及沙门氏菌吞噬作用、改善及增强肠道菌群多样性、调节机体免疫力、降低胆固醇水平、缓解乳糖不耐症、抑制肠黏膜肿瘤细胞的增殖[8-10]。还发现L. acidophilus LA-5能抑制乳腺癌细胞的生长[11]。L. acidophilus NCFM存活于健康和疾病人群的胃肠道系统中,也是常规食品(牛奶、酸奶和婴幼儿奶粉)和膳食补充剂中常见的益生菌。从表现型和遗传型上把L. acidophilus NCFM归为A1型嗜酸乳杆菌菌株[12]。菌株NCFM的功能主要有抑制诱导大鼠异常隐窝的形成、降低了结肠癌发病率、显著降低小肠细菌过度生长的透析病人血液中毒胺的水平、促进乳糖不耐症患者对乳糖的消化等。还发现菌株NCFM能在Caco-2和HT-2黏液分泌细胞培养系统中生存,产生抗菌活性物质,能很好的用于遗传操作和DNA的导入[13]。人们日常消费的L. acidophilus NCFM也有抗炎作用,其能缓解发烧、咳嗽、流鼻涕等症状[14-15]。益生菌与人体健康的作用机制尚需更深入研究。
有研究揭示食用经过遗传改造的L. acidophilus能重置小鼠可能导致癌症的免疫应答,并缩小前癌结肠息肉[16]。此前已有对肠道微生物L. acidophilus的研究证实,若删除其脂磷壁酸(lipteihcoicacid,LTA)分子的基因,会降低导致小鼠结肠炎的炎症应答[17]。为研究LTA是否为促进肿瘤过度活跃的炎症应答的因素之一,Khazaie等[16]给病理性炎症和前癌结肠息肉的小鼠口服缺乏LTA的L. acidophilus,结果证实该疗法重置了过度活跃的炎症应答,小鼠的肠内环境恢复到了健康的平衡态;除此,还发现L. acidophilus可能具有调控肠内免疫、逆转某些前癌状态及预防诸如结肠癌等炎症驱动的恶性肿瘤的功能。
已有研究表明,益生菌分泌的一些代谢产物具有免疫调节作用,能够促进肠道稳态,在保健食品的开发研究中具有显著的开发潜力[18]。研究结果已经阐述了益生菌的胞外蛋白可以参与调节肠黏膜的免疫机制,包括与定殖在肠道的菌群的“信息交流”、与宿主免疫系统之间的相互作用、调节黏膜屏障功能等,通过这些机制可以促进肠道稳态。胞外蛋白对肠黏膜免疫机制的调节通过可识别胞外蛋白的受体的互作来实现,如Toll样受体等,通过胞内信号级联识别胞外蛋白及其携带的信息。一般情况下,信号要通过不同的通路途径进行传输,如丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路,磷脂酰肌醇-3激酶-丝氨酸/苏氨酸蛋白激酶(phosphatidylinositol-3-kinase-protein kinase B,PI3K-AKT)信号通路和糖原合成激酶-3(glycogen synthase kinase 3,GSK-3)信号通路等[19]。这些信号通路途径的激活会引起下游基因表达的改变,从而细胞水平也随之发生改变。因此,MAPK和PI3K-AKT信号传导通路在结直肠癌的发生发展中具有很重要的作用,弄清胞外蛋白作用的信号通路对结肠癌中的作用机制,并且对其靶点(即一些关键蛋白)进行早期干预,可以减轻肠道黏膜的损伤,维持肠上皮稳态,防止结肠癌等肠道疾病的发生[20-21]。Schlee等[22]研究发现L. acidophilus PZ 1138、发酵乳杆菌PZ 1162,干酪乳杆菌干酪亚种LMGP-17806混合益生菌分泌的胞外蛋白可以通过激活NF-κB和MAPK信号通路诱导上皮细胞抗菌肽hβD-2的分泌。Bernardo等[23]研究发现植物乳杆菌分泌的肽类物质可以诱导人类肠道树突细胞产生白细胞介素(interleukin,IL)-10,IL-10对炎症、自身免疫疾病的预防和肠道稳态的维持有很重要的作用。
近些年来,益生菌分泌的胞外蛋白成为学者们研究的一个新的热点,相关生理功能的研究已有报道。目前,胞外蛋白可分为两类,第一类是含有信号肽且位于序列N-末端的蛋白质,第二类是因细菌细胞壁的正常周期从细菌直接脱落的蛋白质。分泌胞外蛋白的益生菌主要有乳酸杆菌、双歧杆菌、大肠杆菌等[24-25]。Yan Fang等[26]采用离子交换法从鼠李糖乳杆菌上清液纯化出两种蛋白质p75、p40,它们通过激活蛋白PI3K-AKT信号通路,从而抑制细胞凋亡和防止小鼠肠上皮细胞的损伤,揭示了p75和p40是一类促生长因子,是维持人类胃肠道稳态重要的分泌蛋白,可以通过特殊的信号通路保护肠黏膜屏障并促进肠上皮稳态。因此,这些研究确认了益生菌分泌的胞外蛋白在肠道黏膜中发挥着很重要的免疫调节作用,为肠道疾病特别是肠道肿瘤的缓解、修复和治疗方面开辟一条新途径。
基于以上研究成果,阐明益生菌分泌的胞外蛋白维持人类胃肠道稳态和保护肠黏膜屏障的机制是一个非常重要的科学问题。本研究将以L. acidophilus CICC6005分离纯化的胞外蛋白为研究对象,以人HT-29结肠癌细胞作为模型,通过对MAPK和PI3K-AKT信号传导通路途径中关键蛋白因子的研究,进一步探讨并揭示L. acidophilus CICC6005胞外蛋白抑制结肠癌细胞的分子机制,并为L. acidophilus CICC6005分泌的胞外蛋白作为抑制、治疗结肠癌的生物功能产品的开发提供新依据。
1 材料与方法
1.1 菌株、材料与试剂
嗜酸乳杆菌(Lactobacillus acidophilus)CICC6005的 67 ku和37 ku胞外蛋白产物,由天津市食品生物技术重点实验室分离纯化获得[27]。
人结肠癌HT-29细胞购自江苏齐氏生物科技有限公司。
全蛋白抽提试剂盒、BCA蛋白定量试剂盒、5×蛋白上样缓冲液、辣根过氧化物酶(horse radish peroxidase,HRP)标记山羊抗兔免疫球蛋白G(immunoglobulin G,IgG) 北京康为世纪生物科技有限公司;蛋白预染Marker #0671 立陶宛Fermantas公司;改良型RPMI-1640培养基 美国Hyclone公司;胎牛血清 美国Gibco公司;兔抗人c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)单克隆抗体、兔抗人细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)单克隆抗体、兔抗人p38单克隆抗体、兔抗人磷酸化p38(phosphorylated p38,p-p38)单克隆抗体、兔抗人p-JNK单克隆抗体、兔抗人p-ERK单克隆抗体、兔抗人p-AKT单克隆抗体、兔抗人PI3K单克隆抗体 美国Cell Signaling Technology公司;兔抗人β-肌动蛋白多克隆抗英国Abcam公司;ECL超敏底物化学发光检测试剂盒美国Millipore公司。
1.2 仪器与设备
DYCZ-24DN型迷你双垂直电泳槽、DYCZ-40D型迷你转印电泳槽、DYY-2C型电泳仪 北京六一仪器厂;PVDF膜(0.45 μm) 美国Millipore公司;X射线摄影暗匣(127 mm×178 mm) 广东粤华医疗器械厂有限公司;X-OMAT型医用X射线胶片 锐珂(厦门)医疗器材有限公司。
1.3 方法
1.3.1 人结肠癌HT-29细胞培养及药物干预
用于HT-29细胞生长的培养基:10 mL胎牛血清和90 mL改良型RPMI-1640培养基混匀。细胞冻存液:5 mL胎牛血清、改良型4 mL RPMI-1640培养基和1 mL 10%二甲基亚砜(dimethyl sulfoxide,DMSO)混匀。
人结肠癌细胞株HT-29,接种于直径100 mm培养皿中,贴壁后分组药物刺激48 h。分组:对照组(只有HT-29细胞)、37 ku胞外蛋白组(HT-29细胞+37 ku胞外蛋白)、67 ku胞外蛋白组(HT-29细胞+67 ku胞外蛋白)。两种胞外蛋白干预剂量的参照文献[28],67 ku和37 ku胞外蛋白组剂量均设4 个质量浓度组,分别为0.001、0.010、0.100、1.000 μg/mL。
1.3.2 提取细胞总蛋白
人结肠癌HT-29细胞总蛋白质的提取,按全蛋白抽提试剂盒说明书进行操作。提取蛋白于-80 ℃分装保存,避免反复冻融。采用二喹啉甲酸法确定总蛋白量,操作按说明书步骤。
1.3.3 Western Blotting
参照文献[28]的方法。L. acidophilus CICC6005胞外蛋白对MAPK和PI3K-AKT信号通路中p38/p-p38(38 ku)、ERK/p-ERK(42/44 ku)、JNK/p-JNK(46/54 ku)、p-AKT(60 ku)和PI3K(85 ku)的表达水平的检测分析,其中加样操作:向细胞总蛋白加入5×蛋白上样缓冲液,前者与后者体积比4∶1,煮沸变性5 min,冷却至室温,用微量加样器吸取样品,潜水加样。检测蛋白质的转膜条件如表1。

表1 MAPK和PI3K-AKT信号通路中各检测蛋白质的转膜条件Table1 Transmembrane conditions for measured proteins involved in MAPK and PII33KK--AAKKTT signaling pathways
1.4 统计学分析
使用SPSS 17.0统计软件对实验数据进行分析处理,进行单因素方差分析,处理结果以±s表示,定义P<0.05为差异有统计学意义。
2 结果与分析
2.1 L. acidophilus CICC6005胞外蛋白对HT-29结肠癌细胞MAPK信号通路的影响
根据本研究方案的设计,重点考察L. acidophilus CICC6005胞外蛋白对HT-29结肠癌细胞MAPK信号通路家族中3 个关键靶点蛋白(p38、ERK和JNK)活化水平,确定胞外蛋白干预后是否通过调控这几个关键蛋白的活性状态达到MAPK信号通路的调控,最终阐述胞外蛋白抑制HT-29细胞的增殖的分子水平。
p38是MAPK家族成员之一,当p38受到外界刺激时,其苏氨酸(Thr180)与酪氨酸(Tyr182)磷酸化同时被激活,激活后的p38 MAPK作用于其下游底物,包括各种转录因子等,使其转录活性升高,导致疾病的发生。因此有效控制这条信号传导通路的活性,可达到缓解和治疗疾病的作用[29]。ERK1/2通路是MAPK的一个重要信号途径,在调节细胞的生长、迁移、分化、存活和凋亡中具有重要作用。JNK是MAPK超家族成员之一,特异性刺激因素先引起丝裂原活化蛋白激酶激酶激酶(mitogenactivated protein kinase kinase kinase,MAPKKK)活化,接下来磷酸化和活化MAPKK的亚型MKK4和MKK7,它们再依次磷酸化和活化JNK[30],活化后的JNK可以参与下游相关基因表达,从而导致疾病的发生。采用Western Blotting技术检测各组HT-29细胞p38、p-p38、ERK1/2、p-ERK1/2、JNK、p-JNK蛋白表达量的变化,结果分别如图1所示,随后利用Quantity One凝胶成像分析软件获得各个条带的灰度积分值,以β-肌动蛋白作为内参对各目的蛋白进行标准化定量,得到的各组样品p38、p-p38、ERK1/2、p-ERK1/2、JNK、p-JNK的相对灰度积分值,分别见图2所示。
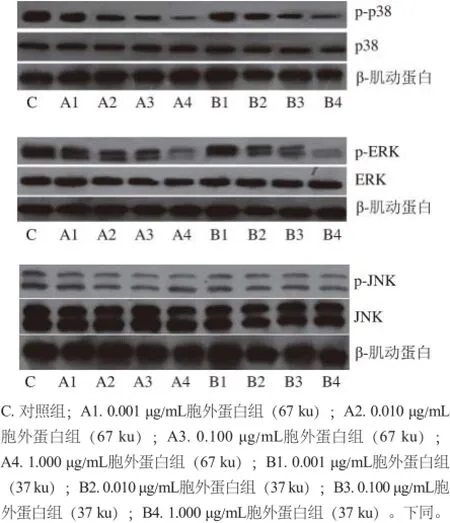
图1 嗜酸乳杆菌胞外蛋白对HT-29细胞各蛋白表达量的影响Fig.1 Effect of extracellular proteins from L. acidophilus on protein expression in HT-29 cells
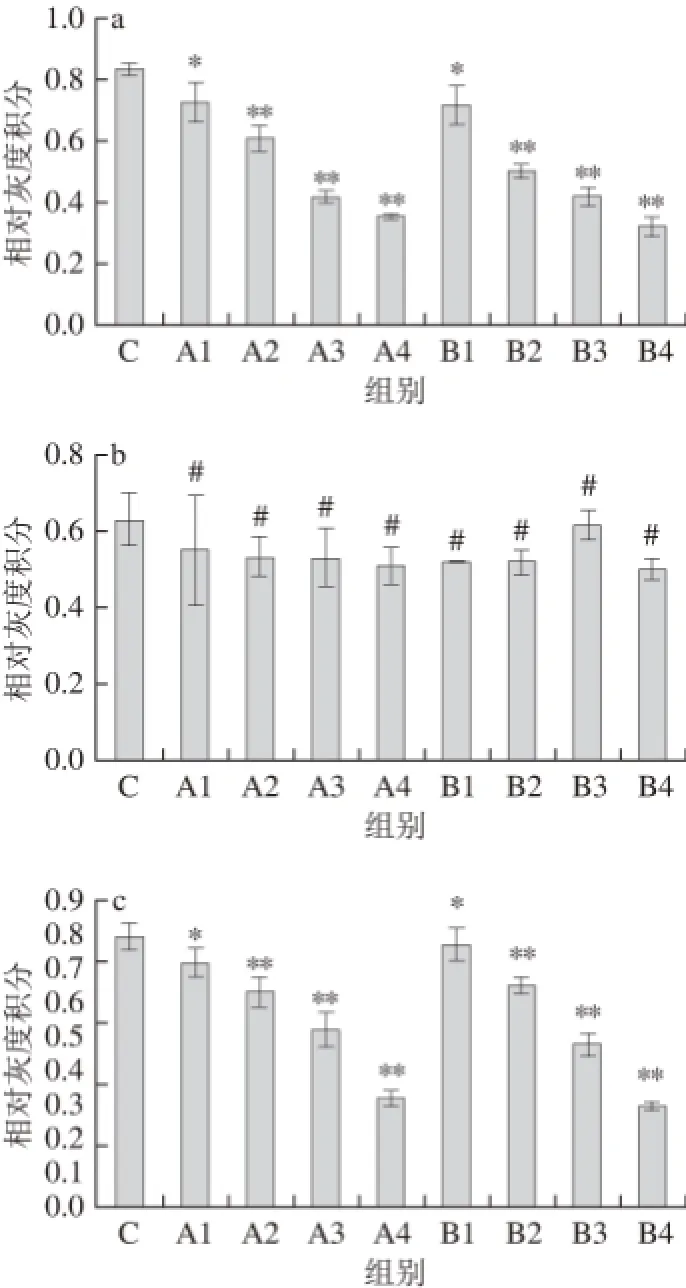
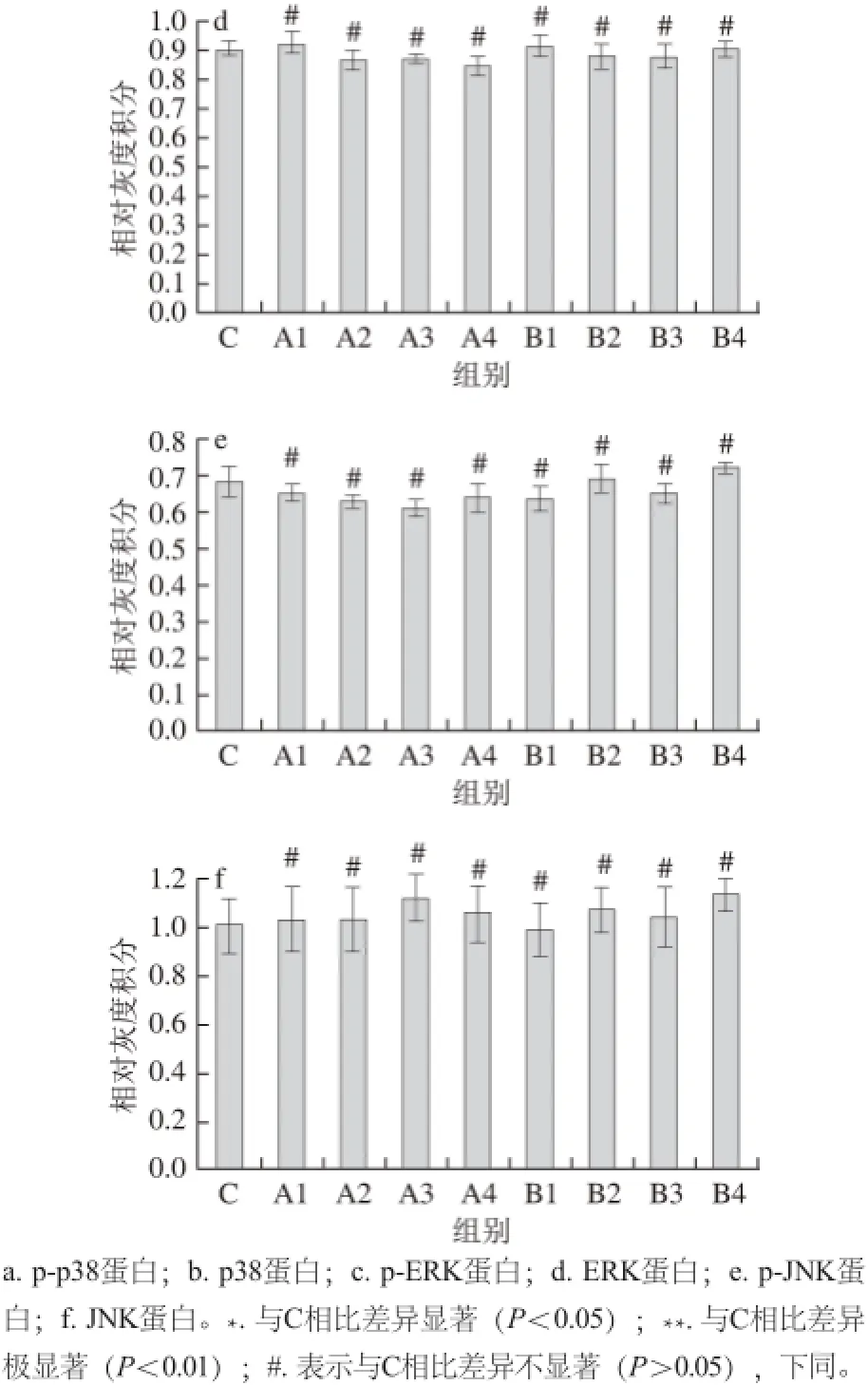
图2 不同胞外蛋白质质量浓度作用HT-29细胞对各组蛋白表达量的影响Fig.2 Changes in protein expression in HT-29 cells exposed to different concentrations of extracellular proteins from L. acidophilus
由图2a可知,不同质量浓度67 ku胞外蛋白作用HT-29细胞48 h,p38蛋白的磷酸化程度随其质量浓度的增大而逐渐减弱,其中A1组与对照组比较p-p38蛋白的表达抑制较为显著(P<0.05),A2、A3、A4组能极显著降低p38蛋白磷酸化程度(P<0.01);p38蛋白的磷酸化程度也随37 ku胞外蛋白质量浓度的增大而减弱,B1、B2、B3、B4组能显著抑制p-p38蛋白的表达,其中,B2组、B3组、B4组与对照组比较差异极显著(P<0.01)。由图2b可知,各组总p38蛋白的表达与对照比较,无显著性差异(P>0.05)。由图2c、d可知,ERK磷酸化程度较对照组都显著下降,并呈现出剂量依赖性,其中,A1,B1组显著降低ERK磷酸化的表达(P<0.05),A2、A3、A4、B2、B3、B4组能极显著降低ERK磷酸化的表达(P<0.01);ERK的表达不随胞外蛋白质量浓度的变化而改变,即各组ERK蛋白的表达与对照组比较,无显著性差异(P>0.05)。由图2e、f可知,各组JNK蛋白表达量与对照组比较,均无显著性差异(P>0.05)。两种胞外蛋白分别在不同质量浓度条件下处理HT-29细胞48h,JNK的磷酸化程度也不随胞外蛋白质量浓度的增大而发生改变,各组p-JNK蛋白表达量与对照组比较,无显著性差异(P>0.05)。
2.2 L. acidophilus CICC6005胞外蛋白对HT-29结肠癌细胞PI3K-AKT信号通路影响的研究
AKT是细胞通路PI3K-AKT的关键分子,在细胞内信号转导系统中位于PI3K的下游。PI3K是肠上皮细胞增殖信号的一条主要信号途径。HT-29结肠癌细胞的增殖主要依赖PI3K的活性[31],因此,抑制PI3K的活性,有利于对结肠癌的缓解和治疗。采用Western Blotting技术检测各组HT-29细胞p-AKT、PI3K蛋白表达量的变化,结果如图3所示,随后利用Quantity One凝胶成像分析软件获得各个条带的灰度积分值,以β-肌动蛋白作为内参对p-AKT和PI3K目的蛋白进行标准化定量,得到的各组样品p-AKT和PI3K蛋白的相对灰度积分值,见图4所示。
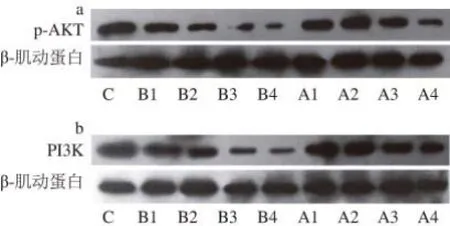
图3 嗜酸乳杆菌胞外蛋白对HT-29细胞p-AKT(a)、PI3K(bb)蛋白表达量的影响Fig.3 Effect of extracellular proteins from L. acidophilus on the expression of p-AKT (a) and PI3K (b) in HT-29 cells
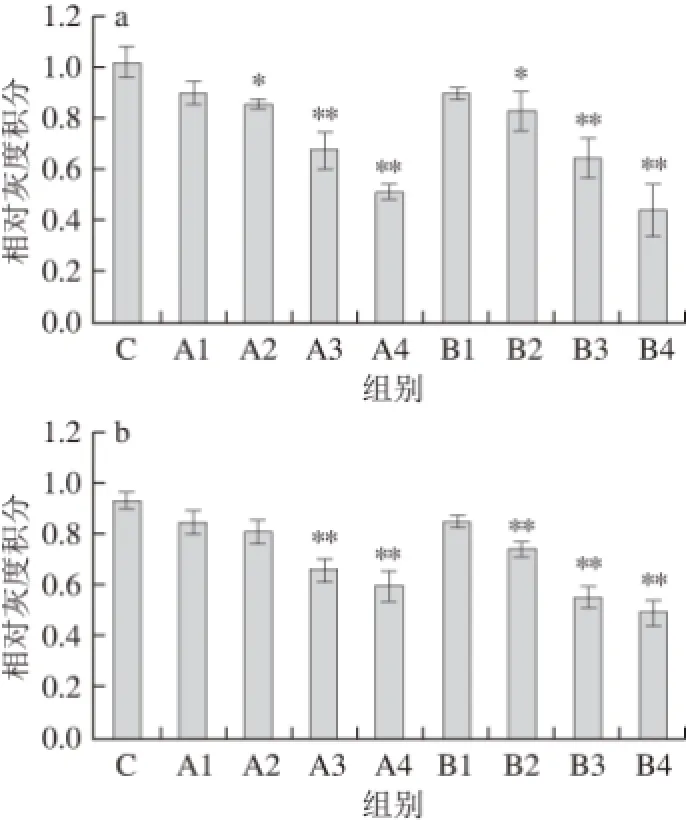
图4 不同蛋白质质量浓度对HT-29细胞p-AKT(a)、PI3K(bb)表达量的变化Fig.4 Changes in protein expression of p-AKT (a) and PI3K (b) in HT-29 cells exposed to different concentrations of extracellular proteins from L. acidophilus
由图4a可以看出,不同质量浓度的两种胞外蛋白作用HT-29结肠癌细胞后,AKT的磷酸化水平明显下调,随着两种胞外蛋白质量浓度的逐步增高,它们的磷酸化水平的下调都更加明显,其中A1、B1组与对照组比较无明显差异(P>0.05),A2、B2组抑制AKT的磷酸化作用较为显著(P<0.05),A3、A4、B3、B4组能极显著降低AKT磷酸化的表达(P<0.01)。由图4b可知,PI3K蛋白的表达水平随着两种胞外蛋白质量浓度的增大而降低,其中A1、A2、B1组与对照组比较,PI3K蛋白的表达无显著差异(P>0.05),A3、A4、B2、B3、B4组均能极显著降低PI3K蛋白的表达(P<0.01)
3 讨 论
L. acidophilus是人体肠道中的重要微生物,能改善和调节肠道微生物菌群的平衡,增强机体免疫力,降低胆固醇水平,缓解乳糖不耐症以及抑制肿瘤细胞的形成等,起到健康促进效果。益生菌的胞外蛋白可以参与调节肠黏膜的免疫机制,包括与宿主免疫系统的作用、调节黏膜屏障功能等,通过这些机制可以促进肠道稳态。胞外蛋白可以作为功能性蛋白用于肠道疾病的生物免疫治疗,为解决肠道疾病提供了一条新的有效途径[32]。已报道研究结论均指向,信号传导网络的异常贯穿在结直肠癌等炎症性疾病的发生发展的各个阶段[33]。研究证实,结直肠癌的发生与细胞增殖和凋亡失控有关,通过调控不同信号转导通路使结肠癌细胞凋亡减少,导致结直肠癌的发生。本实验室前期的研究已确定L. acidophilus CICC6005分泌的两种胞外蛋白对HT-29细胞的增殖有明显抑制作用,并呈剂量和时间依赖关系[34]。
MAPKs是一类细胞内广泛分布的丝氨酸/苏氨酸残基的蛋白激酶,是连接细胞膜表面受体与决定基因表达之间的重要信号调节酶,所以MAPK信号转导通路是将细胞外信号传导入胞内的重要信号转导途径。目前MAPK家族包括3 个主要成员,分别为p38、ERK1/2,JNK,这些酶激活一些转录因子,调控基因表达[35]。
p38是MAPK家族中的重要成员,它是丝氨酸/酪氨酸激酶,当酪氨酸和苏氨酸磷酸化后,从而激活p38,参与调节细胞的生长、分化、分裂、死亡以及细胞间功能同步,已有许多研究成果进行了报道[36]。蒋莎莉[35]用表没食子儿茶素没食子酸酯作用于HT-29细胞的研究表明,该活性成分可能通过抑制p38 MAPK、视网膜细胞瘤蛋白的磷酸化,下调细胞周期蛋白D1、p53、增殖细胞核抗原蛋白表达,诱导HT-29细胞G1期阻滞,抑制HT-29细胞增殖。Miki等[38]发现结肠癌组织中p38 MAPK蛋白呈高表达,并且与增殖及凋亡指数相关。Tang Jun[38]与ONO[39]等研究表明在结肠癌细胞中存在p38γ的mRNA,并发现阻断了p38γ的表达后,结肠癌细胞恶性程度降低及表型逆转,由此认为,p38γ与结肠癌发生、发展密切相关。Jin Heiying等[40]应用基因芯片和实时荧光定量PCR技术检测茶多酚对结肠癌的抑制率及其分子机制,结果提示茶多酚通过抑制p38等基因上调肿瘤抑制率。本课题组前期研究中,利用Western Blotting初步研究了乳源酪蛋白糖巨肽(casein glycomacropeptide,CGMP)对UC小鼠肠黏膜免疫信号通路(NF-κB和p38 MAPK)的影响,结果表明,乳源CGMP可以显著抑制抑制NF-κB的激活,CGMP虽然对p38 MAPK的抑制效果不显著,但仍具有抑制其激活的趋向[41]。本实验以L. acidophilus CICC6005分泌的两种胞外蛋白对HT-29结肠癌细胞总蛋白p38和其磷酸化水平进行研究。结果表明,各组p38蛋白的表达量与对照组比较无显著差异(P>0.05);67 ku胞外蛋白处理HT-29细胞48 h,p38蛋白的磷酸化程度随胞外蛋白质量浓度的增大而逐渐减弱,其中,0.001 μg/mL的67 ku胞外蛋白可显著降低p38蛋白磷酸化程度(P<0.05),0.010、0.100、1.000 μg/mL的67 ku胞外蛋白能极显著抑制p-p38蛋白的表达(P<0.01),p38蛋白的磷酸化程度也随着37 ku胞外蛋白质量浓度的增大而减弱,0.001、0.010、0.100、1.000 μg/mL的胞外蛋白质量浓度均能显著抑制p-p38蛋白的表达(P<0.05或P<0.01)。这表明L. acidophilus CICC6005分泌的两种胞外蛋白可能通过抑制p38蛋白磷酸化程度来调控肿瘤细胞的增殖,并与胞外蛋白对HT-29细胞增殖抑制作用相对同步。
ERK是MAPK三条主要信号传导通路之一。ERK1和ERK2是ERKs中的两个重要成员,分子质量分别为44、42 ku。ERK1/2受上游特异性刺激分子MEK1/2双磷酸化激活,活化的ERK蛋白(p-ERK1/2)形成二聚体,从细胞质移位到细胞核,通过调控一系列转录因子而引起细胞增殖分化。p-ERK1/2活性升高可以刺激肠上皮细胞增生与分化,在人结肠癌细胞中可检测p-ERK表达水平提高。有研究表明,激活的ERK/MAPK信号传导通路在结肠癌形成、发展的过程中起着十分重要作用[42]。付蕾等[43]研究表明,叶黄素对HT-29结肠癌细胞可以通过下调ERK蛋白的磷酸化水平抑制结肠癌HT-29细胞增殖,并且还可以诱导HT-29细胞凋亡。Bocca等[44]研究发现共轭亚油酸能下调Caco-2细胞中Raf-1的表达水平和ERK1/2的磷酸化水平,并伴随着下游转录因子c-myc的表达减少,以达到抑制结肠癌细胞的增殖的效果。Minelli等[45]在大肠癌的研究中发现,载有醇丁酸酯的固体脂质纳米粒能通过下调p-p38及p-ERK的表达,从而抑制大肠癌的转移。本研究结果表明,67 ku和37 ku胞外蛋白处理后,ERK磷酸化程度较对照组都显著下降,并呈现出剂量依赖性,其中,0.001 μg/mL的67 ku胞外蛋白和37 ku胞外蛋白能显著降低ERK磷酸化程度的表达(P<0.05),其他各组也极显著降低ERK磷酸化的水平(P<0.01)。ERK的表达不随胞外蛋白质量浓度的变化而改变,即各组ERK蛋白的表达与对照组比较无显著差异(P>0.05)。许多研究已证实ERK信号转导通路的异常表达或者异常活化与肿瘤关系密切相关,因此,阻断该信号途径的转导对于结、直肠癌等肿瘤的治疗具有重大的意义,本研究结果也证实了这一结论,即L. acidophilus CICC6005分泌的胞外蛋白可以通过阻断细胞内ERK信号通路的激活发挥其抑制肿瘤的作用。
JNK是一种能够特异性磷酸化核内转录因子c-Jun的激酶,JNK的直接上游激酶MEK4(MKK4,JNKK1)和MEK7(MKK7,JNKK2)通过双磷酸化JNK的Thr183和Tyr185位点而激活JNK[46-47]。JNK信号通路的MAPKKK主要有:MEKK1、2、3、4混合连接激酶、凋亡信号调节激酶和TGF-β激活的蛋白激酶[30]。JNK受到上游信号分子的激活后,可使细胞核内转录因子c-Jun的氨基末端第63位和第73位丝氨酸残基被磷酸化,进一步刺激并激活c-Jun,提高其转录活性。c-Jun磷酸化后还可以促进c-Jun/c-Fos异二聚体及c-Jun同二聚体的形成,这些转录因子能够结合很多基因启动子区的转录激活蛋白-1位点,以增强其基因的转录活性能力[48]。此外,JNK激活之后还可以使转录因子Ets-like protein-1和活化转录调控因子-2发生磷酸化,并使其转录活性增强。本研究结果表明,两种胞外蛋白分别在不同质量浓度(0.001、0.010、0.100、1.000 μg/mL)条件下处理HT-29细胞48 h,JNK的磷酸化程度也不随其质量浓度的增大而发生改变,各组p-JNK蛋白水平与对照组比较也无显著差异(P>0.05)。虽然并行存在5 条MAPK信号通路,但是到目前为止关于结直肠癌的研究主要集中在ERK1/2和p38信号通路[48]。提示L. acidophilus CICC6005胞外蛋白并没有通过抑制JNK蛋白磷酸化表达的水平变化来抑制HT-29结肠癌细胞的增殖。
PI3K-AKT信号通路与细胞的增殖、分化、凋亡等细胞反应之间有着密切的联系。PI3K蛋白具有类酯激酶和蛋白激酶的活性,AKT是PI3K通路中的一个重要的下游激酶,并且具有丝/苏氨酸激酶活性,当PI3K蛋白激活后,其直接作用AKT蛋白使其发生磷酸化,从而使下游信号通路因子NF-κB抑制蛋白,NF-κB、Bad蛋白、caspase-9、caspase-3等发生磷酸化反应,进而实现其各种生物学作用,比如促进细胞周期进程、抑制细胞增殖、诱导细胞凋亡[49-51]。PI3K-AKT信号通路中任环节的异常都与结肠直肠癌的发生、发展、治疗和预后密切相关。PI3K-AKT信号通路已成为一个新的治疗靶点。多种物质在诱导结肠癌细胞凋亡和抑制细胞增殖时,伴有PI3K-AKT信号通路各重要蛋白表达的变化。杨琨等[52]的研究表明,咖啡酸苯乙酯可下调PI3K-AKT信号通路中AKT的磷酸化程度从而上调其信号通路下游因子caspase-3、caspase-9的表达,这种方式可以抑制结肠癌细胞Lovo生长的作用。有研究采用人结肠癌Caco-2细胞为研究对象,使用二十二碳六烯酸(docosahexaenoic acid,DHA)对其进行干预,结果表明DHA可以通过降低p-AKT蛋白的表达水平抑制Caco-2细胞的增殖,并可以诱导其凋亡,但是DHA作用于正常人结肠细胞NCM460细胞时,表现出抵抗作用[53]。Semba等[54]研究表明LY294002可以诱导结肠癌细胞(DLD-1、LoVo、HCT15和Colo205)凋亡并且抑制其增殖,其分子机制为下调AKT的磷酸化水平,增强caspase-3的活性。但各种细胞对LY294002的敏感性不同,LoVo细胞的敏感性最强。Park等[55]研究表明,利用视黄醇作用人结肠癌细胞HCT116和SW620 30 min后,通过降低PI3K蛋白的活性诱导两种结肠癌细胞的凋亡,并且研究还发现PI3K蛋白的表达水平与其细胞凋亡呈正相关。王鹤霏等[56]研究显示,硼替佐米可以抑制结肠癌SW480细胞增殖。其机制可能与抑制人第10号染色体磷酸酶和张力蛋白同源缺失基因(phosphatase and tensin homolog deleted on chromosome ten,PTEN)蛋白降解,抑制p-AKT蛋白表达水平有关。本研究结果表明,对于不同质量浓度的67 ku胞外蛋白作用HT-29结肠癌细胞后,AKT的磷酸化水平明显下调,随胞外蛋白质量浓度的提高,其磷酸化水平下调更加明显,其中0.001 μg/mL的67 ku胞外蛋白与对照组比较无明显差异(P>0.05),0.010 μg/mL的67 ku胞外蛋白抑制AKT磷酸化较为显著(P<0.05),质量浓度为0.100、1.000 μg/mL时均能极显著降低p-AKT的表达(P<0.01);PI3K蛋白的表达量也随胞外蛋白质量浓度的增大而降低,其中0.001、0.100 μg/mL组与对照组比较,PI3K蛋白的表达无显著差异(P>0.05),0.100、1.000 μg/mL组均能极显著降低PI3K蛋白的表达(P<0.01)。而对于37 ku的胞外蛋白可显著下调HT-29结肠癌细胞中p-AKT蛋白表达水平,但其中0.001 μg/mL的37 ku胞外蛋白作用结果与对照组比较无明显差异(P>0.0 5),0.0 1 0 μ g/m L的3 7 k u胞外蛋白抑制A K T磷酸化较为显著(P<0.0 5),质量浓度0.1 0 0、1.0 0 0 μ g/m L均能极显著降低AKT的表达(P<0.01);PI3K蛋白的表达量也随胞外蛋白质量浓度的增大而降低,其中0.001 μg/mL组与对照组比较,PI3K蛋白的表达无显著差异(P>0.05),0.010、0.100、1.000 μg/mL组均能极显著降低PI3K蛋白的表达(P<0.01)。胞外蛋白对HT-29结肠癌细胞PI3K蛋白表达和AKT磷酸化程度呈正相关,PI3K作为AKT的上游激活蛋白,说明胞外蛋白对HT-29结肠癌细胞增殖的抑制作用与PI3K-AKT信号通路有关,蛋白PI3K激活后,催化磷脂酰肌醇-4,5-二磷酸发生磷酸化形成PIP3,随后激活下游蛋白AKT,通过这种途径来调控细胞的增殖和凋亡影响,因此,L. acidophilus CICC6005分泌的胞外蛋白抑制HT-29细胞增殖的作用机制可能与对PI3K-AKT信号传导通路的抑制有关。
4 结 论
本研究证实了固态培养L. acidophilus CICC6005分泌的两种胞外蛋白在一定程度上具有抑制HT-29细胞中MAPK信号通路中相关蛋白质的磷酸化程度,下调p-ERK1/2、p-p38蛋白的表达,但对p-JNK蛋白的表达没有影响,同时也影响HT-29细胞中PI3K-AKT信号通路相关蛋白的表达,下调p-AKT、PI3K蛋白的表达。研究结果揭示了L. acidophilus CICC6005分泌的胞外蛋白抑制HT-29结肠癌细胞的分子机制,在促进肠道稳态功效上,可能与MAPK和PI3K-AKT两个信号通路相关。因此,我们的研究结果阐述了L. acidophilus CICC6005分泌的胞外蛋白抑制结直肠癌细胞增殖作用的分子机制,也解释了食用益生菌有助于人类解决结直肠癌的发生和发展问题,该研究结果对人类肠道健康将产生积极的影响。
[1] 刘希山, 罗欣, 梁荣蓉, 等. 嗜酸乳杆菌与嗜热链球菌混合培养制作保健型发酵乳的研究[J]. 中国食物与营养, 2005(10): 34-37.
[2] 孟和毕力格, 张和平, 王俊国. 一种嗜酸乳杆菌及其抗氧化活性的应用: CN101333506[P]. 2008-12-31[2016-05-18]. http://xueshu. baidu.com/s?wd=paperuri%3A%28a70ec4e4887230a62e193bf113ead 5be%29&filter=sc_long_sign&tn=SE_xueshusource_2kduw22v&sc_ vurl=http%3A%2F%2Fd.wanfangdata.com.cn%2FPatent_ CN200710123098.X.aspx&ie=utf-8&sc_us=10231396440386347911
[3] 苏安分. 嗜酸乳杆菌活菌制剂开发研究[D]. 哈尔滨: 东北农业大学, 2011: 1-7.
[4] MATTILA T, SANDHOLM P, MYLLRINEN R, et al. Technological challenges for future probiotic foods[J]. International Dairy Journal, 2002, 12(2): 173-182. DOI:10.1016/S0958-6946(01)00099-1.
[5] SINGHI S C, BARANWAL A. Probiotic use in the critically ILL[J]. Indian Journal of Pediatrics, 2008, 75(6): 621-627. DOI:10.1007/ s12098-008-0119-1.
[6] QIAO J, LI H, WANG Z, et al. Effects of Lactobacillus acidophilus dietary supplementation on the performance, intestinal barrier function, rectal microflora and serum immune function in weaned piglets challenged with Escherichia coli lipopolysaccharide[J]. Antonie van Leeuwenhoek, 2015, 107(4): 883-891. DOI:10.1007/s10482-015-0380-z.
[7] ANDERSON J W, GILLILAND S E. Effect of fermented milk (yogurt) containing Lactobacillus acidophilus L1 on serum cholesterol in hypercholesterolemic humans[J]. Journal of the American College of Nutrition, 1999, 18(1): 43-50. DOI:10.1080/07315724.1999.10718826.
[8] MINIELLO V L, MORO G E, ARMENIO L. Prebiotics in infant milk formulas: new perspectives[J]. Acta Paediatrica Supplement, 2003, 91(441): 68-76. DOI:10.1111/j.1651-2227.2003.tb00649.x.
[9] ALM L, ROBINSON R K. The therapeutic effects of various cultures-an overview[J]. Therapeutic Properties of Fermented Milks, 1991: 45-64.
[10] MARTINI M C, LEREBOURS E C, LIN W J, et al. Strains and species of lactic acid bacteria in fermented milks (yogurts): effect on in vivo lactose digestion[J]. American Journal of Clinical Nutrition, 1991, 54(6): 1041-1046.
[11] KRISHNAMURTHY K, WANG G, ROKHFELD D, et al. Deoxycholate promotes survival of breast cancer cells by reducing the level of pro-apoptotic ceramide[J]. Breast Cancer Research, 2007, 10(6): 1-16. DOI:10.1186/bcr2211.
[12] FIJAN SABINA. Microorganisms with claimed probiotic properties:an overview of recent literature[J]. International Journal of Environmental Research and Public Health, 2014, 11(5): 4745-4767. DOI:10.3390/ijerph110504745.
[13] 杨相宜, 满朝新, 刘颖, 等. 嗜酸乳杆菌NCFM胞外多糖对小鼠免疫相关基因的调控[J]. 食品科学, 2013, 34(5): 213-217. DOI:10.7506/ spkx1002-6630-201305044.
[14] LEE Y K, SALMINEN S. Handbook of probiotics and prebiotics[M]. 2nd ed. New Jersey: John Wiley & Sons, 2008: 447-449. DOI:10.1002/97804. 70432624.
[15] XIE C, LI J, WANG K, et al. Probiotics for the prevention of antibiotic-associated diarrhoea in older patients: a systematic review[J]. Travel Medicine and Infectious Disease, 2015, 13(2): 128-134. DOI:10.1016/j.tmaid.2015.03.001.
[16] KHAZAIE K, ZADEH M, KHAN M W, et al. Abating colon cancer polyposis by Lactobacillus acidophilus deficient in lipoteichoic acid[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(26): 10462-10467. DOI:10.1073/pnas.1207230109.
[17] BORTHAKUR A, BHATTACHARYYA S, KUMAR A, et al. Lactobacillus acidophilus alleviates platelet-activating factor-induced inflammatory responses in human intestinal epithelial cells[J]. PLoS Pathogens, 2013, 8(10): e75664. DOI:10.1371/journal.pone.0075664.
[18] NAGPAL R, KUMAR A, KUMAR M, et al. Probiotics, their health benefits and applications for developing healthier foods: a review[J]. FEMS Microbiology Reviews, 2012, 334(1): 1-15. DOI:10.1111/j.1574-6968.2012.02593.x.
[19] KIM I. Zinc induces tau hyperphosphorylation through extracellular signal-regulated kinase 1/2 (ERK1/2) pathway[D]. Seoul: Yonsei University , 2007: 3-24.
[20] PENG Cheng, LIU Xiangqun, LIU Enyu, et al. Norcantharidin induces HT-29 colon cancer cell apoptosis through the αvβ6-extracellular signalrelated kinase signaling pathway[J]. Cancer Science, 2009, 100(12): 2302-2308. DOI:10.1111/j.1349-7006.2009.01320.x.
[21] 孟菲, 王春凤, 杨桂连. 益生菌与肠上皮细胞间相互作用及免疫调节机制[J]. 食品科学, 2013, 34(21): 394-398. DOI:10.7506/spkx1002-6630-201321077.
[22] SCHLEE M, WEHKAMP J, ALTENHOEFER A, et al. Induction of human beta-defensin 2 by the probiotic Escherichia coli Nissle 1917 is mediated through fl agellin[J]. Infection and Immunity, 2007, 75(5):2399-2407. DOI:10.1128/IAI.01563-06.
[23] BERNARDO D, SÁNCHEZ B, ALHASSI H O, et al. Microbiota/host crosstalk biomarkers: regulatory response of human intestinal dendritic cells exposed to lactobacillus extracellular encrypted peptide[J]. PLoS ONE, 2012, 7(5): e36262. DOI:10.1371/journal.pone.0036262.
[24] 訾祯祯, 杨志伟. 细菌蛋白分泌途径的研究进展[J]. 生物技术通报, 2011(8): 44-50.
[25] 李超, 董明盛. 乳酸菌蛋白质组学研究进展[J]. 食品科学, 2005,26(1): 255-259.
[26] YAN F, CAO H, COVER T L, et al. Soluble proteins produced by probiotic bacteria regulate intestinal epithelial cell survival and growth[J]. Gastroenterology, 2007, 132(2): 562-575. DOI:10.1053/ j.gastro.2006.11.022.
[27] 贾彦, 任效东, 陈庆森, 等. 嗜酸乳杆菌胞外蛋白的分离纯化及抑制HT-29细胞增殖作用的研究[J]. 现代食品科技, 2016, 32(11): 56-61. DOI:10.13982/j.mfst.1673-9078.2016.11.009.
[28] GONG J, CHEN Q, YAN Y, et al. Effect of casein glycomacropeptide on subunit p65 of nuclear transcription factor-κB in lipopolysaccharidestimulated human colorectal tumor HT-29 cells[J]. Food Science and Human Wellness, 2014, 3(2): 51-55. DOI:10.1016/j.fshw.2014.04.001.
[29] 金伯泉. 细胞和分子免疫学[M]. 2版. 北京: 科学出版社, 2001:539-581.
[30] WESTON C R, DAVIS R J. The JNK signal transduction pathway[J]. Current Opinion in Cell Biology, 2007, 19(2): 142-149. DOI:10.1016/ j.ceb. 2007.02.001.
[31] HUET C, SAHUQUILLO-MERINO C, COUDRIER E, et al. Absorptive and mucussecreting subclones isolated from a multipotent intestinal cell line (HT-29) provide new models for cell polarity and terminal differentiation[J]. Journal of Cell Biology, 1987, 105(1): 345-357. DOI:10.1083/jcb.105.1.345.
[32] 陈庆森, 任效东. 一种乳酸菌胞外蛋白的提取方法及应用:CN104388503A[P]. 2015-03-04[2016-05-18]. http://xueshu.baidu. com/s?wd=paperuri%3A%2893c7f5278acb4ef33bada86e4695e6b 4%29&filter=sc_long_sign&tn=SE_xueshusource_2kduw22v&sc_ vurl=http%3A%2F%2Fd.wanfangdata.com.cn%2FPatent%2FCN2014 10680804.0%2F&ie=utf-8&sc_us=8756046018456331948.
[33] CHEN Qingsen, WANG Hua, ZHU Chenchen, et al. Anti-apoptotic effects of milk-derived casein glycomacropeptide on mice with ulcerative colitis[J]. Food and Agricultural Immunology, 2014, 25(4):453-466. DOI:10.1080/09540105.2013.823912.
[34] 王华, 陈庆森. 乳源酪蛋白糖巨肽抗细胞凋亡干预小鼠溃疡性结肠炎效应研究[J]. 食品科学, 2012, 33(1): 230-234.
[35] 蒋莎莉. 表没食子儿茶素没食子酸酯体外对人结肠癌HT-29细胞生长抑制作用及机制研究[D]. 衡阳: 南华大学, 2009: 5-27.
[36] 运晨霞, 郭宏伟, 邓家刚, 等. 芒果苷对2215细胞MAPK信号通路表达的影响[J]. 细胞与分子免疫学杂志, 2011, 27(8): 915-917.
[37] MIKI H, YAMADA H, MITAMURA K. Involvement of p38 MAP kinase in apoptotic and proliferative alteration in human colorectal cancers[J]. Anticancer research, 1998, 19(6B): 5283-5291.
[38] TANG J, QI X, MERCOLA D, et al. Essential role of p38gamma in K-Ras transformation independent of phosphorylation[J]. Journal of Biological Chemistry, 2005, 280(25): 23910-23917. DOI:10.1074/jbc. M500699200.
[39] ONO K, HAN J. The p38 signal transduction pathway: activation and function[J]. Cell Signalling, 2000, 12(1): 1-13. DOI:10.1016/S0898-6568(99)00071-6.
[40] JIN H Y, TAN X, LIU X, et al. The study of effect of tea polyphenols on microsatellite instability colorectal cancer and its molecular mechanism [J]. International Journal of Colorectal Disease, 2011, 25(3): 1407-1415. DOI:10.1007/s00384-010-1095-2.
[41] ZHU Ming, JIA Yuchen, YAN Yali, et al. Amelioration effect of bovine casein glycomacropeptide on ulcerative colitis in mice[J]. Food and Agricultural Immunology, 2015, 26(5): 717-728. DOI:10.1080/095401 05.2015.1018874.
[42] 多玥荷, 孙莉娜, 应森林, 等. 西黄丸通过ERK/MAPK信号通路对人结肠癌裸鼠移植瘤的影响[J]. 中华中医药杂志, 2013, 28(10):3055-3057.
[43] 付蕾, 陈晓哲, 张慧娟, 等. 叶黄素对人结肠癌HT29细胞增殖的抑制及其机制[J]. 世界华人消化杂志, 2013, 21(13): 1234-1244. DOI:10.11569/wcjd.v21.i13.1239.
[44] BOCCA C, BOZZO F, GABRIEL L, et al.Conjugated linoleic acid inhibits Caco-2 cellgrowth via ERK-MAPK signaling pathway[J]. Journal of Nutritional Biochemistry, 2007, 18(5): 332-340. DOI:10.1016/j.jnutbio.2006.07.001.
[45] MINELLI R, OCCHIPINTI S, GIGLIOTTI C L, et al. Solid lipid nanoparticles of cholesteryl butyrate inhibit the proliferation of cancer cells in vitro and in vivo models[J]. British journal of pharmacology, 2013, 170(2): 233-244. DOI:10.1111/bph.12255.
[46] BROWN M D, SACKS D B. Protein scaffolds in MAP kinase signalling[J]. Cellular Signalling, 2009, 21(4): 462-469. DOI:10.1016/ j.cellsig.2008.11.013.
[47] AKELLA R, MOON T M, GOLDSMITH E J. Unique MAP kinase binding sites[J]. Biochimica et Biophysica Acta, 2008, 1784(1): 48-55. DOI:10.1016/j.bbapap.2007.09.016.
[48] 邓蓉, 朱孝峰, 周军民, 等.二萜类化合物excisanin A诱导人结肠癌SW620细胞凋亡及机制研究[J]. 中国药理学通报, 2006, 22(3):273-277.
[49] 王楠, 林洪丽, 吴泰华, 等. TIMP-1抑制大鼠肾小球系膜细胞凋亡与磷脂酰肌醇3激酶/丝/苏氨酸激酶通路的研究[J]. 中国实用内科杂志, 2006, 26(14): 1059-1061. DOI:10.3969/ j.issn.1005-2194.2006.14.007.
[50] 刘漪, 李雪梅, 谭永星. 氢气饱和生理盐水对局灶性脑缺血再灌注损伤大鼠神经功能缺损、神经细胞凋亡及凋亡相关蛋白表达的影响[J]. 临床神经病学杂志, 2013, 26(5): 351-354.
[51] VOLATE S, KAWASAKI B T, HURT E M, et al. Gossypol induces apoptosis by activating p53 in prostate cancer cells and prostate tumor initiating cells[J]. Molecular Cancer Therapeutics, 2010, 9(2):461-470. DOI:10.1158/1535-7163.MCT-09-0507.
[52] 杨琨, 何葵, 李鹏, 等. 咖啡酸苯乙酯对人结肠癌PI3K/AKT信号通路的影响[J]. 社区医学杂志, 2013, 11(6): 1-3.
[53] TOIT-KOHN J L, LOUW L, ENGELBRECHT A M. Docosahexaenoic acid induces apoptosis in colorectal carcinoma cells by modulating the PI3kinase and p38 MAPK pathways[J]. Journal of Nutritional Biochemistry, 2009, 20(2): 106-114. DOI:10.1016/ j.jnutbio.2007.12.005.
[54] SEMBA S, ITOH N, ITOH M, et al. The in vitro and in vivo effects of 2-(4-morpholinyl)-8-phenyl-chromone (LY294002), a specif i c inhibitor of phosphatidy linositol 3-kinase, in human colon cancer cells[J]. Clinical Cancer Research, 2002, 8(6): 1957-1963.
[55] PARK E Y, WILDER E T, CHIPUK J E, et al. Retinol decreases phosphatidy linositol 3-kinase activity in colon cancer cells[J]. Molecular Carcinogenesis, 2008, 47(4): 264-274. DOI:10.1002/ mc.20381.
[56] 王鹤霏, 封斌, 孙艺, 等. 蛋白酶抑制剂硼替佐米抑制PI3K/Akt通路致结肠癌SW480细胞凋亡[J]. 现代生物医学进展, 2013, 13(11):2044-2048.
Extracellular Proteins from Lactobacillus acidophilus Regulate the Activation of Critical Proteins Involved in the MAPK and PI3K-AKT Signaling Pathways
WANG Yong, JIA Yan, REN Xiaodong, MING Zhu, JIANG Yan, ZHAO Pei⋆, PANG Guangchang, YAN Yali, CHEN Qingsen⋆
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China)
Purpose: To explore the role and molecular mechanism of proteins secreted by L. acidophilus CICC6005 in promoting intestinal health and to reveal that this topic is well worth further investigation. Methods: This experiment determined extracellular proteins secreted by L. acidophilus CICC6005 to inhibit the proliferation of HT-29 cells and further explored the pathway by which the extracellular proteins 67 and 37 ku inhibited tumor proliferation. In the present study, HT-29 cells were used as target cells to evaluate the expression levels of the critical target protein p38, c-Jun N-terminal kinase (JNK), c-Jun N-terminal kinase (ERK), phosphorylated p38 (p-p38), phosphorylated c-Jun N-terminal kinase (p-JNK), phosphorylated extracellular signal-regulated kinase (p-ERK), phosphorylated protein kinase B (p-AKT), phosphatidylinositol-3-kinase (PI3K) in the mitogen activated protein kinase (MAPK) and (phosphatidylinositol 3-kinase-protein kinase B) PI3K-AKT signaling pathways through Western blotting in order to explore the molecularmechanism by which that the extracellular proteins from L. acidophilus CICC6005 regulated the proliferation of colon cancer cells. Results: Exposure of HT-29 cells to different concentrations of 67 and 37 ku extracellular proteins from L. acidophilus CICC6005 could significantly inhibit the expression of p-ERK1/2, p-p38, p-AKT and PI3K in a dose-dependent manner for both signaling pathways but not the expression of p-JNK, ERK1/2, p38 and JNK. Conclusion: The extracellular proteins 37 and 67 ku from L. acidophilus CICC6005 could inhibit the proliferation of HT-29 cells, and the mechanism might be related to the activation level of the critical proteins involved in the MAPK and PI3K-AKT pathways. Consumption of extracellular proteins from L. acidophilus could help to maintain intestinal health.
Lactobacillus acidophilus CICC6005; extracellular proteins; colon cancer cell line HT-29; mitogen activated protein kinase (MAPK); phosphatidylinositol-3-kinase/protein kinase B (PI3K-AKT)
10.7506/spkx1002-6630-201703026
TS201.3
A
1002-6630(2017)03-0155-09
2016-06-12
国家自然科学基金面上项目(31071522);天津商业大学国家基金培育项目(160120)
王泳(1993—),女,硕士研究生,研究方向为发酵生物技术、功能成分与肠道健康的关系。E-mail:15620616749@163.com
⋆通信作者:赵培(1978—)女,副教授,硕士,研究方向为细胞分子生物学,黏膜细胞信号传导。E-mail:zhaopei@tjcu.edu.cn陈庆森(1957—),男,教授,硕士,研究方向为发酵生物技术、功能成分与肠道健康的关系。E-mail:chqsen@tjcu.edu.cn
王泳, 贾彦, 任效东, 等. 嗜酸乳杆菌胞外蛋白调控MAPK和PI3K-AKT信号途径关键蛋白活化水平[J]. 食品科学, 2017, 38(3): 155-163. DOI:10.7506/spkx1002-6630-201703026. http://www.spkx.net.cn
WANG Yong, JIA Yan, REN Xiaodong, et al. Extracellular proteins from Lactobacillus acidophilus regulate the activation of critical proteins involved in the MAPK and PI3K-AKT signaling pathways[J]. Food Science, 2017, 38(3): 155-163. (in Chinese with English abstract)
10.7506/spkx1002-6630-201703026. http://www.spkx.net.cn

