酯型茶黄素酶促氧化制备条件研究
王佛生,武永福
(陇东学院农林科技学院,甘肃庆阳745000)
酯型茶黄素酶促氧化制备条件研究
王佛生,武永福
(陇东学院农林科技学院,甘肃庆阳745000)
茶黄素是一类具有苯并卓酚酮结构的植物酚性色素,具有较强的生物活性和多种药理功能,尤其是酯型茶黄素[1]。为了系统研究酯型茶黄素酶促氧化形成的影响因素及其机理,应用马铃薯作为多酚氧化酶(PPO)的酶源制取茶黄素,以期为酯型茶黄素的酶促氧化制备提供新的工业化生产高效途径。对酯型茶黄素酶促氧化形成条件实验表明,儿茶素4g、反应pH值5.5、反应时间60min、反应温度35℃、粗酶液25g、柠檬酸缓冲液100ml的反应体系,酯型茶黄素形成量较高,由此可见在工业生产茶黄素时可加入马铃薯粗酶液以降低成本,提高其产率及其品质。
酯型茶黄素;酶促氧化;儿茶素;多酚氧化酶
酶促氧化制取茶黄素主要是利用茶叶本身或外源多酚氧化酶(PPO)和过氧化物酶(POD)的氧化特性来有目的地生产茶黄素。其机理是PPO对儿茶素进行氧化导致醌类形成,再经非酶性次级氧化变化,从而生成茶黄素。酶促氧化方面的研究较早、方法新颖且成果显著,如茶鲜叶匀浆悬浮发酵、双液相系统酶化学技术和固定化酶技术等,都得到了深入研究,取得了很好的效果。但是由于受到酶制剂的安全性及成本限制,工业化制备酯型茶黄素成本仍然较高,每克茶色素中酯型茶黄素含量不超过90mg[1-11]。本试验利用马铃薯多酚氧化酶(polyphenol oxidase,PPO)来氧化绿茶儿茶素,以期获得工业化制备酯型茶黄素的最佳氧化条件,使酯型茶黄素的定向生物合成具有更高的收率。同时,以茶黄素各单体的积累量为指标,优化氧化条件,探索pH值、时间、温度、酶添加量、底物添加量对茶黄素各单体合成的影响,能更好地调控儿茶素定向合成生物活性更高的茶黄素制品,为茶黄素的产业化开发提供一定的技术支持。
1 材料与方法
1.1 材料及仪器
马铃薯(庆阳市售新鲜);儿茶素(实验室浸提,高效液相分析其组分为EGC 4.237%,DL-C 6.403%,EC 9.513%,EGCG 26.608%,GCG 2.567%,ECG 24.087%)。高效液相色谱系统(岛津LC-20AT,日本岛津公司,SCL20AT控制系统,SPD-20A检测器,LC-20AT泵,Class-Vp色谱工作站);格兰仕WP800A微波炉。
1.2 实验方法
1.2.1 粗酶液制备
将30g马铃薯加入100ml pH值为5.5的预冷柠檬酸—磷酸氢二钠缓冲液中(含适量PVP,其安全有效价廉,也可用其他缓冲液,但价格较高,效果相当),于组织捣碎机中捣碎5min后,纱布挤压过滤,于冷冻离心机中4℃离心20min(6000r/min),得上清液为粗酶液。
1.2.2 最佳反应时间选择
称取1.00g儿茶素溶解于100ml pH值为5.6的马铃薯多酚氧化酶酶液中,通入氧气(也可通入净化空气或剧烈搅拌),在恒温振荡器中35℃条件下,分别反应40min、50min、60min、70min、80min,取15ml反应液微波炉中加热30s终止反应,定容至15ml,再从中取5ml稀释至50ml,样品2次重复,高效液相色谱检测,对各物质各阶段的峰面积作横向比较。以含量最高时的数据作为分析数据,测定不同时间下酯型茶黄素的含量。
1.2.3 最佳反应pH值选择
选择溶液pH值分别为4.5、5.0、5.5、6.0、6.5,其他条件同上,测定不同pH值下酯型茶黄素的含量。
1.2.4 最佳反应温度选择
设置温度分别为15℃、25℃、35℃、45℃和55℃,其他条件同上,测定不同温度下酯型茶黄素的含量。
1.2.5 最佳底物浓度选择
称取1.00g、2.00g、3.00g、4.00g、5.00g儿茶
素溶解于100ml pH值5.5的马铃薯多酚氧化酶酶液中,其他条件同上,测定不同底物浓度下酯型茶黄素的含量。
1.2.6 最佳粗酶液用量选择
称取粗酶液用量10g、20g、30g、40g、50g,加入缓冲液100ml制成不同浓度的粗酶液,其他条件同上,测定不同底物浓度下酯型茶黄素的含量。
1.2.7 高效液相色谱法检测
色谱条件如下:
色谱柱:waters C18(250mm×4.6mm,0.25μm);柱温:35℃;流动相:流动相A为2%醋酸,流动相B为乙腈∶乙酸乙酯=21∶3(V/V),使用前经微孔滤膜(0.45μm)过滤;体积流速:0.9ml/min;检测波长:280nm;进样量:10μl。
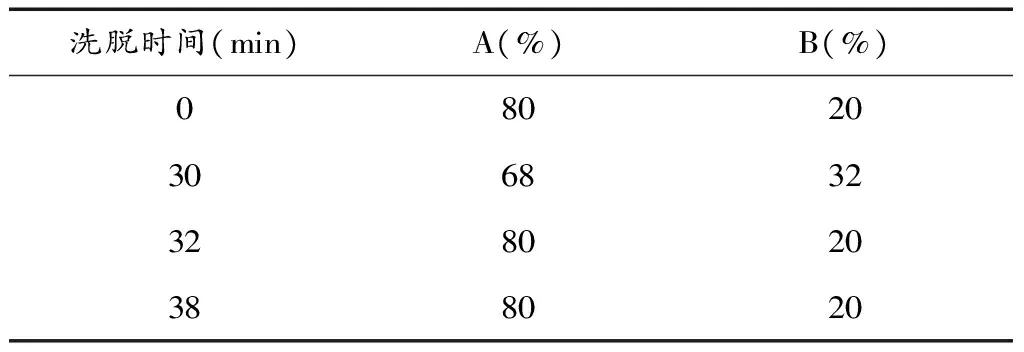
表1 梯度洗脱表
2 结果与分析
2.1 马铃薯PPO酶促氧化形成酯型茶黄素的反应时间曲线
儿茶素在马铃薯多酚氧化酶酶促氧化过程中,茶黄素类物质变化的时间曲线如图1所示。在反应前60min内,茶黄素类物质均呈显著增加趋势,是茶黄素合成的线性增长期。TF在60min时积累量最大,之后略有减少。TF-3-G的生成量在发酵全过程始终处于主导地位,明显高于其它3种茶黄素单体,在70min时积累量最大,但与60min时的生成量相比无明显增加。TF-3′-G和TFDG的生成量较小,在反应过程中均呈先增加后减少的趋势,且在60min至70min时间内含量无明显增加,70min后4类物质都有所减少。因此,确定茶黄素类物质的最佳反应时间是60min。
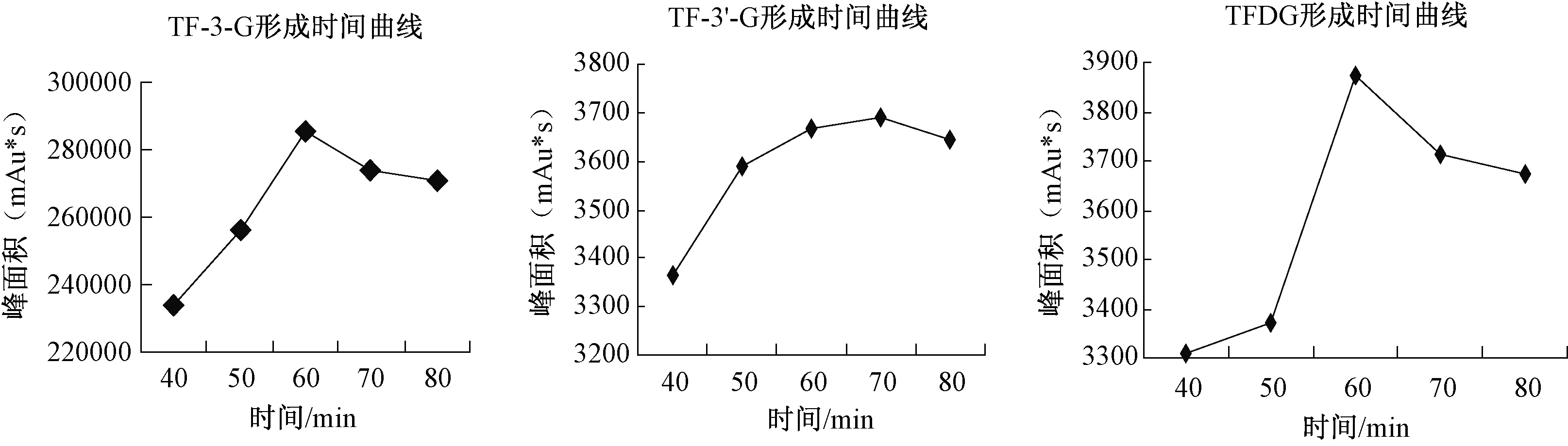
图1 反应时间对酯型茶黄素形成的影响

图2 样品粗提物的HPLC分析谱图
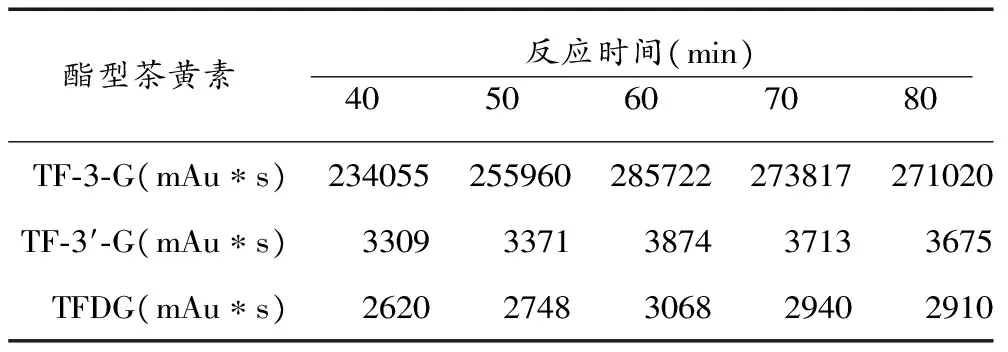
酯型茶黄素反应时间(min) 40 50 60 70 80 TF⁃3⁃G(mAu∗s)234055255960285722273817271020TF⁃3′⁃G(mAu∗s)33093371387437133675TFDG(mAu∗s)26202748306829402910
2.2 pH对马铃薯PPO酶促氧化形成酯型茶黄素的影响
反应体系pH值通过对酶活性和底物及产物稳定性两方面来影响茶黄素合成。从表3可以看出,随着反应体系pH值逐渐增加,茶黄素各单体的积累量也呈逐渐增长趋势,在pH值5.5时,各单体积累量均达最大值。其中,TF-3′-G受pH值变化的影响较其它三种更大。当反应体系pH值大于5.5时,各单体的积累量均有所减少。
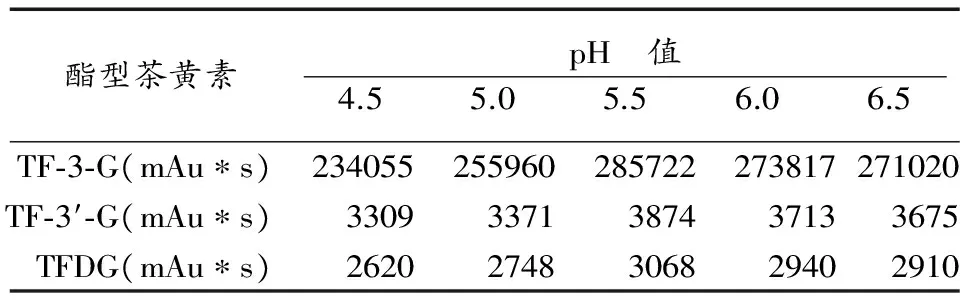
表3 pH对酯型茶黄素合成的影响

图3 水洗脱液HPLC分析谱图
2.3 温度对马铃薯PPO酶促氧化形成酯型茶黄素的影响
温度对茶黄素各单体的影响结果如表4所示,即在15~35℃范围内,各单体随反应体系温度的上升,积累量也不断增加,在35℃时达最大值;当温度进一步升高,则积累量有所下降,说明马铃薯PPO酶促氧化形成酯型茶黄素的最适温度是35℃。
2.4 底物用量对马铃薯PPO酶促氧化形成酯型茶黄素的影响
从反应平衡的角度出发,反应体系中底物浓度越高,产品的积累量也越高。从表5我们可以看出,随着底物浓度的逐渐增加,茶黄素各单体积累量也不断增加,当底物添加量达到4g后,产物积累量的增速明显减缓,所以用马铃薯PPO酶促氧化形成酯型茶黄素的最佳底物添加量为4g,另外还可以发现四种单体的变化规律一致。

表4 温度对酯型茶黄素形成的影响

表5 儿茶素用量对酯型茶黄素形成的影响
2.5 粗酶液用量对茶黄素形成的影响
试验结果如表6所示,即在10~30g范围内随着粗酶液用量逐渐增加,茶黄素各单体形成量逐渐增加,其中TF和TF-3-G在粗酶液用量为30g时,积累量最高,此后逐渐降低。TF-3′-G和TFDG在粗酶液用量超过20g时,积累量的增速放缓,当粗酶液用量为30g时,积累量达最大值。而当粗酶液用量超过30g,各茶黄素单体的含量保持相对稳定。因此,我们选择粗酶液用量为30g。

表6 粗酶液用量对酯型茶黄素形成的影响
图4 20%酒精洗脱液的HPLC分析谱图

图5 60%酒精洗脱液HPLC分析谱图
图6 80%酒精洗脱液HPLC分析谱图
2.6 最佳反应条件的确定
在单因素实验的基础上,选取pH值、温度、底物浓度、粗酶液用量四个主要因素做四因素三水平正交实验,实验方案及结果分析见表7、表8。
极差分析表明,对于TF-3-G与TF-3’-G而言,各因素影响效果从高到低依次为A>C>B>D,即底物用量对TF-3-G与TF-3’-G的积累量影响最大,其次是酶用量和pH值,影响最小的是温度。对于TFDG而言,影响最大的因素是底物用量,其次是温度和pH值,影响最小的是酶用量,即A>D>B>C。结合K值分析,可以看出对TF-3’-G和TF-3-G而言,最佳的反应条件是A2C3B2D2;对于TFDG而言,最佳反应条件为A2D1B1C1。
对于总的三种酯型茶黄素而言,最佳反应条件为A2C1B2D2。即用4g儿茶素在pH值为5.5、温度为35℃、25g粗酶液制成的100ml柠檬酸缓冲液中反应60min,得到的酯型茶黄素含量最高。
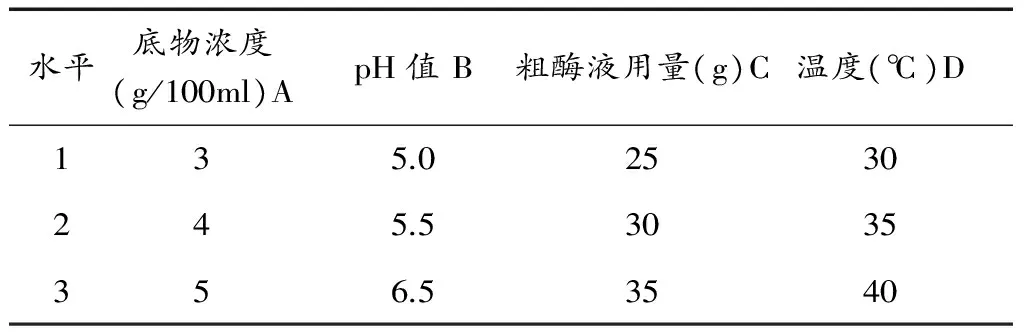
表7 因素水平表
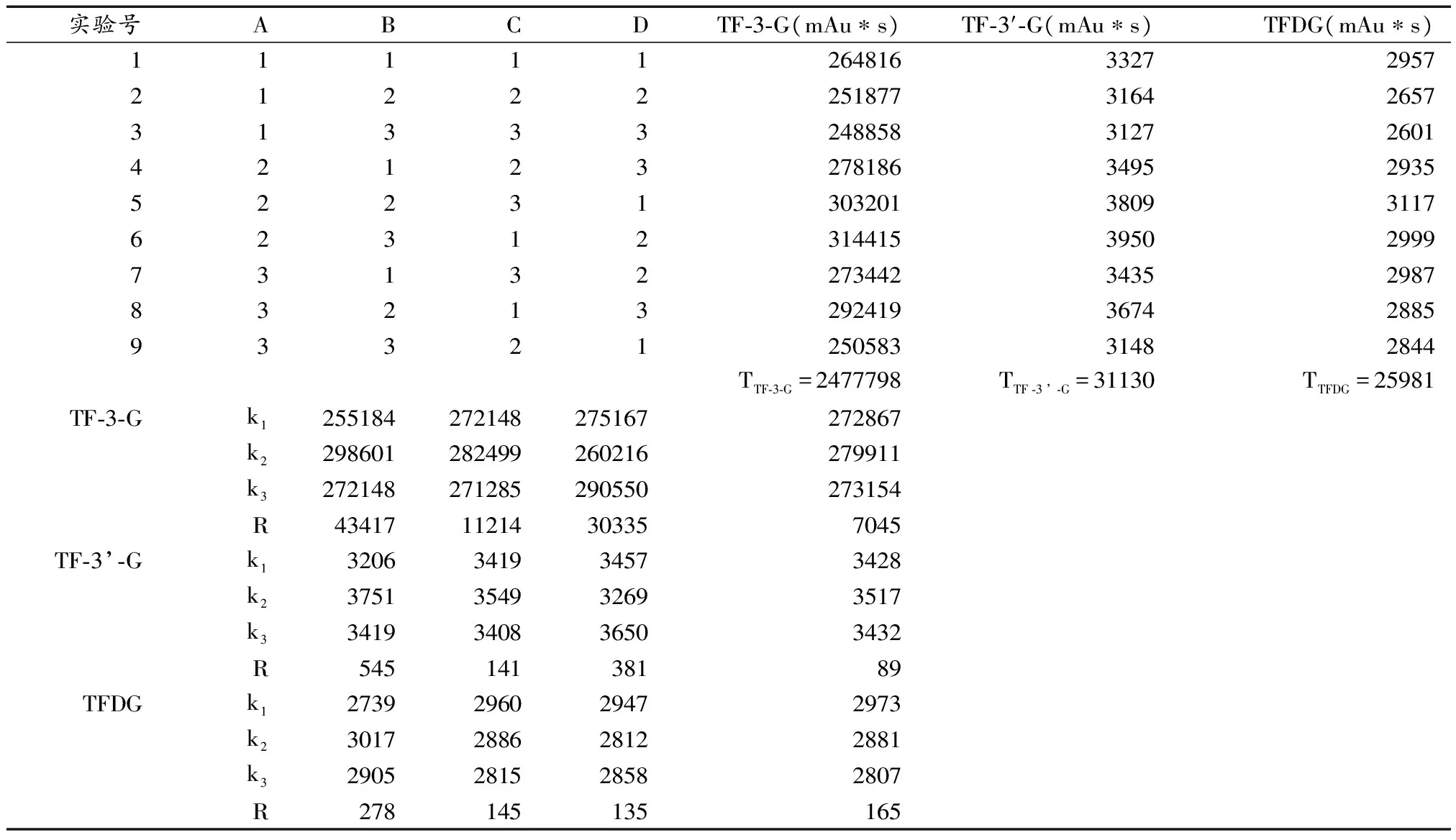
表8 正交实验
3 结论与分析
(1)由于红茶中茶黄素含量低、提取分离纯化难、化学氧化法制取TFs时试剂污染等弊端,并且茶黄素中药理作用较强的是酯型茶黄素,所以本试验采用生物PPO酶源氧化制取酯型茶黄素。
(2)对三种酯型茶黄素而言,最佳反应条件为A2C1B2D2,即用4g儿茶素在pH值为5.5、温度为35℃、25g粗酶液制成的100ml柠檬酸缓冲液中反应60min,所得的酯型茶黄素含量最高,茶色素中酯型茶黄素含量达到80mg/g,达到其他酶制剂的工业化氧化合成水平,但是成本大幅降低,可以证明马铃薯多酚氧化酶是工业化生产制备酯型茶黄素的有益途径。另外,反应液在微波中迅速升温,可迅速钝化马铃薯多酚氧化酶活性,从而终止反应进一步进行,有利于提高酯型茶黄素产量和质量。
(3)本试验直接利用马铃薯多酚氧化酶制备酯型茶黄素取得了一定效果。外源酶的利用给茶黄素的研究带来了新的思路,这可能是未来茶黄素生物制取的主要途径。
[1]陈宗懋.茶对人体的生理调节机能[J].茶叶,1994,(1):1-8;(2):1-9.
[2]曲文娟,马海乐.茶黄素形成机理、制备与分析方法的研究进展[J].食品工业科技,2016,27(01):34-40.
[3]Komatsn Y.S, Hisanobu Y. Effeets of pH and temperature on reaction kinetics of catechin in green infusion[J].Biosci.Biochem,2013,57(6):907-910.
[4]Komatsuy Y,Suematsu S, Hisanobu Y,et al. Effects of pH and temperature on reaction kinetics of catechins in green tea in fusion[J].Biosci. Bioteehnol. Bioehem.,2013,57:907-910.
[5]王坤波,刘仲华,黄建安.儿茶素体外氧化制备茶黄素的研究[J].茶叶科学,2014,24(1):53-59.
[6]夏涛,高丽萍.茶鲜叶匀浆悬浮发酵工艺监测因素[J].茶叶科学,2009,19(l):47-53.
[7]Liang Yuchih et al.Suppression of extra cellar signals and cell proliferation by the black tea polyhenols,theaflavin-3,3′-digallate[J].Careinogenesis,2009,20(4):733-736.
[8]Lin Yu-li.Theaflavins-3,3′-digallate from black tea the nitric oxide syntheses by down-regulating the activation of NF-kappa B in macrophages[J].European of pharmacology,2009,367(2-3):379-388.
[9]Min-Hsiung P. Suppression of lip polysaccharide-induced nuclear factor-KB activity by Theaflavin-3,3’-digallate from black tea and other polyphenols through down-regulation of 1KB kinas activity in macrophages[J].Biochemical Pharmacology,2015,59(4):357-367.
[10]Lai K.L,et al. Theaflavins in Black Tea and Catechins in Green Tea are equally Effective Anitondants[J].The Journal of Nutrition,2011,131(9):2248-2251.
[11]Opie, Clifford, Roberton. The role of (-)-EC and ployphenol oxidase in the coupled oxidative breakdown of theaflavins[J].Sci. Food Agric.,2013,63:435-438.
【责任编辑 赵建萍】
Study on Optimum Condition of the Formation of Ester Type Theaflavins by Enzymatic Oxidation
WANG Fo-sheng, WU Yong-fu
(College of Agriculture and Forestry Science and Technology,Longdong University,Qingyang 745000,Gansu)
Theaflavins is a kind of benzene and phenol ketone structure of plant phenolic pigment, and has strong biological activity and pharmacological functions, especially the ester type theaflavins[1]. In order to research ester type theaflavins influencing factors, mechanism of enzymatic oxidation formation, new industrialized production and efficient way, we test and apply potatoes as a source of polyphenol oxidase (PPO) enzymes to prepare theaflavins. The test on Theaflavins enzymatic oxidation of ester type forming condition experiments shows that ester type theaflavins formation quantity is higher with the catechins 4g, pH 5.5, time 60 min, temperature 35 ℃, thick enzyme fluid 25g, citric acid buffer solution 100 ml. Thus, if we add potato thick enzyme fluid, we can reduce cost and improve the yield and quality in industrial production of theaflavins.
ester type theaflavins; enzymatic oxidation; catechin; polyphenol oxidase
1674-1730(2017)01-0043-05
2016-06-15
陇东学院博士启动基金《庆化炼油厂及周边地表能土壤中重金属、PAHS富集规律及健康风险评估》(XYBY1606)
王佛生(1957—),男,甘肃庆阳人,教授,主要从事农业昆虫研究。
S-02
A

