1型鸭肝炎病毒RT-PCR快速检测方法的建立
王永娟,朱善元,王安平,吴 双,洪伟鸣,左伟勇
(江苏农牧科技职业学院/江苏省兽用生物制药高技术研究重点实验室,江苏 泰州 225300)
1型鸭肝炎病毒RT-PCR快速检测方法的建立
王永娟,朱善元,王安平,吴 双,洪伟鸣,左伟勇*
(江苏农牧科技职业学院/江苏省兽用生物制药高技术研究重点实验室,江苏 泰州 225300)
为建立快速检测临床1型鸭肝炎病毒(DHAV-1)感染的方法,根据DHAV-1的vp1基因序列设计1对引物,以DHAV-1及其他常见的感染鸭的病毒基因组为模板,建立了DHAV-1的特异性RT-PCR检测方法;以10倍梯度稀释的DHAV-1 RNA为模板,测定该方法的灵敏度;采集江苏多地的疑似DHAV-1感染病料,提取基因组进行RT-PCR扩增,产物经测序鉴定后判断所建立方法的检测率。结果显示,建立的方法可以特异性扩增DHAV-1vp1基因保守区360 bp的序列,最低可检测1 fg基因组模板,对临床样品检测率为100%。表明,成功建立了特异性强、灵敏度高且可以用于临床快速诊断DHAV-1感染的方法。
鸭; 1型鸭肝炎病毒; 反转录PCR; 检测
1型鸭病毒性肝炎是由1型鸭肝炎病毒 (duck hepatitis virus type 1,DHAV-1)引起的一种以雏鸭肝脏为主要病理变化的急性高度致死性传染病,死亡率可达90%以上,是危害养鸭业的主要传染病之一,呈世界性分布[1]。该病毒于2004年被Tseng等[2]首次分离并确定,2006年Kim等[3]首次报道其全基因组序列,2012年其被国际病毒分类委员会(ICTV)列为小核糖核酸病毒科、禽肝炎病毒属[4]。该病毒全基因组编码2 249 个氨基酸,编码蛋白质顺序为5′-UTR-VP0-VP3-VP1-2A1-2A2-2A3-2B-2C-3A-3B-3C-3D-3′[3]。vp1基因 ORF 由714 个碱基组成,编码26.4 ku的VP1蛋白,为DHAV-1的结构蛋白之一。任邵娜等[5]对12株DHAV-1临床分离株的vp1基因进行测序发现,不同毒株vp1基因的核苷酸序列同源性为99.2%~100%,保守性较高,可作为建立DHAV-1检测方法的候选基因。
目前,临床上检测DHAV-1的方法有病毒分离鉴定[6]、病毒中和试验[7]、免疫电镜[8]、ELISA[9-11]等。PCR检测技术具有灵敏度高、简便、快速、安全等特点,易于推广;对标本的纯度要求较低,无需分离病毒即可检测[12],已在多种病毒的诊断检测中被应用,在鸭病毒性肝炎的检测中也有报道,但均未研制成商品化试剂盒。为此,以病毒vp1基因为目标基因,建立快速、敏感、廉价的RT-PCR检测方法,以期在临床上推广应用。
1 材料和方法
1.1 材料
1型鸭肝炎病毒、鸭瘟病毒、鸭坦布苏病毒、番鸭细小病毒均由中国农业科学院上海兽医研究所馈赠,鸭呼肠孤病毒由福建省农业科学院惠赠,鸭低致病性禽流感病毒由扬州大学兽医学院馈赠;9日龄SPF鸡胚购自扬州朝天歌农牧科技有限公司。
主要试剂:dNTP、RNA酶抑制剂、DNA聚合酶、DNA Marker、病毒基因组提取试剂盒均购自TaKaRa公司;M-MLV反转录试剂盒购自BBI公司。
1.2 试验方法
1.2.1 病毒扩增 将DHAV-1原液用PBS缓冲液按照1︰10、1︰100、1︰1 000比例稀释,尿囊腔无菌接种9日龄SPF鸡胚,每个胚体接种0.1 mL。无菌收取接毒24~120 h死亡或未死亡的胚体,观察病变情况。剪碎研磨后加适量PBS缓冲液制成匀浆,反复冻融3次后,5 000 r/min离心10 min吸取上清液,-80 ℃保存。
1.2.2 病毒基因组RNA提取 取收集的病毒液100 μL,按照病毒基因组提取试剂盒说明书进行病毒基因组RNA提取,提取时未加入Carrier RNA。最后将病毒基因组RNA溶解于40 μL的无RNase酶 dH2O中,用分光光度仪测定病毒基因组RNA的纯度与含量。
1.2.3 RT-PCR方法的建立 根据已发表的vp1基因序列(登录号EU621879.1)设计1对引物,上游引物F:5′- GTTTGGGAGGCAATGGTT -3′,下游引物R:5′- ATTGAGTCCACATGAACAG -3′。设置25 μL反应体系进行反转录,包括反转录酶1 μL、dNTPs 2 μL、随机引物2 μL、5×RT Buffer 5 μL、抑制剂0.5 μL和RNA模板14.5 μL,反应程序为:25 ℃ 10 min,42 ℃ 60 min,70 ℃ 10 min。
反应体系为50 μL,包括cDNA产物5 μL,上、下游引物各1 μL,2×TaqMix酶25 μL,dH2O 18 μL。反应程序为:94 ℃预变性4 min;94 ℃变性30 s,52 ℃退火45 s,72 ℃延伸1 min,25个循环;最后72 ℃延伸10 min。反应结束后取5 μL产物进行1.5%琼脂糖凝胶电泳,并用凝胶成像系统拍照分析。同时设无RNA的空白对照组。
1.2.4 特异性测定 参照病毒基因组提取试剂盒说明书,分别提取1型鸭肝炎病毒、鸭瘟病毒、呼肠孤病毒、鸭坦布苏病毒、番鸭细小病毒和鸭低致病性禽流感病毒基因组,按上述RT-PCR方法,分别以DHAV-1上、下游引物进行扩增,扩增产物于1.5%琼脂糖凝胶电泳进行分析。
1.2.5 灵敏度测定 以提取的1 μL RNA为模板进行10倍梯度稀释,按照上述反转录及PCR程序进行扩增,然后取扩增产物5 μL进行1.5%琼脂糖凝胶电泳,并用凝胶成像系统拍照分析。
1.2.6 临床样品检测 从江苏省泰州、扬州、射阳和徐州等地采集7份疑似DHAV-1感染的番鸭肝脏组织,分别取1 g左右,按照病毒基因组提取试剂盒说明书提取病毒基因组RNA,再按上述方法进行RT-PCR扩增,设不加RNA的空白对照组及DHAV-1阳性对照组,扩增产物进行1.5%琼脂凝胶电泳分析,特异性扩增条带切胶回收后,送上海英俊公司测序。
2 结果与分析
2.1 DHAV-1病毒扩增结果
鸡胚在接种DHAV-1后,于第2天开始出现死亡,至第5天时各稀释度处理的鸡胚全部死亡。取出胚体后发现,胚体体积明显小于同日龄未接毒的鸡胚,胚体水肿、肝脏及全身出血明显。
2.2 DHAV-1 RT-PCR检测方法的建立
提取DHAV-1病毒基因组RNA,分光光度计测得质量浓度为10.9 ng/μL。病毒基因组经反转录后进行PCR扩增,PCR产物经1.5%琼脂糖凝胶电泳后,可见清晰条带(图1),与预期360 bp目的片段相符。
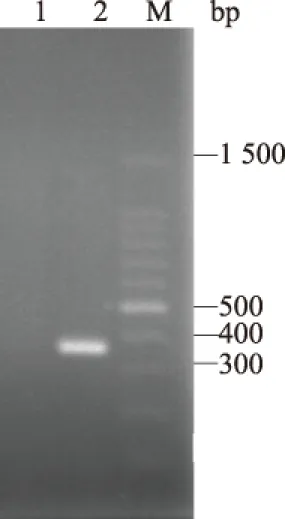
M.100 bp DNA Ladder Marker; 1.空白对照; 2.DHAV-1图1 DHAV-1的RT-PCR扩增结果
2.3 DHAV-1 RT-PCR特异性检测结果
在同等反应条件下,应用 DHAV-1上、下游引物对1型鸭肝炎病毒、鸭瘟病毒、鸭呼肠孤病毒、鸭坦布苏病毒、番鸭细小病毒和鸭低致病性禽流感病毒基因组进行RT-PCR扩增,扩增产物经1.5%琼脂糖凝胶电泳分析(图2)可见,除DHAV-1有特异性360 bp条带外,其他病毒均未扩增出任何条带。

M.100 bp DNA Ladder Marker; 1—6分别为鸭瘟病毒、鸭呼肠孤病毒、 鸭坦布苏病毒、番鸭细小病毒、鸭低致病性禽流感病毒、1型鸭肝炎病毒图2 RT-PCR检测DHAV-1的特异性扩增结果
2.4 DHAV-1 RT-PCR灵敏度检测结果
在同等反应条件下,改变基因组RNA的剂量,以10.9 ng/μL的RNA 1 μL为起始剂量,10倍梯度稀释,在10-7稀释度之后,无特异性条带扩增(图3),对应 RNA约为1 fg。

M.100 bp DNA Ladder Marker; 1—10.109~100稀释的DHAV-1图3 RT-PCR检测DHAV-1的灵敏度扩增结果
2.5 临床样品DHAV-1 的RT-PCR检测结果
用建立的方法检测临床采集的7份疑似病料,检测结果如图4所示,均在预期360 bp处有特异性扩增,而空白对照组无扩增,检出率为100%。7个扩增产物的测序结果与vp1基因序列(登录号EU621879.1)同源性为100%。

M.100 bp DNA Ladder Marker; 1.空白对照; 2—8.临床样品; 9.阳性对照图4 临床样品DHAV-1的 RT-PCR检测结果
3 结论与讨论
1型鸭肝炎病毒的初代分离一般使用鸭胚,经鸭胚盲传若干代后可形成鸡胚适应毒,可在9~11日龄鸡胚或10~14日龄鸭胚中增殖,但是鸭胚接种的敏感性与病毒产生量明显高于鸡胚[13]。尽管如此,由于国内SPF鸭胚的局限性,大多数试验仍然选择SPF鸡胚进行病毒增殖。本试验将DHAV-1毒株经尿囊腔接种9日龄鸡胚,鸡胚在24 h后出现死亡,到第5天时全部死亡,死亡率达100%,鸡胚病变明显;同时,以这些胚体毒的基因组为模板建立了RT-PCR检测方法,证实了该病毒样本接种鸡胚的有效性。
VP1蛋白为DHAV-1的结构蛋白之一,任邵娜等[5]的研究结果表明,DHAV-1临床分离株的vp1基因序列同源性高达99.2%~100%,可作为建立检测方法的候选基因。本研究通过DNAstar软件分析了5条GenBank中已登录的vp1基因序列(登录号EU621879.1、EU621875.1、EU621876.1、EF151312.1、JQ316452.1)确定保守区域,同时,比对鸭瘟病毒、鸭呼肠孤病毒、鸭坦布苏病毒、番鸭细小病毒和鸭低致病性禽流感病毒相关基因的序列,最终根据EU621879.1序列设计能够特异性扩增360 bp条带的引物,建立RT-PCR检测方法,以便普遍适用于临床上DHAV-1感染样品的快速检测。利用建立的方法检测江苏地区的7例疑似DHAV-1感染病例,检出率和准确性达100%,进一步证实了所用引物和建立方法的正确性。该方法与程安春等[8]的方法相比,在确保检出率的基础上,进一步提高了灵敏度,而且廉价、快捷、准确,对采样要求较低,适于在临床推广应用,为DHAV-1快速检测试剂盒研制奠定了基础,对DHAV-1感染病例的快速检测、疫情控制具有指导意义。
[1] Liu M,Zhang T,Zhang Y,etal. Development and e valuation of a VP1-ELISA for detection of antibodies to duck hepatitis type 1 virus[J].Journal of Virological Methods,2010,169(1):66-69.
[2] Tseng C H,Knowles N J,Tsai H J.Molecular analysis of duck hepatitis virus type 1 indicates that it should be assigned to a new genus[J].Virus Res,2007,123(2):190-203.
[3] Kim M C,Kwon Y K,Joh S J,etal.Molecular analysis of duck hepatitis virus type 1 reveals a novel lineage close to the genus Parechovirus in the family Picornaviridae [J].J Gen Virol,2006,87:3307-3316.
[4] 张忠信.ICTV第九次报告对病毒分类系统的一些修改[J].病毒学报,2012,28(5):595-599.
[5] 任邵娜,袁生,蒲文珺,等.Ⅰ型鸭肝炎病毒VP1基因克隆与序列分析[J].湖北农业科学,2014,53(21):5208-5212,5216.
[6] Swayne D E,Glisson J R,Jackwood M W,etal.A laboratory manual for theisolation and identification of avian pathogens[M].4th ed.Dubuque:International Book Distributing Co.,2006.
[7] 汪铭书,程安春,陈孝跃.鸭病毒性肝炎的研究——强毒在雏鸭体内的分布及排泄[J].中国兽医学报,1997,17(3):254-257.
[8] 程安春,汪铭书,廖得惠,等.应用胶体金免疫电镜技术检测鸭肝炎病毒[J].中国兽医杂志,1994,20(6):3-4.
[9] 马秀丽,宋敏训,于可响,等.鸭病毒性肝炎病毒vp1 基因表达及其抗体检测ELISA方法的建立[J].微生物学报,2008,48(8):1110-1114.
[10] Liu M,Zhang T ,Zhang Y.Development and evaluation of a VP1-ELISA for detection of antibodies to duck hepatitis type 1 virus[J].J Virol Methods,2010,169:66-69.
[11] 董井泉,张蕾,马波,等.1型鸭肝炎病毒VP1 蛋白优势抗原区的鉴定及抗体检测ELISA 方法的建立[J].中国预防兽医学报,2014,36(7):542-546.
[12] 胡成,朱善元,左伟勇,等.鸭I型肝炎病毒一步法RT-LAMP可视化快速检测方法的建立[J].江苏农业学报,2015,31(3):613-618.
[13] Ding C Y,Zhang D B.Molecular analysis of duck hepatitis virus type 1[J].Virology,2007,361:9-17.
Establishment of RT-PCR Method for Detection of
Duck Hepatitis Virus Type 1
WANG Yongjuan,ZHU Shanyuan,WANG Anping,WU Shuang,HONG Weiming,ZUO Weiyong*
(Jiangsu Agri-animal Husbandry Vocational College/Jiangsu Provincial Key Laboratory of Veterinary Bio-pharmaceutical High Tech Research,Taizhou 225300,China)
In order to establish a rapid detection method for dicnical duck hepatitis virus type 1(DHAV-1) infection,a pair of primers based onvp1 gene sequence was designed.Using DHAV-1 or other common disease virus genome as template,a specificity RT-PCR method was established.The template was ten times diluted for sensitivity detection.Some suspected DHAV-1 infected epidemic materials were collected from Jiangsu province.Genome of the materials were extracted and detected followed with sequence determination.The results showed that the established method could specifically amplifyvp1 conservative region 360 bp sequence.The sensitivity and specificity results showed that the detection limitation was 1 fg,and there was no cross reactions with other duch virused.The detection rate of clinical samples was 100%.The results showed that a high specificity and high sensitivity RT-PCR method for rapid clinical diagnosis of duck DHAV-1 infection was successfully established.
duck; duck hepatitis virus type 1; RT-PCR; detection
2016-08-22
江苏省高校自然科学研究面上项目(16KJB230004);江苏省“六大人才”高峰资助项目(NY-023,10410015002);江苏农牧科技学院“凤凰人才工程”项目;江苏农牧科技职业学院重点支持项目(NSFZD1405,NSFPT201510,NSFPT201512)
王永娟(1980-),女,江苏海门人,副教授,博士,主要从事动物传染病防治研究。E-mail:43088591@qq.com
*通讯作者:左伟勇(1978-),男,山东泰安人,教授,博士,主要从事动物疫病防控研究。E-mail:979490023@qq.com
S855.3
A
1004-3268(2017)02-0116-04

