miR-124通过靶基因IQGAP1调控甲状腺癌细胞分化、增殖的机制
于 佳 何 庆 刘玲梅 李宇琛
(天津市海河医院内科,天津 300350)
miR-124通过靶基因IQGAP1调控甲状腺癌细胞分化、增殖的机制
于 佳 何 庆1刘玲梅 李宇琛
(天津市海河医院内科,天津 300350)
目的 探讨miR-124对甲状腺癌细胞的作用机制。方法 通过RT-PCR检测人甲状腺癌细胞K1、BCPAP、TPC-1和人甲状腺细胞Nthy-ori 3-1中miR-124的表达水平。MTT法检测甲状腺癌细胞K1转染miR-124 mimics、mimics control后的细胞存活率。根据靶基因预测软件The miRBase、TargetScan、PicTar预测miR-124的靶基因IQGAP1,构建wt-IQGAP1和mut-IQGAP1,采用双荧光素酶活性检测鉴定靶基因的正确性。Western印迹检测转染miR-124 mimics、mimics control后甲状腺癌细胞K1中IQGAP1的表达情况。甲状腺癌细胞K1中转染siIQGAP1和siIQGAP1 control,用MTT检测细胞增殖能力,Western印迹检测细胞中IQGAP1蛋白表达含量。结果 甲状腺癌细胞K1、BCPAP、TPC-1中的miR-124的相对表达量与甲状腺细胞相比差异显著(P<0.05),三种甲状腺癌细胞中K1细胞的表达量最低。转染后12 h内,空白组、miR-124 mimics组和mimics control组的甲状腺癌K1细胞的存活数量差异不显著(P>0.05),从转染后12 h开始,miR-124 mimics组与对照组、mimics control组相比,甲状腺癌细胞生长抑制明显。预测miR-124的靶基因可能为IQGAP1,转染miR-124 mimics 野生型IQGAP1中荧光素酶活性比突变型IQGAP1中荧光素酶活性显著降低,差异显著(P<0.05)。mimics control和wt-IQGAP1和mut-IQGAP1共转染组比较无明显差异(P>0.05)。转染miR-124 mimics组甲状腺癌K1细胞IQGAP1蛋白明显下降,miR-124负调控IQGAP1的表达。抑制甲状腺癌K1细胞中IQGAP1基因,细胞增殖能力减弱,细胞中IQGAP1蛋白表达减弱。结论 miR-124在甲状腺癌细胞中表达下调,miR-124可以抑制甲状腺癌细胞的增殖分化,其通过负调控靶基因IQGAP1抑制癌细胞增殖分化。
甲状腺癌;miRNA;靶基因;增殖
甲状腺癌发病率高,致死率高,治疗预后差〔1〕,因此,寻找治疗和诊断甲状腺癌的小分子标志物对于提高甲状腺癌的诊断率和治疗效果都具有重要意义。miRNA是一种小分子的RNA,由20~25个核苷酸组成〔2〕。生物机体内存在多种小RNA分子,这些小分子是非编码性的单链RNA,具有多种生物学功能。近年来,小RNA分子与肿瘤的关系受到广泛关注,在胃癌、肝癌、乳腺癌、宫颈癌、淋巴癌等多种肿瘤中已经得到验证〔3〕。miR-124在乳腺癌、胃癌中表达下调〔4〕,但关于miR-124在甲状腺癌中的表达研究尚未见相关报道。本研究通过对比多种甲状腺癌细胞中miR-124表达水平,研究miR-124对甲状腺癌细胞增殖的影响,探讨miR-124对相关靶基因的调控机制。
1 材料与方法
1.1 材料 人甲状腺癌细胞K1、BCPAP、TPC-1和人甲状腺细胞Nthy-ori 3-1均为本实验室保存。主要仪器与试剂:酶标仪(南京德铁实验设备有限公司),紫外分光光度计(美国Thermo),CO2培养箱(日本SANYO),超净工作台(苏州净化设备有限公司),倒置显微镜(日本尼康),水浴锅(上海精密仪器仪表公司),离心机(湖南恒诺医用设备有限公司),荧光素酶检测试剂盒(碧云天生物技术有限公司),反转录试剂盒〔宝生物工程(大连)有限公司〕,DMEM培养基(美国Sigma),DAB显色液(美国Thermo),Triozl细胞裂解液(美国Thermo),抗体稀释液(杭州联科生物股份有限公司),胎牛血清(FBS)(杭州四季青有限公司),MTT(碧云天生物技术有限公司),青链霉素(美国Sigma),PBS(碧云天生物技术有限公司),胰蛋白酶(美国Sigma),脱脂奶粉(雅培),细胞总蛋白提取(碧云天生物技术有限公司),Real-time PCR试剂盒(上海欣百诺生物工程有限公司),兔抗IQGAP1多克隆抗体(北京博尔迈生物技术有限公司),鼠抗人β-actin抗体(北京博尔迈生物技术有限公司),辣根过氧化物标记的二抗(北京博尔迈生物技术有限公司)。
1.2 方法
1.2.1 细胞培养 从液氮罐中取出人甲状腺癌细胞K1、BCPAP、TPC-1和人甲状腺细胞Nthy-ori 3-1,放置于37℃水浴锅中融化,观察细胞完全融化后,加入8倍体积的细胞生长液(含青霉素100 U/ml,链霉素0.1 mg/ml,15%FBS的DMEM培养基,pH7.2),1 000 r/min离心10 min,弃上清,加入细胞生长液,于37℃、5%CO2培养箱中培养48 h。观察细胞生长液颜色变浅时,加入0.5%的胰蛋白酶消化细胞,1 000 r/min离心10 min,弃去胰蛋白酶消化液,加入新鲜的细胞生长液悬浮细胞,接种于细胞培养瓶中培养。
1.2.2 RT-PCR检测细胞中miR-124表达 取对数生长期的人甲状腺癌细胞K1、BCPAP、TPC-1和人甲状腺细胞Nthy-ori 3-1,加入适量Triozl细胞裂解液,放置于冰上静置5 min,用移液枪吹打细胞。将裂解的细胞转移至1.5 ml EP管中,加入200 μl氯仿充分混匀,上下颠倒10次,室温静置3 min。4℃12 000 r/min离心15 min,吸取水相层至新的EP管中,加入异丙醇500 μl混合均匀,室温下静置20 min,4℃ 12 000 r/min离心15 min,弃上清。加入75%的乙醇充分混合,10 000 r/min离心5 min,弃上清,放置于超净工作台中晾干,加入DEPC水,-80℃保存。用紫外分光光度计检测提取的RNA浓度及纯度,按照反转录试剂盒说明书反转录合成各组细胞miR-124的cDNA,按照荧光定量PCR试剂盒操作说明书扩增miR-124的cDNA,分析各组细胞中miR-124表达水平。
1.2.3 细胞转染 取对数生长期的甲状腺癌细胞K1,加入胰蛋白酶消化后,接种于6孔细胞培养板中,调整细胞浓度为每毫升含有5×103个细胞,37℃、CO2培养箱中培养过夜,观察细胞融合度大约为80%后,将细胞生长液换成不含血清的DMEM不完全培养基继续孵育1 h以增加转染效率。将5 μl转染试剂Lipofectamine 2000与250 μl的不完全培养基混合均匀后,室温下静置5 min,同时取250 μl的不完全培养基与miR-124 mimics、mimics control混合室温静置5 min。将Lipofectamine 2000混合物加入到miR-124 mimics、mimics control混合物中,室温静置20 min。将混合物加入到细胞中,37℃、CO2培养箱中培养6 h,换含有胎牛血清的完全培养液继续培养。
1.2.4 MTT法检测转染细胞增殖情况 转染miR-124 mimics、mimics control后的K1细胞接种于96孔细胞培养板中,同时设置空白对照组,空白对照组用未转染的甲状腺癌细胞K1,细胞浓度为3×105个/ml,每孔加入100 μl细胞悬液,37℃、CO2培养箱中培养24 h后,加入50 μl MTT溶液(浓度为5 mg/ml),37℃孵育4 h。小心弃去上清,加入150 μl DMSO溶液混合,摇床震荡10 min,观察结晶物充分溶解后,放置于酶标仪上检测各孔吸光度,为了提高实验结果的准确性,每组设置8个复孔。观察细胞存活情况。
1.2.5 miR-124靶基因预测与鉴定 根据靶基因预测软件The miRBase(http://www.mirbase.org/)、TargetScan(http://www.targetscan.org/)、PicTar(http://pictar.mdc-berlin.de/)预测miR-124的靶基因,结果显示IQGAP1可能是miR-124的靶基因。分别构建野生型IQGAP1荧光素酶报告基因载体(wt-IQGAP1)和突变型IQGAP1荧光素酶报告基因载体(mut-IQGAP1),将这两种质粒wt-IQGAP1和mut-IQGAP1分别与miR-124 mimics和mimics control混合后共同转染到甲状腺癌K1细胞中,37℃、CO2培养箱中培养48h。收集的细胞经PBS洗涤后,根据双荧光素酶报告基因检测试剂盒检测荧光素酶活性。
1.2.6 Western印迹检测IQGAP1的表达 转染miR-124 mimics、mimics control后的甲状腺癌K1细胞培养24 h后,收集细胞并加入冰预冷的PBS反复洗涤细胞3次,胰蛋白酶消化细胞后,10 000 r/min离心5 min,加入适量PBS悬浮细胞,10 000 r/min离心5 min,弃上清,重复洗涤细胞2次。加入细胞蛋白提取液充分混合,放置于冰上孵育20 min,振荡器上震荡10 min。吸取裂解细胞转移至离心管中,1 000 r/min离心10 min,取蛋白上清置于-20℃冰箱中保存备用。紫外分光光度计测定蛋白浓度及纯度,取蛋白样品与loading buffer混合,100℃煮沸变性5 min。SDS蛋白胶用12%分离胶和5%浓缩胶,80 V电压电泳观察溴酚蓝进入浓缩胶和分离胶交界处,调整电压为120 V至电泳结束。取出蛋白凝胶置于电泳缓冲液中浸泡20 min,按照滤纸、PVDF膜、蛋白凝胶、滤纸的顺序在300 mA转膜90 min。取出PVDF膜加5%脱脂奶粉的封闭液在37℃封闭2 h,PBST洗涤PVDF膜,加入一抗,室温下孵育2 h,PBST洗涤3次,每次5 min,加二抗孵育过夜。PBST洗膜,加入DAB显色液,暗室中曝光,用凝胶光密度软件分析蛋白表达含量。
1.2.7 IQGAP1对细胞增殖影响 将处于对数生长期的甲状腺癌细胞K1转染siIQGAP1和 siIQGAP1 control,MTT法检测细胞增殖情况,转染方法同1.2.3,MTT法检测细胞增殖同1.2.4。Western印迹检测转染siIQGAP1和 siIQGAP1 control后的甲状腺癌细胞中IQGAP1 的表达水平,方法同1.2.6。
1.3 统计学分析 采用SPSS13.0软件行方差分析。
2 结 果
2.1 各组细胞中miR-124的表达检测 甲状腺癌细胞K1中miR-124相对表达量为(1.14±0.11),BCPAP中为(3.24±0.21),TPC-1中为(2.31±0.16),Nthy-ori 3-1中为(3.98±0.24)。甲状腺癌细胞K1、BCPAP、TPC-1中的miR-124的相对表达量与甲状腺细胞相比差异显著(P<0.05),三种甲状腺癌细胞中K1细胞的表达量最低。
2.2 MTT法检测细胞增殖情况 转染后12 h内,空白组、miR-124 mimics组和mimics control组的甲状腺癌K1细胞的OD值差异不显著(P<0.05)。从转染后12 h开始,miR-124 mimics组与空白组、mimics control组相比,细胞生长抑制明显(见图1)。从转染后48 h开始,miR-124 mimics组与空白组、mimics control组相比细胞吸光度差异显著(P<0.05),miR-124可以明显抑制甲状腺癌细胞K1的增殖。
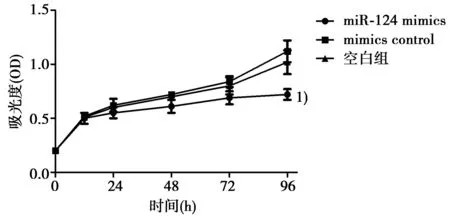
与空白组比较:1)P<0.05 图1 MTT法检测miR-124对甲状腺癌细胞K1的存活影响
2.3 miR-124靶基因鉴定 转染miR-124 mimics 野生型IQGAP1中荧光素酶活性比突变型IQGAP1中荧光素酶活性显著降低(P<0.05)。mimics control与wt-IQGAP1和mut-IQGAP1共转染组无明显差异(P>0.05),说明miR-124的靶基因为IQGAP1。
2.4 Western印迹检测IQGAP1蛋白表达含量 将转染有miR-124 mimics的甲状腺癌K1细胞中IQGAP1蛋白表达含量与空白组和mimics control组相比差异显著(P<0.01)。空白组和mimics control组的IQGAP1蛋白表达含量差异不显著(P>0.05)。miR-124 mimics组甲状腺癌K1细胞IQGAP1蛋白明显下降(图2),说明miR-124 mimics可以有效抑制IQGAP1蛋白的表达,miR-124负调控IQGAP1的表达。

1:miR-124 mimics;2:mimics control;3:空白组图2 Western印迹检测IQGAP1蛋白表达情况
2.5 IQGAP1对甲状腺癌细胞影响 转染siIQGAP1后的甲状腺癌细胞K1与对照组相比增殖能力明显减弱(P<0.05)。提示siIQGAP1可以明显减弱细胞中IQGAP1蛋白的表达量。见图3。

图3 IQGAP1对甲状腺癌细胞的影响
3 讨 论
甲状腺癌早期临床症状不明显且不易察觉,目前治疗甲状腺癌的方法主要有非手术治疗和手术治疗,非手术治疗可以有效缓解症状,延长生存率,主要应用于晚期肿瘤不能完全切除的患者;手术治疗一般适用于早期诊断为甲状腺瘤的患者,对患者的身体状况要求较高〔5〕。传统的诊断和治疗方法具有很大的局限性,给甲状腺肿瘤早期诊断和治疗带来了巨大挑战。甲状腺癌的发生和发展受多种基因、多种信号因子的调控〔6〕,寻找诊断和治疗甲状腺癌的小分子标志物是目前迫切需要解决的问题。
miRNA是一种小分子的RNA,在机体中具有调控功能,有研究发现,miRNA可以调控细胞的生长和凋亡,与胰岛素的分泌、大脑形态形成都有密切关系〔7〕。近年来,miRNA与肿瘤之间的关系也得到广泛关注,有研究发现miRNA具有抑癌基因和癌基因的作用〔8〕。研究表明,miR-125b与乳腺癌、卵巢癌、肺癌、肝癌有密切关系,在癌症的发生过程中起到抑癌基因的作用。miR-15a和miR-16-1在淋巴瘤和骨髓瘤中低表达,通过上调Bcl-2的表达促进癌症的发生。miR-21在胶质母细胞瘤中过度表达,表达水平是正常组织的100倍,可以通过抑制癌细胞凋亡促进肿瘤的发生。miR-17-5p、miR-18a、miR-19b等都是目前为止在淋巴瘤中得到验证的癌基因〔9〕。
miR-124已经被发现在乳腺癌、肝癌、胃癌细胞和组织中低表达,为一种抑癌基因。为了探究miR-124在甲状腺癌中的作用机制,本研究选用了人甲状腺癌细胞K1、BCPAP、TPC-1和人甲状腺细胞Nthy-ori 3-1,通过细胞RNA提取,反转录合成miR-124的cDNA,RT-PCR检测细胞中miR-124的表达水平。结果提示,miR-124在人甲状腺癌细胞中的表达水平明显低于人甲状腺细胞Nthy-ori 3-1,说明miR-124在甲状腺癌细胞中低表达,发挥抑癌基因的作用。转染miR-124 mimics、mimics control
的甲状腺癌K1细胞经MTT法检测,miR-124mimics可以明显抑制甲状腺癌K1细胞的增殖,进一步验证了miR-124的抑癌作用。
miRNA主要通过作用于靶基因发挥抑癌或癌基因的作用。有研究表明miR-221可以作用于靶基因BRAF发挥作用。miR-21作用于靶基因PNTE,下调PNTE的表达,而PNTE与信号通路PIK/AKT有关。miR-124在肝癌细胞中干扰STAT3信号通路发挥抑癌基因作用,在胃癌中,miR-124可以下调靶基因EZH2的表达,在乳腺癌细胞中,miR-124作用于靶基因FLOT1影响癌细胞的增殖和侵袭力〔10〕。
IQGAP1是一种支架蛋白,为IQGAPs家族的一员。IQGAP1含有能与多种蛋白相结合的区域,可以与Rac1、ERK、Src等多种蛋白相结合作用于信号通路MAPK和Wnt。在肝癌中,IQGAP1过表达可以活化Wnt信号通路,促进肝癌的发生和发展,IQGAP1在乳腺癌中高表达,促进乳腺癌细胞增殖分化〔11〕。本研究通过转染miR-124 mimics、mimics control,Western blot 检测细胞中IQGAP1的表达水平,与空白组相比IQGAP1表达明显下降,说明IQGAP1是一种癌基因,miR-124 mimics可以有效降低IQGAP1的表达。通过抑制IQGAP1基因,可使甲状腺癌细胞增殖能力明显减弱,说明miR-124可通过作用于IQGAP1基因抑制甲状腺癌细胞增殖。
1 郑向前,董 莉,高 明.甲状腺恶性肿瘤治疗研究进展〔J〕.中华普通外科杂志,2016;31(2):175-6.
2 汪 霄.康莱特对晚期乳腺癌患者血清miRNA-21的影响研究〔J〕.中国现代医生,2016;54(3):70-2,76.
3 王 鹏,刘长庭.非小细胞肺癌中microRNA与EGFR-TKI获得性耐药机制的研究进展〔J〕.肿瘤学杂志,2016;22(3):161-6.
4 杨 群,苏 波,郑 郧.阿尔茨海默病小鼠与野生型小鼠海马中miRNA表达差异〔J〕.中国老年学杂志,2016;36(3):532-6.
5 杜 倩,于莉莉,赵 晶.1393例甲状腺癌临床特点分析〔J〕.中国病案,2016;17(2):64-7.
6 单丹丹,兰 天,李 琦.甲状腺癌患者根治术的围手术期综合护理方法及临床效果〔J〕.中国医药指南,2016;14(9):237.
7 马 列.miR-182表达异常对甲状腺癌细胞株 SW579增殖迁移的影响〔J〕.现代肿瘤医学,2016;24(5):699-702.
8 殷德涛,雷梦园.甲状腺癌靶向研究的热点与展望〔J〕.中国普通外科杂志,2015;24(5):623-6.
9 张琰琰.微小RNA在B细胞淋巴瘤中的研究进展〔J〕.肿瘤研究与临床,2015;27(4):277-80.
10 辛 婧,徐银胜,张 芳.MicroRNA-124对人宫颈癌的抑制作用及机制研究〔J〕.中国生物工程杂志,2015;35(10):13-9.
11 刘子冬,方 芳,王 芳.卵巢浆液性肿瘤中IQGAP1与E-cadherin表达的检测〔J〕.细胞与分子免疫学杂志,2014;30(5):530-2.
〔2016-06-15修回〕
(编辑 郭 菁)
何 庆(1969-),男,博士,主任医师,主要从事糖尿病、甲状腺等内分泌疾病研究。
于 佳(1983-),女,硕士,主治医师,主要从事内分泌研究。
R73
A
1005-9202(2017)03-0566-03;
10.3969/j.issn.1005-9202.2017.03.018
1 天津市医科大学总医院内分泌科

