生物转化法制备茶生物质色素
王富邦,巩继贤,任燕飞,娄江飞李辉芹,张健飞
(1.天津工业大学纺织学院,天津 300387;2.天津工业大学先进纺织复合材料教育部重点实验室,天津 300387)
生物转化法制备茶生物质色素
王富邦1,2,巩继贤1,2,任燕飞1,2,娄江飞1,2李辉芹1,2,张健飞1,2
(1.天津工业大学纺织学院,天津 300387;2.天津工业大学先进纺织复合材料教育部重点实验室,天津 300387)
利用微生物发酵技术对铁观音茶中功能物质茶多酚进行生物转化,使之转化为茶生物质色素。重点讨论pH值对转化途径的影响及利用枯草芽孢杆菌液态发酵时茶色素的积累量与发酵时间的关系。结果表明:用pH5磷酸缓冲液对铁观音茶梗进行悬浮发酵后茶色素含量明显高于中性条件下的茶色素含量。铁观音茶梗经枯草芽孢杆菌液态发酵后,在第3天茶色素含量积累达到最大,铁观音茶末发酵液在第5天茶色素含量积累达到最大。
发酵 茶多酚 生物转化 茶生物质色素
0 引言
色素广泛应用于印染、食品、制药、化妆品等各个行业。传统的合成染料是经过石油的下游原料并经过有机合成技术制备得到的,若将其整理到织物上会对人体构成潜在的伤害[1]。因此,面对当前严峻的环境污染问题,研究人员必须从源头上寻找新的色素来源[2]。生物质色素是可再生资源,并在全球广泛分布,由于其可生物降解且与环境相容,因此近年来受到人们的高度重视与青睐[3]。
茶叶在中国南方、东南亚以及斯里兰卡等许多地区和国家都有所种植[4]。在茶叶的加工过程中会产生茶梗等许多下脚料,倘若利用生物转化技术将茶梗等下脚料转化为茶生物质色素,便可实现废弃资源的高效利用[5]。茶叶中有一种功能物质称为茶多酚,利用生物转化技术可以转化为茶色素[6],茶色素是由茶黄素、茶红素以及茶褐素组成的混合物[7]。
微生物合成是利用微生物细胞工厂的作用,在细胞内外酶系的作用下,实现前体物质的转化或通过从头合成制备目标产物的过程[8]。微生物合成从本质上看是一系列生物催化过程。生物技术是21世纪三大核心技术之一,对于国民经济的发展具有巨大的推动作用。生物转化技术是利用微生物产生的酶或酶系对生物体中的某些物质进行结构修饰,因此对于实现绿色制备以及清洁生产具有重要意义[9]。
1 实验部分
1.1 材料与仪器
材料:铁观音茶梗粉与茶末(市售)。
菌种:黑曲霉和枯草芽孢杆菌,均由天津工业大学纺织学院生化实验室提供。
试剂:乙酸乙酯,乙醇,氯化钠,磷酸等,均为分析纯,由天津市科密欧化学试剂有限公司生产;牛肉粉,蛋白胨,琼脂粉等,均由北京奥博星生物技术有限公司生产。
仪器:LDZH-50KBS高温高压灭菌锅(上海申安医疗器械厂),SW-CJ-1FD垂直流超净工作台(苏州净化设备有限公司),LRH-150生化恒温培养箱(上海一恒科技有限公司),V-1200可见分光光度计(上海美普达仪器有限公司),UV-2401PC紫外—可见分光光度计(日本岛津公司),WND-100高速中药粉碎机(浙江省伟能达电器有限公司)等。
1.2 实验方法
1.2.1 铁观音茶梗粉的黑曲霉菌悬液发酵
将培养的黑曲霉用无菌生理盐水浸泡几秒钟,再分别倒入无菌瓶中进行血球板计数,按一定比例用无菌水配成4×10cfu/ml的黑曲霉菌悬液[10]。
将配制好的黑曲霉菌悬液分别用小型喷雾器均匀地喷洒在乌龙茶的表面,样品置于30℃的生化恒温培养箱,一定时间后加入沸水煮沸10min,终止发酵。
1.2.2 铁观音茶梗末的悬浮发酵
将铁观音茶梗用烘箱烘制干燥,用中药粉碎机粉碎成茶梗末。将5g茶梗粉与0.02mol/L磷酸缓冲液以固液比50:1混合放入容器,在一定温度(30℃),pH5条件下恒温振荡水浴发酵。
1.2.3 枯草芽孢杆菌液态发酵
将活化后的枯草芽孢杆菌在超净工作台中接种到含有培养基的铁观音茶粉溶液(茶粉:蒸馏水=1:100,接种量10%),然后置于摇床中进行发酵(温度:30℃,转速:140r/min),每24h取样测试,连续测6d。
1.3 测试方法
1.3.1 黑曲霉菌悬液发酵茶色素分离与测定
(1)供试样制备:称取3.00克茶样,置于250ml三角烧瓶中加沸水125毫升,在沸水浴上提取10min,浸提中搅拌2~3次,浸提完毕,趁热抽滤于干燥三角瓶中,冷却至室温。
(2)吸取上述供试液25ml于100ml分液漏斗中,加乙酸乙酯25毫升,振摇5min,静置待分层后,将乙酸乙酯层(上层)和水层(下层)分别置于100ml具塞三角瓶,将瓶塞塞好备用[11]。
(3)吸取乙酸乙酯萃取液2ml,放在25ml容量瓶中,加入95%乙醇定容得a液(TF+TRsⅠ)。
(4)吸取乙酸乙酯萃取液15ml,加入2.5% NaHCO3溶液15ml ,在50ml分液漏斗中迅速强烈
振荡30s,静置分层后,弃去NaHCO3水层。吸取乙酸乙酯上层液4ml,放入25ml容量瓶中,用95%乙醇定容至刻度得c液[12](TF).
(5)吸取第一次水层待用液2ml,放入25ml容量瓶中,加入2ml饱和草酸溶液和6ml水,并用95%乙醇定容至刻度得d液[13](TRsⅡ+TB)。
(6)分别吸取25ml供试液和25ml正丁醇放入100ml分液漏斗中,摇振3min,待分层后将水层(下层)放于50ml三角瓶中,取水层液2ml于25ml容量瓶中,分别加2ml饱和草酸溶液和6ml蒸馏水,再用95%乙醇定容至刻度,得b溶液[14](TB)。
(7)用1cm比色皿,以95%乙醇作空白参比,在380nm波长处分别测定各溶液的吸光度A[15]。
由公式计算
茶黄素(%)=Ac×2.25/(m×w)×100%
茶红素(%)=(2Aa+2Ad-Ac-2Ab)×7.06/(m×w)×100%
茶褐素(%)=7.06×2Ab/(m×w)×100%
式中,m-试样质量(g);w-试样干物质含量(%)
Aa-溶液a的吸光度;Ab-溶液b的吸光度;
Ac-溶液c的吸光度; Ad-溶液d的吸光度。
2.25和7.06均为在同等操作条件下的换算系数。
1.3.2 枯草芽孢杆菌液态发酵色素含量
在V-1200可见分光光度计测发酵液的生物量(OD600),将发酵液用离心机经过离心后(转速10000r/min,时间10min)取其上清液用分光光度计进行测试,均以蒸馏水作为参比,记录发酵液的生物量(OD600)及Abs(672nm)。
2 结果与讨论
2.1 时间对黑曲霉菌悬液发酵效果的影响

表1 发酵时间对茶色素含量影响

图1 发酵时间对茶色素含量的影响
由图1可知:随着时间延长,茶红素含量开始下降,茶褐素含量有所上升,茶黄素变化微小。在发酵过程中,一部分茶红素经过氧化聚合后形成大分子的茶褐素。根据茶色素的生物转化机理:黑曲霉产生的氧化酶种类较多,既能产生胞内酶,亦能产生胞外酶,其中多酚氧化酶(PPO)和过氧化物酶(POD)对儿茶素的转化能力相对较强,茶黄素是儿茶素的初级氧化产物,随着进一步的催化氧化,茶黄素会氧化聚合形成茶红素和茶褐素。茶红素经进一步氧化聚合形成茶褐素。其转化机理如图2所示[16]:

图2 茶色素的生物转化机理
2.2 pH值对铁观音茶梗末悬浮发酵效果的影响

表2 pH值对发酵效果的影响
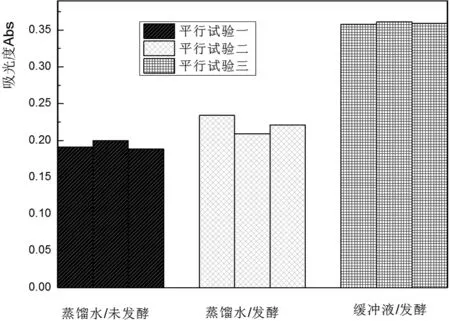
图3 pH值对铁观音茶梗悬浮发酵效果的影响
由图3可知:用pH磷酸缓冲液发酵的茶色素含量明显高于中性实验的茶色素含量。根据其转化机理分析:降低pH值,改变了儿茶素的氧化还原电位,使POD/PPO的活性比增加,从而引起酚醌的氧化降解。降低pH值亦可减缓茶黄素的非络性氧化消耗速率,因此可改变pH值对茶红素形成影响的复杂性。研究表明:pH4.0虽然已经低于茶叶鲜叶生理pH值,且在此条件下PPO活性大幅度降低,但悬浮发酵体系中茶黄素(TF)含量却大量积累[17],发酵后期TF含量降低缓慢,这可能与降低pH值对非络性氧化的影响程度大于络性氧化有关,所以发酵pH值应控制在5左右较为合适。
2.3 枯草芽孢杆菌液态发酵

(a)茶梗发酵液生物量与时间的关系
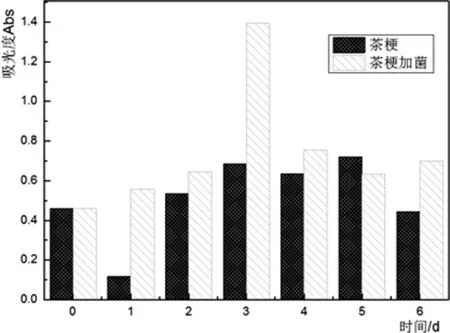
(b)茶梗发酵液色素含量与时间的关系

(c)茶末发酵液生物量与时间的关系
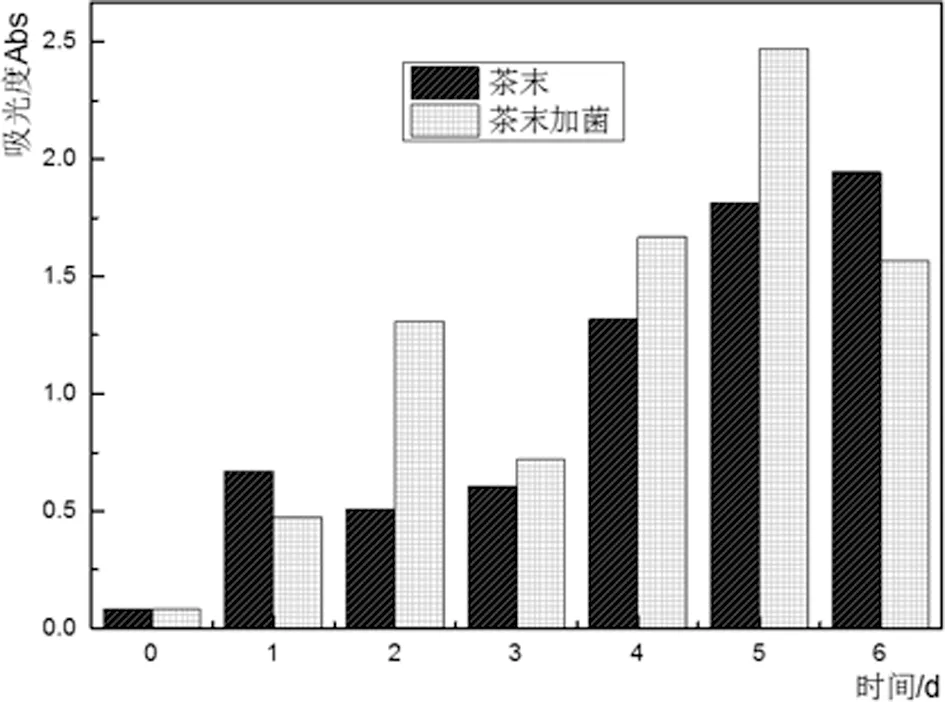
(d)茶末发酵液色素含量与时间的关系
由图4(a)和(c)可知:在铁观音茶的液态发酵过程中,枯草芽孢杆菌的生物量是持续增加的,说明实现这种转化过程的不仅仅是空气的氧化作用,真正起决定作用的是微生物枯草芽孢杆菌产生的酶(酶系)的催化作用。由图4(b)可知:铁观音茶梗经枯草芽孢杆菌液态发酵后,在第3天茶色素含量积累达到最大。继续发酵后,茶色素含量有所减少。图4(d)中铁观音茶末发酵液在第5天茶色素含量积累达到最大,之后有所减少,说明茶色素在枯草芽孢杆菌产生的酶(酶系)作用下转化成了其他物质。
2.4 茶生物质色素的转化途径分析
茶多酚是茶色素的主要前体物质,儿茶素是茶多酚的主要成分。在不同的pH值条件下儿茶素与茶色素之间的转化途径也会有所不同。与中性条件相比,儿茶素在酸性条件下容易发生氧化聚合反应,生成儿茶素的二聚体和三聚体。儿茶素在碱性条件下容易被氧化成酚醌,其易发生氧化缩合反应形成儿茶素聚合物。与酸性氧化聚合相比,儿茶素在碱性条件下更易形成其高聚物。与此同时,在碱性条件下,儿茶素之间会发生苯环环化反应生成茶黄素,茶黄素与其他物质发生偶联氧化反应生成茶红素,茶红素进一步发生氧化聚合反应会生成大分子物质茶褐素。其转化途径如图5所示:
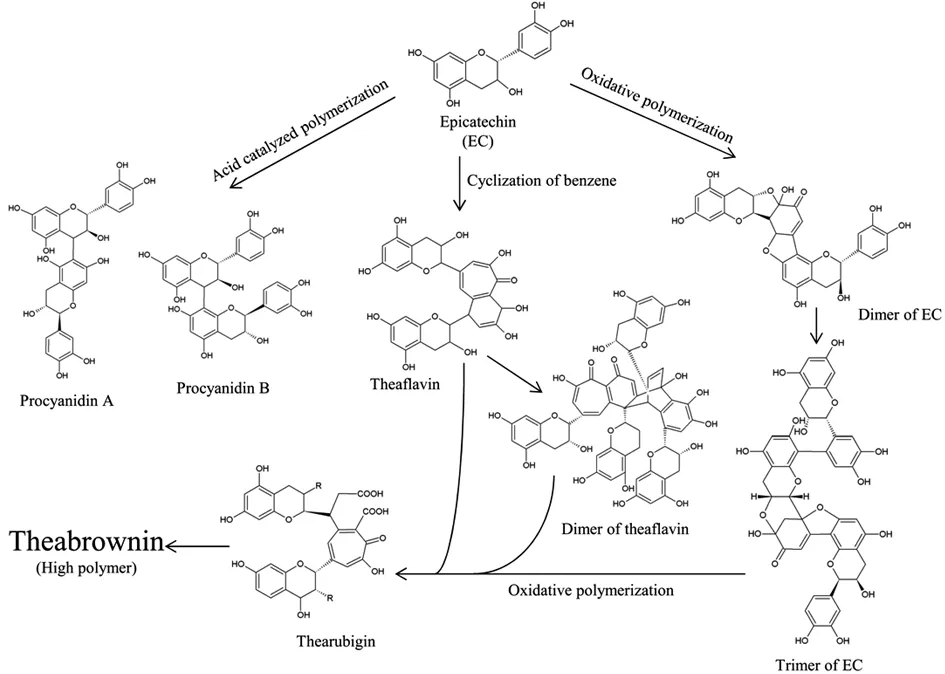
图5 茶色素的生物转化途径[18]
微生物,尤其是真菌具有极强的生物转化能力。具有多酚生物转化能力的真菌微生物有黑曲霉、酵母菌、根霉、产黄青霉、冠突散囊菌等[19];细菌微生物有枯草芽孢杆菌等。多酚的生物转化是在微生物产生的单宁酶的催化作用下完成的,单宁酶是一种具有水解催化能力的诱导酶[20],目前产单宁酶的微生物主要是曲霉属和青霉属的真菌。在微生物发酵过程中,茶多酚总量随着发酵时间的延长显著降低,这是由于微生物分泌代谢产生胞外酶,催化茶多酚氧化聚合形成茶色素。
在茶多酚与茶色素的生物转化过程中,不同种类的微生物对茶多酚的转化能力有所不同。在黑曲霉和酵母菌对普洱茶进行混菌发酵的实验中,只需发酵6d,茶多酚的含量从最初的31.16%减少到5.32%,减少的茶多酚转化成了茶色素,在这一转化过程中,黑曲霉起主要作用,酵母菌起次要作用[21]。在黑曲霉、日本根霉和产黄青霉三种真菌对乌龙茶的混菌发酵过程中[22],经过25d发酵后,多酚含量下降了45.4%,色素含量增加了34.8%,减少的多酚大部分都转化成了色素。
3 结论
(1)pH影响多酚类化合物的氧化还原电位,降低pH值,改变了多酚类物质的氧化还原电位,使儿茶素的氧化速率下降,从而增加了茶黄素的生成量;增大pH值,可加快茶黄素氧化聚合成茶红素的速度。因此,铁观音茶梗在悬浮发酵过程中,pH值在5左右较为合适。
(2)在铁观音茶的液态发酵过程中,枯草芽孢杆菌的生物量是持续增加的,说明实现这种转化过程的不仅仅是空气的氧化作用,真正起决定作用的是微生物枯草芽孢杆菌产生的酶(酶系)的催化作用。铁观音茶梗经枯草芽孢杆菌液态发酵后,在第3天茶色素含量积累达到最大,继续发酵后,茶色素含量有所减少。铁观音茶末发酵液在第5天茶色素含量积累达到最大,之后有所减少,说明茶色素在枯草芽孢杆菌产生的酶(酶系)作用下转化成了其他物质。
[1] Tuli H S, Chaudhary P, Beniwal V, et al. Microbial pigments as natural color sources: current trends and future perspectives[J]. Journal of Food Science and Technology, 2015, 52(8): 4669-4678.
[2] Ratnapandian S, Fergusson S M, Wang L. Application of acacia natural dyes on cotton by pad dyeing[J]. Fibers and Polymers. 2012, 13(2): 206-211.
[3] 巩继贤,王富邦,任燕飞,等.红色系生物质色素在纺织品染色中的应用现状与展望[J].成都纺织高等专科学校学报,2016(4):114-119,131.
[4] 吕海鹏,张悦,杨停,等. 不同产地普洱茶主要化学成分含量的差异分析[J]. 食品工业科技, 2016(08): 59-64.
[5] 凌萌乐,刘通讯. 不同氨基酸对普洱茶发酵过程中多酚类物质转化及品质的影响[J]. 食品与发酵工业, 2013(05): 120-125.
[6] Sharma K, Bari S S, Singh H P. Biotransformation of tea catechins into theaflavins with immobilized polyphenol oxidase[J]. Journal of Molecular Catalysis B: Enzymatic, 2009, 56(4): 253-258.
[7] 李静,操庆国. 茶色素制备方法的研究[J]. 江西农业学报, 2012(08): 103-104.
[8] Polak J, Jarosz-Wilkolazka A. Fungal laccases as green catalysts for dye synthesis[J]. Process Biochemistry, 2012, 47(9): 1295-1307.
[9] Polak J, Jarosz-Wilkolazka A. Whole-cell fungal transformation of precursors into dyes[J]. Microb Cell Fact,2010, 9: 51.
[10]李萍,刘通讯. 微生物发酵对乌龙茶内在品质的影响[J]. 现代食品科技, 2008(08): 773-776.
[11]龚恕. 普洱茶多酚提取分离研究[D]. 武汉:华中农业大学, 2006.
[12]李成仁. 可可茶加工工艺研究[D]. 广州:中山大学, 2009.
[13]Wang Q, Gong J, Chisti Y, et al. Production of theabrownins using a crude fungal enzyme concentrate[J]. Journal of Biotechnology,2016, 231: 250-259.
[14]卢世昌,徐梅生. 茶黄素和茶杠素分光光度测定法的改进[J]. 茶叶科学, 1964, 8(1): 38-44.
[15]付秀娟. 普洱茶发酵优势微生物、酶与主要功能物质关系的研究[D]. 天津:天津商业大学, 2012.
[16]萧伟祥,钟瑾,萧慧,等. 制茶发酵中茶色素形成生化机理[J]. 福建茶叶, 1998(3): 8-12.
[17]夏涛. 红茶色素形成机理的研究[J]. 茶叶科学, 1999(02): 139-144.
[18]Ren Y, Gong J, Wang F, et al. Effect of dye bath pH on dyeing and functional properties of wool fabric dyed with tea extract[J]. Dyes and Pigments,2016, 134: 334-341.
[19]董坤,熊辛宇,蓝增全. 普洱茶发酵过程中微生物类群分析[J]. 现代农业科技, 2009(01): 164-165.
[20]谭和平,周李华,钱杉杉,等. 茶叶发酵中的酶学研究进展[J]. 中国测试, 2009(01): 19-23.
[21]张天英,支春翔,张浩,等. 茶叶发酵过程中多酚变化规律及抗氧化性研究[J]. 湖北农业科学, 2011(15): 3144-3147.
[22]李萍,刘通讯. 微生物发酵对乌龙茶内在品质的影响[J]. 现代食品科技, 2008(08): 773-776.
2016-12-06
国家自然科学基金项目(31200719, 51403152, 51473122)
王富邦(1992-),男,硕士研究生,研究方向:生物质色素染色。
巩继贤(1975-),男,博士,副教授,硕士生导师。
TS193
A
1008-5580(2017)01-0094-05

