丹江口水库枯水期浮游细菌群落组成及影响因素研究
陈兆进,丁传雨,朱静亚,李 冰,黄 进,杜宗明,王 亚,李玉英*
(1.南阳师范学院农业工程学院,河南省南水北调中线水源区生态安全重点实验室,河南 南阳 473061;2.南水北调中线水源区水安全河南省协同创新中心,河南 南阳 473061;3.南水北调中线渠首环境监测应急中心,河南 淅川 474475)
丹江口水库枯水期浮游细菌群落组成及影响因素研究
陈兆进1,2,丁传雨1,2,朱静亚1,2,李 冰2,3,黄 进2,3,杜宗明2,3,王 亚2,3,李玉英1,2*
(1.南阳师范学院农业工程学院,河南省南水北调中线水源区生态安全重点实验室,河南 南阳 473061;2.南水北调中线水源区水安全河南省协同创新中心,河南 南阳 473061;3.南水北调中线渠首环境监测应急中心,河南 淅川 474475)
为了解丹江口库区南水北调中线工程通水后浮游细菌群落组成及影响因素,于2016枯水期(1月)对丹江库区内5个典型生态点位表层水样进行采集.水质监测结果表明库区水质总体较好,除总氮和高锰酸盐指数外,其他各项指标符合I类水标准要求.总氮(TN)和高锰酸盐指数(CODMn)为库区的主要污染因子,水体整体处于中营养状态.采用高通量测序技术对浮游细菌群落组成进行研究,结果表明主要由放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、蓝藻门(Cyanobacteria)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)、壁厚菌门(Firmicutes)、酸杆菌门(Acidobacteria)等22个门和323个属组成.5位点样品具有丰富的群落组成,浮游细菌群落多样性排序为:黑鸡嘴>台子山>库心>宋岗>渠首.对浮游细菌群落组成与环境因子的关系进行典范对应分析(CCA),结果表明: T、pH值、NH4+-N、SD显著影响浮游细菌群落结构.
丹江口库区;浮游细菌;群落结构;高通量测序;环境因子
湖泊微生物中,浮游细菌数量巨大,在有机物降解及营养物循环过程中具有重要作用,是水生态系统的重要组成部分.全面了解湖泊生态系统中浮游细菌群落多样性、分布特征及其在生态系统中的功能和作用,对于管理和维护湖泊生态环境具有深远的意义[1-2].
由于只有不到 1%的微生物可以纯培养,限制了自然界中绝大部分微生物的认识.基于免培养的变性梯度凝胶电泳、分子克隆文库等技术被应用到对海洋、湖泊水体浮游细菌的研究之中,增加了人们对这一微生物群体多样性及动态规律的认识[3].近年来,高通量测序技术的出现,大大加速了宏基因组学的发展.该技术操作简单、成本低廉,能快速高通量得到特定的DNA 片段,较之前的分子生物多样性研究能更全面地展示生物群落结构,极大地推动了生物多样性研究[4,5].采用高通量测序和变性梯度凝胶电泳相结合的方法研究厦门外海微型浮游生物群落,结果表明MiSeq测序能得到更丰富的浮游生物群落信息,表现出技术上的优势[6].
丹江口水库作为南水北调中线工程核心水源区,其水质状况直接关系到受水区居民的饮水安全.根据流域内降水特征及水文节律,每年 12月至次年4月为枯水期,此阶段径流量较小,不利库区水体污染物稀释、扩散、降解,水生态系统承受着巨大的污染压力[7].有关丹江口库区浮游细菌群落研究开展较少,本研究选取通水后第 2年枯水期(2016年1月)丹江库区5个典型站位,采用高通量测序技术对浮游细菌群落16S rDNA多样性进行分析,研究其群落组成和分布特征.结合典范对应分析(CCA)进一步探讨细菌丰度、群落结构与环境因子间的关系,以期为丹江口水库水环境保护提供参考依据.
1 材料与方法
1.1 样品采集与水质理化指标测定
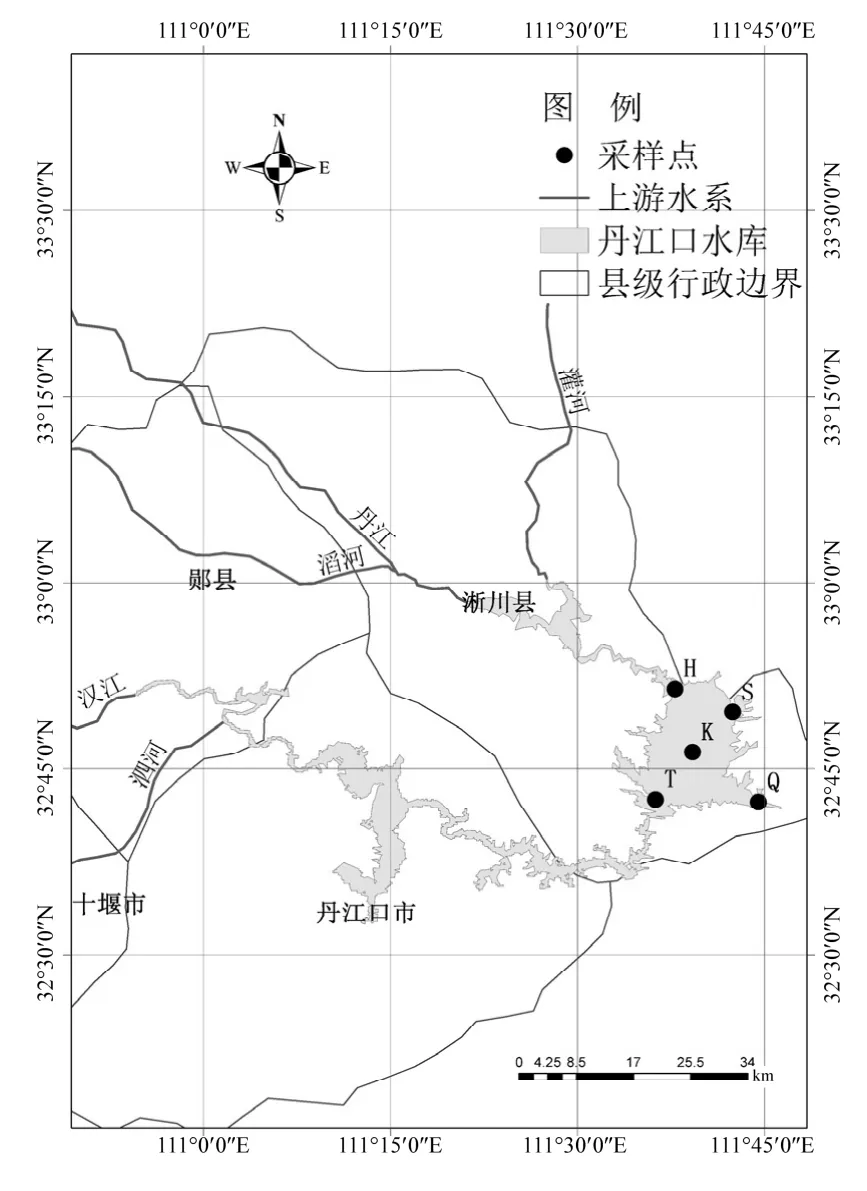
图1 采样点分布Fig.1 Location map of the sample sites of Danjiangkou reservoir
根据丹江口水库的地理位置特征和人类活动影响程度,选取属于河南省南阳市的丹江库区库心(样品编号为K,无人为干扰)、渠首(样品编号为 Q,重度人为干扰,陶岔渠首大坝取水口上游 100m)、黑鸡嘴(样品编号为 H,中度人为干扰,有居民点,上游支流汇入)、宋岗(样品编号为S,重度人为干扰,有居民点、轮渡码头)和台子山(样品编号为 T,轻度人为干扰,为丹江库区与汉江库区分界线)5个位点为采样点,具体位置如图 1所示.根据库区降水特征及水文节律,于2016年1月(枯水期)月初进行水样的采集工作.参照《水和废水监测分析方法》(第四版)[8]用柱状采水器采集表层(深度 50cm)水样 2L,所有点位均取平行样3组. 500mL水样用于提取细菌总 DNA,置于预先灭菌容器中存于冰盒,4h内运回实验室进行检测分析,剩余水样用于水质指标测定.参照《水和废水监测分析方法》(第四版)[8]测定水样pH、水温(T)、总氮(TN)、铵氮(NH4+-N)、总磷(TP)、透明度(SD)、电导率(Cond)、化学需氧量(COD)、生化需氧量(BOD)、溶解氧(DO)、高锰酸盐指数(CODMn)以及叶绿素a含量(Chl a)理化指标.
1.2 样品总 DNA提取
500mL表层新鲜水样经0.22µm无菌微孔滤膜过滤,用以收集浮游细菌,将滤膜剪碎置于50mL无菌离心管中.按照 Omega Water DNA Kit (Omega, USA)的说明,提取水体中的DNA.将提取得到的细菌总DNA通过微量紫外分光光度计(NanoDrop®ND-1000, Wilmington, DE, USA)测定DNA浓度和纯度.
1.3 高通量测序
采用通用引物(338F/806R)对浮游细菌 16S rRNA基因的V3~V4区扩增,修饰后的通用引物含有不同的 Tag标签用以区分不同样品[5].PCR扩增体系为20μL,其中含5×FastPfu Buffer 4μL、2.5mmol/L dNTPs 2μL、Forward Primer (5μmol/L 0.8μL、Reverse Primer(5μmol/L) 0.8μL、FastPfu Polymerase 0.4μL、DNA模板 10ng.补ddH2O至20μL.PCR扩增的反应条件为: 94℃,5min;30× (94℃,30s;54℃,30s;72℃.45s);72℃.10min.每个样品3个重复,将不同样品的PCR扩增产物均一化至10nmol/L后等体积混合,利用上海美吉生物医药科技有限公司的MiSeq PE300测序仪(Illumina Inc..San Diego.CA.USA)完成序列测定.
1.4 数据分析
1.4.1 高通量数据分析 高通量数据的生物信息学分析采用Qiime进行,根据序列的相似度,将序列归为多个OTU,OTU产出后,统计各个样品含有OTU情况及每个OTU中含有序列的数目,得到每个 OTU的分类学信息[9].选取相似度在97%条件下的OTU生成预期的稀释曲线,并利用软件mothur计算丰富度指数Chao1和ACE,覆盖度指数(good's coverage)以及多样性指数Simpson和Shannon指数进行Alpha 多样性分析[10].利用 PCoA、Correlation聚类法分别进行数据处理、细菌群落分布、主成分分析和聚类分析.采用 Linear Discriminant Analysis(LDA) coupled with effect size measurements(LEfSe)在线工具寻找组与组之间有统计学差异的生物标志物[11].
1.4.2 典范对应分析 典范对应分析(CCA)能将可能相关的多个环境因子一起进行分析,可以很好地反映种群或群落与环境的关系.本文采用CANOCO软件(版本 4.5) 进行浮游细菌和环境因子的CCA分析,排序结果用物种-环境因子关系的双序图表示[12].在主轴1和主轴2构成的平面中,箭头表示环境因子,向量长短代表着相应环境因子在主轴中的作用,箭头所处象限表示环境因子与排序轴间相关性的正负[13].
1.4.3 方差分析 浮游细菌群落多样性与环境因子之间的相关性采用 SPSS19.0软件进行分析.不同采样点位间的环境因子比较采用单因素方差分析,显著性水平设定为P<0.05,相关图表制作在 Excel中完成.
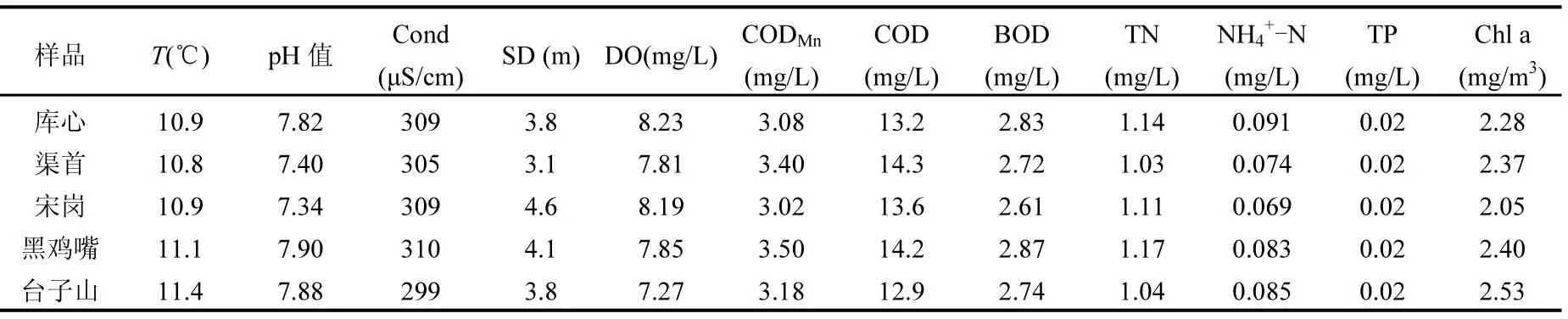
表1 各采样点水体主要理化参数Table 1 The main physical and chemical properties of water samples
2 结果与分析
2.1 水质营养状态评价
2016年1月对丹江口水库库心、渠首等5位点水质的理化监测结果表明各水体的水质总体较好,除总氮(均超过 1.00mg/L,为 IV类地表水标准)和高锰酸盐指数外(均超过3.00mg/L,为II类地表水标准),其他各项指标符合《地表水环境质量标准》(GB38382-2002)I类水标准要求(表 1)[14].其中黑鸡嘴总氮含量最高,其次为库心和宋岗.从图1可知黑鸡嘴、库心和宋岗集中分布于丹江库区靠近丹江入水口,研究表明丹江流域存在农业面源污染,其中总氮明显超标,是超标的原因[7,15-16].按照《地表水资源质量评价技术规程》(SL395-2007)[17]进行水库营养状态的评价,以总氮、总磷、高锰酸盐指数、叶绿素a和透明度5个参数作为水质营养状态参数,丹江库区库心、渠首等5位点总氮赋分值均为60,总磷、高锰酸盐指数、叶绿素a和透明度的赋分值介于30~40之间.库心、渠首等5位点营养状态指数EI均为38.综合评价,丹江库区水体处于中营养状态.
2.2 浮游细菌稀释性曲线
丹江库区浮游细菌稀释性曲线随测序条数的增加物种丰富度呈现前期增加后期趋向平缓(图2).由图2可知,库心、渠首等5位点每个样本的测序曲线在测序条数达到 20000条以上时物种数都基本趋向平稳,说明此时测序数据量合理,足够代表物种的丰富度.
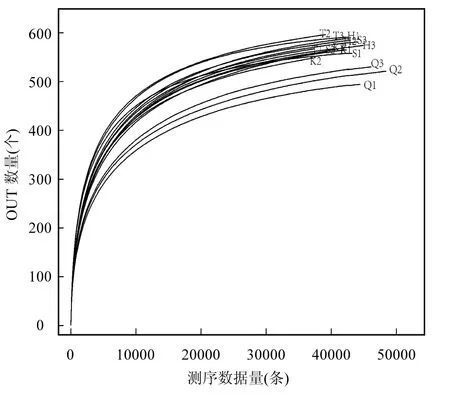
图2 浮游细菌稀释性曲线Fig.2 Rarefaction curve of bacterioplankton community
2.3 浮游细菌群落多样性的评估
高通量测序表明丹江口水库库心、渠首等5位点样品具有丰富的群落组成,其群落多样性均较高(表2).5组样品文库覆盖率均在99.80%以上,完全能够反映该区域浮游细菌群落的种类和结构.渠首样品OTU数、丰富度指数Chao1和ACE、Shannon指数低于其他组样品,其中 OTU数、Chao1和ACE差异达到显著水平(P<0.05),表明其浮游细菌群落多样性低于其他样品(表2).综合OTU数、丰富度指数Chao1和ACE以及多样性指数Simpson和Shannon指数,5组样品浮游细菌群落多样性排序为:黑鸡嘴>台子山>库心>宋岗>渠首.
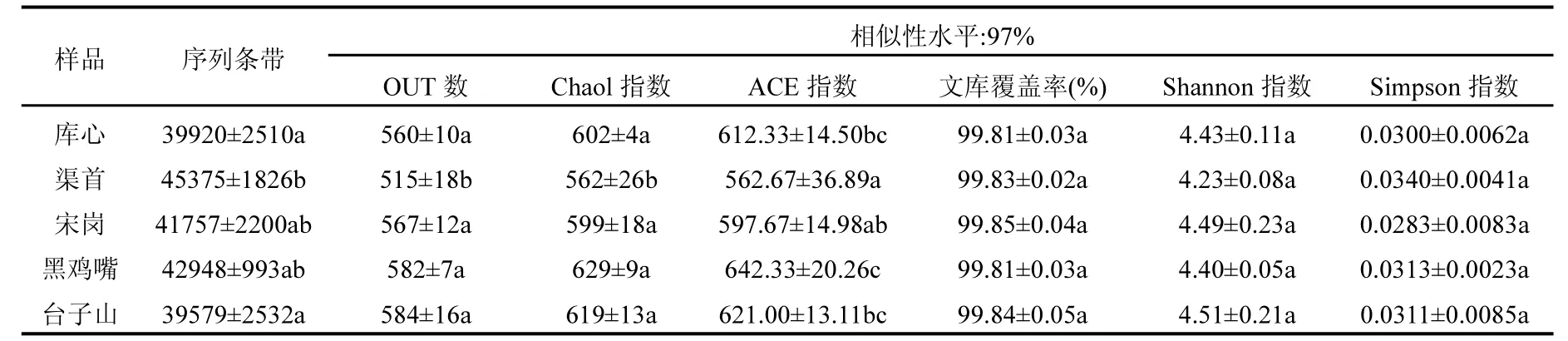
表2 浮游细菌群落多样性评估表Table 2 Estimation of bacterioplankton community diversity
2.4 浮游生细菌多样性的主成分分析
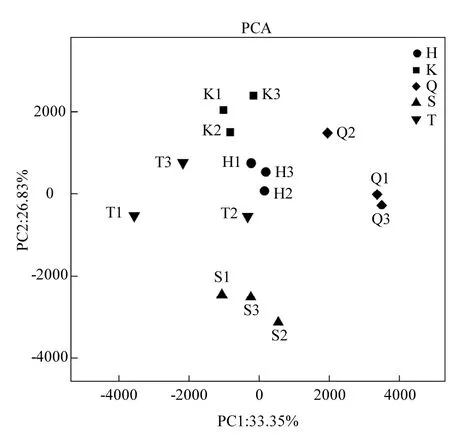
图3 浮游细菌多样性的主成分分析Fig.3 PCA analysis of bacterioplankton community diversity

图4 不同样品相似性聚类树(A)和门水平上物种相对丰度分布(B)Fig.4 Similarity tree (A) and relative read abundance (B) of different bacterioplankton community structures at phylum levels in different treatments
利用Qiime 软件对库心、渠首等5位点样品相关群落进行了主成分分析.如图3所示,横坐标 PC1贡献度为33.35%,纵坐标 PC2贡献度为26.83%,5位点中无人为干扰的库心样品聚集在PCA 分析图上侧.人为干扰较轻的台子山样品、黑鸡嘴样品与库心样品在PCA 分析图中距离较近.人为干扰较重的宋岗样品聚集于图3下侧,渠首样品聚集于图3右侧,渠首和宋岗样品与其他3组样品浮游细菌群落差异较大.综合以上分析表明不同样品来源浮游细菌群落结构有所差异,其中人为干扰对浮游细菌群落影响较大.后续使用基于Unweighted UniFrac的UPGMA方法对库心、渠首等5位点样品浮游细菌群落构成的相似性进行聚类分析,通过样品加权的聚类分析,同样可以有效的将不同人为干扰程度样品实现组间聚类(图4A).
2.5 浮游细菌群落结构分析
高通量测序结果表明,15组实验样品平均序列条数为41916,OTUs平均数561(表2),经过分析主要为细菌的 22个门,包括放线菌门(Actinobacteria)、变形菌门 (Proteobacteria)、蓝藻门 (Cyanobacteria)、拟杆菌门 (Bacteroidetes)、疣 微 菌 门 (Verrucomicrobia)、 壁 厚 菌 门(Firmicutes)、酸杆菌门 (Acidobacteria)等(图4B).其中黑鸡嘴、台子山样品包含19门,宋岗样品包括18门,库心样品包括17门,渠首样品包括16门.浮游细菌主要分布于323个属,其中宋岗样品包括245属,黑鸡嘴样品包括239属,台子山样品包含237属,库心样品包括218属,渠首样品包括194属.属于放线菌门、变形菌门、蓝藻门、拟杆菌门的序列总和占全部序列的 71.56%~ 83.53%,这些细菌为优势种群.其中,放线菌门为库心、黑鸡嘴样品最优势种群和台子山样品第二优势菌群,分别占总群落的27.86%、28.31%和23.68%;变形菌门为宋岗、台子山样品最优势种群和库心、黑鸡嘴样品第二优势菌群,分别占总群落的29.72%、24.62%、20.49%和20.44%;蓝藻门为渠首最优势种群和宋岗第二优势菌群,分别占总群落的 27.48%和 20.58%;拟杆菌门为渠首第二优势菌群,占总群落的22.37%.
2.6 不同样品差异细菌分析
为了进一步确定各组细菌种属的丰富度差异,我们采用在线统计工具LEfSe来寻找宏基因组生物标志物.该方法是建立在统计学差异、生物学一致性和相同检验效能估计基础之上的,通过分析高通量测序数据在每个样品中的分类信息,在生物学上提供不同级别的可能的生物标志物[11].LEfSe法计算出不同样品中的差异菌属,所有菌在门、纲、目、科、属水平的差异信息用饼形图表示,饼形图红色、绿色、蓝色、紫红色、青色分别代表在黑鸡嘴、库心、渠首、宋岗和台子山组中达到 LEfSe程序生物标志物筛选标准(图5).
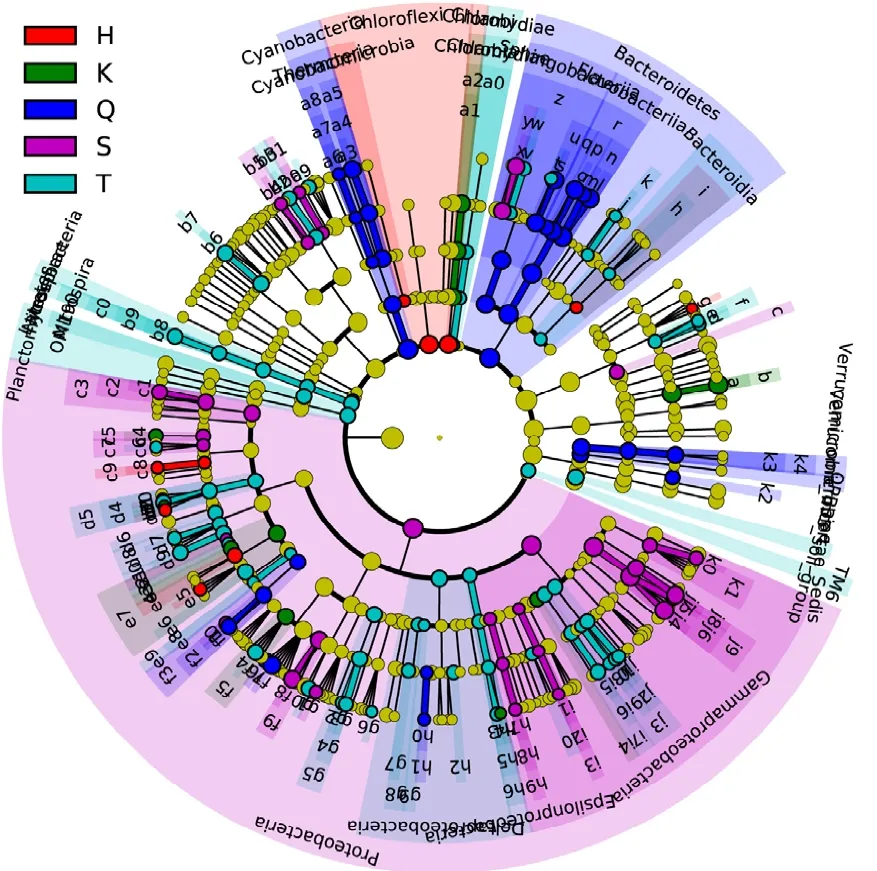
图5 不同样品差异细菌分布Fig.5 Taxon with statistical differences between different bacterioplankton communities
最内圈表示门水平的差异,依次往外的圈表示纲、目、科、属,不同颜色扇形面积表示在此范围内的菌均有差异(图 5).在门的水平上,宋岗样品中1个主要门(变形菌门)的细菌存在显著差异,渠首样品中2个门(蓝藻门、拟杆菌门)的细菌存在显著差异,台子山和黑鸡嘴样品中各有2个门的细菌存在显著差异,库心样品在门水平上无显著差异.在属的水平上,宋岗样品中变形菌门的Brevundimonas、Sphingomonas、 Massilia、Deefgea、 Pseudomonas,壁 厚 菌 门 的Exiguobacterium、Planococcus、拟杆菌门的Pedobacter等共13属的细菌存在显著差异,渠首样品中拟杆菌门的 Fluviicola、Owenweeksia、Flavobacterium,变形菌门的 Sphingopyxis、Albidiferax、Limnohabitans、Anaeromyxobacter、 Anaeromyxobacter,蓝藻门的Synechococcus等共10个属的细菌存在显著差异,台子山样品中放线菌门的 Candidatus Aquiluna,拟杆菌门的Pseudarcicella、 Terrimonas,壁 厚 菌 门 的Oceanobacillus、Paenibacillus,变形菌门的Hyphomicrobium、Paracocccus、Defluviicoccus Reyranella、Limnobacter、Methylotenera等共20个属细菌存在显著差异,库心样品中放线菌门的CL500-29marine group 和 变 形 菌 门 的Bradyrhizobium、Roseovarius共3个属细菌存在显著差异,黑鸡嘴样品中放线菌门的Arthrobacter和变形菌门的 Methylobacterium、Gemmobacter、Candidatus Defluviella共4个属细菌存在显著差异.
2.7 浮游细菌群落组成与环境因子的相关分析
采用CCA分析水体环境因子与LEfSe分析筛选出的主要细菌之间的关系.由图6可知,所分析的环境因子中T、TN、SD、Cond与第一排序轴 (AX1)正相关,其中SD相关系数最大,为0.881,呈极显著正相关(P<0.01). pH、CODMn、BOD等与AX1负相关,均未达显著水平. T、pH、NH4+-N与第二排序轴(AX2)正相关,相关系数都较大,分别为0.780、0.945、0.850,呈显著正相关(P<0.05), Cond、DO、COD和CODMn与第二排序轴 (AX2)负相关.从第一、第二排序轴的相关性分析可以看出, T、pH、NH4+-N、SD对浮游细菌群落有较大影响, TN、DO、Cond等对其也有一定影响.相关性分析结果表明 Candidatus Aquiluna、Crenothrix、Methylobacter、Sulfuricurvum等 8个属的细菌与 T呈显著正相关, Anaeromyxobacter、Fluviicola与T呈显著负相关. Defluviicoccus、Legionella、Nitrosomonas等 8个属的细菌与 COD 呈显著负相关, Synechococcus与 COD 呈 显 著 正 相 关. Methyloversatilis 与 pH 呈 显 著 正 相 关 , Methylomonas、Sulfuricurvum、Paracocccus与Cond呈显著负相关, Sphingomonas与SD呈显著正相关, Methylotenera、Pseudarcicella与DO呈显著负相关, Defluviicoccus与CODMn呈显著负相关, Aeromonas、Rheinheimera与NH4+-N呈显著负相关,CL500-29marine group与NH4+-N呈显著正相关, Candidatus Defluviella与TN呈显著正相关. NH4+-N、TN、T、pH与浮游细菌多样性指数中OTU数、丰富度指数Ace、Chao1、Shannon指数均呈正相关.
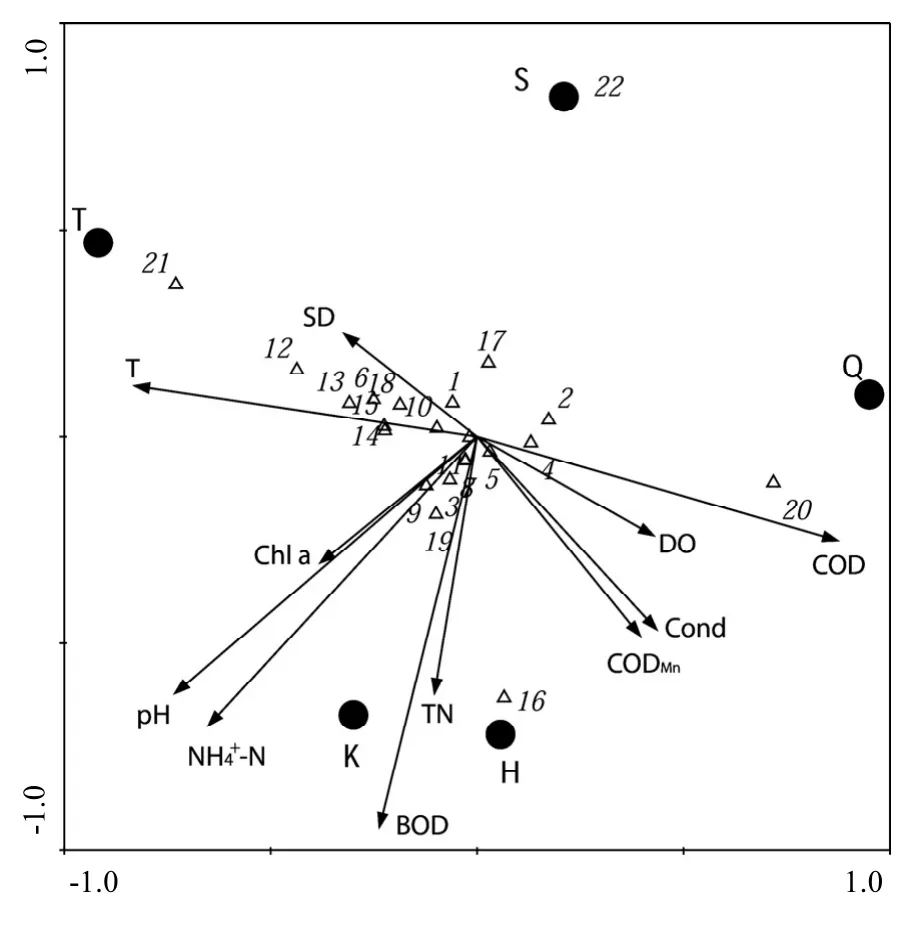
图6 浮游细菌物种与环境因子的CCA排序Fig.6 CCA ordination biplot between bacterioplankton species and environmental factors
3 讨论
3.1 南水北调通水后丹江口库区枯水期水质测定
为了解蓄水后丹江口库区水质状况及影响库区水质的主要污染因子,本研究测定了通水后第二年枯水期(2016年1月)丹江库区5个典型站位水质,结果表明总氮和高锰酸盐指数为库区主要污染因子,对水库营养状态进行评价,EI指数均为 38,处于中营养状态,与朱媛媛等
[7]结果基本一致.5位点中总氮含量较高的黑鸡嘴、库心和宋岗集中分布于丹江库区靠近丹江入水口,徐国策等[15]研究表明丹江流域存在农业面源污染,其中总氮明显超标,其可能是水体中总氮超标的主要原因.蓄水新增淹没的农田面积近 26万亩,研究表明农业面源污染已经成为丹江口水库的主要污染源,水库新增淹没区农田养分物质释放的潜在风险不容忽视[18].蓄水同时导致库容大幅增加,流速降低,各项水文要素均发生了很大变化,而这些水文要素的变化相应地会带来水环境要素的改变,从而影响库区水质[19].
3.2 高通量测序揭示丹江口库区浮游细菌群落组成
丹江口水库作为南水北调中线工程的水源区,关于浮游细菌群落组成及其影响因素研究开展很少,相关工作亟待开展.本课题组曾于 2005年对水源区浮游微生物群落进行测定,选用选择性培养基对细菌、真菌、放线菌、霉菌、异养菌、大肠杆菌、粪大肠杆菌的丰度和分布进行了调查研究,并分析了理化性质与水域微生物丰度和水温、Chla、COD、BOD、DO等诸多生态因子的关系[20].在此之后,关于丹江口库区浮游细菌群落研究鲜见报道.为了解蓄水后丹江口库区浮游细菌群落组成,本实验采用Illumina公司MiSeq测序平台对丹江库区库心、渠首等5位点浮游细菌群落组成进行了研究,发现其主要由放线菌门、变形菌门、蓝藻门、拟杆菌门、疣微菌门、壁厚菌门、酸杆菌门等22个门, CL500-29marine group、Limnohabitan、Bacillus、Synechococcus等323个属组成,表现出群落组成的丰富性.丹江口库区浮游细菌群落组成与之前研究的鄱阳湖、太湖、滇池等淡水湖泊[2,21-24]以及长江、南明河等河流[25-26]及其河口[3]等水体典型的细菌组成类群相似,这些典型的淡水细菌大都隶属于变形菌门、蓝细菌门、拟杆菌门、放线菌门和疣微菌门等[2,26].本次实验结果与 2005年研究[20]相比,更全面、更准确了解丹江口库区浮游细菌群落组成,揭示了丹江口库区的细菌种群类别,为丹江口库区水质保护提供重要的依据.
3.3 浮游细菌群落与环境因子的关系
研究表明,水体中的环境因子,包括湖泊的形态特征(例如:湖泊的大小和深度)、物理化学特征(例如:温度、pH、盐度、无机营养盐等)、有机质的浓度和类型以及食物网的组成和物种间的相互作用等均能影响浮游细菌的群落组成
[2].本实验采用Illumina公司MiSeq测序平台对丹江库区库心、渠首等5位点浮游细菌群落组成进行了研究,采用在线统计工具LEfSe分析各组细菌种属的丰富度差异,同时对差异浮游细菌群落与理化指标进行CCA分析.结果表明, T、pH、NH4+-N、SD对浮游细菌群落有较大影响, Candidatus Aquiluna、Crenothrix等8个属的细菌与T呈显著正相关, Anaeromyxobacter、Fluviicola与 T呈显著负相关.拟杆菌门的CL500-29marine group属是浮游细菌最为优势种群,占 5组样品浮游细菌的 10.18%~16.74%,相关性分析表明与 NH4+-N呈显著正相关.另外,Aeromonas、Rheinheimera与NH4+-N呈显著负相关, Candidatus Defluviella与TN呈显著正相关.在各种水生态环境中,溶解无机氮是异养细菌重要的 N源,同时过量的氮可能导致水体富营养化,造成水质恶化.Haukka等[27]报道在淡水生态系统中添加总氮和磷酸盐后,浮游细菌的群落结构发生变化,这种变化可能与生态系统中添加营养物质后引起的水体富营养化有关.丹江流域存在农业面源污染,其中总氮明显超标[15,18],可能会影响丹江口水库浮游细菌群落组成.
4 结论
4.1 2016年1月丹江口水库库心、渠首等5位点监测结果表明水体的水质总体较好,除总氮和高锰酸盐指数外,其他各项指标符合 I类水标准要求.以总氮、总磷、高锰酸盐指数、叶绿素 a和透明度5个参数作为水质营养状态参数,丹江口水库水体处于中营养状态.
4.2 高通量测序表明丹江口水库具有丰富的浮游细菌群落组成,主要由放线菌门、变形菌门、蓝藻门、拟杆菌门、疣微菌门、壁厚菌门、酸杆菌门等22个门和323个属的细菌组成.浮游细菌群落多样性排序为:黑鸡嘴>台子山>库心>宋岗>渠首.
4.3 浮游细菌与环境因子 CCA分析表明,T、pH、NH4+-N、SD等对丹江口浮游细菌群落有较大影响,不同环境因子对于不同菌群具有不同影响.
[1] Brendan Logue J, Lindström ES. Biogeography of Bacterioplankton in Inland Waters [J]. Freshwater Reviews, 2008,1(1):99-114.
[2] 任丽娟,何 聃,邢 鹏,等.湖泊水体细菌多样性及其生态功能研究进展 [J]. 生物多样性, 2013,21(4):421-432.
[3] 阚金军,孙 军.河口细菌群落多样性及其控制因素:以切萨皮克湾为例 [J]. 生物多样性, 2011,19(6):770-778.
[4] van Dijk E L, Auger H, Jaszczyszyn Y, et al. Ten years of next-generation sequencing technology [J]. Trends in Genetics, 2014,30(9):418-426.
[5] 张军毅,朱冰川,超 徐,等.基于分子标记的宏基因组16S rRNA基因高变区选择策略 [J]. 应用生态学报, 2015,26(11):3545-3553.
[6] Yu L Y, Zhang W J, Liu L M, et al. Determining microeukaryotic plankton community around xiamen island, southeast china, using Illumina MiSeq and PCR-DGGE techniques [J]. PLoS ONE, 2015,10(5):e0127721.
[7] 朱媛媛,田进军,李红亮,等.丹江口水库水质评价及水污染特征[J]. 农业环境科学学报, 2016,35(1):139-147.
[8] 国家环境保护总局.水和废水监测分析方法(第四版) [M]. 北京:中国环境科学出版社, 2002:239-284.
[9] Caporaso J G, Kuczynski J, Stombaugh J, et al. QIIME allows analysis of high-throughput community sequencing data [J]. Nature Methods, 2010,7(5):335-336.
[10] Schloss P D, Westcott S L, Ryabin T, et al. Introducing mothur: Open-Source, Platform-Independent, Community-Supported software for Describing and comparing microbial communities [J]. Applied and Environmental Microbiology, 2009,75(23):7537-7541.
[11] Segata N, Izard J, Waldron L, et al. Metagenomic biomarker discovery and explanation [J]. Genome Biology, 2011,12(6):1-18.
[12] Ter Braak CJ, Smilauer P. CANOCO reference manual and CanoDraw for Windows user's guide: software for canonical community ordination (version 4.5) [M]. Microcomputer Power, Ithaca, NY, 2002.
[13] 任学敏,杨改河,朱 雅,等.环境因子对太白山高山植被物种组成和丰富度的影响 [J]. 生态学报, 2014,34(23):6993-7003.
[14] GB/3838-2002 地表水环境质量标准 [S].
[15] 徐国策,李占斌,李 鹏,等.丹江中游典型小流域土壤总氮的空间分布 [J]. 地理学报, 2012,67(11):1547-1555.
[16] 肖春艳,俐 武,赵同谦,等.南水北调中线源头区蓄水前土壤氮磷分布特征 [J]. 中国环境科学, 2013,33(10):1814-1820.
[17] SL/395-2007 地表水资源质量评价技术规程 [S].
[18] 王 剑,尹 炜,赵晓琳,等.丹江口水库新增淹没区农田土壤潜在风险评估 [J]. 中国环境科学, 2015,35(1):157-164.
[19] 冯 静,何太蓉,韦 杰.三峡工程蓄水前后库区水质变化及对策分析 [J]. 重庆师范大学学报(自然科学版), 2011,28(2):23-27.
[20] 李玉英,张乃群,胡兰群,等.南水北调中线工程水源区微生物菌群研究 [J]. 水利渔业, 2006,26(4):57-59.
[21] Niu Y, Shen H, Chen J, et al. Phytoplankton community succession shaping bacterioplankton community composition in Lake Taihu, China [J]. Water Research, 2011,45(14):4169-4182.
[22] 吕明姬,汪 杰,范 铮,等.滇池浮游细菌群落组成的空间分布特征及其与环境因子的关系 [J]. 环境科学学报, 2011,31(2): 299-306.
[23] Dai Y, Yang Y, Wu Z, et al. Spatiotemporal variation of planktonic and sediment bacterial assemblages in two plateau freshwater lakes at different trophic status [J]. Applied Microbiology and Biotechnology, 2016,100(9):4161-4175.
[24] 寇文伯,黄正云,张 杰,等.鄱阳湖湖泊细菌群落组成及结构-以松门山为例 [J]. 生态学报, 2015,35(23):7608-7614.
[25] 毛 莉,张 明,白 芳,等.三峡库区支流蓝藻水华对浮游细菌群落组成的影响 [J]. 水生生物学报, 2016,40(3):609-614.
[26] 唐 婧,徐小蓉,商传禹,等.南明河城区河段细菌多样性与环境因子的关系 [J]. 微生物学报, 2015,55(8):1050-1059.
[27] Haukka K, Kolmonen E, Hyder R, et al. Effect of nutrient loading on bacterioplankton community composition in lake Mesocosms [J]. Microbial Ecology, 2006,51(2):137-146.
Community structure and influencing factors of bacterioplankton during low water periods in Danjiangkou Reservoir.
CHEN Zhao-jin1,2, DING Chuan-yu1,2, ZHU Jing-ya1,2, LI Bing2,3, HUANG Jin2,3, DU Zong-ming2,3, WANG Ya2,3, LI Yu-ying1,2*
(1.Key Laboratory of Ecological Security for Water Source Region of Mid-line Project of South-to-North Diversion Project of Henan Province, College of Agricultural Engineering, Nanyang Normal University, Nanyang 473061, China;2.Henan Collaborative Innovation Center of Water Security for Water Source Region of Mid-line Project of South to North Diversion Project, Nanyang 473061, China;3.Emergency Centre for Environmental Monitoring of Mid- line Project of South to North Water Division, Xichuan 474475, China). China Environmental Science, 2017,37(1):336~344
The Danjiangkou reservoir is the main source of water for the “middle-route” of the South to North Water Diversion Project in China. Its water quality directly affects the safety of drinking water for residents along this route. In this study, 15surface-water samples were collected from the reservoir at low-water period (January) in 2016, and 12 essential environmental factors were investigated. The results showed that the water quality in the reservoir was strongly influenced by total nitrogen (TN) and the permanganate index, with the water quality being ranked at IV or II for all locations. The water in this reservoir was in the mesotrophic state. The high-throughput sequencing approach was adopted to analyze the distribution characteristics of the community structure and diversity of bacterioplankton and their relationship to environmental factors. Phylogenetic analysis based on 16S rDNA sequences showed that bacterioplankton could be divided into 22 major phylogenetic groups. The dominant phylogenetic groups included Actinobacteria, Proteobacteria, Cyanobacteria, Bacteroidetes, Verrucomicrobia, Firmicutes, and Acidobacteria. At the genus level, the dominant phylogenetic groups included CL500-29 marine group, hgcI clade, Fluviicola, Sediminibacterium, Flavobacterium, LD28 freshwater group, Limnohabitans, Synechococcus, Bacillus, and Cyanobacteria norank. Diversity of the bacterioplankton community in the Danjiangkou reservoir can be ranked in the following order: Heijizui >Taizishan>Kuxin>Songgang>Qushou. The results of canonical correspondence analysis (CCA) for the relationship between the22 phyla of bacterioplankton and 12environmental factors showed that the T, pH, NH4+-N, and SD were the main environmental factors affecting the distribution characteristics of the bacterioplankton community.
Danjiangkou Reservoir;bacterioplankton;community structure;high-throughput sequencing;environmental factor
X524
A
1000-6923(2017)01-0336-09
陈兆进(1985-),男,安徽合肥人,讲师,博士,主要从事土水污染控制、修复与资源化利用研究.发表论文10余篇.
2016-03-22
国家自然科学基金项目(41601332);河南省教育厅高等学校重点科研项目(16A210012,14A180015);南阳师范学院高层次人才科研启动费资助项目(ZX2014069)
* 责任作者, 教授, lyying200508@163.com

