沉淀氧化法制备Fe3O4及对Cu2+的吸附性能
王新生,曲 黎,王雪静,黄世江,李珅珅
(1.河南科技学院新科学院,河南 新乡 453003;2.河南科技学院化学化工学院,河南 新乡 453003)
沉淀氧化法制备Fe3O4及对Cu2+的吸附性能
王新生1,曲 黎1,王雪静2,黄世江1,李珅珅1
(1.河南科技学院新科学院,河南 新乡 453003;2.河南科技学院化学化工学院,河南 新乡 453003)
本文利用沉淀氧化法合成Fe3O4粉末,研究反应温度、反应时间、碱用量对产物产量的影响,得出了最佳反应条件: 反应温度80℃,反应时间40min,氢氧化钠的加入量150mL。此条件下得到的Fe3O4颗粒大小为2~3μm,表面光滑,粒径均匀,对Cu2+的吸附量随初始浓度的增加而增加。当Cu2+的初始浓度为300g·L-1时,Fe3O4对Cu2+的吸附量高达18.1mg·g-1。
沉淀氧化法;四氧化三铁;Cu2+;吸附
目前印刷、电解等行业的工业废水中含有大量Cd2+、Pb2+、Hg2+、Cu2+等重金属离子,严重污染环境和水体。近年来,由于对环境治理的要求越来越严格,具有吸附速率快、吸附量大、选择性高及易分离等特性的磁性微纳米在去除环境中污染物,特别是吸附水体中的重金属和毒害有机物的领域受到研究者的广泛关注。其中Fe3O4微纳米材料由于其超顺磁性、高矫顽力、高表面活性等特性,成为磁性微纳米材料的研究热点,在废水处理领域得到了广泛的应用[1-3]。
Fe3O4制备方法主要有微乳液法、溶胶-凝胶法、共沉淀法、溶剂热法等。微乳液法[4]制备条件繁杂,且得到的四氧化三铁晶形不一;溶胶-凝胶法[5]的反应条件较为复杂,批量复制性差;共沉淀法[6]制备的四氧化三铁物相复杂,纯度不高;溶剂热法[7]需要加入有机溶剂,并且要在高压下操作。
本文利用沉淀氧化法合成Fe3O4微晶,研究反应温度、pH、反应时间、碱用量等因素对产物的影响,找出最佳反应条件,并对最佳反应条件下得到的样品进行结构分析,研究其对模拟废水中Cu2+的吸附性能,旨在提供一种简单廉价的Fe3O4制备方法,用于处理工业废水,保护环境。
1 实验部分
1.1 分析仪器
SIMENS D5005 X射 线 衍 射 仪,Nicolet/ instruments NEXWS 470傅立叶红外光谱仪。JEOL JEM-6390LV扫 描 电 镜 (SEM),Perkin-Elmer Lambda-17紫外-可见分光光度计。
1.2 分析测试方法
在D5005 X射线衍射仪上分析样品的物相。测试条件:CuKa辐射,管电流15mA,管电压35mV,扫描速度0.2°·min-1。
采用JEOL JEM-6390LV扫描电镜(SEM)观察试样的形貌和大小。
采用Nicolet/instruments NEXWS 470傅立叶红外光谱仪对样品红外吸收特征进行表征,KBr压片。
1.3 Fe3O4的制备
分别配制浓度均为1mol·L-1的硫酸亚铁及氢氧化钠溶液待用。量取100mL配置好的硫酸亚铁溶液置于500mL烧杯中,按硝酸铵与硫酸亚铁的质量比为1∶10向烧杯中加入硝酸铵粉末,搅拌使其溶解。将溶液加热到50℃,向溶液中通入O2,按一定比例量取氢氧化钠溶液,在15min内逐滴滴加到混合溶液中恒温反应。控制反应pH在2.2~5.5之间,恒温持续通入O2。反应完全后,趁热用含有少量维生素C的蒸馏水进行抽滤,洗涤5~6次,用氯化钡溶液滴加抽滤滤液至无沉淀产生即可。将洗涤后的滤饼放入50℃烘箱中干燥1h,待冷却后研磨为粉末,并装入坩埚中,拧紧管盖放入烧结炉中加温至670℃,灼烧1h之后隔绝空气冷却至室温,得到Fe3O4。
1.3.1 试样A1~A5的制备
按Fe3O4的实验步骤,氢氧化钠加入量为150mL,反应时间为30min,反应温度分别为50℃、60℃、70℃、80℃、90℃,得到的5个样品标为A1~A5。1.3.2 试样B1~B5的制备
按Fe3O4的实验步骤,氢氧化钠加入量为150mL,反应温度设定为80℃,反应时间分别为10min、20min、30min、40min、50min,得到的5个样品标为B1~B5。
1.3.3 试样C1~C5的制备
按Fe3O4的实验步骤,反应温度设为80℃,反应时间设为40min,氢氧化钠的加入量分别为100mL、125mL、150mL、175mL、200mL,得到的5个样品标为C1~C5。
1.4 合成Fe3O4的反应原理
合成Fe3O4的反应原理为:

其中硝酸铵作为缓冲剂,可避免反应过程中的局部碱化,这是有效控制溶液pH值的措施。硝酸铵中的NO32-可以直接参与氧化反应,有效促进Fe3O4的生成。
pH值为2.0~5.5时,Fe2+会生成Fe(OH)2沉淀,但反应过程中很难将pH值控制在2.0~5.5。为了将pH值保持在这一范围,使反应能够在弱酸性条件下进行,将氢氧化钠逐滴滴加到硫酸亚铁混合溶液中,并在反应中一直搅拌溶液,避免滴加氢氧化钠造成局部碱化。
1.5 吸附性能的研究
将0.1g的Fe3O4置 于 含Cu2+为0、100、150、200、300、400、500mg·L-1的60mL溶液中,在恒温条件下振荡24h后,2500 r·min-1离心2h,在烧杯中进行吸附平衡实验,测定Fe3O4的吸附性能。吸附平衡后,将磁性Fe3O4从溶液中分离出来,取适量溶液在离心机上离心分离,取上层清液用紫外分光光度计测量吸附平衡后溶液中Cu2+的吸光度,根据式(3)计算吸附容量。

式中:M为单位吸附量,mg·g-1;C0为金属离子(Cu2+)的初始浓度,mg·L-1;Ce为平衡溶液中的金属离子(Cu2+)浓度,mg·L-1;V为Cu2+溶液体积,L;m为Fe3O4质量,g。
2 结果与讨论
2.1 反应温度对产物产量的影响
表1是5个反应温度下得到的样品的质量变化。从表1可以看出,反应温度在80℃时,得到的产物产量最高。

表1 产物产量随反应温度的变化
2.2 反应时间对产物产量的影响
表2是5个反应时间下得到的样品的质量变化。从表2可以看出,反应时间为40min时,得到的产物产量最高。理论上,四氧化三铁分子中同时存在Fe2+和Fe3+,利用沉淀氧化法制备四氧化三铁,只需将起始悬浮液中的部分Fe2+氧化为Fe3+。时间过长,反而会有三氧化二铁产生,但氧化时间不够长,得不到单一相的四氧化三铁分子。
鸭梨:是“压力”的谐音。百度贴吧中某才子无意间将“压力”打成“鸭梨”,引得贴吧中无数人模仿。“鸭梨山大”因与“亚历山大”谐音,从而也在网络上迅速走红。“压力”给人沉重感,甚至有人会“谈压力色变”,用日常生活中的水果“鸭梨”来代替“压力”减少沉重感、紧张程度,并具有几分娱乐、趣味的气质。
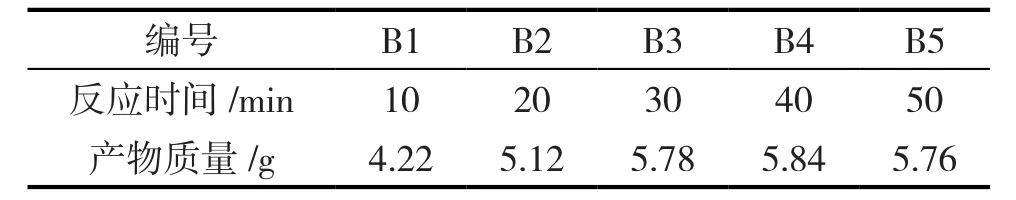
表2 产物产量随反应时间的变化
2.3 NaOH加入量对产物产量的影响
表3是NaOH加入量对产物质量的影响。从表3可以看出,NaOH加入量为200mL时,得到的产物产量最高,不过C3~C5的产量增加幅度不大。为节约成本,NaOH加入量可定为150mL。NaOH的加入量应当严格控制,以使反应体系的pH值一直稳定在2.0~5.5之间。NaOH的加入量过少,会导致二价铁离子沉淀不完全,产物减少;若NaOH过多,则会形成其他氧化物沉淀,比如原料中含有少量杂质Mn2+,在pH=8.5左右时,Mn2+会生成Mn(OH)2,从而降低Fe3O4纯度。

表3 产物产量随NaOH加入量的变化
从以上实验结果可以得出最佳的反应条件应为:反应温度80℃,反应时间40min,NaOH加入量150mL,也就是C3的反应条件。下面对C3的样品进行分析。
2.4 XRD表征
图1是样品C3的XRD图。经与标准图谱对比得知,各XRD谱图均与标准Fe3O4图谱一致,由此可证明所得产物为Fe3O4。

图1 样品C3的粉末X射线衍射图谱Fig.1 X-ray diffraction patterns of sample C3
2.5 IR表征
图2是样品C3的红外光谱图。与标准IR谱图对比可知,样品C3与Fe3O4的标准IR图谱基本一致, 3440cm-1的峰是由羟基伸缩振动产生的,羟基振动对应的峰在1621cm-1处,Fe-O-Fe的伸缩振动则在576cm-1。

图2 样品C3的IR图谱Fig.2 FTIR spectrum of sample C3
2.6 SEM图
图3是C3样品的SEM图。从图3看出,Fe3O4颗粒大小在2~3μm,表面光滑,粒径均匀。

图3 样品C3的SEM图Fig.3 SEM photograph of the sample C3
2.7 Fe3O4的吸附性能
图4显示了Cu2+初始浓度对Fe3O4吸附性能的影响。在实验浓度开始范围内,Fe3O4对Cu2+的吸附量随初始浓度的增加而增加,当Cu2+的初始浓度达300g·L-1时,Fe3O4对Cu2+的吸附量达18.1mg·g-1,此后浓度增加,吸附量几乎不再发生变化。
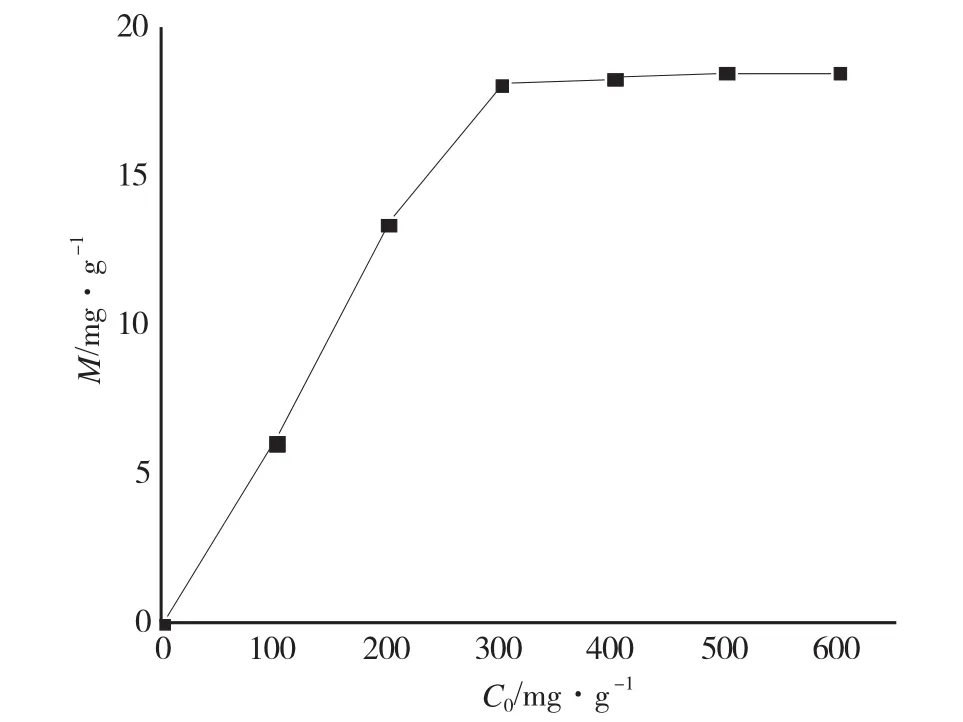
图4 Cu2+初始浓度对Fe3O4吸附性能的影响Fig.4 Effect of initial concentration on adsorption of Cu2+with Fe3O4
3 结论
利用沉淀氧化法合成了Fe3O4微晶,反应温度、反应时间、碱用量都会对产物的产量有一定的影响。从实验数据中得到最佳的反应条件为:反应温度80℃,反应时间40min,氢氧化钠的加入量150mL,此条件下得到的Fe3O4颗粒大小在2~3μm,表面光滑,粒径均匀。Fe3O4对Cu2+的吸附量随初始浓度的增加而增加,当Cu2+的初始浓度为300g·L-1时,Fe3O4对Cu2+的吸附量高达18.1mg·g-1,此后浓度增加,吸附量几乎不再发生变化。
[1] 姜炜,李凤生,杨毅,等.磁性壳聚糖复合微球的制备和性能研究[J].材料科学与工程学报,2004,22(5):660-662.
[2] Ge Fei, Li Meng-Meng, Ye Hui, et al. Effective removal of heavy metal ions Cd2+,Zn2+,Pb2+,Cu2+from aqueous solution by polymer-modified magnetic nanoparticles [J]. J Hazard Mater., 2012, 212(15): 366-372.
[3] Feng Yuan, Gong Jilai, Zeng Guangming, et al. Adsorption of Cd(Ⅰ) and Zn(Ⅱ) from aqueous solutions using magnetic hydroxyapatite nanoparticles adsorbents[J]. Chem. Eng. J., 2010, 162(2): 487-494.
[4] Zhou Z H, Wang J, Liu X, et al. Synthesis of Fe3O4nanoparticles from emulsions[J]. J. Mater. Chem., 2001(11): 1704-1709.
[5] Tadao Sugimoto, EgonMatijevic. Formation of uniform spherical magnetite particles by crystallization from ferrous hydroxide gels[J]. Colloid Interface Sci., 1980, 74(8): 227-243.
[6] Visalakski G, Venkateswaran G, Kulshreshtha S K, et al. Composition Characteristics of Magnetite Synthesized from Aqueous Solutions at Temperatures Up to 523K[J]. Mater. Res. Bull., 1993, 28: 829-836.
[7] 彭登峰,拜山·沙德克,杨世才,等.溶剂热法制备翠玉状Fe3O4微晶及表征[J].人工晶体学报,2009,38(2):497-500.
Synthesis of Fe3O4by Precipitation Oxidation Method and its Adsorption to Cu2+
WANG Xinsheng1, QU Li1, WANG Xuejing2, HUANG Shijiang1, LI Shenshen1
(1. Xinke College, Hennan Institute of Science and Technology, Xinxiang 453003, China; 2. School of Chemistry and Chemical Engineer, Henan Institute of Science and Technology, Xinxiang 453003, China)
Fe3O4was prepared by precipitation oxidation method. The influences of various reaction conditions such as reaction temperature, reaction time and the amount of alkali on the yields of samples were investigated. The results showed that the best reaction conditions were: reaction temperature 80℃, reaction time 24h, the amount of alkali 150mL. The sample obtained on the best reaction condition were characterized by XRD,SEM and IR spectrum. Its size was 2~3μm. Its adsorbance of Cu2+in simulated wastewater increased with the Cu2+concentration increasing. The adsorbance was 18.1mg/g when Cu2+concentration was 300g/L
precipitation oxidation method; Fe3O4; Cu2+; adsorption
O 611.62;O 643.3
A
1671-9905(2017)01-0019-04
河南科技学院新科学院科技创新基金(XKCJ2016ZY001)
王雪静(1967-),女,教授,博士,研究方向:功能材料,E-mail: xjw1206@163.com
2016-11-14

