大豆根际促生菌的分离筛选及其对大豆和百脉根生长与品质的影响
曾庆飞,王茜,陆瑞霞,刘正书,吴佳海,王小利
(贵州省草业研究所,贵州 贵阳550006)
大豆根际促生菌的分离筛选及其对大豆和百脉根生长与品质的影响
曾庆飞,王茜,陆瑞霞,刘正书,吴佳海,王小利*
(贵州省草业研究所,贵州 贵阳550006)
从贵州毕节地区大豆根际土壤中分离溶磷菌株,从大豆根瘤中分离根瘤菌株。对分离出的溶磷圈直径与菌落直径的比值(D/d值)在2.20以上的溶磷菌株分别进行溶磷能力、生长素(IAA)及有机酸分泌能力、产酸产碱性能测定,筛选出优良溶磷菌4株;对分离出的根瘤菌通过大豆试管苗回接及促生效应试验,筛选出高效根瘤菌2株。将筛选出的6株菌经拮抗反应试验后分别按单一溶磷菌接种剂、单一根瘤菌接种剂、溶磷菌+根瘤菌复合接种剂3种处理制备菌悬液,采用盆栽方法分别对大豆和百脉根进行促生效应试验。结果表明,与对照相比,除单一根瘤接种剂对增加大豆株高无效果外,另外2个处理对大豆株高有提升效果,所有处理对大豆茎粗、生物量、结荚数、荚重、单粒数及单粒重都有明显的促进作用。其中溶磷菌+根瘤菌复合菌液对大豆株高、茎粗、幼苗地上生物量和地下生物量的促进效果最好,分别比对照高出21.26%,40.79%,15.88%和42.19%。3个处理对百脉根的第一、二茬株高及地上生物量、全氮、全磷和粗蛋白含量均有明显的提升效应,其中依然是溶磷菌+根瘤菌复合菌液的处理效果最好,分别比对照高出20.82%,54.88%,106.14%,148.78%,19.34%,61.88%和19.34%,与对照差异均达极显著水平(P<0.01)。说明所筛选的菌株组合能产生良好的促生互作效应。
大豆根际溶磷菌;大豆根瘤菌;分离筛选;大豆和百脉根;促生效应
植物根际促生菌(plant growth promoting rhizobacteria, PGPR)是一类自由生活在土壤或定殖于植物根际具有固氮、解磷、释钾、形成铁载体或产生植物激素等能力的有益微生物。PGPR种类繁多,广泛存在于植物根际与根系,其中根瘤菌和溶磷菌是研究最早、经生产开发对农业系统贡献最大的两类促生菌,也是新型生物肥料研究与应用的热点之一[1]。
根瘤菌可将空气中的分子氮转化为有机氮,供自身和植物利用。根瘤菌与豆科植物形成的共生体系是生物固氮体系中最强的共生系统,在改善土壤质量、促进植物的生长过程中起着极其重要的作用[2]。溶磷菌也是农业生态系统中一类具有解磷功能的重要微生物,能将土壤中以无机或有机态结合的难溶性磷化物转化为可被植物吸收利用的水溶性磷酸盐。此外,溶磷菌还能产生有机酸及活性酶类、分泌植物生长所需的植物激素,在改善植物根际环境及营养条件的同时,促进植物的营养生长和生殖生长,进而提高农作物的产量和品质[3]。因此,寻找开发利用具有解磷能力的根际溶磷菌来挖掘土壤中潜在的磷库资源,增加土壤中速效磷的含量及供磷能力,以及筛选利用高效根瘤菌株,改善植物的氮素营养,并降低化肥过量施用所造成的环境污染,已成为发展现代绿色农业的重要任务之一[4-5]。
溶磷菌广泛存在于农业土壤和自然土壤中,但以植物根际土壤中出现较多,而且不同土壤及不同植物根际,其溶磷微生物的数量与种类也存在着较大的差异[6]。研究者们已先后从春小麦(Triticumaestivum)及夏玉米(Zeamays)等禾本科作物、苜蓿(Medicagosativa)与披碱草(Elymusdahuricus)等牧草、杉木(Cunninghamialanceolata)和马尾松(Pinusmassoniana)等林木植物的根际土壤中分离筛选到了不同的溶磷菌株,并进行了溶磷特性、溶磷机理方面的相关研究[7-9],但关于大豆(Glycinemax)根际溶磷菌的研究报道却相对较少。另一方面,根瘤菌接种剂的研制与应用虽在各国已广泛开展,但根瘤菌接种剂的推广应用普遍存在着接种效果不稳定的问题,根瘤菌接种剂效率的发挥存在着区域适用性[10],从地方豆科植物根瘤中搜集分离优良菌株,进而开发研制适合在本地区推广使用的有效根瘤接种剂,具有重要的生产价值及现实意义。本研究从地方大豆根瘤中分离筛选出了具有较强促生性能的根瘤菌株,从大豆根际土壤中分离筛选出了具有较强溶磷能力的溶磷菌株,对优良溶磷菌株的产酸产碱性能、有机酸与生长素的分泌能力进行了测定,并就筛选出的优良溶磷菌和根瘤菌对大豆和百脉根(Lotuscorniculatus)的促生增质效果进行了具体试验,以期为牧草高效溶磷菌肥的研制提供物质保证并奠定技术基础。
1 材料与方法
1.1 供试材料
1.1.1 根际土样的采集 大豆根际土壤于2012年5-7月分别采自贵州省毕节市大方县双山镇平原村和东关乡金坪村、黔西县锦星镇白泥村和雨朵镇蒿芝村以及威宁彝族回族苗族自治县草海镇黄仓村和炉山镇青竹村的大豆种植地,按五点取样法采集附着于大豆健康根系的根际土壤,常规方法混合后装入无菌封口袋,低温保存后带回实验室用于溶磷菌的分离。
1.1.2 大豆根瘤的采集 在与采集大豆根际土壤相同的大豆种植地,于大豆的分枝期或成熟期,选择生长良好的植株挖取根瘤,采集新鲜健壮、颜色鲜艳的成年根瘤,剪时稍带一段根,将采集样品保藏于装有变色硅胶的离心管中密封,低温保存用于根瘤菌的分离。
1.1.3 盆栽种子 用作肥效试验的大豆(品种名:黔豆1号)及百脉根(品种名:歌德)种子由贵州省草业研究所资源育种室提供。菌株处理对大豆和百脉根生长与品质的影响测定于2014年4月中旬至8月上旬进行。
1.2 培养基
PKO(Pikovaskaia’s)无机磷培养基[11]:用于溶磷菌的分离及溶磷能力测定;YMA(酵母膏甘露醇)培养基[11]:用于根瘤菌的分离;NFM(无氮液体培养基)[12]:用于分离菌株的产酸产碱性能测定;Hoagland半固体有氮培养基[13]:用于根瘤菌回接与试管苗促生性能测试;无色氨酸King培养基[11]:用于菌株生长素分泌能力测定;LB(溶菌肉汤培养基)[13]:用于菌株的活化及菌种保存。
1.3 优良促生菌株的分离筛选
1.3.1 溶磷菌株的分离及初筛 按照常规分离细菌法[14]制备土样悬液,逐级稀释后涂布于含有难溶性磷酸钙的PKO平板培养基上,28 ℃恒温箱中倒置培养,挑取平板上有明显透明圈的分离物纯化保存,再将纯化菌株分别点接于PKO固体培养基上,每个菌株4次重复,测定各菌株的溶磷圈直径(diameter of phosphorus-solubilizing halo,D值)和菌落直径(diameter of colony, d值),计算D/d值,根据比值大小对溶磷菌株进行初步筛选[15]。
1.3.2 溶磷菌株的溶磷能力及分泌有机酸量的测定 制备初筛出的各溶磷菌株菌悬液至浓度为107~108cuf/mL,分别取0.5 mL菌悬液接种于盛有50 mL已灭菌PKO液体培养基的三角瓶中,以不接菌的培养基作对照,每个处理3次重复。28 ℃、150 r/min恒温摇床上振荡培养7 d后,培养液于4 ℃、10000 r/min转速下离心10 min,取适量上清液用钼锑抗比色法[16]测定处理液在700 nm处的吸光度。扣除对照值后计算各菌株的溶磷量,以P mg/L计;同时使用雷磁PHS-3C型pH计按仪器操作说明测定菌悬液的pH值。
菌株分泌有机酸的含量采用酸碱滴定法[17]测定。每个菌株取5 mL离心后的上清液,加1滴酚酞作指示剂,用0.1 mol/L NaOH滴定各上清液,有机酸总量(C)用下列公式计算:C=0.1×R÷5×1000,式中:R为NaOH滴定数量,减去CK值得到各菌株的有机酸分泌量,单位用mmol/L表示[11]。
1.3.3 溶磷菌株的产酸、产碱性能测试 分别取0.5 mL已制备好的各菌株的菌悬液接种于盛有30 mL已灭菌NFM液体培养基的三角瓶中,以不接菌的培养基作对照,每个处理3次重复。28 ℃、125 r/min恒温摇床上振荡培养72 h后,观察记录培养基的颜色变化。若培养液颜色不变(绿色或草绿色)为中性菌株,变成黄色为产酸菌株,变成蓝色为产碱菌株。同时利用雷磁PHS-3C型pH酸度计测定各菌株培养液的pH值,以检验其酸碱性[3]。
1.3.4 溶磷菌株分泌生长素能力测定 菌株分泌生长素(3-indoleacetic acid, IAA)能力采用Salkowski比色法测定[18]。Salkowski(S2)比色液组成为:FeCl34.5 g,10.8 mol/L浓硫酸1000 mL。将0.5 mL菌悬液接种于盛有30 mL已灭菌的无色氨酸King培养基中,28 ℃、150 r/min恒温摇床上振荡培养7 d,10000 r/min离心10 min,每菌株取1 mL上清液滴入检测板上,加入等量S2比色液,另外在比色液中分别加入50,30和10 mg/L的标准植物生长激素1 mL作梯度对照,室温静置15 min后观察颜色变化,确定菌株是否具有分泌IAA的能力。取能够分泌IAA菌株的上清液1 mL,加入S2比色液1 mL,于黑暗中静置30 min后用紫外分光光度计在530 nm处测定吸光度,根据标准曲线计算各菌株的IAA分泌量(单位:mg/L)。
1.3.5 根瘤菌的分离与纯化 将采集的新鲜、饱满的大豆根瘤,用自来水冲净表面泥土,10%次氯酸钠浸泡消毒20~30 min后无菌水冲洗,在无菌条件下将根瘤压碎,挤出汁液,在YMA平板上划线,置于28 ℃下培养。5 d后挑取典型单菌落进行革兰氏染色,镜检,若不纯,进一步纯化,直至获得纯化菌株,分别用YMA斜管和30%甘油保藏。
1.3.6 根瘤菌的回接鉴定与筛选 根瘤菌的回接鉴定与筛选采用试管苗根瘤及促生测定法。选用口径3.5 cm、高35 cm的大试管加入Hoagland半固体有氮培养基100 mL灭菌;挑选同一批次的籽粒饱满、大小均一的大豆种子(黔豆1号),用0.1%的升汞表面消毒5 min后,再用75%的酒精消毒约3 min,无菌水冲洗干净,在灭菌三角瓶里用无菌水室温浸种48 h,选择催芽成功的大豆种子无菌条件下接种于试管内的培养基中,分别加入5 mL各根瘤菌株的YMA发酵菌液,每个菌株3次重复,以YMA液体空白培养基作对照,然后放入25 ℃、光照16 h的培养箱中恒温培养,观察记录管内植株根瘤形成及幼苗生长情况,40 d后进行结瘤与促生性状测定。测定项目包括根瘤数、根长、株高、地上生物量(鲜重,干重)、地下生物量(鲜重,干重)。测定方法:将幼苗从试管内小心取出,蒸馏水洗净根部琼脂,吸水纸吸取根表水分,然后平铺在桌面的滤纸上。直接数数统计每株根瘤总数;将幼根拉直,用20 cm透明直尺测量根长与地上部株高;用干净刀片切断分离植株地上部与地下部,用万分之一电子天平称取地上生物量(鲜重)与地下生物量(鲜重),然后分别将地上、地下部于105 ℃杀青30 min,在恒温85 ℃下烘干12 h至恒重后再用相同电子天平称取地上生物量(干重)和地下生物量(干重)。
1.3.7 菌株拮抗反应试验及菌悬液的制备 拮抗反应试验:将各供试菌株活化后分别两两交叉划线接种于LB固体培养基上,28 ℃恒温箱中倒置培养5~10 d,每天观察两菌株交叉点的菌落生长情况。若交叉点菌株生长良好,说明两菌株间没有拮抗反应;若交叉点菌株不生长或生长较弱,说明两菌株间有拮抗作用。选择不发生拮抗反应的菌株制备菌悬液并进行盆栽试验。
溶磷菌菌悬液的制备:将各供试菌株在LB斜面培养基上活化培养1~2 d,选择生长良好、无杂菌、无污染的菌落,分别接种于100 mL LB液体灭菌培养基中,28 ℃、125 r/min摇床培养3~5 d。在波长660 nm处测定培养菌液光密度(OD)值,当OD660值大于0.5时,用无菌水在无菌条件下调节各菌株悬液OD值至0.5,用灭菌量筒将菌液注入灭菌玻璃瓶中常温密封保存。
根瘤菌菌悬液的制备:将筛选出的促生性能良好的菌株纯培养物分别挑取1环接种到100 mL YMA液体培养基中,28 ℃、150 r/min恒温摇床培养72 h,用液体YMA培养基调OD=0.9(波长=600 nm),菌体浓度约为2×109个/mL,待用。
1.4 盆栽试验
1.4.1 播种与菌液施用 在花钵中装入适量供试土壤,不施任何底肥。土壤取自贵州省农业科学院院内试验地,试验地土壤全氮含量1.70 g/kg,有效磷15.70 mg/kg,速效钾130.00 mg/kg,有机质31.17 g/kg,pH 6.03(数据由贵州大学环境与资源研究所测定)。分别选取同一批次的籽粒饱满、大小均一的大豆和百脉根种子,用设计的各处理菌液于阴凉处浸种约2 h后播入土内,大豆每盆播种5粒,百脉根每盆播种50粒,加入50 mL 处理菌液,另设空白培养基浸种作对照,每个处理3次重复。将不同处理的花盆随机摆放于光照充足的地方,按常规盆栽试验进行管理,大豆在分枝期前、百脉根在第1茬收获前再各施一次处理菌液。
1.4.2 大豆和百脉根株高的测定 盆栽大豆分别在播种20 d后的幼苗期、分枝期和开花期,于每一处理的每个重复中随机选择5株共15株,将植株拉直,用100 cm卷尺测定其从地面至最高点的绝对高度,计算平均值;百脉根分别在第1茬和第2茬收获时,于每一处理的每个重复中随机选择10株共30株,用相同方法测定绝对高度,计算平均值。
1.4.3 大豆幼苗和百脉根生物量的测定 在盆栽大豆播种20 d后、盆栽百脉根分别在第1茬和第2茬的收获期,大豆每处理随机选择5株,百脉根各处理每次随机选择10株,将地上部分和地下根系分别在105 ℃下杀青15~30 min后,于85 ℃下烘至恒重,使用万分之一电子天平称重,计算地上生物量和地下生物量的平均值。
1.4.4 大豆茎粗、结荚数、荚重、单粒数及单粒重的测定 盆栽大豆每处理随机选择5株,分别在分枝期和开花期用软皮尺测定茎粗,在收获期统计每株结荚数及单株粒数,用万分之一电子天平称取单株荚重及粒重,计算每株单荚重与单粒重的平均值。
1.4.5 百脉根全氮、全磷、粗蛋白、粗脂肪含量的测定 在百脉根第1茬收获时,随机选择3个单株的地上部分,分别测定植株的全氮、全磷、粗蛋白及粗脂肪含量。
全氮含量测定采用凯氏定氮法[19],计算公式为:N(%)=(V1-V0)×V2×n×100×0.014/3W×V3。式中:N为样品中的全氮含量,V1为滴定样品时的盐酸用量(mL),V0为空白滴定时的盐酸用量(mL),V2为消化液定容体积(mL),n为滴定样品时盐酸的当量浓度,W为样品干重(g),V3为蒸馏时消化液的吸取体积(mL),3代表重复数。
全磷量的测定采用H2SO4-H2O2消煮,钼黄比色法[20],计算公式为:P(%)=ρ·V×分取倍数×10-4/3m。式中:ρ为从标准曲线中查得显色液P的质量浓度(μg/mL),V为显色液体积(mL),分取倍数:消煮液定容体积(mL)/吸取消煮液体积(mL),m为干样品质量(g),3为重复数。
粗蛋白(crude protein, CP)含量由公式直接计算:CP(%)=N%×6.25。式中:N%为所测样品的含氮量,6.25为氮换算成蛋白质的系数。
粗脂肪(crude fat, CF)的测定采用索氏抽提法[21],计算公式为:CF(%)=(b-c)/(b-a)×100×3。式中:a为称量瓶加滤纸包的重量(g),b为称量瓶加滤纸包和烘干样重(g),c为称量瓶加滤纸包和抽提后烘干残渣重(g),3为重复数。
1.5 数据统计分析
采用Excel 2010整理数据,运用LSD法进行多重比较,统计学分析使用SPSS 16.0软件。
2 结果与分析
2.1 大豆根际溶磷菌的分离与筛选
2.1.1 根际溶磷菌的分离及溶磷圈筛选 通过溶磷圈法,从采集的大豆根际土壤中于含有难溶性磷酸钙的PKO平板上,挑选获得36株具有明显透明圈的菌落纯化保存;将纯化菌株分别点接于PKO固体培养基上,D/d值在1.50以上的有23个菌株;经过10d培养,D/d值大于2.20的菌株有7株(表1),作为初步筛选出的菌株,占供试菌株的19.4%,其中菌株DR19的D/d值最大,达2.55,其次为菌株DR24和DR7,D/d值分别为2.50和2.51。
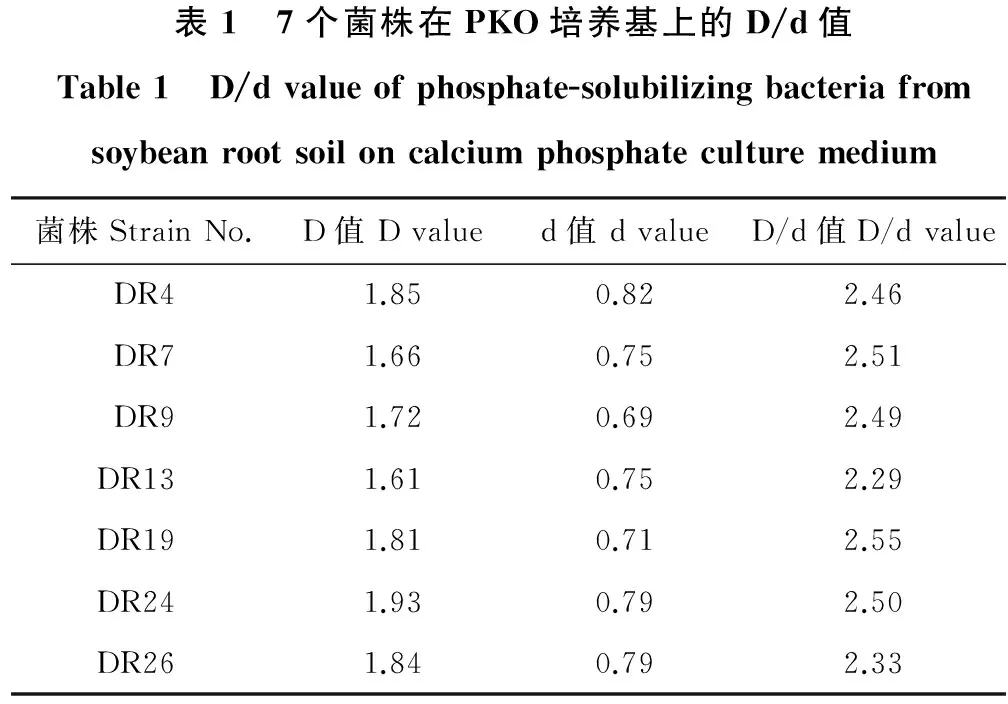
表1 7个菌株在PKO培养基上的D/d值Table1 D/dvalueofphosphate-solubilizingbacteriafromsoybeanrootsoiloncalciumphosphateculturemedium菌株StrainNo.D值Dvalued值dvalueD/d值D/dvalueDR41.850.822.46DR71.660.752.51DR91.720.692.49DR131.610.752.29DR191.810.712.55DR241.930.792.50DR261.840.792.33
2.1.2 菌株的溶磷能力及分泌有机酸量 在以磷酸钙作为磷源的液体培养条件下,培养7 d后7个菌株的溶磷量在151.64~179.70 μg/mL(表2),其中菌株DR13的溶磷能力最强,达179.70 μg/mL,其次是菌株DR7,溶磷量为173.94 μg/mL,两者溶磷量均与最小溶磷量为151.64 μg/mL的菌株DR26之间达到显著差异(P<0.05)。
从表2可以看出,在溶磷培养过程中,各菌株培养液的pH值均呈下降趋势,由最初的7.00下降到5.00~6.00之间,下降了1~2个单位。
总有机酸量测定结果表明,7个菌株在PKO培养液中生长7 d后均能分泌有机酸,但存在数量差别,其中菌株DR13的分泌量最高,达14.00 mmol/L,其次为菌株DR4和DR19,分泌量均为11.33 mmol/L,分泌有机酸量之间的差异达显著水平(P<0.05)。菌株DR26分泌有机酸量最小,仅为6.00 mmol/L,与其余菌株分泌量之间达到极显著差异(P<0.01)。
2.1.3 菌株的产酸、产碱性能 菌株的产酸产碱性能测试结果显示(表3),分离筛选出的7个菌株均为产碱菌株,在NFM液体培养基中,使培养介质颜色由绿色转变成蓝色,且各介质培养液pH值主要集中在7.54~7.93之间的弱碱性范围内,只有菌株DRI3的介质培养液pH值达到了8.44。

表2 7个菌株对磷酸钙中磷的溶解量及分泌有机酸量Table2 Capacityofphosphatedissolvingandorganicacidproductionofsevenstrains菌株号StrainNo.有效磷增量Incrementofavailablephosphorus(μg/mL)pH值pHvalue总有机酸Totalorganicacid(mmol/L)DR4153.87±4.17Ab5.2911.33ABbDR7173.94±0.64Aa5.0510.00BbDR9157.94±8.88Ab5.438.00BdDR13179.70±1.80Aa5.4014.00AaDR19165.44±6.96Aab5.5411.33ABbDR24168.30±5.81Aab5.349.33BcDR26151.64±3.36Ab5.586.00Ce 注:同列不同大写字母表示差异达极显著水平(P<0.01),不同小写字母表示差异达显著水平(P<0.05),下同。 Note:Differentcapitallettersinthesamecolumnindicatethesignifi-cantdifferenceatP<0.01level,differentsmalllettersshowthesignifi-cantdifferenceatP<0.05level.Thesamebelow.表3 7个菌株的产酸产碱性能Table3 Acidoralkaliproducingabilityofsevenstrains菌株号StrainNo.颜色Color产酸或产碱AcidoralkaloidsproductionpH值pHvalueDR4蓝色Blue产碱Alkaloidsproduction7.55DR7蓝色Blue产碱Alkaloidsproduction7.59DR9蓝色Blue产碱Alkaloidsproduction7.54DR13蓝色Blue产碱Alkaloidsproduction8.44DR19蓝色Blue产碱Alkaloidsproduction7.93DR24蓝色Blue产碱Alkaloidsproduction7.60DR26蓝色Blue产碱Alkaloidsproduction7.76表4 7个菌株分泌生长素的能力Table4 CapacityofIAAsecretionofsevenstrains菌株号StrainNo.显色反应ChromogenicreactionIAA值ValueofIAA(μg/mL)DR4深粉红色Deeppink18.07±0.34AaDR7浅粉红色Lightpink7.65±0.63DeDR9浅粉红色Lightpink10.85±1.47CcDR13粉红色Pink11.49±0.24CcDR19深粉红色Deeppink14.01±0.67BbDR24深粉红色Deeppink14.97±0.46BbDR26浅粉红色Lightpink9.00±0.82Dd
2.1.4 菌株分泌生长素的能力 对分离筛选出的7株溶磷能力较强的菌株进行IAA分泌能力的测定,结果表明,所有供试菌株均具有一定分泌生长素的能力(表4)。定性检测结果显示,各菌株呈现出色泽不同的显色反应。红色浓度越大,菌株分泌生长素的能力可能越强。从定量测定的结果看,菌株DR4分泌IAA的能力最大,分泌量达18.07μg/mL,均与其余菌株分泌IAA量之间呈极显著差异(P<0.01);其次为DR24,分泌IAA量为14.97μg/mL,除与菌株DR19(分泌IAA量为14.01μg/mL)之间未达显著水平差异外,与其余各菌株之间分泌IAA量都达到极显著水平(P<0.01);菌株DR7分泌IAA 的量最小,为7.65μg/mL,是最大IAA 量的42.3%,表现出微弱分泌IAA 的能力。
2.2 大豆根瘤菌的分离与筛选
2.2.1 大豆根瘤菌的分离 在采集的23份根瘤样品中,通过含结晶紫的YMA平板划线分离培养,最终获得在平板上生长良好的56株纯化根瘤菌。纯化菌株在YMA 平板上的生长菌落多为圆形,直径在2~3mm之间,革兰氏染色均为阴性。挑选菌落隆起而光滑、边缘整齐、有粘液产生的典型菌株,进行根瘤菌株的回接与促生效果试验,用于优良菌株的筛选。
2.2.2 根瘤菌的回接与促生效应试验结果 将9株具有典型菌落特征的根瘤菌用于大豆试管苗的回接与促生效能试验,试验结果如表5所列。
测定结果显示,挑选的9株参试菌株回接后,在Hoagland半固体有氮培养基中都能使大豆幼苗的根系形成根瘤,而对照无结瘤发生。其中菌株D2与D4的结瘤数量明显高于其余7个菌株。与对照相比,9个菌株对大豆试管苗生长量的影响均达显著水平,其中菌株D2对大豆试管苗的促生效果最好,生长40d后幼苗的株高、根长、地上生物量和地下生物量均明显大于其他菌株处理的幼苗,并与对照达到极显著差异。菌株D1处理的幼苗株高位居第二,但根长与地上生物量却低于菌株D3、D4处理的幼苗。综合比较促生苗的株高、根长和地上生物量3个指标,菌株D4的促生效果仅次于D2,然后是菌株D3、D9和D5,菌株D6D7、D8的促生效果相对较低。
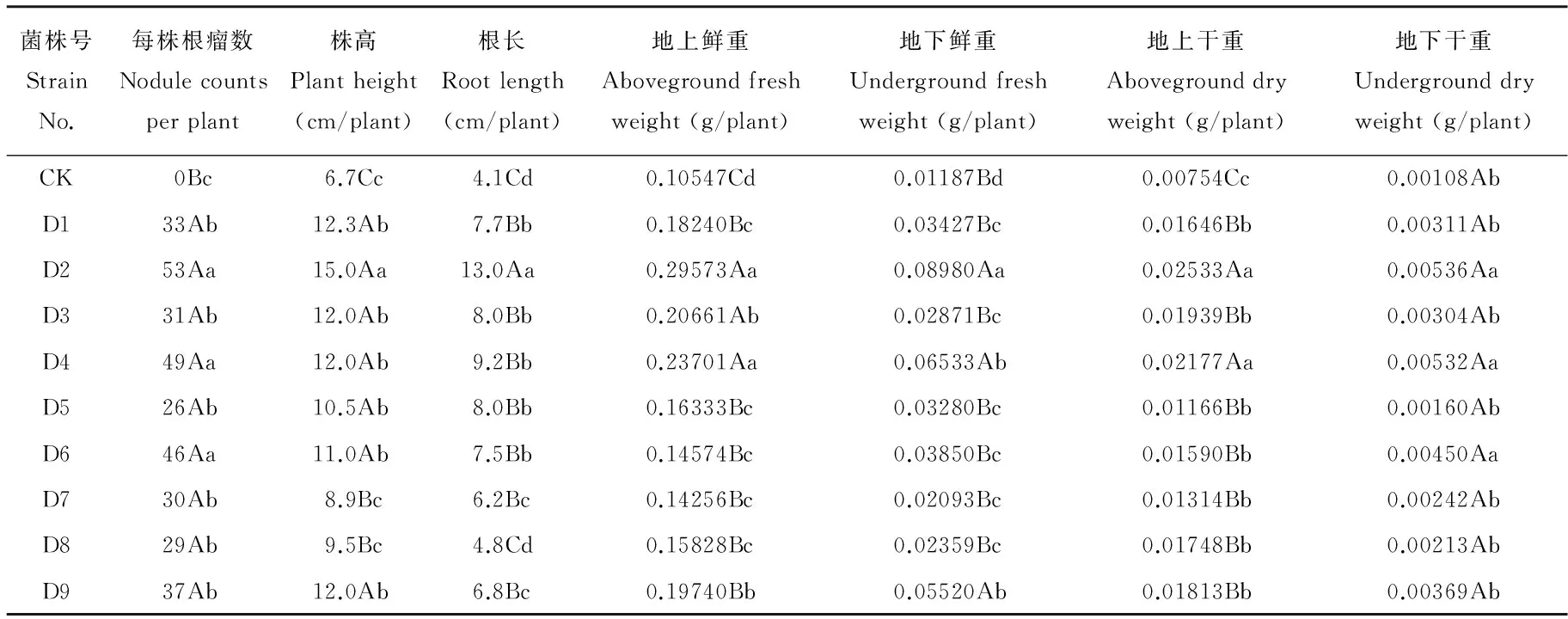
表5 9株根瘤菌对大豆试管苗结瘤与生长量的影响Table 5 Effect of nine rhizobium strains on nodulation and growth of soybean tube seedlings
2.3 菌株拮抗反应及菌剂处理设置
溶磷菌株根据D/d值、溶磷能力和IAA分泌能力等指标,挑选出DR19、DR13、DR24和DR4四个菌株,根瘤菌根据回接筛选结果挑选出D2和D4参与对大豆和百脉根的促生效应试验。首先对挑选出的6个菌株两两划线培养,结果发现所有平板划线交叉处的菌落均生长良好,表明6个菌株间无拮抗反应。将最终筛选出的6个菌株设成3个不同的组合处理,设置情况见表6(注:菌株名称与组合及其体积比等正在申报国家发明专利)。
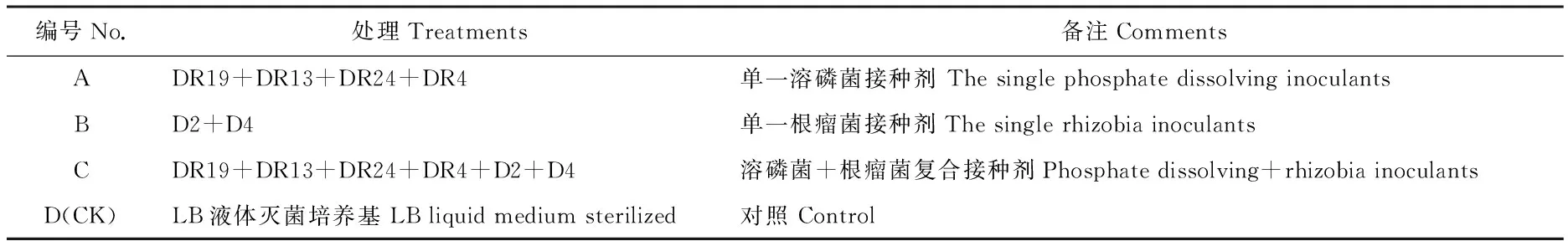
表6 菌剂处理设计Table 6 Design of stain treatments
2.4 不同菌株处理对大豆和百脉根生长的影响
2.4.1 对大豆株高与茎粗和百脉根株高的影响 各菌剂处理对盆栽大豆分枝期和开花期株高及茎粗的影响效果分别见表7和表8。
在分枝期和开花期,单一溶磷菌接种剂和溶磷菌+根瘤菌复合接种剂处理的大豆株高均较对照高,单一根瘤菌接种剂处理较对照低(表7)。其中在分枝期,溶磷菌+根瘤菌复合接种剂处理的大豆株高为69.93 cm/株,比对照(55.53 cm/株)高出25.93%,并达显著性差异;在开花期,溶磷菌+根瘤菌混合处理的大豆株高较对照高出21.26%,差异达到显著水平。说明经过溶磷+根瘤菌混合处理后,对大豆株高具有明显的促进作用。对于经过单一根瘤菌处理的大豆,在分枝期和开花期的株高(53.73和81.13 cm/株)分别比对照低3.24%和2.01%,说明供试根瘤菌剂对提高大豆株高无效果。
在分枝期和开花期,单一溶磷菌、单一根瘤菌和溶磷菌+根瘤菌混合处理的大豆茎粗均较对照明显提高(P<0.05)(表8)。在分枝期,溶磷菌、根瘤菌和溶磷+根瘤菌三者处理的茎粗分别为2.87,2.69和2.73 cm,分别比对照(2.11 cm)提高35.69%,27.24%和29.29%。在开花期,根瘤菌和溶磷+根瘤菌对大豆茎粗的增大作用明显加强,两者处理的大豆茎粗分别为2.85和3.04 cm,比对照(2.16 cm)提高31.93%和40.79%;溶磷处理的大豆茎粗相对分枝期,其增大作用略有减弱,开花期大豆茎粗较对照提高33.94%。
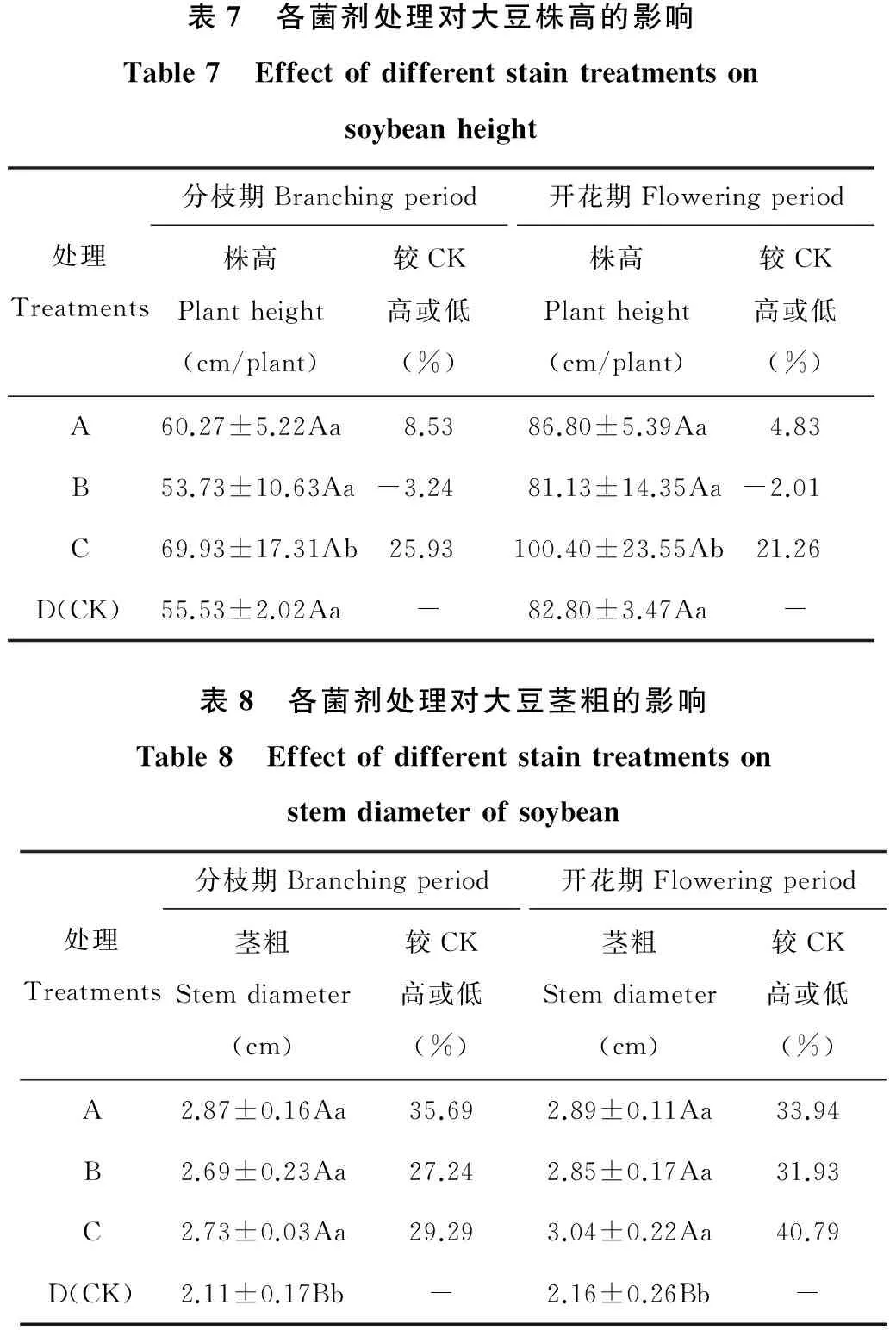
表7 各菌剂处理对大豆株高的影响Table7 Effectofdifferentstaintreatmentsonsoybeanheight处理Treatments分枝期Branchingperiod株高Plantheight(cm/plant)较CK高或低(%)开花期Floweringperiod株高Plantheight(cm/plant)较CK高或低(%)A60.27±5.22Aa8.5386.80±5.39Aa4.83B53.73±10.63Aa-3.2481.13±14.35Aa-2.01C69.93±17.31Ab25.93100.40±23.55Ab21.26D(CK)55.53±2.02Aa-82.80±3.47Aa-表8 各菌剂处理对大豆茎粗的影响Table8 Effectofdifferentstaintreatmentsonstemdiameterofsoybean处理Treatments分枝期Branchingperiod茎粗Stemdiameter(cm)较CK高或低(%)开花期Floweringperiod茎粗Stemdiameter(cm)较CK高或低(%)A2.87±0.16Aa35.692.89±0.11Aa33.94B2.69±0.23Aa27.242.85±0.17Aa31.93C2.73±0.03Aa29.293.04±0.22Aa40.79D(CK)2.11±0.17Bb-2.16±0.26Bb-
较CK高或低:Increase or decrease rate compared with CK.下同 The same below.
各菌株处理对盆栽百脉根第1茬和第2茬株高的影响效果见表9。从表9可以看出,各菌剂处理对百脉根第1茬及第2茬株高的影响差异较大。在第1茬时,A、B、C各处理均较对照有所增加,其中C处理的百脉根株高为25.49 cm/株,比对照(21.10 cm/株)增加20.82%;B处理对百脉根株高的影响不大,仅较对照增加1.06%。在各处理中,C处理与其余处理间株高差异达到极显著水平(P<0.01),其余处理间未达显著水平(P>0.05)。到第2茬时,各菌剂处理株高在13.67~16.44 cm/株之间,较对照株高增加28.73%~54.88%,均与对照差异达极显著水平(P<0.01)。
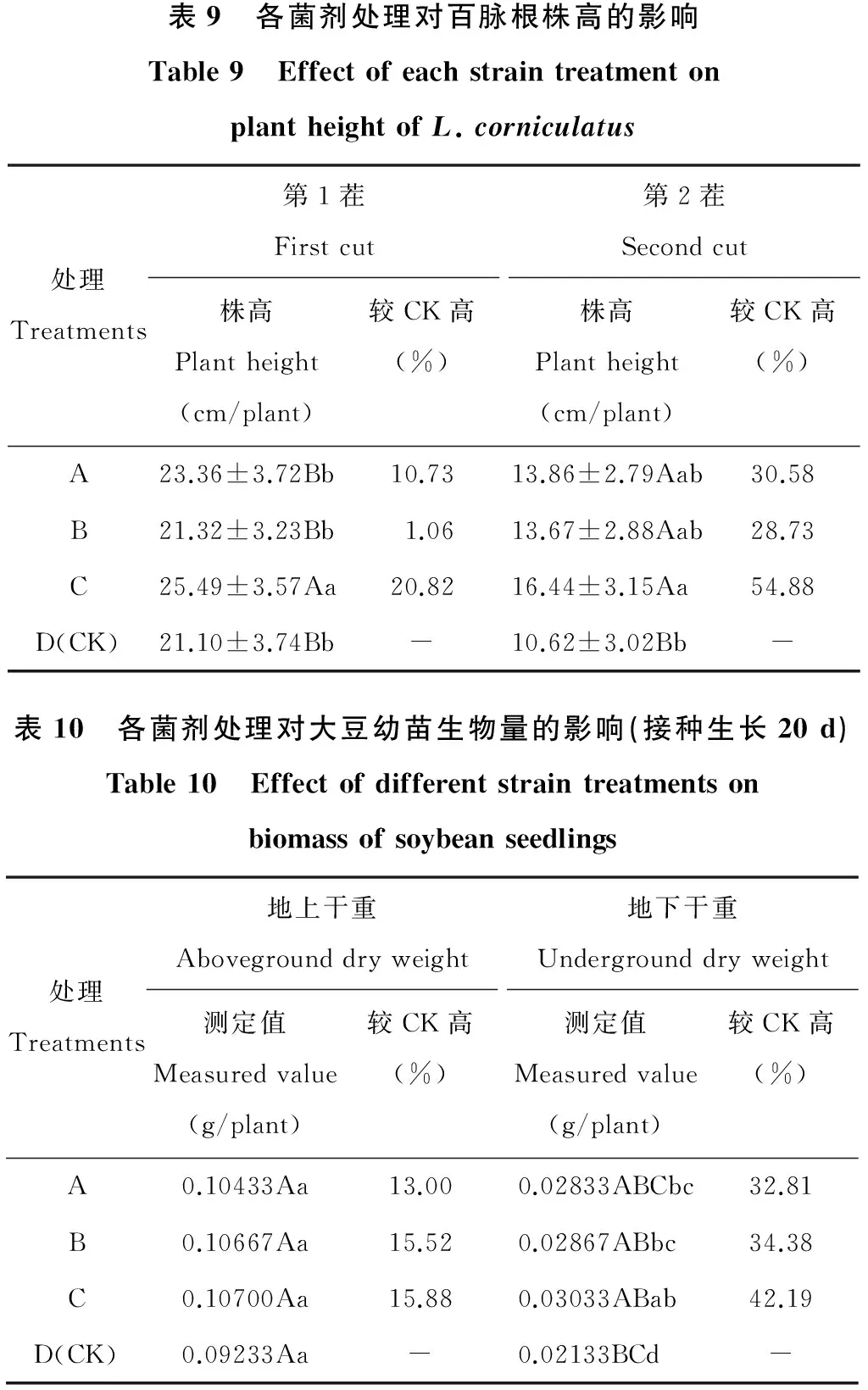
表9 各菌剂处理对百脉根株高的影响Table9 EffectofeachstraintreatmentonplantheightofL.corniculatus处理Treatments第1茬Firstcut株高Plantheight(cm/plant)较CK高(%)第2茬Secondcut株高Plantheight(cm/plant)较CK高(%)A23.36±3.72Bb10.7313.86±2.79Aab30.58B21.32±3.23Bb1.0613.67±2.88Aab28.73C25.49±3.57Aa20.8216.44±3.15Aa54.88D(CK)21.10±3.74Bb-10.62±3.02Bb-表10 各菌剂处理对大豆幼苗生物量的影响(接种生长20d)Table10 Effectofdifferentstraintreatmentsonbiomassofsoybeanseedlings处理Treatments地上干重Abovegrounddryweight测定值Measuredvalue(g/plant)较CK高(%)地下干重Undergrounddryweight测定值Measuredvalue(g/plant)较CK高(%)A0.10433Aa13.000.02833ABCbc32.81B0.10667Aa15.520.02867ABbc34.38C0.10700Aa15.880.03033ABab42.19D(CK)0.09233Aa-0.02133BCd-
较CK高:Increase rate compared with CK.下同The same below.
2.4.2 对大豆幼苗和百脉根生物量的影响 各菌剂处理接种20 d后对盆栽大豆生物量的影响效果见表10。测定结果显示,各菌剂处理与对照相比,对大豆幼苗地上生物量均有一定的促进作用,但差异不显著;各菌剂处理对地下生物量的提高作用却与对照都达到了极显著差异,说明3个菌剂处理都能明显促进大豆幼苗根系的生长,其中溶磷菌+根瘤菌复合菌剂对大豆幼苗生物量具有最好的提高效果。
各处理对百脉根地上生物量的影响效果见表11。从表11可知,第1茬各菌剂处理的单株地上生物量比对照增加了14.68%~106.14%,其中C处理效果最好,地上生物量比B处理增加了91.46%,与其他各处理间的地上生物量差异达到极显著水平(P<0.01);第2茬各处理单株地上生物量较第1茬小,但比对照的单株地上生物量增加了87.40%~148.78%,与对照差异达极显著水平(P<0.01),而且也是C处理的影响效果最佳。综合分析同一处理在不同茬次对百脉根地上生物量的影响,各处理在第2茬的促生效果均强于第1茬,说明各处理对百脉根地上生物量的促生效果在第2茬均较第1茬好,即无论是溶磷菌剂、固氮菌剂,还是溶磷与固氮菌剂混合,其促生效果的作用均较持续和稳定。
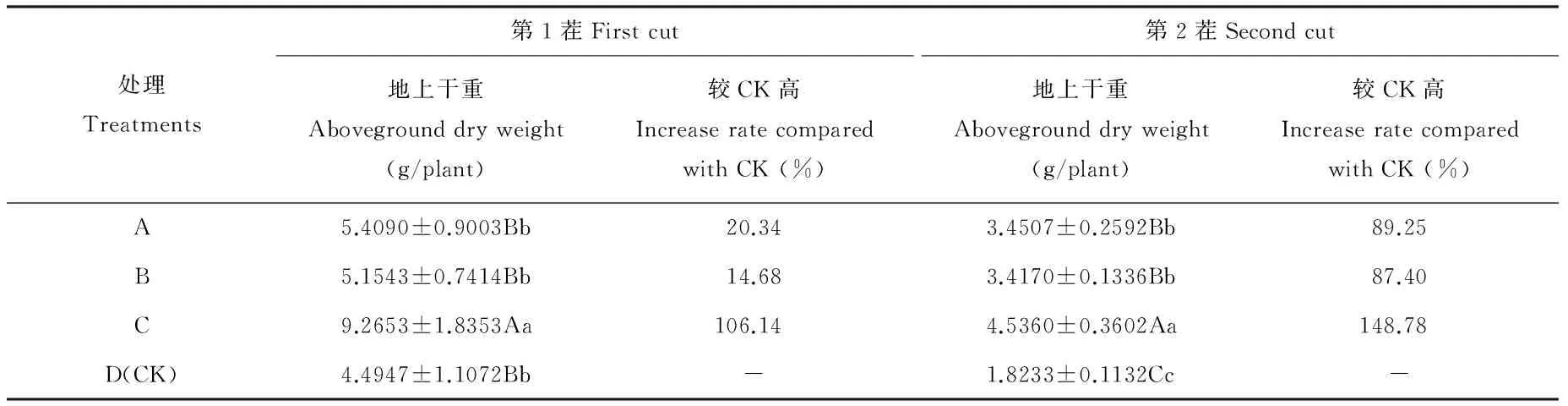
表11 各处理对百脉根地上生物量的影响Table 11 Effect of each treatment on above dry weight of L. corniculatus
2.4.3 对大豆结荚数、荚重、单粒数及单粒重的影响 在收获期,各处理对大豆结荚数及荚重的影响效果见表12。结果表明,溶磷、固氮和溶磷+固氮混合处理的大豆单株荚数分别比对照提高37.70%,55.74%和44.26%,经固氮菌剂处理的大豆单株荚数最多,为6.33个/株,其次为溶磷+固氮处理。在单荚重方面,表现出固氮>溶磷>溶磷+固氮,荚重分别为0.74,0.68和0.64 g/盆,比对照(0.62 g/盆)分别提高20.21%,9.96%和3.75%。
各处理对大豆单粒数及单粒重的影响效果见表13。从表中可知,各菌剂处理都能提高大豆的单粒数及单粒重,但提高程度有所不同。A、B、C三个处理的大豆单株粒数分别为10.27,11.47和10.73粒/株,分别比对照(7.33粒/株)高出40.00%,56.36%和46.36%,单株粒数增加效果表现为固氮>溶磷+固氮>溶磷>CK。A、B、C三个处理的大豆单粒重分别较对照提高了39.99%,57.20%和33.25%,提高效果体现为固氮>溶磷>溶磷+固氮>CK。
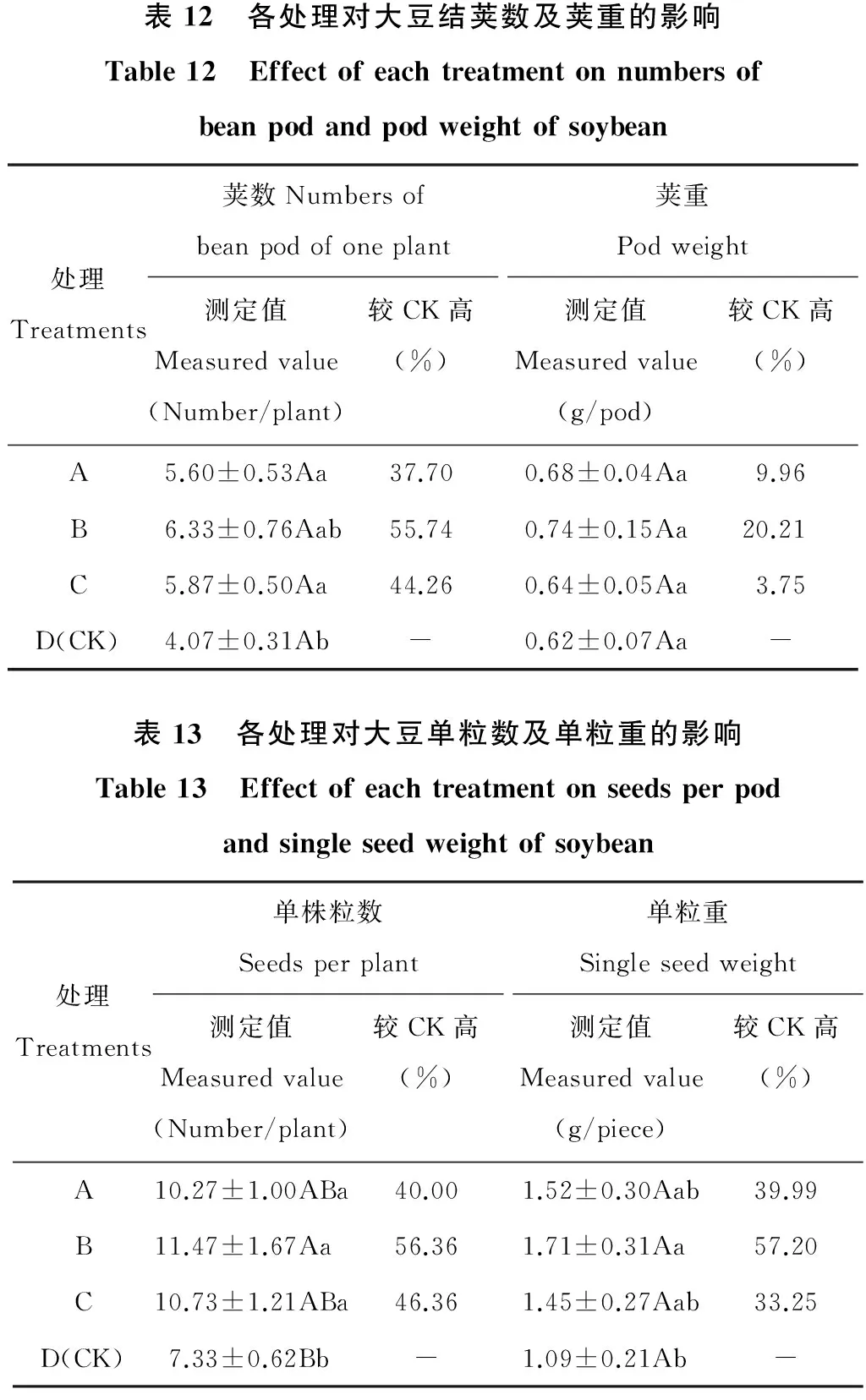
表12 各处理对大豆结荚数及荚重的影响Table12 Effectofeachtreatmentonnumbersofbeanpodandpodweightofsoybean处理Treatments荚数Numbersofbeanpodofoneplant测定值Measuredvalue(Number/plant)较CK高(%)荚重Podweight测定值Measuredvalue(g/pod)较CK高(%)A5.60±0.53Aa37.700.68±0.04Aa9.96B6.33±0.76Aab55.740.74±0.15Aa20.21C5.87±0.50Aa44.260.64±0.05Aa3.75D(CK)4.07±0.31Ab-0.62±0.07Aa-表13 各处理对大豆单粒数及单粒重的影响Table13 Effectofeachtreatmentonseedsperpodandsingleseedweightofsoybean处理Treatments单株粒数Seedsperplant测定值Measuredvalue(Number/plant)较CK高(%)单粒重Singleseedweight测定值Measuredvalue(g/piece)较CK高(%)A10.27±1.00ABa40.001.52±0.30Aab39.99B11.47±1.67Aa56.361.71±0.31Aa57.20C10.73±1.21ABa46.361.45±0.27Aab33.25D(CK)7.33±0.62Bb-1.09±0.21Ab-
2.5 不同菌株处理对百脉根营养成分的影响
2.5.1 对百脉根全氮、全磷含量的影响 各菌剂处理对百脉根全氮、全磷含量的影响效果见表14。测定结果显示,经A、B、C三种菌剂处理后的百脉根全氮含量在1.94%~2.18%之间,而对照仅为1.83%,提高范围达6.20%~19.34%。除B处理与对照相比未达极显著差异外(P>0.01),A、C处理的全氮含量均与对照达到极显著差异水平(P<0.01)。
在对全磷含量的影响上,施用各处理菌剂后,与对照相比全磷含量提升幅度高达20.93%~61.88%,差异均达极显著水平(P<0.01)。其中C处理的全磷含量最高,为0.77%,这可能是溶磷菌剂与固氮菌剂共同作用的结果。A处理的全磷含量略大于B处理。综合分析各处理对百脉根全氮、全磷含量的影响,发现均存在C>A>B>CK的效果关系。
2.5.2 对百脉根粗蛋白、粗脂肪含量的影响 各菌剂处理对百脉根粗蛋白、粗脂肪含量的影响效果见表15。从测定结果可以看出,与对照相比,各处理对百脉根粗蛋白含量均有提高作用,影响效果表现为:C>A>B>CK,而对粗脂肪含量的影响效果有所不同,表现为:A>C>CK>B。由于粗蛋白含量受含氮量的影响,各处理对百脉根粗蛋白含量的影响与含氮量是一致的。在粗脂肪含量上,A、C处理分别较对照增加了25.08%和0.40%,B处理反而较对照降低了11.23%,说明施用单一的固氮菌剂后,不利于百脉根体内能量物质粗脂肪的积累。
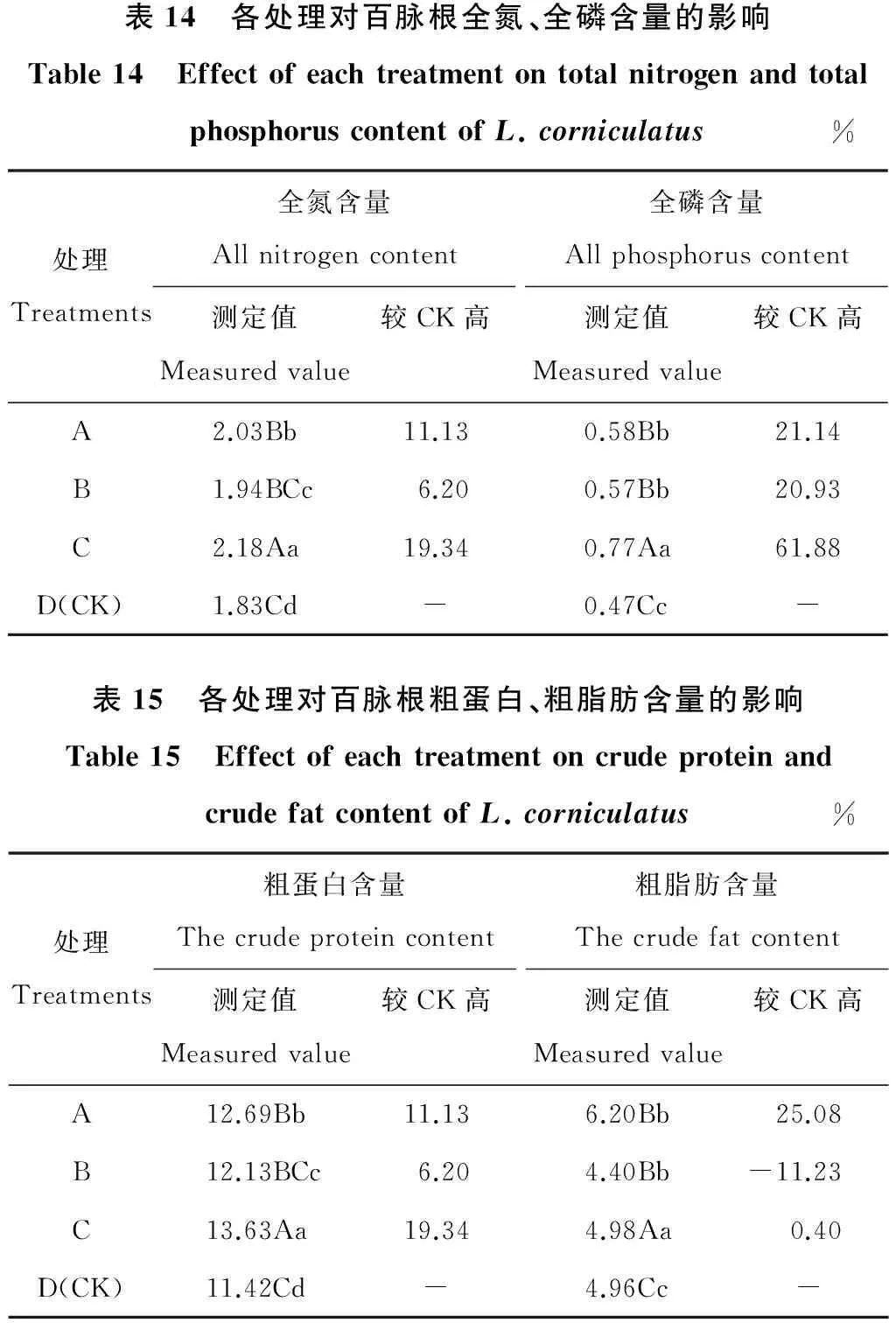
表14 各处理对百脉根全氮、全磷含量的影响Table14 EffectofeachtreatmentontotalnitrogenandtotalphosphoruscontentofL.corniculatus%处理Treatments全氮含量Allnitrogencontent测定值Measuredvalue较CK高全磷含量Allphosphoruscontent测定值Measuredvalue较CK高A2.03Bb11.130.58Bb21.14B1.94BCc6.200.57Bb20.93C2.18Aa19.340.77Aa61.88D(CK)1.83Cd-0.47Cc-表15 各处理对百脉根粗蛋白、粗脂肪含量的影响Table15 EffectofeachtreatmentoncrudeproteinandcrudefatcontentofL.corniculatus%处理Treatments粗蛋白含量Thecrudeproteincontent测定值Measuredvalue较CK高粗脂肪含量Thecrudefatcontent测定值Measuredvalue较CK高A12.69Bb11.136.20Bb25.08B12.13BCc6.204.40Bb-11.23C13.63Aa19.344.98Aa0.40D(CK)11.42Cd-4.96Cc-
3 讨论
农田土壤中氮、磷、钾缺乏,过多施用化肥,养分利用率低下,并由此产生一系列资源、环境和农产品品质等负面效应,是我国农业生产中普遍存在的一个问题。研究开发具有多种有益生物学作用的植物根际促生菌,研制并利用对环境友好的微生物菌肥,是解决这一问题的有效途径[22]。高效根瘤菌可以通过生物固氮机制为作物提供环保氮肥,优良溶磷菌能将土壤中的难溶性磷转化成可被植物吸收利用的可溶性磷,进而逐渐变成了代表未来绿色农业发展方向之一的“白色农业”中的生力军[23]。早有将具有固氮、溶磷特性的PGPR生物菌肥应用于甘蔗(Saccharum)、青稞(Hordeumvulgare)、草莓(Fragaria×ananassa)、苹果树(Malusdomestica)等经济作物并产生良好效果的报道[24]。将PGPR复合菌肥应用于牧草中的三叶草(Trifoliumrepens)、紫花苜蓿(Medicagosativa)、箭舌豌豆(Viciasativa)、岷山红三叶(Trifoliumpratensecv. Minshan)等,也得到了提质增产的效果[25]。
本研究从贵州毕节地区的大豆根瘤中分离筛选出对大豆试管苗具有良好结瘤作用和促生效果的5株根瘤菌;从大豆根际土壤分离菌株中通过溶磷圈法筛选出7株具有较强溶磷能力的溶磷菌株。溶磷圈直径(D)与菌落生长直径(d)及其比值是表征溶磷菌相对溶磷能力的一个指标,在筛选出的7株溶磷菌株中,D/d值均在2.20以上。在对筛选菌株的溶磷能力作进一步的检测时发现,在PKO固体平板上D/d值最大的菌株,在PKO液体培养基中溶解无机磷的能力却不一定是最大。如菌株DR19的D/d值最大,达2.55,但在液体培养基振荡培养条件下测得的有效磷增量为165.44 μg/mL,而菌株DR13的D/d值为2.29,在液体PKO培养基中的有效磷增量却高达179.70 μg/mL。说明菌株的D/d值与在液体培养条件下的溶磷能力不呈绝对的正相关关系,这可能是由两种培养过程和培养方式有所不同而导致的。因为在PKO平板培养中,透明圈是通过菌株自身分泌的有机酸经渗透扩散于菌落周围形成的,而在液体培养基中菌株可溶解多种形态的磷,所以通过D/d值筛选出的溶磷菌株必须经由液体培养法来进一步判断其真实溶磷能力。
很多PGPR都能通过自身代谢产生吲哚乙酸、赤霉素等之类的植物激素,进而有效调节植物的生命活动,促进植物的生长发育[24]。在本研究筛选出的溶磷菌株中,都有不同水平的IAA及有机酸的分泌能力。植物激素的分泌水平与菌株的促生效果之间的直接关系是被众多研究所证实了的,而有机酸的分泌量与溶磷菌株的溶磷量之间的相关性存在着不同结论的报道,有机酸分泌与菌株溶磷能力的相互关系尚待进一步深入研究。在本研究筛选出的溶磷菌株中,DR19、DR13、DR24、DR4四个菌株除具有较强的溶解无机磷的能力外,还具有较高的分泌IAA和有机酸的能力,因而被挑选出作为优良溶磷菌株,连同对大豆试管苗具有较好促生效果的根瘤菌D2和D4一起,用于进行大豆和百脉根的盆栽促生效应试验。
促生效应试验中,除单一根瘤菌剂处理对增加大豆株高无效果外,单一根瘤菌剂、单一溶磷菌剂、根瘤+溶磷复合菌剂3个处理与对照相比,对增加大豆的茎粗、生物量、单株荚数、荚重、单株粒数、单粒重,以及对提升百脉根的株高、地上生物量、全氮、全磷和粗蛋白含量,都有不同程度的促进作用。综合而言,在对大豆和百脉根的促生作用、在对百脉根全氮全磷含量的促进吸收增幅上,都是以溶磷+固氮复合菌剂处理的促进效果最好,说明本研究所挑选的根瘤菌与溶磷菌2类促生菌具有“1+1>2”的良好互作效应。这种不同菌株组合的加成效应与马文彬等[26]对箭舌豌豆的生长影响研究和韩华雯等[27]对紫花苜蓿产量和品质的影响研究结果是一致的。当然,根瘤菌与溶磷菌,以及同一类菌的不同菌株之间,存在着互作与拮抗两种不同的关系。只有深入研究PGPR的作用机理,筛选具有叠加促进效应的菌株组合,研发高效型复合菌剂,才能充分发挥PGPR的促生增质效果,这也是微生物菌肥的一个研究发展方向[28]。
植物根际促生菌剂的研制与应用已成为现代农业发展过程中不可缺少的组成部分。然而在PGPR接种剂中,根瘤菌接种剂的推广应用普遍存在着接种效果不稳定的问题,因为豆科植物能否结瘤固氮存在着复杂的共生匹配机理,它是根瘤菌本身的遗传特性、寄主基因以及生态环境等诸多因素相互作用的结果。在一个地区效果显著的接种剂,引进到另一个地区后效果可能会明显下降,根瘤菌接种剂效率的发挥存在着区域适用性[10]。豆科植物根瘤菌接种剂的筛选和应用必须考虑菌株对当地环境的适应能力,而从地方豆科植物根瘤中搜集分离优良菌种则是最有效的方法[29]。本研究从地方大豆根瘤中分离筛选高效根瘤菌株,目的就是为了寻找能在本地与豆科作物种类匹配、固氮能力好、竞争结瘤能力强的根瘤菌株。另一方面,已有研究表明,在与大豆或豌豆的共生体系中,溶磷芽孢杆菌和根瘤菌之间的合作能够促进植物的生长发育,刺激根瘤菌的种群数量和结瘤[28];土壤中的有效磷能促进大豆根瘤菌对氮的固定和氨的转化,并有利于根瘤的发育,进而有效增加植株的株高、生物量和产量,提高大豆籽粒的氮素含量[30]。因此,同时接种溶磷菌,不但能有效溶解土壤中的无机磷,促进根系对磷素的吸收,还能增加植株的根瘤数量与共生固氮效率。本研究中根瘤+溶磷复合菌剂对大豆和百脉根的最佳促生增质效果也验证了溶磷菌与根瘤菌的这一优势组合效应。
在植物根际促生菌中,大豆根瘤菌的研究报道已有很多,但对大豆根际溶磷菌的报道却相对较少。本研究从大豆根际分离筛选出的溶磷菌,除对大豆具有促生效果外,对百脉根也有促生增质效应。本研究对大豆根瘤菌和根际溶磷菌的分离筛选及其不同组合菌液对大豆和百脉根的促生影响进行了较为系统的前期试验,下一步除对筛选出的优良菌株作出分子生物学鉴定外,还将进行不同菌株组合对其他豆科牧草的促生抗逆效果研究,以期为促进地方草地生态畜牧业的健康发展提供技术支持。
References:
[1] Li H Z, Pan M. Research progress of plant growth-promoting rhizobacteria in soil. Guangzhou Chemical Industry, 2014, 42(10): 52-54. 李海宗, 潘梅. 土壤中植物根际促生菌研究进展. 广州化工, 2014, 42(10): 52-54.
[2] Jiang W, Guan X Q, Yu J Z. Biological nitrogen fixation and intensive grassland livestock husbandry. Acta Prataculturae Sinica, 2003, 12(6): 42-46. 姜薇, 关秀清, 于井朝. 生物固氮在集约化草地畜牧业中的作用. 草业学报, 2003, 12(6): 42-46.
[3] Liu X X, Lu R X, Wang X L,etal. Selection, identification and growth promotion of inorganic phosphorus-dissolving bacterial strains in rhizosphere ofTrifoliumrepens. Agricultural Science and Technology, 2012, 13(10): 2058-2064.
[4] Gyaneshwar P, Naresh K G, Parekh L J,etal. Role of soil microorganisms in improving P nutrition of plants. Plant and Soil, 2002, 245: 83-93.
[5] Hamdali H, Ouhdouch Y. Rock phosphate-solubilizing actinomycetes screening for plant growth-promoting activities. World Journal of Microbiology and Biotechnology, 2008, 24: 2565-2575.
[6] Babana A H, Antoun H. Biological system for improving the availability of Tilemsi phosphate rock for wheat (TriticumaestivumL.) cultivated in Mali. Nutrient Cycling in Agroecosystems, 2005, 72: 147-157.
[7] Feng R Z, Feng Y H, Yao T,etal. The screening of phosphobacteria and solubilizing phosphate ability in the rhizosphere of alfalfa and wheat. Journal of Gansu Agricultural University, 2005, 40(5): 604-608. 冯瑞章, 冯月红, 姚拓, 等. 春小麦和苜蓿根际溶磷菌筛选及其溶磷能力测定. 甘肃农业大学学报, 2005, 40(5): 604-608.
[8] Huang P F, Liu J A, Jin A X,etal. Isolation and screening, identification of phosphorus-solubilizing bacteria in rhizosphere soil ofPinusmassonuanaand its phosphate-degradation capacity. Chinese Agricultural Science Bulletin, 2012, 28(19): 12-16. 黄鹏飞, 刘君昂, 靳爱仙, 等. 马尾松根际土壤溶磷菌分离筛选、鉴定及其溶磷效果研究. 中国农学通报, 2012, 28(19): 12-16.
[9] Li F X, Zhang D G, Yao T. Study on cultural conditions of plant growth promoting rhizobacteria in rhizosphere of oat in alpine region. Journal of Gansu Agricultural University, 2004, 39(3): 316-320. 李凤霞, 张德罡, 姚拓. 高寒地区燕麦根际高效PGPR菌培养条件研究. 甘肃农业大学学报, 2004, 39(3): 316-320.
[10] Grönemeyer J L, Kulkarni A, Berkelmann D,etal. Identification and characterization of rhizobia indigenous to the Okavango region in Sub-Saharan Africa. Applied and Environmental Microbiology, 2014, 44(3): 174-178.
[11] Zhang Y, Zhu Y, Yao T,etal. Interactions of four PGPRs isolated from pasture rhizosphere. Acta Prataculturae Sinica, 2013, 22(1): 29-37. 张英, 朱颖, 姚拓, 等. 分离自牧草根际四株促生菌株(PGPR)互作效应研究. 草业学报, 2013, 22(1): 29-37.
[12] Zhu Y, Yao T, Li Y E,etal. Screening of phosphate-solubilizing bacteria and their acting mechanisms in the rhizosphere of red clover. Acta Agrestia Sinica, 2009, 17(2): 259-263. 朱颖, 姚拓, 李玉娥, 等. 红三叶根际溶磷菌分离及其溶磷机制初探. 草地学报, 2009, 17(2): 259-263.
[13] Hariprased P, Niranjana S R. Isolation and characterization of phosphate-dissoloving rhizobacteria to improve plant health of tomato. Plant and Soil, 2009, 316: 13-24.
[14] Shekhar Nautiyal C. An efficient microbiological growth medium for screening phosphate solubilizing microorganisms. Federation of European Microbiological Societies, 1999, 170: 265-270.
[15] Bai W J, Hu R R, Zhang J E,etal. A study on the isolation, screening and phosphate solubilizing capacity of phosphate solubilizing bacteria in the rhizosphere of corn. Journal of South China Agricultural University, 2013, 34(2): 167-176. 白文娟, 胡蓉蓉, 章家恩, 等. 玉米根际溶磷细菌的分离、筛选及溶磷能力研究. 华南农业大学学报, 2013, 34(2): 167-176.
[16] Li Y E, Yao T, Zhu Y,etal. Isolation and characteristics of phosphorus-solubilizing bacteria in rhizosphere of alfalfa and sainfoin in Lanzhou. Chinese Journal of Grassland, 2009, 1: 45-51. 李玉娥, 姚拓, 朱颖, 等. 兰州地区苜蓿和红豆草根际溶磷菌筛选及菌株部分特性研究. 中国草地学报, 2009, 1: 45-51.
[17] Zhang Y, Lu G X, Xie Y L,etal. The relationship between organic acid secreted from phosphorus-solubilizing bacteria and the phosphate-solubilizing ability. Acta Agrestia Sinica, 2015, 23(5): 1033-1038. 张英, 芦光新, 谢永丽, 等. 溶磷菌分泌有机酸与溶磷能力相关性研究. 草地学报, 2015, 23(5): 1033-1038.
[18] Zhang Y, Zhu Y, Yao T. Characteristics of phosphate dissolving and IAA secretion of phosphate-solubilizing bacteria isolated fromTrifolium. Grassland and Turf, 2012, 32(5): 36-40. 张英, 朱颖, 姚拓. 三叶草根际溶磷菌溶磷及分泌IAA能力测定. 草原与草坪, 2012, 32(5): 36-40.
[19] Fan X, Xiao Z M, Zhang W,etal. Comparison of Kjeldahl and Dumas combustion methods for the determination of crude protein in feedstuffs. Feed Industry, 2014, 35(24): 47-53. 樊霞, 肖志明, 张维, 等. 杜马斯燃烧法与凯氏定氮法测定植物源性饲料原料中粗蛋白质含量的比较. 饲料工业, 2014, 35(24): 47-53.
[20] Li H J. Comparative study on determination of phosphorus content in two kinds of plants. Modern Agricultural Science and Technology, 2012, 11: 16-17. 李会娟. 2种植物磷含量的检测方法比较研究. 现代农业科技, 2012, 11: 16-17.
[21] Li Q, Qiu M M. A rapid determination method of crude fat in grain. Modern Agricultural Science and Technology, 2008, 23: 189-190. 李茜, 邱敏敏. 粮食中粗脂肪的快速测定方法. 现代农业科技, 2008, 23: 189-190.
[22] Liu S C, Feng X, Yu J. Research progress of plant growth-promoting rhizobacteria and its environmental effects. Hubei Agricultural Sciences, 2009, 48(11): 2882-2887. 刘淑琮, 冯炘, 于洁. 植物根际促生菌的研究进展及其环境作用. 湖北农业科学, 2009, 48(11): 2882-2887.
[23] Yao T. Associative nitrogen-fixing bacteria in the rhizosphere ofAvenasativain an alpine region II-Phosphate-solubilizing power and auxin production. Acta Prataculturae Sinica, 2004, 13(3): 1-8. 姚拓. 高寒地区燕麦根际联合固氮菌研究II—固氮菌的溶磷性和分泌植物生长素特性测定. 草业学报, 2004, 13(3): 1-8.
[24] Hu J C, Xue D L, Ma C X,etal. Research advances in plant growth promoting rhizobacteria and its application prospect. Chinese Journal of Applied Ecology, 2004, 15(10): 1963-1966. 胡江春, 薛德林, 马成新, 等. 植物根际促生菌(PGPR)的研究与应用前景. 应用生态学报, 2004, 15(10): 1963-1966.
[25] Rong L Y, Yao T, Ma W B,etal. The inoculants potential of plant growth promoting rhizobacteria strains to improve the yield and quality ofTrifoliumpretensecv. Minshan. Acta Prataculturae Sinica, 2014, 23(5): 231-240. 荣良燕, 姚拓, 马文彬, 等. 岷山红三叶根际优良促生菌对其宿主生长和品质的影响. 草业学报, 2014, 23(5): 231-240.
[26] Ma W B, Yao T, Wang G J,etal. Assessment of rhizobacteria strains forViciasativa. Acta Prataculturae Sinica, 2014, 23(5): 241-248. 马文彬, 姚拓, 王国基, 等. 根际促生菌筛选及其接种剂对箭舌豌豆生长影响的研究. 草业学报, 2014, 23(5): 241-248.
[27] Han H W, Sun L N, Yao T,etal. Effects of bio-fertilizers with different PGPR strain combinations on yield and quality of alfalfa. Acta Prataculturae Sinica, 2013, 22(5): 104-112. 韩华雯, 孙丽娜, 姚拓, 等. 不同促生菌株组合对紫花苜蓿产量和品质的影响. 草业学报, 2013, 22(5): 104-112.
[28] Camacho M, Santamarfa C, Temprano F,etal. Co-inoculation withBacillussp. CECT 450 improves nodulation inPhaseolusvulgarisL. Canadian Journal of Microbiology, 2001, 47: 1058-1062.
[29] Bejarano A, Ramírez-Bahena M H, Velázquez E,etal. Vigna unguiculata is nodulated in Spain by endosymbionts ofGenisteaelegumesand by a new symbiovar (vignae) of the genus Bradyrhizobium. Systematic and Applied Microbiology, 2014, 37(7): 533-540.
[30] Xue X Y, Feng R H, Guan D W,etal. Screening and analysis for efficient co-inoculation system of soybean rhizobia and plant growth-promoting rhizobacteria. Soybean Science, 2011, 30(4): 613-620. 薛晓昀, 冯瑞华, 关大伟, 等. 大豆根瘤菌与促生菌复合系筛选及机理研究. 大豆科学, 2011, 30(4): 613-620.
Identification of soybean growth-promoting rhizobacteria and their effects on the growth and quality of Glycine max and Lotus corniculatus
ZENG Qing-Fei, WANG Qian, LU Rui-Xia, LIU Zheng-Shu, WU Jia-Hai, WANG Xiao-Li*
GuizhouInstituteofPrataculture,Guiyang550006,China
In order to screen combinations of rhizobacteria which have growth-promoting and quality-improving effects on local leguminous crops, phosphorus-solubilizing bacteria were isolated from soybean rhizospheric soils in the Bijie Region of Guizhou Province and rhizobium strains were isolated from soybean root nodules. Phosphorus-solubilizing strains with ratios of the diameter of the phosphorus-solubilizing halo to colony diameter of more than 2.20 were tested for their abilities of phosphorus-solubilizing, 3-indoleacetic acid (IAA)-secreting, organic acid and alkali production. Four superior phosphate-solubilizing strains were selected. For the isolated rhizobium strains, two highly efficient strains were screened out by means of back-inoculation and growth-promoting effect tests on soybean tube seedlings. The six selected strains were tested for antagonistic reactions and three types of bacterial suspension were prepared: phosphate dissolving only, rhizobia only and a mix of the two. These were immediately inoculated intoGlycinemaxandLotuscorniculatusin pots to test their growth-promoting effects. The results showed that, compared to control, the rhizobia only inoculants had no effect on the plant height ofG.maxwhereas the other two treatments could significantly increase height. All three treatments had significant promoting effects onG.maxstem diameter, biomass, number of bean pods, weight of pods, seeds per pod and single seed weight. Among the three treatments, the mix of phosphate dissolving and rhizobia inoculants showed the best growth effects on soybean seedling plant height, stem diameter, aboveground biomass and underground biomass (respectively 21.26%, 40.79%, 15.88% and 42.19% higher than control). With regard toL.corniculatus, all three treatments could improve first and second harvest plant height, aboveground biomass, total nitrogen content, total phosphorus content and crude protein content. Again, the effects of the mixed treatment of phosphate dissolving with rhizobia inoculants were the highest (respectively 20.82%, 54.88%, 106.14%, 148.78%, 19.34%, 61.88% and 19.34% higher than control). The results thus indicate that combining phosphate-solubilizing with rhizobium bacteria strains produces a favourable interaction effect.
phosphorus-solubilizing bacteria in the rhizosphere of soybean; soybean rhizobia; isolation and screening;GlycinemaxandLotuscorniculatus; growth-promoting effect
10.11686/cyxb2016063
http://cyxb.lzu.edu.cn
2016-03-02;改回日期:2016-04-12
国家自然科学基金项目(31560035)和贵州省科技支撑计划项目(黔科合NY字[2016]3004)资助。
曾庆飞(1969-),男,贵州德江人,副研究员,博士。E-mail:zengqingfei2008@163.com*通信作者Corresponding author. E-mail:wangxiaolizhenyuan@126.com
曾庆飞, 王茜, 陆瑞霞, 刘正书, 吴佳海, 王小利. 大豆根际促生菌的分离筛选及其对大豆和百脉根生长与品质的影响. 草业学报, 2017, 26(1): 99-111.
ZENG Qing-Fei, WANG Qian, LU Rui-Xia, LIU Zheng-Shu, WU Jia-Hai, WANG Xiao-Li. Identification of soybean growth-promoting rhizobacteria and their effects on the growth and quality ofGlycinemaxandLotuscorniculatus. Acta Prataculturae Sinica, 2017, 26(1): 99-111.

