c-Myc调控PIK3R3抑制黑色素瘤B16-F10细胞的迁移和侵袭①
杨镓宁 邓 菲 潘 宁
(四川省医学科学院,四川省人民医院皮肤外科,成都610072)
c-Myc调控PIK3R3抑制黑色素瘤B16-F10细胞的迁移和侵袭①
杨镓宁 邓 菲②潘 宁
(四川省医学科学院,四川省人民医院皮肤外科,成都610072)
目的:探讨c-Myc调控PIK3R3对黑色素瘤B16-F10细胞的迁移和侵袭的影响。方法:运用免疫组化检测PIK3R3在正常皮肤组织和黑色素瘤组织的表达;检测慢病毒(LV3-c-Myc和LV3-PIK3R3)对c-Myc和PIK3R3基因的沉默效率;使用EdU增殖实验检测沉默c-Myc和PIK3R3后黑色素瘤细胞株B16-F10的增殖情况;Transwell侵袭实验检测c-Myc和PIK3R3的表达对黑色素瘤细胞B16-F10的侵袭能力的影响;划痕实验检测c-Myc和PIK3R3的表达对黑色素瘤细胞B16-F10迁移能力的影响;qPCR检测沉默c-Myc和PIK3R3后miR-199a的表达;qPCR检测转染miR-199a mimics和miR-199a inhibitor后c-Myc和PIK3R3的表达;双荧光素酶报告基因系统检测miR-199a对c-Myc和PIK3R3转录活性的影响。结果:和正常皮肤组织比较,PIK3R3在黑色素瘤组织中表达明显增加;沉默c-Myc和PIK3R3基因后,黑色素瘤细胞株B16-F10的增殖、侵袭和转移能力明显降低;沉默c-Myc和PIK3R3基因后,miR-199a表达上调;转染miR-199a mimics后,c-Myc和PIK3R3表达降低;转染miR-199a inhibitor后,c-Myc和PIK3R3表达上调;双荧光素酶报告基因系统检测结果显示,miR-199a可以直接调控c-Myc和PIK3R3的转录活性。结论:c-Myc可以通过miR-199a调控PIK3R3的表达,从而促进黑色素瘤细胞的增殖、侵袭和迁移能力。
miR-199a;c-Myc;黑色素瘤;Western blot;Transwell;划痕实验;PIK3R3
黑色素瘤是高转移高侵袭性的一种恶性肿瘤,也称为恶性黑色素瘤(Malignant melanoma,MM),它是世界范围内男性中是第五大恶性肿瘤,女性中是第六大恶性肿瘤,通常发病在皮肤表面,约占皮肤肿瘤十分之一,一旦确诊后患者的死亡率高达80%以上,较难治愈,在发病人群中存在一定的家族聚集现象[1]。黑色素瘤容易出现早起转移,侵袭至其他组织器官,且在早期发病期间症状不明显,不易发现,早期诊断率较低,一旦确诊多属于晚期情况,诊断治疗的效果较差,这是导致黑色素瘤死亡率居高不下的主要原因[2]。因此,探讨黑色素瘤侵袭和转移机制可以在一定程度上提高黑色素瘤的早期诊断和治疗,有效减少肿瘤的发生和进展,进而降低黑色素瘤死亡率。
MicroRNA(miRNA) 是一类新的小分子非编码RNA,可以与基因的3′-UTR端的连接,从而影响靶基因mRNA的性能,对细胞的增殖、分化、侵袭、转移以及凋亡进行调控[3]。miRNA领域在黑色素瘤中涉及较少,只有少量报告对黑色素瘤的单一表达谱进行研究,比如在黑色素瘤中发现miR-221可结合的3-UTR′端,调控酪氨酸激酶信号通路中关键受体Ckit的转录和翻译,提示其参与黑色素瘤的发生发展过程[4]。miR-199a和miR-33的表达与黑色素瘤的高转移特性显著正相关,可能成为黑色素瘤转移中的关键miRNA[5]。
Myc基因是较早发现的癌基因,Myc基因家族包括c-Myc、N-Myc、L-Myc等,其中c-Myc定位于8号染色体上。c-Myc由不编码蛋白质的第1 外显子和编码蛋白质的第2、3外显子构成。c-Myc 基因编码c-Myc致癌蛋白,可以调控细胞增殖功能。c-Myc 是一个多功能的基因,可以调控细胞周期,细胞的生长代谢、细胞恶性转变等生物学功能[6,7]。正常细胞中的 c-Myc 原癌基因一旦被异常激活为癌基因,c-Myc mRNA 和 c-Myc蛋白的相关表达会异常增高,使细胞的生长增殖不受正常的调节限制,开始向恶性细胞特性转变,同时c-Myc的高水平表达还可以抑制细胞的正常分化,影响细胞的正常凋亡,进而诱导肿瘤的发生。Wang等[8]研究表明,c-Myc基因表达与脉络膜黑色素瘤的发生、发展密切相关。但是在皮肤黑色素瘤中c-Myc的表达水平和调控机制尚未有文献报道。
磷脂酰肌醇-3-激酶(PIK3R3)是信号通路中重要的信号因子,参与细胞增殖、生长、分化、细胞迁移和凋亡等多个生理过程,在多种肿瘤中存在广泛激活的现象[9]。PIK3CA基因在非小细胞肺癌、前列腺癌和肠癌等肿瘤中表达增高。经过活化后的PIK3R3可调控Akt、mTOR等家族成员等[10]。PIK3R3的异常表达会影响癌细胞的迁移侵袭等生物学功能[11]。因此,我们推测可能通过miR199a负性调控的c-Myc表达通过PI3K/AKT信号通路抑制黑色素瘤的侵袭转移等恶性生物学功能,并研究c-Myc在黑色素细胞中的作用及其机制。
1 材料与方法
1.1 材料 人皮肤黑色素瘤细胞株B16-F10购买自武汉大学中国典型培养物保藏中心。细胞培养条件:含10%胎牛血清的RPMI1640,37℃,5%CO2条件下培养。胎牛血清,RPMI1640培养基均购自Gibco公司。PIK3R3兔单克隆抗体均购自Abcam(ab186612)。Transwell小室购自美国Millipore公司,Matrigel购自美国BD公司。miR-199a mimics,miR-199a inhibitors,PIK3R3和c-Myc沉默及对照慢病毒购自上海吉凯制药技术有限公司。miR-199a、PIK3R3和c-Myc qPCR引物以及RNA提取试剂盒、逆转录试剂盒、PCR试剂盒均购自广州复能基因有限公司。
1.2 方法

1.2.2 qPCR 荧光定量PCR检测miR-214、PIK3R3和c-Myc的表达 用Trozel (Gibco) 抽提组织总RNA,逆转录,PCR扩增miR-199a、PIK3R3和c-Myc,PIK3R3和c-Myc用GAPDH作为内参物,miR-199a使用U6作为内参。反应条件:以100 ng总RNA为模版,逆转录cDNA,反应条件为:37℃ 15 min,95℃ 5 min。后根据PCR试剂盒说明书进行PCR反应。获得数据以RQ=2-ΔΔCT计算mRNA表达量。实验重复3次。
1.2.3 PIK3R3蛋白检测 配制10%SDS-PAGE,每孔加入30 μg蛋白样品。使用湿转法电转至PVDF膜,5%脱脂奶粉封闭2 h,1∶1 000 TBST稀释一抗(山羊抗人PIK3R3多克隆抗体),4℃过夜;加入辣根过氧化酶物标记兔抗羊IgG(1∶5 000)稀释,室温孵育2 h;ECL发光。实验重复3次。
1.2.4 Transwell侵袭实验检测黑色素瘤细胞迁移能力 所有试剂及器材均于冰上预冷,将Transwell小室置于24孔板内,将Transwell小室内膜均匀涂抹Matrigel胶 50 μl (0.2 μg/μl),37孵育15 min,使胶凝固;消化、离心、计数细胞后,按照2.5×104ml-1用无血清培养基稀释细胞,制成细胞悬液;按照每孔200 μl,将细胞悬液加入Transwell上室,同时在Transwell下室加入10%FBS+培养基600 μl,放入37℃孵箱培养;甲醛固定,结晶紫染色10 min,然后用棉签轻轻擦拭内膜上的细胞。显微镜下技术,计数4个高倍视野(×40)下穿过滤膜的细胞数。实验重复3次。
1.2.5 划痕实验检测黑色素瘤细胞迁移能力 划痕实验:将B16-F10细胞接种于6孔板,待细胞融合度生长在90%时,用200 μl消毒枪头从上而下划线,并在显微镜下观察,测量划痕的初始距离(0 h);在24 h后,测量划痕的距离,并拍照,计算细胞的迁移率。实验重复3次。

2 结果
2.1 PIK3R3在黑色素瘤组织中表达增加 黑色素瘤及癌旁组织免疫组化结果显示,PIK3R3定位在细胞核中,胞浆和胞质中较少。PIK3R3在黑色素瘤癌组织中呈强阳性表达,在癌旁组织中呈弱阳性表达(图1)。黑色素瘤组织中PIK3R3的表达明显高于癌旁组织,差异具有统计学意义(P<0.05,图1)。
2.2 c-Myc在不同黑色素瘤细胞株中的表达 Western blot实验结果显示: 相比WM451、 A375、SK-MEL-1、B16-BL6细胞株,c-Myc蛋白在B16-F10细胞株中表达最高,所以后续实验我们选取B10-F10作为实验细胞株,见图2。

图1 免疫组化检测PIK3R3在黑色素瘤组织和癌旁组织的表达情况(×40)Fig.1 Expression of PIK3R3 in Melanoma was detected using immunohistochemical staining(×40)Note: *.P<0.05.
2.3 c-Myc通过miR-199a调控 PIK3R3的表达 我们通过生物信息学进行预测(Targetscan)、c-Myc和 PIK3R3互为内源竞争性RNA。c-Myc和PIK3R3可能通过miR-199a进行相互调控。本研究发现,与对照组(LV3-NC)比较,黑色素瘤细胞株B16-F10感染慢病毒LV3-c-Myc后,PIK3R3的蛋白水平和 mRNA水平明显降低(图3A,P<0.05)。
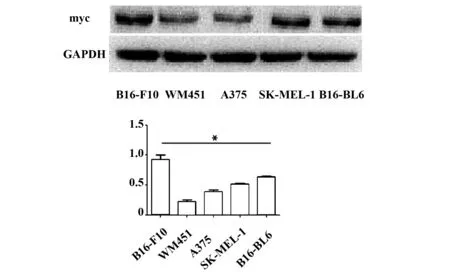
图2 c-Myc在不同黑色素瘤细胞株中的表达Fig.2 Expression of c-Myc in different melanoma cell linesNote: *.P<0.05.

图3 c-Myc通过miR-199a调控 PIK3R3的表达Fig.3 c-Myc regulated PIK3R3 through miR-199aNote: *.P<0.05.A.The level of PIK3R3 mRNA decreased after silencing c-Myc;B.PIK3R3 protein level decreased after silencing c-Myc;C.c-Myc mRNA level decreased after silencing PIK3R3;D.mRNA level of miR-199a after increased silencing PIK3R3 and c-Myc.Error bars represent standard error.
同时我们发现,和对照组(LV3-NC)比较,黑色素瘤细胞株B16-F10感染慢病毒LV3-PIK3R3后,c-Myc的mRNA水平明显下调(图3B,P<0.05)。我们的结果提示,c-Myc和 PIK3R3可以相互调控。我们进一步研究发现,分别沉默c-Myc和PIK3R3后,miR-199a表达升高(图3C,P<0.05),这提示miR-199a是c-Myc和PIK3R3相互调控的一个关键因子。
2.4 c-Myc和PIK3R3是miR-199a的直接靶点 为了进一步证实c-Myc和 PIK3R3互为内源竞争性RNA,运用B16-F10细胞,我们转染miR-199a mimics和miR-199a inhibitors。结果显示(图3),和对照组比较,转染miR-199a mimics后,c-Myc和 PIK3R3表达降低;转染miR-199a inhibitors后,c-Myc和 PIK3R3表达上调。同时双荧光素酶报告系统检测发现,c-Myc和PIK3R3是miR-199a的直接靶点。结果提示,c-Myc和PIK3R3是miR-199a的直接靶点,c-Myc和PIK3R3可能通过miR-199a相互调控。见图4。
2.5 沉默c-Myc和PIK3R3后,黑色素瘤细胞B16-F10侵袭能力降低 细胞侵袭穿过Matrigel基质胶的能力可以反映细胞的侵袭能力。Transwell实验结果表明:感染LV3-c-Myc或者LV3-PIK3R3后,黑色素瘤细胞B16-F10通过Matrigel基质胶的细胞数量分别为(45.54±6.76)和 (50.65±4.63)明显少于感染LV3-NC的B16-F10细胞 (310.90±21.86),差异有统计学意义(P<0.05)。我们的结果说明,沉默c-Myc和PIK3R3可以抑制黑色素瘤细胞B16-F10的侵袭能力,见图5。
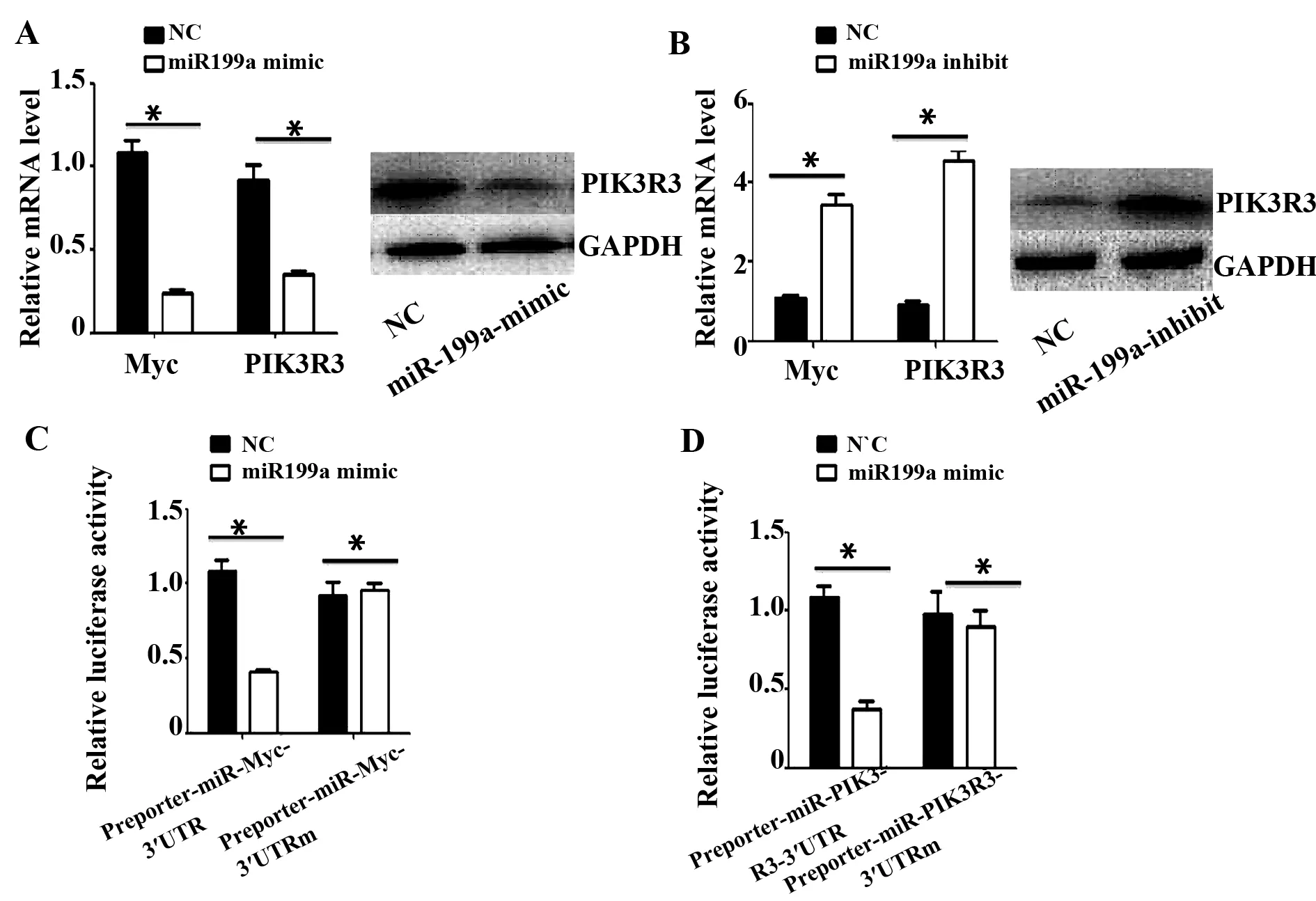
图4 c-Myc和PIK3R3是miR-199a的直接靶点Fig.4 c-Myc and PIK3R3 are direct target of miR-199aNote: *.P<0.05.A.c-Myc and PIK3R3 were down-regulated after transfection with miR-199a mimics;B.c-Myc and PIK3R3 were up-regulated after miR-199a inhibitors transfection;C,D.c-Myc and PIK3R3 are direct targets of miR-199a.Error bars represent standard error.
2.6 沉默c-Myc和PIK3R3后,黑色素瘤细胞B16-F10迁移能力降低 在显微镜下测量24 h后,各组细胞任意三个部位的划痕的宽度,迁移率=[D(t=24 h)-D(t=0 h)]/D(t=0 h)。划痕实验结果表明:与LV3-NC转染细胞组比较,在24 h时,LV3-c-Myc或LV3-PIK3R3感染细胞组迁移率明显降低 [ (0.79±

图5 Transwell侵袭实验检测沉默c-Myc和PIK3R3对黑色素瘤细胞B16-F10侵袭能力的影响Fig.5 Effect on invasion ability of B16-F10 after silencing c-Myc and PIK3R3 cells were detected by Transwell matrigel invasion assaysNote: *.P< 0.05.Error bars represent standard error.

图6 划痕实验检测沉默c-Myc和PIK3R3对黑色素瘤细胞B16-F10转移能力的影响Fig.6 Effect on migration ability of B16-F10 cells after silencing c-Myc or PIK3R3 were detected by wound healing assaysNote: *.P< 0.05.Error bars represent standard error.

图7 沉默c-Myc的表达可以抑制黑色素瘤细胞的体内成瘤能力Fig.7 Ability in vivo tumorigenicity of B16-F10 cells after silencing c-Myc were detected in nude miceNote: Error bars represent standard error.*.P< 0.05.
0.04)% vs (0.42±0.02)%,P<0.05;(0.79±0.04)% vs (0.32±0.04)%,P<0.05],差异有统计学意义。表明沉默c-Myc和PIK3R3后,黑色素瘤细胞B16-F10迁移能力降低,见图6。
2.7 沉默c-Myc后,黑色素瘤细胞成瘤能力减弱 裸鼠体内成瘤可以检测肿瘤细胞在体内的生物活性和增值侵袭能力。裸鼠体内成瘤实验表明,沉默c-Myc的黑色素瘤细胞在裸鼠体内成瘤情况明显与对照组相比要慢,4周后肿瘤体积与对照组相比要小[(1.68±0.08)cm3vs (0.37±0.12)cm3,P<0.05],4周后肿瘤质量与对照组相比要轻[(1.45±0.11) g vs (0.32±0.06) g,P<0.05]。差异有统计学意义。说明沉默c-Myc后黑色素瘤B16-F10细胞的裸鼠体内成瘤能力受到的抑制,见图7。
3 讨论
皮肤黑色素瘤起源于神经棘来源的黑色素细胞的恶性肿瘤,其恶性程度极高。黑色素细胞在各种体内外致癌因素的影响下,早期就可以出现远处转移,容易导致转移部位异常增生,除了细胞异常增生,细胞凋亡也出现不可调控的状态,黑色素瘤的临床诊断和治疗都有很大的滞后性。探索黑色素瘤的发生、发展的生物学机制,并探讨黑色素瘤发生和进展的分子生物学机制,可以为黑色素瘤的诊治提供新的重要途径[12]。
在多种肿瘤中都可以发现c-Myc 的异常活化的现象。在小鼠的肝脏模型中过表达c-Myc 可诱发小鼠肝脏肿瘤的形成[13],在临床患者肝癌样品组织中也能观察到c-Myc 组织学表达的异常增高[14]。通过针对肝癌基因芯片的生物学表达及功能分析发现,c-Myc基因在肝癌的发生发展过程中发挥重要作用[15]。Baroudi等[16]研究表明,在细胞中c-Myc的异常激活可以导致miRNA功能被抑制,从而促进恶性肿瘤的发生,该结果提示,c-Myc所介导的基因表达沉默可能会引起肿瘤中miRNA水平广泛下调。我们实验旨在验证c-Myc介导的基因沉默在黑色素瘤发生发展中所起到的作用及其可能的生物学机制。
目前关于miRNA的研究包括生物信息学预测以及生物芯片筛选,但两者都需要通过后续试验验证[17,18]。由于miRNA的作用机制非常复杂,比如:调控蛋白的稳定性或者定位[19]和DNA以及RNA之间相互作用调控基因表达[20,21]、形成mRNA调控基因的表达[22]、调控mRNA前体的拼接、作为内源性竞争性RNA发挥调控作用等。本研究通过生物信息学分析我们的研究证实,c-Myc通过miR-199a调控PIK3R3的表达,影响黑色素瘤B16-F10的迁移和侵袭,从而促进黑色素瘤的发生和发展。
磷脂酰肌醇-3-激酶(PIK3R3)是细胞内脂质底物的转换器。可以被酪氨酸激酶激活,进而产生第二信使(cAMP,cGMP)参与多条信号通路,调控细胞的增殖和侵袭。Huang等[23]研究表明PIK3R3在结肠癌中,可以促进其生长和转移,抑癌因子miR-152可以直接靶向PIK3R3抑制结肠癌的恶性生物学行为。有研究发现,PIK3R3可以诱导EMT从而促进结肠癌的转移能力[24]。在黑色素瘤当中,miR-221可以通过靶向PIK3R3抑制黑色素瘤细胞的增殖、侵袭和转移能力[25]。本研究中,我们发现PIK3R3在黑色素瘤组织中表达增加,同时沉默PIK3R3后,黑色素瘤B16-F10细胞转移和侵袭能力降低,这和前面其他研究报告结果相一致。
周建大等[26]研究发现,在黑色素瘤中,miR-199a可以通过靶向调控Let-7b,抑制黑色素瘤细胞的侵袭转移。另一项研究表明,奈铂达通过促进miR-199a表达抑制黑色素瘤细胞B16-F10的增殖和侵袭[27]。在黑色素瘤细胞B16-F10中,过表达miR-199a后,癌细胞明显被抑制。这说明miR-199a参与了黑色素瘤的发生和进展。我们的研究发现,miR-199a可以直接靶向调控c-Myc和PIK3R3。这说明Myc和PIK3R3可能是促进肿瘤的作用,并且也间接说明c-Myc和PIK3R3之间的相互调控是通过miR-199a来实现的。
在本研究中,我们发现在黑色素瘤细胞B16-F10中,c-Myc的沉默会通过调控PI3K/AKT信号通路中PIK3R3蛋白来相应下调促癌miR199a分子的表达,并且发现促癌miR-199a与PIK3R3复合物之间有一种相互抑制的关系,从而可以形成一个双负反馈环路。在黑色素瘤发生的过程中,该环路的失衡会导致miR-199a的进一步过表达以及下游信号通路的异常活化。本研究结果不但丰富了miRNA表观沉默机制的内容,而且还为以c-Myc和PIK3R3为分子靶标的黑色素瘤癌治疗新策略提供了新的理论依据。
[1] 徐 毅,周建大,罗成群,等.中国汉族人黑色素瘤家系临床特点分析[J].激光生物学报,2007,16(6):792-794.
[2] Rigel DS,Russak J,Friedman R.The evolution of melanoma diagnosis:25 years beyond the ABCDs[J].CA,2010,60(5):301-316.
[3] Molnár A,Schwach F,Studholme DJ,etal.miRNAs control gene expression in the single-cell alga Chlamydomonas reinhardtii[J].Nature,2007,447(7148):1126-1129.
[4] Igoucheva O,Alexeev V.MicroRNA-dependent regulation of cKit in cutaneous melanoma[J].Biochemical Biophysical Res Communica,2009,379(3):790-794.
[5] 周建大,谭建湘,谢慧清,等.原发性皮肤黑色素瘤的 microRNA 基因芯片研究[J].中国医师杂志,2010,12(3):405-406.
[6] Boxer LM,Dang CV.Translocations involving c-Myc and c-Myc function[J].Oncogene,2001,20(40):5595-5610.
[7] Hoffman B,Amanullah A,Shafarenko M,etal.The proto-oncogene c-Myc in hematopoietic development and leukemogenesis[J].Oncogene,2002,21(21):3414-3421.
[8] Wang MX,Shields JA,Donoso LA.Subclinical metastasis of uveal melanoma[J].Int Ophthalmol Clin,1993,33(3):119-127.
[9] Carvalho S,Schmitt F.Potential role of PI3K inhibitors in the treatment of breast cancer[J].Future Oncol,2010,6(8):1251-1263.
[10] Tokunaga E,Oki E,Egashira A,etal.Deregulation of the Akt pathway in human cancer[J].Current Cancer Drug Targets,2008,8(1):27-36.
[11] López-Knowles E,O′Toole SA,McNeil CM,etal.PI3K pathway activation in breast cancer is associated with the basal-like phenotype and cancer-specific mortality[J].Int J Cancer,2010,126(5):1121-1131.
[12] Wang Y,He H,Chang J,etal.Mueller matrix microscope:a quantitative tool to facilitate detections and fibrosis scorings of liver cirrhosis and cancer tissues[J].J Biomedical Optics,2016,21(7):71112.
[13] Shachaf CM,Kopelman AM,Arvanitis C,etal.MYC inactivation uncovers pluripotent differentiation and tumour dormancy in hepatocellular cancer[J].Nature,2004,431(7012):1112-1117.
[14] Beer S,Komatsubara K,Bellovin DI,etal.Hepatotoxin-induced changes in the adult murine liver promote MYC-induced tumorigenesis[J].PLoS One,2008,3(6):e2493.
[15] Buendia MA,Bourre L,Cairo S.Myc target miRs and liver cancer:small molecules to get Myc sick[J].Gastroenterology,2012,142(2):214-218.
[16] El Baroudi M,Corà D,Bosia C,etal.A curated database of miRNA mediated feed-forward loops involving MYC as master regulator[J].PLoS One,2011,6(3):e14742.
[17] Zhou M,Wang X,Shi H,etal.Characterization of long non-coding RNA-associated ceRNA network to reveal potential prognostic lncRNA biomarkers in human ovarian cancer[J].Oncotarget,2016,7(11):12598-12611.
[18] Liu E,Liu Z,Zhou Y.Carboplatin-docetaxel-induced activity against ovarian cancer is depende on up-regated lncRNA PVT1[J].Int J Clin Experi Pathol,2015,8(4):3803.
[19] Tian T,Li C,Xiao J,etal.Quantitative assessment of the polymorphisms in the HOTAIR incRNA and cancer risk:a meta-analysis of 8 case-control studies[J].PLoS One,2016,11(3):e0152296.
[20] Zhou Q,Chen F,Fei Z,etal.Genetic variants of lncRNA HOTAIR contribute to the risk of osteosarcoma[J].Oncotarget,2016,7(15):19928-19934.
[21] Liu FT,Qiu C,Luo HL,etal.The association of HOTAIR expression with clinicopathological features and prognosis in gastric cancer patients[J].Panminerva Med,2016,58(2):167-174.
[22] Zhang L,Liu Z,Li X,etal.Low long non-coding RNA HOTAIR expression is associated with down-regulation of Nrf2 in the spermatozoa of patients with asthenozoospermia or oligoasthenozoospermia[J].Int J Clin Experi Pathol,2015,8(11):14198.
[23] Huang XF,Chen JZ.Obesity,the PI3K/Akt signal pathway and colon cancer[J].Obesity Rev,2014,10(6):610-616.
[24] Zou H,Li L,Carcedo IG,etal.Synergistic inhibition of colon cancer cell growth with nanoemulsion-loaded paclitaxel and PI3K/mTOR dual inhibitor BEZ235 through apoptosis[J].Int J Nanomed,2016,11:1947.
[25] 侯丽丽,程 冰,张旭东,等.TRAIL 诱导黑色素瘤细胞中 miRNA-221 的表达[J].安徽医科大学学报,2011,46(2):120-124.
[26] 周建大,谭建湘,谢慧清,等.Let-7b和miR-199a对B16F10细胞增殖生长的影响[J].中国医师杂志,2011,13(6):721-726.
[27] 李 娟,陆上苏,陆彬彬,等.重组人血管内皮抑素联合顺铂治疗鼠 B16 恶性黑色素瘤移植模型的实验研究[J].江苏医药,2008,34(5):506-508.
[收稿2016-08-15 修回2016-10-12]
(编辑 许四平)
c-Myc promoted migration and invasion of malignant melanoma B16-F10 cells through regulating PIK3R3
YANGJia-Ning,DENGFei,PANNing.
DepartmentofDermatologicalSurgery,SichuanAcademyofMedicalSciences&SichuanProvincialPeople′sHospital,Chengdu610072,China
Objective:To investigate the effect and the related mechanism of c-Myc on the proliferation,invasion and migration ability of malignant melanoma B16-F10 cells.Methods: We detected the expression of PIK3R3 in malignant melanoma and normal tissues.Efficiency of gene silencing of c-Myc and PIK3R3 was determined by qPCR and Western blot.We detected the proliferate ability of B16-F10 cells after silencing c-Myc and PIK3R3 using EdU assay.We detected the migration and invasion ability of B16-F10 cells after silencing c-Myc and PIK3R3 using wound healing assays and Transwell matrigel invasion assays.The expression of miR-199a after silencing c-Myc and PIK3R3 using qPCR.The expression of c-Myc and PIK3R3 was detected by qPCR after transfecting miR-199a mimics or miR-199a inhibitor.Dual-luciferase reporter assay system was used to detect miR-199a regulating c-Myc and PIK3R3.Results: Compared normal skin tissue,expression of PIK3R3 was significantly increased in malignant melanoma tissue;after silencing c-Myc and PIK3R3 gene,the proliferation,invasion and metastasis of melanoma cell line B16-F10 were significantly reduced;expression of miR-199a upregulated after silencing c-Myc and PIK3R3 genes,expression of c-Myc and PIK3R3 decreased after transfecting miR-199a mimics,expression of c-Myc and PIK3R3 upregulated after transfecting miR-199a inhibitor,dual luciferase reporter system test results revealed miR-199a can directly regulate c-Myc and PIK3R3 transcription activity.Conclusion: miR199a regulated the expression of c-Myc,then promote proliferation,migration and invasion in malignant melanoma cells.
miR-199a;c-Myc;Malignant melanoma;Western blot;Transwell;Wound healing assay;PIK3R3
10.3969/j.issn.1000-484X.2017.01.013
①本文为四川省卫计委科研课题(No.140084)。
杨镓宁(1981年-),男,硕士,主治医师,主要从事皮肤肿瘤的基础与临床研究,E-mail:13880602002@163.com。
R739.5
A
1000-484X(2017)01-0066-06
②四川省医学科学院,四川省人民医院肾脏内科,成都610072。