广东小鼠腺病毒血清学调查及病毒和抗体在人工感染小鼠体内消长规律研究
罗银珠,张 钰,潘金春,王 静,袁 文,何丽芳,吴瑞可, 黄碧洪,郭鹏举,黄 韧*
(1. 广东省实验动物监测所,广州 510663;2. 广东省实验动物重点实验室,广州 510663)
广东小鼠腺病毒血清学调查及病毒和抗体在人工感染小鼠体内消长规律研究
罗银珠1,2,张 钰1,2,潘金春1,2,王 静1,2,袁 文1,2,何丽芳1,2,吴瑞可1,2, 黄碧洪1,2,郭鹏举1,2,黄 韧1,2*
(1. 广东省实验动物监测所,广州 510663;2. 广东省实验动物重点实验室,广州 510663)
目的 了解我省小鼠腺病毒(Mad)自然感染情况及探究人工感染Mad小鼠体内各脏器组织中病毒分布规律及血清抗体变化。方法 采用ELISA方法对2007年和2015年饲养于普通环境小鼠血清及2013年~2015年广东省12家监督单位和32家委托单位SPF级小鼠血清进行病毒抗体检测。利用腹腔注射方法感染36只3周龄BALB/c小鼠,0.2 mL/只,浓度为4.5×106copies/μL,每天观察动物临床表现,并于攻毒前第0天和攻毒后第3、7、10、15、18、21、30、37、44、51、60天剖检小鼠(各3只),取组织标本(心、肝、脾、肺、肾、脑、胃、盲肠内容物)及血清,应用实时荧光定量PCR(QPCR)方法检测组织病毒核酸,ELISA方法检测血清抗体水平。结果 普通饲养小鼠抗体阳性率为24.44%~84.15%,其中以Mad-2型K87株血清型为主。SPF级小鼠Mad血清抗体阳性率均为0%。所有攻毒小鼠均呈隐性感染,无临床表现。攻毒后第3天及7天小鼠各组织病毒核酸检测阳性率均为100%(3/3),其中以脾脏100%阳性率维持时间最长(60 d)。除肝脏外,小鼠各组织病毒含量均在攻毒后7 d达到高峰,其中以脾脏病毒含量最高(5.5×105copies/μL),其次是心脏(3.4×105copies/μL)、盲肠内容物(2.6×105copies/μL)和胃(2.6×105copies/μL),脑为0.8×105copies/μL。攻毒后15 d可测出血清抗体,在37 d达到峰值,此后至60 d一直维持高水平。结论 SPF级小鼠Mad感染率低,普通环境饲养小鼠 Mad感染率高。人工感染小鼠脾脏病毒含量最高,阳性率维持时间最长,说明病毒可以在脾脏内长期复制,感染后第7天为组织病毒核酸最佳检测时间点。血清抗体在感染后15~60 d内均可以作为监测指标。
小鼠腺病毒;血清学;调查;人工感染;体内分布
小鼠腺病毒(mouse adenovirus,Mad)属于腺病毒科,哺乳动物腺病毒属,核酸线性双股DNA[1,2]。目前已报道有Mad-1型FL株(1960年Hartley等[3]分离)、Mad-2型K87株(1966年Kazuo Hashimaoto等[4,5]分离)和Mad-3型(2009年Boris Klempa等[6]分离)三个血清型。小鼠是Mad的自然宿主,Becker 等[9]2007年在英国地区捕获的野鼠血清流行病调查中检测出有较高Mad阳性率(68%),但在实验鼠自然感染率不高[1,7,8],隐性感染居多,被感染的小鼠可长期带毒和排毒并可增加感染其他病原微生物可能性,从而影响小鼠健康,干扰实验研究。国家实验动物微生物监测标准(GB14922.2-2011)将Mad列入需要排除的检测项目。为了解我省SPF级与普通级小鼠中Mad流行情况、病毒和抗体在人工感染小鼠体内消长规律,本实验对我省2013~2015年SPF级小鼠及2007年和2015年广州地区普通环境饲养小鼠进行Mad抗体检测,并利用Mad-1型FL株低浓度感染低日龄小鼠来模拟自然感染,观察感染鼠临床症状及抗原抗体消长情况,旨在为我省实验小鼠质量控制工作及Mad科学研究提供实验室参考。
1 材料和方法
1.1 小鼠血清、病毒和细胞株
2007年和2015年广州地区普通环境饲养小鼠血清及2013年~2015年广东省12家监督单位和32家委托单位提供的SPF级小鼠。
小鼠腺病毒FL株购自美国典型菌种保藏中心(ATCC VR-550),BHK-21细胞由本实验室保存。
1.2 实验动物
SPF级BALB/c小鼠,雄性,36只,3周龄,体重15~18 g,购自于广东省医学实验动物中心[SCXK(粤)2013-0002],饲养于广东省实验动物监测所二级生物安全感染实验室内[SYXK(粤)2012-0122],实行光照/黑暗各12 h昼夜循环,自由进食,动物实验开展经广东省实验动物监测所动物使用和管理委员会审批(I-IACUC2015003)。实验前,随机抽取部分动物血清经酶联免疫吸附试验(ELISA)检测确定为Mad抗体阴性。
1.3 主要试剂和仪器
荧光定量PCR仪为ABI 7500;酶标仪为Thermo MμLtiskan GO;DNA 抽提试剂盒购自 Omega 公司;ELISA抗体检测试剂盒购于EXPRESS BIO公司;DMEM培养液购自Gibco公司;DNA聚合酶购自大连宝生物公司;其余试剂均为进口或国产分析纯。
1.4 实验方法
1.4.1 QPCR引物合成
所用Mad引物参照参考文献[10]。引物由上海英潍捷基生物技术有限公司合成。
1.4.2 病毒滴度测定
将小鼠腺病毒接种BHK-21细胞,吸附作用1 h后加入含2%血清的维持液,放入37℃、5%CO2细胞培养箱中培养,倒置生物显微镜观察细胞形态,70%细胞产生细胞病变(CPE)后收获病毒液,反复冻融3次,离心取上清液作为感染病毒,并用QPCR对病毒拷贝数进行定量。
1.4.3 人工感染试验
取浓度约为4.5×106copies/μL的病毒液,腹腔注射病毒液每只0.2 mL。动物接种病毒后,观察60 d。每天观察动物的皮毛、外观、行为活动、饮食和精神状态。并在感染后第3、7、10、15、18、21、30、37、44、51、60天时,随机各取3只,麻醉后眼眶采血以制备血清置-20℃待测,随后脱颈椎安乐死并快速采集小鼠心脏、肝、脾、肺、肾、脑、胃、盲肠内容物置-20℃待测。
1.4.4 QPCR检测各组织抗原
称量适量组织,加入600 μL的PBS缓冲液于组织研磨机上研磨3~5 min,将组织匀浆。研磨后,10000 r/min离心10 min,取200 μL上清抽提核酸,具体步骤参照核酸提取试剂盒(TIANamp Genomic DNA Kit)说明书。最后应用ABI 7500 Real-Time PCR System,Taqman RT-PCR两步法试剂盒(Takara)即95℃ 30 s,95℃ 5 s,60℃ 30 s,进行40个循坏,荧光信号采集设于60℃,溶解曲线设置为:95℃ 5 s,65℃ 1 min,50℃ 30 s,进行荧光定量PCR检测鉴定。1.4.5 血清抗体检测(ELISA)
根据试剂盒说明进行操作:样本稀释及加样,将血清样本从1∶50稀释,再向ELISA 微孔板各加100 μL稀释好的样本;37℃孵育后洗板,每孔加100 μL酶标二抗,37℃孵育后洗板,加显色液;反应完毕,立即用酶标仪读数,测试波长为405 nm。
结果判定方法:样本(或对照)A值=特异孔A值-非特异孔A值;阳性对照A值≥0.600,阴性对照A值≤0.250,则试验成立;样本A值≥0.300判为阳性,样本A值<0.300判为阴性。
1.5 统计学方法
所有数据采用GraphPad Prism 5.01进行数据处理及分析。
2 结果
2.1 小鼠抗体阳性率
小鼠抗体检测结果,广州地区普通环境饲养小鼠Mad抗体检测阳性率较高(见表2),2015年比2007年高4倍,均以Mad-2 K87血清型流行为主。2013年~2015年广东省SPF级小鼠Mad阳性率为0%(见表3),说明SPF级小鼠Mad感染率低或无。
2.2 人工感染小鼠临床表现、血清及体内组织分布结果
2.2.1 临床观察结果
BALB/c感染Mad后直至实验结束(60 d),除感染初期动物出现轻微立毛,在精神状态、运动及饮食方面等均无明显异常,总体呈现隐性感染状态。

表1 Mad引物序列

表2 2007和2015年广州地区普通环境饲养小鼠Mad抗体阳性率(%)

表3 2013年~2015年广东省检测SPF级动物感染率比较
注:动物来源于广东省12家监督单位和32家委托单位SPF级小鼠。
Note.SPF mice from the 12 supervision companys and 32 units entrusted of Guangdong province.
2.2.2 组织病毒含量变化
感染后第3天及7天小鼠各组织病毒核酸检测阳性率均为100%(3/3),其中以脾脏100%阳性检测率维持时间最长(图1A)。感染后第7天病毒核酸在脾组织中含量最高,其次是心脏、盲肠和胃,最低是肺和肝(图1B)。小鼠体内各组织病毒含量均在人工感染后第7天达到高峰(肝在第3天),随后病毒核酸开始下降。(图1C、 图1D)。
2.2.3 血清抗体滴度变化
感染小鼠体内抗体滴度随着感染时间迁移而升高,接种后15 d可测出阳性抗体(阳性率为100%(3/3)),在37 d达到峰值,此后至60 d可一直维持高水平, 为便于计算,抗体滴度用Log2的指数表示(图2)。
3 讨论
腺病毒科已知分有5类包括哺乳动物腺病毒属(Mastadenovirus)、禽腺病毒属(Aviadenovirus)、鱼类腺病毒属(Ichtadenovirus)、唾液酸酶腺病毒属(Siadenovirus)、腺嘧啶富集性腺病毒属(Atadenovirus)等[11]。鼠腺病毒(Mad)属于哺乳腺病毒。中国Mad在啮齿类动物中血清流行病学情况,20世纪90年代中期1985~1987 (14个省市38个单位开放饲养和SPF小鼠),开放养小鼠阳性率为4%(24/623),屏障小鼠阳性率为 0%(0/178)[12],21世纪初 2003~2007年(21个省/市、47个单位送检39个品系小鼠)血清阳性率0.24%[13];近年2012~2013(10余个省市36家实验动物使用机构) Mad血清阳性率8.3%(27/325)[14],总体呈现高低高曲线。从我省小鼠血清流行性调查实验数据可以看出2013年~2015年间SPF级小鼠Mad感染率为0。说明Mad在实验用SPF鼠内流行率低,而对比之下,广州地区普通环境饲养的小鼠血清病毒抗体检测阳性率高,2015年达到80%以上,显示着该病毒在该鼠群中携带率高,并以Mad-2 K87血清型流行为主。以上结果反映了我省在实验鼠Mad病毒控制及质量控制方面达到较好的水平,而开放饲养环境下因饲养过程中有与携带病原野鼠接触的可能性导致Mad在普通级小鼠内流行。
实验小鼠自然感染临床虽然不多见,但可能会干扰实验研究,特别是涉及中枢神经系统、肾脏和肠胃系统[8,15]。本试验结果显示通过腹腔途径接种BALB/c小鼠后,感染小鼠无呈现明显的临床症状,感染后3 d Mad各组织呈现100%阳性检出率并以脾脏100%阳性检出率维持时间最长(60 d)。在血液系统,神经系统,消化系统等均检测出病毒核酸,此结果与1998年报告[8]将此归类为多系统性感染疾病结论一致。脑内检出病毒核酸,与研究[16,17]发现内皮细胞是其主要侵袭目标,可破坏小鼠血脑屏障的结果相吻合。病毒载量结果显示各组织载毒量在7 d最高,到15 d大部分组织病毒载量检测不到或没有,暗示该病毒致病力有限。心脏在本次实验中其最高组织病毒载量为3.4×105copies/μL(7 d),位同时段组织病毒载量第二(第一为脾脏),这与2015年关于Mad-1与心肌炎关系研究[18],报道[19-21]Mad感染成年C57小鼠内可引起脑脊髓炎出血性脑脊髓炎病症,小鼠心肌炎结果形成互相佐证。小鼠脾脏引起本实验的关注,其病毒含量明显高于其他组织,且在脾脏持续复制,核酸检测阳性维持时间最长,说明脾脏是病毒长期复制的器官。
本试验所感染小鼠大部分组织载毒量在7 d达到高峰然后逐渐下降至检测不到,相比之下Mad抗体水平在15 d即可以检测到抗体(阳性率为100%,n=3),抗体滴度在37 d达到峰值,此后至60 d一直维持高水平。提示感染早期(15 d前)以病原核酸检测为宜, 15 d后以抗体检测为主,并建议对小鼠群的监测每1~2个月进行一次,可及时了解小鼠群中Mad流行情况。在感染早期,盲肠内容物及胃都出现了高载毒量,证实该病毒可通过粪便途径传播和排毒,粪便、垫料是Mad的重要传播途径之一,必须严格执行动物房生物安全和卫生管理是预防与控制Mad的传播重要举措。

注:(A)100%核酸阳性率在各组织的维持时间;(B)0~18 d心、盲肠内容物、胃、脑、肾、肺、肝Mad病毒核酸含量变化图;(C)各组织感染第7天核酸含量差异;(D)0~60 d脾脏Mad病毒核酸含量变化图。图1 Mad病毒在感染小鼠各组织差异(n=3)Note.(A)100% antigen positive rate and difference tissues.(B)0~18 d Mad contents of heart, cecum contents, stomach, brain, kidney, lung, and liver.(C)Contents of Mad in difference tissues(7 d).(D)Content of Mad in spleen(0~60 d).Fig.1 Mad nucleic acids in difference tissues of infected mice
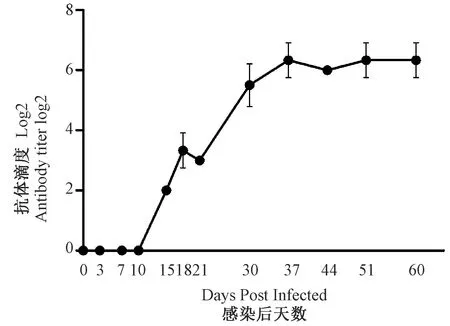
注:抗体滴度是能检出阳性结果的最大稀释倍数。图2 感染 BALB/c小鼠抗Mad血清抗体的测定(n=3)Note.Antibody titer is the biggest diluted multiples in checking out the positive sample.Fig.2 Determination of serum antibody against Mad of BALB/c mice infected
QPCR核酸检测法近年来广泛被用于微生物核酸检测,该检测方法具有快速、敏感、特异、通用、成本低及可定量等优点,对腺病毒感染的早期诊断及预防具有重要意义[22]。本研究利用QPCR法,从Mad感染小鼠不同时间的组织标本中检测到病毒并对病毒核酸含量进行准确定量检测,可以用来判断感染小鼠病毒的复制与所致疾病的病程的关系,为实验动物小鼠腺病毒的检测、流行病学监测、预防等提供重要的理论依据和技术支持。
[1] 田克恭. 实验动物病毒性疾病[M]. 北京:中国农业出版社,1992,41-45.
[2] Davison AJ, Benko M, Harrach B. Genetic content and evolution of adenoviruses[J]. J Gen Virol,2003,84:2895-2908.
[3] Hartley JW, Rowe WP. A new mouse virus apparently related to the ade-novirus group[J]. Virol , 1960,11: 645-647.
[4] Hashimoto K,Sugiyama T, Sasaki S. An Adenovirus Isolated from the Feces of Mice I. Isolation and identification[J]. Jpn J Microbiol, 1966,10(2):115-125.
[5] van der Veen J, Mes A.Serological classification of two mouse adenoviruses[J]. Arch Gesamte Virusforsorsch, 1974,45(4):386-387.
[6] Klempa B, Kruger DH, Auste B,etal. A novel cardiotropic murine adenovirus representing a distinct species of mastadenoviruses[J]. J Virol,2009,83(11):5749-59.
[7] 贺争鸣,范文平, 卫礼,等.小鼠腺病毒单克隆抗体的研制及初步应用[J].中国实验动物学报,1997,5(2):15-18.
[8] Baker DG.Natural Pathogens of Laboratory Mice, Rats, and Rabbits and Their Effects on Research [J]. Clin Microbiol Rev,1998, 11(2),231-266.
[9] Becker SD,Bennett M, Stewart JP,etal.Serological survey of virus infection among wild house mice(Mus domesticus) intheUK[J].Lab Anim,2007,41(2):229-238.
[10] Bootz F, Sieber I,Popovic D,etal. Comparison of the sensitivity of in vivo antibody production tests with in vitro PCR-based methods to detect infectious contamination of biological materials[J]. Lab Anim, 2003,37(4):341-51.
[11] AdamsAdams MJ.Virus Taxonomy:Adenoviridae-Family[M].Elsevier Inc, 2012,125-141
[12] 贺争鸣,吴惠英,卫礼,等.小鼠腺病毒在鼠群中心感染及血清学检测方法的比较[J].北京实验动物学,1988,5(2):16-20.
[13] 王吉,卫礼,巩薇,等. 2003-2007年我国实验小鼠病毒抗体检测结果与分析[J].实验动物与比较医学,2008,28(6):394-396
[14] 王翠娥,陈立超,周倩,等. 实验大鼠和小鼠多种病毒的血清学检测结果分析[J].实验动物科学,2014,31(2):20-24.
[15] Ginder DR. Increased susceptibility of mice infected with mouse adenoviruses to Escherichia coli-induced pyelonephritis[J]. J Exp Med,1964,120: 1117-1128.
[16] Charles PC, Guida JD,Brosnan CF,etal. Mouse adenovirus type-1 replication is restricted to vascular endothelium in the CNS of susceptible strains of mice[J]. Virol,1998,245(2):216-228.
[17] Gralinski LE,Ashley SL,Dixon SD,etal. Mouse adenovirus type 1-induced breakdown of the blood-brain barrier[J]. J Virol, 2009, 83(18), 93-98.
[18] McCarthy MK, Procario MC,Twisselmann N,etal. Proinflammatory effects of interferon gamma in mouse adenovirus 1 myocarditis[J]. J Virol, 2015 ,89(1):468-79.
[19] Guida JD, Fejer G,Pirofski LA,etal. Mouse adenovirus type 1 causes a fatal hemorrhagic encephalomyelitis in adult C57BL/6 but not BALB/c mice[J]. J Virol,1995, 69(12):7674-7681.
[20] Blailock ZR, Rabin ZR,Melnick JL.Adenovirus endocarditis in mice[J].Science,1967,157 (3784):69-70.
[21] Blailock ZR, Rabin ER, Melnick JL. Adenovirus myocarditis in mice. An electron microscopic study[J]. Exp Mol Pathol,1968,9(1):84-96.
[22] 姚新华,郭英飞.实时荧光定量 PCR快速检测腺病毒方法的建立与评价[J]. 解放军预防医学杂志,2015,33 (2):127-129.
Serological Survey of Mad Infection Among Mice in Guangdong and Distribution and Serological Studies in Artificial Infection
LUO Yin-zhu1,2, ZHANG Yu1,2,PAN Jin-chun1,2,WANG Jing, YUAN Wen1,2,HE Li-fang1,2, WU Rui-ke1,2, HUANG Bi-hong1,2, Guo Peng-ju1,2, HUANG Ren1,2*
(1. Guangdong Laboratory Animals Monitoring Institute, Guangzhou 510663, China; 2.Guangdong Provincial Key Laboratory of Laboratory Animals, Guangzhou 510663, China)
Objective To investigate the natural infection rate of Mouse Adenovirus(Mad)in Guangdong province and to estimate the tissue distribution and serology changes of Mad in infected mice. Methods Serums of mice from general environment of Guangzhou in 2007 and 2015, and the SPF mice from12 supervision and 32 entrusted units of Guangdong province among 2013~ 2015 were detected by ELISA.Thirty-six 3 weeks old BALB/c mice were each intraperitoneally inoculated with 0.2 mL of Mad in 4.5×106copies/μL concentration. The tissue samples, including heart, liver, spleen, lung, kidney, brain, stomach , cecum contents and serum were taken at 0 d before inoculation, and 3, 7, 10, 15, 18, 21, 30, 37, 44, 51, 60 d after inoculation (3 animals each time).Real-time fluorescent quantitative PCR (Q - PCR) method was used to detect the virus nucleic acid of tissue. In addition, the antibody against Mad was detected by ELISA.Results Antibody positive rate was 24.44%~84.15% and 0% among the general environment mice and the SPF mice, respectively, which is given priority to with Mad-2 K87 serotype strains. There were no clinical manifestations among all infected mice.The virus nucleic acid positive rate was 100% (3/3) in all tissue samples in 3 d and 7 d, which maintained a longest time to 60 d in spleen. Besides the liver, virus nucleic acid content were highest at 7 d in each tissue of infected mice, with spleen highest (5.5×105copies/μL), heart was second at 3.4×105copies/μL, cecum contents and stomach ranked third ( 2.6×105copies/μL), followed by brain (0.8×105copies/μL). The antibody could be successfully detected at 15 d after inoculated, hit the peak at 37 d and maintained a high level until 60 d.Conclusions Mad infection rate is low in SPF mice, high in general environment mice.Mad nucleic acid content is the highest and positive rate maintain the longest in spleen,suggesting that Mad mainly replicate in spleen. And 7 d is the best pot for nucleic acid testing.Serum neutralizing antibody can be used as a monitoring index within 15 ~ 60 d after infection.
Mouse adenovirus; Serology; Survey; Artificial infection; Distribution.
广东省科技计划项目(2014B070706006)。
罗银珠(1983-),女,硕士,兽医师,研究方向:实验动物病原学。E-mail: agluo122@sina.com
黄韧(1959-),男,博士,研究员。E-mail: labking@sohu.com
研究报告
【文献标识码】 A 【文章编号】1671-7856(2017) 01-0043-06
10.3969.j.issn.1671-7856.2017.01.009
2016-07-08

