基于离子液体辅助氯霉素分子印迹聚合物的制备及应用
王小玉,孙复钱,曾国屏,刘昕昕,喻继文,赖家平
(1.江西省科学院 应用化学研究所,江西 南昌 360102;2.华南师范大学 化学与环境学院,广东 广州 510006)
基于离子液体辅助氯霉素分子印迹聚合物的制备及应用
王小玉1*,孙复钱1,曾国屏1,刘昕昕1,喻继文1,赖家平2*
(1.江西省科学院 应用化学研究所,江西 南昌 360102;2.华南师范大学 化学与环境学院,广东 广州 510006)
以氯霉素(CAP)为模板,2-乙烯基吡啶(2-Vp)为功能单体,四氢呋喃和离子液体1-丁基-3-甲基咪唑四氟硼酸盐[BMIm]BF4的混合溶液为反应溶剂,乙二醇二甲基丙烯酸酯(EGDMA)为交联剂,偶氮二异丁腈(AIBN)为引发剂,合成了氯霉素的分子印迹及非印迹聚合物。优化功能单体、不同溶剂对印迹聚合物吸附性能的影响,结果表明,以2-乙烯基吡啶为功能单体,四氢呋喃和离子液体[BMIm]BF4(体积比1∶1)作为反应溶剂合成的分子印迹聚合物对氯霉素具有高的吸附容量,良好的特异性识别性能。氯霉素分子印迹聚合物的印迹因子为2.6,进行吸附-解吸附循环5次后,氯霉素印迹聚合物的性能稳定,可重复使用。将制备的氯霉素分子印迹聚合物作为富集材料,应用于鸡蛋样品中氯霉素的检测,回收率可达62.3%~81.1%,准确性好。
氯霉素;分子印迹聚合物;离子液体;鸡蛋样品;分离富集
氯霉素(Chloramphenicol,CAP,结构式见图1)是一种广谱性抗生素,在家禽的疾病预防与治疗以及养蜂业、水产养殖业等中得到了广泛的应用。然而长期使用可引起再生性障碍性贫血和其他恶性的血液病。动物性食品与水产品中的氯霉素残留对人体健康也构成了很大威胁。欧盟、美国等均在法规中规定CAP残留限量标准为“零容许量”[1],即不得检出。我国也禁止将氯霉素及其盐、酯用于食品及动物食料。因此建立高灵敏度、高选择性的动物源性食品氯霉素残留的检测方法是非常必要的。
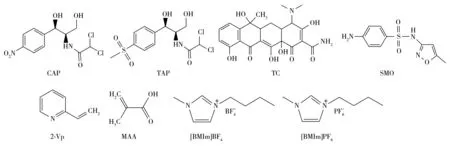
图1 氯霉素、甲砜霉素、四环素、磺胺甲唑、功能单体及离子液体的化学结构式Fig.1 Chemical structures of chloramphenicol, thiamphenicol, tetracycline, sulfamethoxazole,functional monomers and ionic liquids
目前氯霉素残留的分析方法主要有微生物法、酶联免疫分析法、气相色谱法(GC)、高效液相色谱法(HPLC)以及色谱-质谱联用法(LC-MS和GC-MS)等[2-7]。由于动物源性食品的基质成分复杂,干扰多,目标分析物含量极低,所以前处理方法对于样品分析来说十分关键。固相萃取(SPE)[7]是应用最广的样品前处理方法之一,但绝大多数固相萃取吸附剂缺乏选择性。分子印迹聚合物(Molecularly imprinted polymers,MIPs)是一类对特定物质具有特异性吸附的分离材料[9-10],在复杂基质样品前处理领域中得到广泛关注。已有文献将CAP的分子印迹聚合物用于电化学传感器、HPLC和SPE固定相的报道[10-12]。
室温离子液体(Room temperature ionic liquids,RTILs)是一类环境友好、无污染、低熔点和宽电化学窗口的新型溶剂,在电化学、化学反应及分离过程中得到了广泛的应用[13-14]。离子液体也被应用于分子印迹技术中,Wang等[15]采用室温离子液体1-乙基-3-甲基咪唑六氟磷酸盐([BMIm]PF6)为介质溶胶-凝胶技术制备了分子印迹整体柱,并将其应用于手性物质的分离。Sun等[16]以1-丁基-3-甲基咪唑四氟硼酸盐([BMIm]BF4)为致孔剂,采用原位聚合法制备了诺氟沙星印迹整体柱。He等[17]利用[BMIm]BF4作为溶剂和致孔剂,采用溶胶-凝胶及牺牲空间法制备了睾丸素的分子印迹聚合物。
本文以氯霉素(CAP)为模板,2-乙烯基吡啶(2-Vp)为功能单体,四氢呋喃和离子液体[BMIm]BF4的混合溶液为反应溶剂,乙二醇二甲基丙烯酸酯(EGDMA)为交联剂,偶氮二异丁腈(AIBN)为引发剂,合成了氯霉素的分子印迹聚合物。对合成聚合物的条件进行了优化,并研究了氯霉素印迹聚合物的吸附性能。该制备过程简单,印迹材料可多次重复利用,将其作为选择性吸附剂,可实现对鸡蛋样品中痕量氯霉素的富集和检测。
1 实验部分
1.1 试剂与仪器

L-550台式低速离心机(长沙市湘仪离心机有限公司),AVATAR 360傅立叶变换红外光谱仪(美国Nicolet公司),SS-550扫描电子显微镜、UV-2450型紫外/可见分光光度计、LC-20AT高效液相色谱(日本岛津公司)。氯霉素在C18-柱上的色谱测定条件:使用Shimadzu VP-ODS 型C18-色谱柱(5 μm,150 mm×4.6 mm);流动相:色谱纯乙腈-水(体积比40∶60,含0.1%乙酸);流速为1.0 mL/min;进样体积为20 μL;紫外检测器,检测波长为254 nm或275 nm。
1.2 氯霉素分子印迹聚合物的制备
称取氯霉素80.8 mg置于磨口玻璃瓶中,加入3 mL四氢呋喃或离子液体[BMIm]BF4或不同比例的四氢呋喃和[BMIm]BF4混合溶液作为溶剂,振荡使氯霉素溶解。然后向玻璃瓶中加入105 μL 2-乙烯基吡啶,用橡胶瓶盖塞紧,然后放至摇床上振荡30 min,加入943 μL乙二醇二甲基丙烯酸酯和引发剂偶氮二异丁腈10 mg,超声溶解混匀后,通氮气10 min,密封后放入60 ℃恒温水浴锅中,反应24 h。制备的聚合物先用甲醇洗涤3次,60 ℃下真空干燥。干燥后的聚合物研磨过筛,得到微米级颗粒。然后用洗脱液甲醇-乙酸(体积比9∶1)洗脱聚合物以提取模板分子,直至洗脱液在275 nm处无紫外吸收。用甲醇洗涤印迹聚合物3次以除去残留的乙酸,最后在60 ℃下真空干燥至恒重,即得干燥的印迹聚合物。非印迹聚合物的合成除不加入模板分子氯霉素外,其它步骤均与印迹聚合物的制备步骤相同。
1.3 氯霉素分子印迹聚合物吸附性能的研究
氯霉素分子印迹聚合物的动力学吸附性能实验:称取氯霉素分子印迹聚合物30 mg置于离心管中,每个离心管中加入6.0 mL浓度为10 mg·L-1的氯霉素的乙腈溶液,室温下振荡。每隔一段时间(5,10,15,……,60 min)后,取100 μL吸附后的上清液,然后利用高效液相色谱测定溶液中氯霉素的浓度,直至吸附后的溶液浓度值基本无变化为止。
氯霉素分子印迹聚合物及非印迹聚合物吸附实验:分别称取10 mg干燥的氯霉素分子印迹聚合物及相应的非印迹聚合物,置于10 mL离心管中,然后分别加入10 mg/L氯霉素的乙腈溶液3.0 mL,室温下振荡12 h,利用高效液相色谱测定溶液中氯霉素的浓度。聚合物对氯霉素的吸附量按照下式计算:Q=(C0-Ce)V/m。其中,C0(mg/L)和Ce(mg/L)分别代表氯霉素溶液的初始浓度和吸附平衡后的平衡浓度,V(mL)代表吸附溶液的体积,m(g)代表聚合物的质量。
氯霉素分子印迹聚合物的吸附-解吸实验:准确称取30.0 mg氯霉素分子印迹聚合物,加入3.0 mL 80.0 mg/L的氯霉素溶液,室温振荡12 h后,利用高效液相色谱测定吸附后溶液中氯霉素的浓度。然后用甲醇-乙酸(9∶1)洗涤上述吸附完氯霉素的印迹聚合物,直至洗脱液在275 nm处无紫外吸收,用甲醇洗涤印迹聚合物3次除去残留的乙酸,60 ℃下真空干燥至恒重。再向该聚合物中加入3.0 mL 80.0 mg/L的氯霉素溶液,室温振荡12 h后,利用高效液相色谱测定吸附后溶液中氯霉素的浓度。重复5次。
1.4 氯霉素分子印迹聚合物应用于鸡蛋样品中氯霉素的分离富集
对市场上购买的鸡蛋样品进行前处理。首先将鸡蛋样品制成匀浆,称取3份鸡蛋样品,每份5.0 g,置于50 mL离心管中。分别以氯霉素标准溶液加至鸡蛋样品中,使其最终浓度为5.0,10.0,30.0 μg/kg;然后分别加入20 mL乙醇-水(体积比6∶4)溶液,将样品溶液在振荡器上振荡1 h,离心,将上清液倒入另一离心管中;再向沉淀物中加入20 mL乙醇-水(6∶4)溶液,重复提取2次。合并3次提取的上清液,吹干浓缩后,用乙腈定容至50 mL,过0.22 μm滤膜,密封待用。每个添加浓度平行3份。将50 mg氯霉素分子印迹聚合物分别加入上述处理好的3个浓度添加水平的氯霉素工作液,室温下振荡吸附,离心,将上层清液倒掉,反复吸附几次后,用甲醇-乙酸(9∶1)洗涤氯霉素分子印迹聚合物,收集洗脱液,吹干,用流动相定容,利用高效液相色谱测定吸附后溶液中氯霉素的浓度。每个添加浓度平行3份。
2 结果与讨论
2.1 氯霉素分子印迹聚合物的制备条件优化
分子印迹聚合物的性能与功能单体、交联剂以及溶剂等因素有关。首先,选择合适的功能单体特别重要,只有当功能单体与模板分子之间能形成作用较强的多作用位点时,所制备的分子印迹聚合物对模板分子才会有较好的识别性能。其次,溶剂的选择也直接影响到聚合物的识别性能。因为在制备分子印迹聚合物时,溶剂不但是反应介质,还有致孔剂的作用。选择的反应溶剂不但能溶解模板分子、功能单体、交联剂及引发剂等,还必须能产生一定的大孔,使所制备的聚合物具有大的比表面积,从而能很好地识别模板分子。
2.1.1 溶剂的选择分别选择了氯仿和四氢呋喃两种溶剂作为反应的溶剂,实验结果表明,以氯仿为溶剂时,模板分子氯霉素的溶解性很差,超声加热也不能溶解;而以四氢呋喃为溶剂时,模板分子的溶解性很好,所以选用四氢呋喃作为反应溶剂。
2.1.2 功能单体的选择分别选择2-乙烯基吡啶和甲基丙烯酸为功能单体,四氢呋喃为溶剂合成了分子印迹聚合物和非印迹聚合物,考察了两种功能单体合成的印迹聚合物及非印迹聚合物的吸附性能。实验发现以2-乙烯基吡啶为功能单体合成的印迹聚合物对模板分子的吸附量是甲基丙烯酸为功能单体时的1倍,两者的非印迹聚合物的吸附容量几乎相等,印迹聚合物与非印迹聚合物对氯霉素的吸附差别非常明显。其原因可从功能单体与模板氯霉素的结构中发现。功能单体甲基丙烯与模板分子之间只存在氢键作用;而功能单体2-乙烯基吡啶与模板分子氯霉素的结构中均含有1个六元的共轭环状结构,故它们在预聚合过程中除了有氢键作用之外,可能还存在π-π共轭的结合力,故两者之间的作用力较强。因此以2-乙烯基吡啶为功能单体合成的印迹聚合物对氯霉素的吸附容量大。本实验采用2-乙烯基吡啶为功能单体。
2.1.3 离子液体的选择分别选用两种咪唑类离子液体[BMIm]BF4和[BMIm]PF6(图1)作为反应溶剂,发现亲水性离子液体[BMIm]BF4能很好地溶解模板分子氯霉素;而疏水性离子液体[BMIm]PF6粘度很大,对氯霉素的溶解性很差,所以本实验选用离子液体[BMIm]BF4作为混合反应溶剂。由于离子液体本身具有特殊的物理化学性质,其在反应体系中所占的比例会直接影响合成的聚合物的形态和吸附性能。考察了反应溶剂[BMIm]BF4和THF的用量,发现当THF和[BMIm]BF4的体积比大于1时,二者分层,不相溶;当THF与[BMIm]BF4的体积比小于1时,二者能互溶。分别以THF,BMIm[BF4],THF-[BMIm]BF4(1∶1)和THF-[BMIm]BF4(1∶2)为反应溶剂合成了氯霉素分子的印迹聚合物及非印迹聚合物,其扫描电镜图见图2。以单独的THF为反应溶剂时,合成的聚合物较致密(图2a,2b);以单一离子液体BMIm[BF4]为反应溶剂,合成的聚合物有明显的孔径通道(图2g,2h);当加入不同比例的离子液体[BMIm]BF4后,两种溶剂混合合成的聚合物分散性较好,均优于使用单一溶剂,得到了粒径分布相对均匀的微球,其中THF∶[BMIm]BF4为1∶1时,得到的微球粒径为300~700 nm(图2c,2d),而THF∶[BMIm]BF4为1∶2时,微球的粒径变小,大小为300~400 nm(图2e,2f)。印迹聚合物与非印迹聚合物相比,有更多的空隙,有利于目标物的传输和吸附。从不同溶剂组成合成的印迹聚合物及非印迹聚合物对氯霉素的吸附容量(图3)来看,当THF∶[BMIm]BF4为1∶1(体积比)时,合成的印迹聚合物的吸附容量最大,印迹效果最好,吸附结果与扫描电镜的结果相符。本实验选用THF∶[BMIm]BF4=1∶1的混合溶剂作为反应溶剂,2-乙烯基吡啶为功能单体,交联剂为乙二醇二甲基丙烯酸酯,引发剂为偶氮二异丁腈,合成氯霉素分子印迹聚合物,其中模板分子、功能单体、交联剂的摩尔比为1∶4∶20。

图2 分别以四氢呋喃、四氢呋喃+离子液体、离子液体为溶剂合成的氯霉素分子印迹聚合物及非印迹聚合物的扫描电镜图Fig.2 SEM images of CAP-MIP and NIP prepared using only THF,THF+ionic liquids,and only ionic liquids as porogena.MIP(THF),b.NIP(THF),c.MIP(T∶B=1∶1),d.NIP(T∶B=1∶1),e.MIP(T∶B=1∶2),f.NIP(T∶B=1∶2),g.MIP([BMIm]BF4),h.NIP([BMIm]BF4)
2.2 氯霉素分子印迹聚合物对氯霉素吸附性能的研究

图3 不同溶剂合成的印迹聚合物及非印迹聚合物对氯霉素吸附Fig.3 The adsorption of as-prepared MIP and NIP towards to CAP using different solvent in the polymerization
氯霉素印迹聚合物MIPs和NIPs的热力学吸附结果如图4所示。随着氯霉素浓度的增加,MIPs对氯霉素的吸附量也逐渐增加。当氯霉素的浓度较低时,模板分子氯霉素不能全部占据印迹聚合物上的印迹识别位点,此时分子印迹聚合物和非印迹聚合物对氯霉素的吸附量差别不大。但是随着氯霉素溶液浓度的增加,由于非印迹聚合物没有特异性识别的印迹位点,因此吸附量变化很小。这说明氯霉素分子印迹聚合物与非印迹聚合物相比,其表面及内部形成了对模板分子氯霉素具有特异性识别作用的印迹位点。因此,氯霉素分子印迹聚合物对模板分子氯霉素的吸附量远大于非印迹聚合物对氯霉素的吸附量。另外,当氯霉素溶液的浓度超过一定范围时,模板分子占据了所有的印迹位点,此时印迹聚合物达到饱和吸附平衡。当氯霉素的浓度为80 mg·g-1时,MIPs对氯霉素的吸附基本达到吸附平衡,最大吸附量约为1.88 mg·g-1;而非印迹聚合物对模板分子氯霉素的最大吸附量约为0.72 mg·g-1。
图4B为氯霉素分子印迹聚合物对氯霉素的动力学吸附,从图中可以看出,在开始一段时间内,印迹聚合物对模板分子氯霉素的吸附量增加较快,但随着时间的延长,印迹聚合物对模板分子的吸附量增加逐渐减小,大约210 min左右,印迹聚合物对模板分子的吸附量几乎不再增加,吸附达到平衡。这可能是由于在吸附过程的开始阶段,印迹聚合物的识别位点较多,氯霉素分子可以较快地占据这些识别位点。但随着时间的延长,氯霉素分子占据了大多数识别位点,从而使印迹聚合物对氯霉素吸附量增加的趋势逐渐变缓。经过足够长的时间之后,氯霉素分子占据了所有的识别位点,印迹聚合物对氯霉素的吸附量不再增加,吸附达到平衡,吸附曲线出现平台。

印迹聚合物对模板分子的识别选择性通常用印迹因子(α)来评价:α=QMIP/QNIP,其中,QMIP和QNIP分别为印迹聚合物和非印迹聚合物对模板分子氯霉素的饱和吸附量。通过公式计算出氯霉素印迹聚合物对氯霉素的印迹因子α为2.61,说明氯霉素印迹聚合物对模板分子具有较好的选择性。

图5 氯霉素分子印迹聚合物和非印迹聚合物对氯霉素、甲砜霉素、四环素、磺胺甲唑的吸附Fig.5 The adsorption of as-prepared MIP and NIP towards to CAP, TAP, TC and SMO
2.3 氯霉素分子印迹聚合物的选择性

2.4 氯霉素分子印迹聚合物的重复使用性能
分子印迹聚合物的重复利用性能是评价分子印迹聚合物吸附性能的重要指标。为了考察氯霉素分子印迹聚合物的重复使用性能,对其进行了吸附-解吸实验。结果显示,印迹聚合物每次的吸附量都会比前1次有所下降。这可能是由于在前1次的吸附过程中部分模板分子被吸附在印迹聚合物的内部,占据了一部分印迹位点,洗脱过程中无法将其洗脱下来,从而使得这部分识别位点不能再吸附新的模板分子,或是在洗脱过程中印迹聚合物的部分结合位点的空间结构遭到破环,造成了聚合物吸附量的逐次降低。对同一印迹聚合物进行了5次吸附-解吸实验,第5次吸附量为第1次吸附量的79.78%。由此可见,制备的印迹聚合物的重复利用性较好。
2.5 氯霉素分子印迹聚合物对鸡蛋样品中氯霉素的分离富集
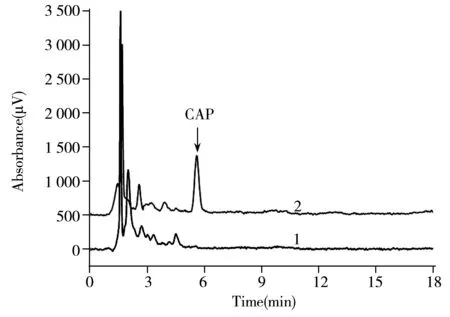
图6 氯霉素分子印迹聚合物对鸡蛋样品的富集色谱图Fig.6 Chromatograms of CAP-MIPs for enrichment of CAP in the spiked egg sample at concentration of 30.0 μg·kg-1curve 1:egg sample; curve 2:elution of CAP-MIPs washed with a mixture of methanol-acetic acid(9∶1) after adsorbing samples
将氯霉素分子印迹聚合物材料作为选择性吸附剂应用于鸡蛋样品中氯霉素的分离富集。如图6所示,曲线1为加标水平30.0 μg·kg-1的鸡蛋加标液;曲线2为氯霉素分子印迹聚合物对鸡蛋加标液吸附富集之后,用甲醇-乙酸(9∶1)洗脱分子印迹聚合物的洗脱液。由图6可知,鸡蛋加标液经过氯霉素分子印迹聚合物的富集后,氯霉素出现很明显的色谱峰,能够利用高效液相色谱快速检测氯霉素含量。对购于超市的鸡蛋样品未检出氯霉素残留。为了验证MIPs结合HPLC测定氯霉素的可靠性,向鸡蛋添加5.0,10,30 μg·kg-13个水平的氯霉素标准液,每个添加水平平行3份,测定氯霉素的平均回收率分别为62.3%,76.2%和81.1%,相对标准偏差(RSD)均小于11.5%,方法的回收率和准确性均较好,表明氯霉素分子印迹聚合物适用于鸡蛋样品中痕量氯霉素的富集和检测。
3 结 论
本文以四氢呋喃和离子液体[BMIm]BF4为反应混合溶剂,2-乙烯基吡啶为功能单体,乙二醇二甲基丙烯酸酯为交联剂,偶氮二异丁腈为引发剂制备了氯霉素分子印迹聚合物。制备的分子印迹聚合物为粒径分布均匀的微球,具有多孔结构,对模板分子具有高的吸附容量,响应动力学较快,选择识别性能良好,可以重复使用。使用氯霉素印迹聚合物作为吸附材料,对鸡蛋样品中的氯霉素进行选择性富集,效果较理想,对鸡蛋样品中加标回收率可达62.3%~81.1%,有望应用于实际样品中氯霉素残留量的检测分析。
[1] Commission Regulation 1430/94 of 22 June 1994.Laying Down a Community Procedure for the Establishment of Maximum Residue Limits of Veterinary Medicinal Products in Foodstuffs of Animal Origin.Off.J.Eur.Commun.,1994,L156:6.
[2] Impens S,Reybroeck W,Vercammen J,Courtheyn D,Ooghe S,DeWash K,Smedts W,DeBrabander H.Anal.Chim.Acta,2003,483:153-163.
[3] Huang J F,Zhang H J,Feng Y Q.J.Agric.FoodChem.,2006,54:9279-9286.
[4] Huang J X,Hu Y F,Pan J L,Xu Z G,Li G K.Sci.ChinaB(黄健祥,胡玉斐,潘加亮,许志刚,李攻科.中国科学B辑),2009,39:733-746.
[5] Wen Y Y,Chen L,Li J H,Liu D Y,Chen L X.TrAC,TrendsAnal.Chem.,2014,59:26-41.
[6] Kaufmann A,Butcher P,Maden K,Walker S,Widmer M.Anal.Chim.Acta,2015,862:41-52.
[7] Zhang Y,Li G K.J.Instrum.Anal.(张毅,李攻科.分析测试学报),2008,27(2):215-221.
[8] Hu Y F,Li G K.J.Instrum.Anal.(胡玉斐,李攻科.分析测试学报),2009,28(8):989-994.
[9] Chen L,Xu S,Li J.Chem.Soc.Rev.,2011,40:2922-2942.
[10] Mena M L,Agüí L,Martinez-Ruiz P,Yáňez-Sedeno P,Reviejo A J,Pingarrón J M.Anal.Bioanal.Chem.,2003,376:18-25.
[11] Shi X,Wu A,Zhang S,Li R,Zhang D.J.Chromatogr.B,2007,850:24-30.
[12] Shi X Z,Song S Q,Sun A L,Liu J H,Li D X,Chen J.Analyst,2012,137:3381-3389.
[13] Passerini S,Appeteccha G B.MRSBull.,2013,38(7):540-547.
[14] Poole C F,Lenca N.TrAC,TrendsAnal.Chem.,2015,71:144-156.
[15] Wang H F,Zhu Y Z,Yan X P,Gao R Y,Zheng J Y.Adv.Mater.,2006,18:3266-3270.
[16] Sun X L,He J,Cai G R,Lin A Q,Zheng W J,Liu X,Chen L X,He X W,Zhang Y K.J.Sep.Sci.,2010,33:3786-3793.
[17] He C Y,Long Y Y,Pan J L,Li K,Liu F.Talanta,2008,74:1126-1131.
Preparation and Application of Molecularly Imprinted Polymers for Chloramphenicol Based on Ionic Liquids Assistance
WANG Xiao-yu1*,SUN Fu-qian1,ZENG Guo-ping1,LIU Xin-xin1,YU Ji-wen1,LAI Jia-ping2*
(1.Applied Chemistry Research Institute of Jiangxi Academy of Sciences,Nanchang 360102,China;2.School of Chemistry & Environment,South China Normal University,Guangzhou 510006,China)
In this work,the molecularly imprinted polymers(MIPs) for chloramphenicol(CAP)(CAP-MIPs) were prepared by ionic liquids assistance using 2-vinylpyridine as functional monomer,ethylene glycol dimethacrylate(EGDMA) as the cross-linker and 2,2′-azobisisobutyronitrile(AIBN) as the initiator in the mixture of tetrahydrofuran and ionic liquid 1-butyl-3-methylimidazolium tetrafluoroborate([BMIm]BF4) as the porogenic solvent.The effects of functional monomer,progenic solvent on the binding capacity of MIPs were optimized.The MIPs possessed a high capacity and a favorable selectivity for CAP in the preparation of MIPs using 2-vinylpyridine as functional monomer and ionic liquid([BMIm]BF4)(1∶1,by volume) as polymeric solvent.The imprinting factor of CAP-MIPs reached to 2.6.The reusability of CAP-MIPs without any deterioration in capacity was demonstrated for five adsorption-desorption cycles.The developed method was applied in the enrichment and determination of CAP in spiked egg samples using CAP-MIPs as the adsorbent,with CAP recoveries of 62.3%-81.1%.
chloramphenicol;molecularly imprinted polymers(MIPs);ionic liquids;egg;enrichment
10.3969/j.issn.1004-4957.2017.01.003
2016-09-06;
2016-11-02
江西省自然科学基金项目(201402BAB203017)
*通讯作者:王小玉,副研究员,研究方向:应用化学,Tel:0791-88177783,E-mail:wangxy6@sina.com 赖家平,教授,研究方向:光学分析及光化学传感器,环境分析及生物医药分析,Tel:020-39310257,E-mail:laijp@scnu.edu.cn
O657.7;R978.16
A
1004-4957(2017)01-0018-07

