异育银鲫呼肠孤病毒的分离与鉴定
巴翠玉, 张培军, 赵福广, 杜晓燕, 焦 雪, 李月红
(1吉林农业大学 动物科学技术学院,吉林 长春130118; 2吉林省卫生监测检验中心,吉林 长春 130000;3 吉林省水产科学研究院,吉林 长春 130033)
异育银鲫呼肠孤病毒的分离与鉴定
巴翠玉1, 张培军2, 赵福广1, 杜晓燕3, 焦 雪1, 李月红1
(1吉林农业大学 动物科学技术学院,吉林 长春130118; 2吉林省卫生监测检验中心,吉林 长春 130000;3 吉林省水产科学研究院,吉林 长春 130033)
【目的】发现异育银鲫Carassiusauratusgibelio新病原,为其病害防控提供理论基础。【方法】 从吉林省某养殖场采集异育银鲫出血病疑似病样,对其进行细菌分离及寄生虫观察、鲤疱疹病毒Ⅱ型的PCR检测和人工感染试验,然后用感染滤液接种鲤上皮瘤细胞(EPC),并对其进行电镜观察。对病毒基因组进行SDS-PAGE电泳分析、RT-PCR鉴定及序列测定。【结果】 发病异育银鲫无细菌及寄生虫感染,鲤疱疹病毒Ⅱ型的PCR检测无特异性条带,将过滤后的患病鱼组织滤液感染健康异育银鲫, 7 d内死亡率高达86.7%。盲传4代后出现明显的细胞病变。负染后电镜下可观察到病毒粒子,直径约70 nm,病毒颗粒近球形,无囊膜结构,初步判断为呼肠孤病毒(暂命名JL-4)。SDS-PAGE结果揭示,JL-4 基因组由11条dsRNA组成,呈现水生呼肠孤病毒基因组典型特征。将RT-PCR扩增产物的序列进行聚类分析,结果显示,JL-4与呼肠孤病毒HZ08株S6序列相似性高达99%,证明该分离株为呼肠孤病毒。【结论】 从患病异育银鲫中分离到1株呼肠孤病毒。
异育银鲫; 呼肠孤病毒; 鲤上皮瘤细胞; 分离与鉴定; SDS-PAGE
水生呼肠孤病毒Aquareovirus具双层衣壳,病毒粒子直径为60~70 nm,二十面体对称,无囊膜,基因组由11 条分节段的双链RNA 组成[1-5],其不仅能感染淡水鱼类,还能感染海水鱼类,已在世界范围造成比较广泛的危害。草鱼呼肠孤病毒(Grass carp reovirus,GCRV)隶属水生呼肠孤病毒属,为呼肠孤病毒科Reoviridae新成员,是中国大陆分离的第1株鱼类病毒[6-8]。该病毒主要引起中国、越南、缅甸等亚洲国家淡水养殖中的草鱼在鱼种阶段发生出血病,死亡率高达90%以上,还可感染青鱼、麦穗鱼和稀有鮈鲫等,使其发生出血病症状而死亡。该病毒流行广、危害大、死亡率高、发病季节长,严重影响了广大养殖者的积极性和我国淡水养殖业的健康发展[9-12]。
异育银鲫Carassiusauratusgibelio是一种改良的鲤科鱼类,因其肉质鲜美、生长速度快、饲养周期短、经济效益高等优点,深受广大生产者和消费者的欢迎,是我国重要的食用经济鱼类之一。其产量可以达到1.12~1.50 kg·m-2[13-14]。近年来由于养殖密度大和品种退化等原因,异育银鲫的养殖遭遇了病害,部分池塘连续发病率在70%以上,死亡率高达80%[15]。目前对其患孢子虫病、斜管虫病,以及败血症、溶血性腹水病等细菌性疾病[16-19]的研究较多,但对病毒性出血病的研究报道较少,其中鲤疱疹病毒Ⅱ型(Cyprinidherpesvirus-2,CyHV-2)感染异育银鲫是近年新出现的一种严重病毒性疾病,已经造成重大经济损失。2015年5月中旬,吉林省某渔场异育银鲫暴发严重病害,造成异育银鲫的大规模死亡,经济损失惨重。本研究通过对发病异育银鲫样品,在排除细菌感染的可能后,应用鲤上皮瘤细胞(EPC) 分离到1株病毒,暂命名为JL-4,并通过电镜观察、核酸分析、序列测定等方法对该病毒进行了研究,旨在发现新的病原,为异育银鲫的病害防控提供理论基础。
1 材料与方法
1.1 材料
1.1.1 材料来源 患病异育银鲫于2015年5月采自吉林省某渔场,体质量约40~50 g, 临床症状为眼球突出、鳃出血、胸鳍和腹鳍基部出现充血现象、鱼身出现不同的出血点及溃烂。解剖之后发现鱼鳃部发红,且有的鳃丝发白,内脏多处均出现充血症状。
健康异育银鲫购自吉林省新立城水库,平均体质量(68.00±0.91) g,24~26 ℃水温驯养7 d后,选取体格健壮、规格整齐、游动活跃的异育银鲫进行试验。
1.1.2 试验试剂 鲤上皮瘤细胞(EPC)由吉林农业大学水产研究室保存;M199 培养基、胎牛血清(FBS)、胰酶为Gibco 公司产品;Taq酶、dNTPs、DNA Marker、DNA提取试剂盒购自TaKaRa 公司; cDNA反转录试剂盒、Trizol Reagent 购于Invitrogen 公司;胶回收试剂盒购自Qiagen公司;其他试剂均为国产分析纯。
1.1.3 引物的设计和合成 引物由上海生工合成,引物设计参照《SN3584-2013草鱼出血病检疫技术规范》[20],序列为S6R:5′-AGTTCTCAAAGCTGAGACAG-3′和S6F:5′-ACGTGCGATTGGAAGAGCTT-3′。
1.2 细菌分离及寄生虫观察
参照徐洋等[21]的方法,从患病鱼的肝胰脏、脾、肾等组织进行细菌分离,所用培养基为胰酪胨大豆琼脂(TSA)。同时,取病鱼鳃、鳍条等组织在显微镜下检查寄生虫情况。
1.3 鲤疱疹病毒Ⅱ型的PCR检测
收集病鱼的鳃、肝胰脏、肠等组织,用DNA提取试剂盒提取DNA。参考GenBank中CyHV-2的基因序列,根据保守序列设计引物,F:5′-GGACTTGCGAAGAGTTTGATTTCTAC-3′;R:5′-CCATAGTCACCCATAGTCAC-3′。PCR反应体系(25 μL)为:ddH2O 5 μL,上、下游引物各1 μL,2×TaqMix 12.5 μL,DNA模板5 μL,MgCl20.5 μL。PCR程序为:94 ℃预变性5 min;94 ℃ 1 min,54 ℃ 1 min,72 ℃ 1 min,35个循环;72 ℃延伸10 min。PCR产物经10 g·L-1琼脂糖凝胶电泳,纯化后交由上海生工测序。
1.4 样品处理
无菌条件下,取濒临死亡、具有典型症状的发病异育银鲫的鳃、肝胰脏和肠等组织,用经高压灭菌的研钵将其碾碎,加入含φ为10%血清的M199培养基,将其制成匀浆,反复冻融3次。4 ℃、12 000 r·min-1离心10 min,取上清,经直径为0.22 μm微孔滤膜过滤,滤液备用。
1.5 人工感染试验
选用健康异育银鲫60尾,随机分为2组:对照组和试验组。将2组鱼同时放入相同水环境的不同鱼缸中。对照组每条鱼注射无菌生理盐水0.2 mL,试验组每条鱼注射“1.4”中制备的滤液0.2 mL,25 ℃ 水温下饲养 7 d,观察并记录鱼体变化情况。
1.6 病毒分离和电镜观察
EPC细胞经传代长成致密单层细胞,弃培养液,用PBS缓冲液洗涤2次,加入1 mL“1.4”中制备的滤液,27 ℃培养箱中吸附1 h,弃滤液,加入含10%(φ)血清和1%(φ)双抗的细胞培养液,27 ℃恒温培养。每天观察细胞是否病变, 若无病变再盲传5代,并每天用显微镜观察病变细胞的比例,待病变细胞80 %以上时收获。
收集盲传4代的病变细胞,反复冻融3次,4 ℃、12 000 r·min-1离心20 min后,取30 μL上清液进行负染后用透射电镜进行观察。
1.7 病毒基因组的SDS-PAGE鉴定
按照Trizol Reagent提取病毒RNA。配制聚丙烯酰胺凝胶:10%分离胶和5%浓缩胶,每孔病毒RNA上样量为50 μL RNA提取物混合10 μL 6×Loading Buffer,加入凝胶样品孔中。恒压80 V开始电泳,直至样品浓缩成1条线,加大电压至120 V继续电泳20 h。电泳结束后,进行硝酸银染色后拍照。
1.8 RT-PCR鉴定和生物信息学分析
按照cDNA反转录试剂盒进行反转录。 PCR反应体系(50 μL)为:TaKaRa LA-Taq0.5 μL, cDNA模板2 μL,10×PCR Buffer 5 μL,dNTPs 8 μL,上、下游引物各2 μL,ddH2O 30.5 μL。PCR程序为:94 ℃预变性3 min;94 ℃ 30 s,54 ℃ 30 s,72 ℃ 1 min,40个循环;72 ℃延伸7 min。PCR产物纯化后交由上海生工测序。测序结果通过NCBI数据库进行Blast比对分析,使用MEGA5.0构建系统发育树。
2 结果与分析
2.1 细菌分离及寄生虫观察
对发病异育银鲫进行细菌分离,仅在肝胰脏组织分离板有个别菌生长,判定是杂菌或是继发感染的细菌,并非是引起异育银鲫发病的病原菌。取发病鱼的鳃及鳍条显微镜下观察未见有寄生虫感染。
2.2 鲤疱疹病毒Ⅱ型的PCR检测
以发病异育银鲫的鳃、肝胰脏、肠等组织的DNA为模板,经PCR扩增未得到CyHV-2特异性片段(图1),说明该病的病原不是鲤疱疹病毒Ⅱ型。
2.3 人工感染试验
人工感染试验中,感染3 d后,异育银鲫开始发病,同自然发病症状相同,表现为:眼球突出、鳃出血、胸鳍和腹鳍基部出现充血现象、鱼身出现不同的出血点及溃烂。解剖之后发现鱼鳃部发红,且有的鳃丝发白,内脏多处出现充血症状。7 d后,试验组30尾试验鱼,共死亡26尾,死亡率约为86.7%,对照组无死亡。

M:DL2000 DNA Marker;1、2为异育银鲫DNA。
2.4 病毒分离和电镜观察
组织液感染单层EPC细胞24 h后并未出现任何病变,盲传4代36 h后开始出现病变,表现为单层细胞局部出现边缘不整齐的空洞,少许细胞脱落,随着细胞病变效应(CPE)的发展,细胞呈网状收缩,逐渐脱落崩解,最后呈现典型破鱼网状(图2A)。而未接种病毒的对照细胞生长状态良好(图2B)。

A:被感染细胞 B: 对照组细胞
病毒悬液经过负染,在透射电镜中观察到病毒粒子,大小均一,直径约70 nm,病毒颗粒近球形,无囊膜结构,中间有一电子密度至密区域(图3)。初步鉴定为呼肠孤病毒,暂时命名为JL-4。

图3 电镜下的病毒粒子Fig.3 The viron under electron microscope
2.5 病毒基因组的SDS-PAGE鉴定
将JL-4核酸样品进行SDS-PAGE电泳20 h,硝酸银染色,结果显示病毒基因组产生10条清晰条带(图4),其中S4和S5由于相对分子质量接近,2条带不能完全分开,这11条带按照相对分子质量从大到小可以分为3组,即S1、S2、S3;S4、S5、S6和S7、S8、S9、S10、S11,为典型的水生呼肠孤病毒基因组核酸带型。
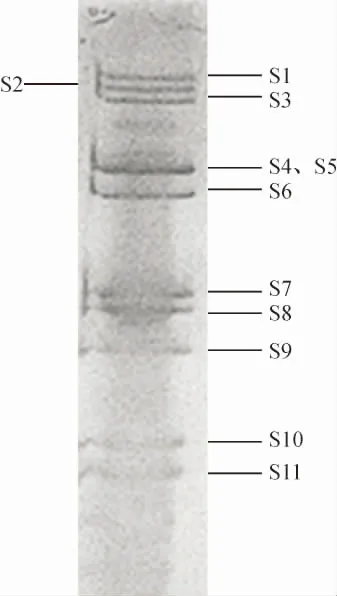
图4 病毒基因组SDS-PAGE电泳图谱Fig.4 SDS-PAGE pattern of the isolate genome
2.6 RT-PCR鉴定
以JL-4株cDNA为模板,经PCR扩增得特异性片段,与预期产物的大小相符合(图5)。将上述PCR 扩增产物进行测序,用NCBI/Blast 对该序列进行同源性分析,结果如图6所示,该序列与GenBank 中已发表的呼肠孤病毒HZ08株第6 基因片段核苷酸序列(登录号:GQ896337.1)的相似性达99%,因此可确定该病毒为呼肠孤病毒。

M:DL2000 DNA Marker;1为JL-4的cDNA基因组。

图6 基于S6序列构建的系统进化树Fig.6 Phylogenetic tree based on S6 sequences
3 讨论与结论
本试验对从吉林省某渔场采集的发病异育银鲫样品进行病原的分离鉴定,为鉴定是否为细菌性感染疾病,进行了细菌的平板划线分离,仅在肝胰脏组织分离板中可见个别细菌生长,故判断是杂菌或是继发感染的细菌,并非是引起异育银鲫发病的病原菌。通过人工感染试验发现试验组的发病症状与自然条件下鱼体发病症状一致,表现为眼球突出、鳃出血、胸鳍和腹鳍基部出现充血现象、鱼身出现不同的出血点及溃烂。解剖发现鳃部发红,且有的鳃丝发白,内脏多处出现充血症状。感染7 d后,致死率达到86.7%。但张超等[22]研究发现草鱼呼肠孤病毒HZ08株感染草鱼后, 病鱼体色发黑, 并无明显出血症状,这与本试验有所差异。不同病毒株感染的鱼体发病症状不同,可能是因为不同基因型所致。而刘永奎等[23]和郝贵杰等[2]研究发现草鱼感染草鱼呼肠孤病毒后,发病草鱼口腔及上下颌、头盖、眼眶周围、鳃盖及鳍条基部都充血,与本试验结果相似。采用EPC细胞分离的方法对病样进行病毒分离,病样组织滤液感染单层EPC细胞24 h后并未出现任何病变,盲传4代后开始出现病变,表现为单层细胞局部出现边缘不整齐的空洞,少许细胞脱落,随着细胞病变效应(CPE)的发展,单层细胞呈网状收缩,逐渐脱落崩解,最后呈现典型破鱼网状。与刘宝芹等[24]研究发现的草鱼呼肠孤病毒不导致细胞病变的结果不一致,可能是JL-4发生了变异的原因,或者是因为不同的呼肠孤病毒株对EPC的感染性是有差异的。
病毒悬液经过负染后,在透射电镜中观察到病毒粒子大小均一,直径约70 nm,病毒颗粒近球形,无囊膜结构,中间有一电子密度至密区域。与曾伟伟等[25]从草鱼中分离到的草鱼呼肠孤病毒JX09-01株电镜观察结果一致。而陈吉刚等[26]从锯缘青蟹中分离到的呼肠孤病毒的病毒直径约为60 nm,可能是从不同养殖品种中分离到的原因。提取病毒RNA后进行SDS-PAGE凝胶电泳和RT-PCR检测,凝胶电泳结果显示病毒基因组产生10条清晰条带,其中S4和S5由于分子量接近,2条带不能完全分开,这11条带按照分子量从大到小可以分为3 组, 即S1、S2、S3;S4、S5、S6和S7、S8、S9、S10、S11,为典型的水生呼肠孤病毒基因组核酸带型,该结果与曾令兵等[6]从患出血病斑点叉尾鮰中分离出的斑点叉尾鮰呼肠孤病毒的SDS-PAGE结果相似,而与张叔勇等[27]从锯缘青蟹中分离到的呼肠孤病毒的12条核酸带构成结果不同。经RT-PCR检测,获得特异性目的条带,测序结果在NCBI中进行Blast比对,结果与GCRV相应序列相似性达99%。综上研究表明,本试验分离到的JL-4病毒株为水生呼肠孤病毒。该病毒的分离鉴定为异育银鲫出血性疾病的防治策略和后续的研究提供了重要的参考,具有一定的理论意义。
[1] 张超,王庆,石存斌,等. 草鱼呼肠孤病毒HZ08株的分离与鉴定[J]. 中国水产科学, 2010,17(6):1257-1263.
[2] 郝贵杰,沈锦玉,潘晓艺,等. 草鱼呼肠孤病毒湖州分离株的分离及鉴定[J]. 渔业科学进展, 2011,32(1):47-52.
[3] 李永刚,曾伟伟,王庆,等. 草鱼呼肠孤病毒分子生物学研究进展[J]. 动物医学进展, 2013,34(4):97-103.
[4] HE Y X,XU H X,YANG Q,et al. The use of aninvitromicroneutralization assay to evaluate the potential of recombinant VP5 protein as an antigen for vaccinating against grass carp reovirus [J].Virol J, 2011,8(1): 132.
[5] JIAN J C,WANG Y,YAN X Y,et al. Molecular cloning and prokaryotic expression ofvp5 gene of grass carp reovirus strain GCRV096[J]. Virus Genes,2013,47(3): 483-489.
[6] 曾令兵,徐进,李艳秋,等. 斑点叉尾鮰出血病病原呼肠孤病毒的分离与鉴定[J]. 病毒学报, 2009(6):460-466.
[7] 王方华,李安兴. 草鱼病毒性出血病研究进展[J]. 南方水产, 2006,2(3):66-71.
[8] XUE R Y,LIU L,CAO G L,et al. Oral vaccination of BacFish-vp6 against grass carp reovirus evoking antibody response in grass carp[J]. Fish Shellfish Immun, 2013, 34(1): 348-355.
[9] 马贵华,陈道印,刘六英,等. 草鱼出血病的免疫学研究进展[J]. 渔业现代化, 2008,35(1):45-49.
[10]ZHANG Q Y,RUAN H M,LIZ Q,et al. Detection of grass carp hemorrhage virus(GCHV) from Vietnam and comparison with GCHV strain from China[J]. High Tech Lett, 2003,9(2): 7-13.
[11]CAI L,SUN X Y, SHAO L, et al. Functional investigation of grass carp reovirus nonstructural protein NS80[J].Virol J, 2011,8(1): 168.
[12]FAN C,SHAO L,FANG Q. Characterization of the nonstructural protein NS80 of grass carp reovirus[J].Arch Virol, 2010,155(11):1755-1763.
[13]谢小平,丁华林,王春林. 异育银鲫养殖及病害防治技术[J]. 江西水产科技, 2014(4):30-32.
[14]周贤军,解绶启,谢从新,等.异育银鲫幼鱼对饲料中赖氨酸的利用及需要量研究[J] .水生生物学报, 2006, 30(3):247-255.
[15]王亚冰,梁利国,高金伟,等. 异育银鲫源杀鲑气单胞菌杀鲑亚种的分离鉴定[J]. 微生物学通报, 2016,43(7):1532-1539.
[16]王增福, 谢红梅, 张静.水产动物嗜水气单胞菌病研究进展[J].水利渔业, 2002, 22(2):18-19.
[17]陆承平.致病性嗜水气单胞菌及其所致鱼病综述[J] .水产学报, 1992, 16(3):282-288.
[18]ZHANG C,WANG Q,SHI C B,et al. Molecular analysis of grass carp reovirus HZ08 genome segments 1-3 and 5-6[J].Virus Genes, 2010,41(1): 102-104.
[19]KUMAR B K,RAGHUNATH P,DEVEGOWDA D,et al. Development of monoclonal antibody based sandwich ELISA for the rapid detection of pathogenicVibrioparahaemolyticusin seafood[J].Int J Food Microbiol, 2011,145(1): 244-249.
[20]国家质量监督检验检疫总局.草鱼出血病检疫技术规范:SN/T 3584—2013[S].北京:中国标准出版社,2013.
[21]徐洋,郝贵杰,沈锦玉,等. 2株草鱼呼肠孤病毒江西株的分离与鉴定[J]. 淡水渔业, 2010,40(3):44-49.
[22]张超. 草鱼呼肠孤病毒HZ08 株的分离鉴定与全基因组分子特征分析[D]. 上海:上海海洋大学, 2010.
[23]刘永奎,王庆,曾伟伟,等. 草鱼呼肠孤病毒JX-0902株的分离和鉴定[J]. 中国水产科学, 2011,18(5):1077-1083.
[24]刘宝芹,曾伟伟,王庆,等. 草鱼呼肠孤病毒HZ08株FQ-PCR检测方法的建立及应用[J]. 中国水产科学, 2012,19(2):329-335.
[25]曾伟伟,王庆,刘永奎,等. 1株草鱼呼肠孤病毒弱毒株的分离、鉴定及免疫原性初步分析[J]. 水生生物学报, 2011,35(5):790-795.
[26]陈吉刚,杨季芳,王海丽,等. 养殖锯缘青蟹呼肠孤样病毒粒子的电镜观察[J]. 海洋学研究, 2008,26(4):93-96.
[27]张叔勇,郑大胜,白志强,等. 1株锯缘青蟹呼肠孤病毒的分离纯化及鉴定[J]. 海洋渔业, 2007,29(3):277-280.
【责任编辑 庄 延】
Isolation and identification of a reovirus strain from Gibel carp
BA Cuiyu1, ZHANG Peijun2, ZHAO Fuguang1, DU Xiaoyan3, JIAO Xue1, LI Yuehong1
(1 Animal Science and Technology College,Jilin Agricultural University,Changchun 130118,China;
2 Jilin Province Health Surveillance Inspection Center,Changchun 130000,China;
3 Freshwater Fisheries Research Institute of Jilin Province,Changchun 130033,China)
【Objective】 To discover a new pathogen of Gibel carp (Carassiusauratusgibelio), and to provide a theoretical basis for the disease prevention and control. 【Method】 Gibel carps suspected having hemorrhagic disease were collected from a farm in Jilin Province. Tissues were observed for bacterial infection and parasite contamination. PCR was used to detectCyprinidherpesvirus-2. Artificial infection was conducted, the infection filtrate was vaccinated to the carp epithelial tumor cells (EPC), and the EPC were observed by an electron microscope. The virus genome was analyzed by SDS-PAGE and identified by RT-PCR and sequencing. 【Result】 Neither bacterial nor parasitic infection was detected.Cyprinidherpesvirus-2 specific bands were not detected by PCR. After healthy Gibel carps were infected with tissue filtrate of sick fish, the mortality rate reached 86.7% within seven days. Clear cytopathy was detected after four generations via blind passage. The virus particles were observed by an electron microscope after negative staining, the particle was spherical with around 70 nm in diameter and with no envelope. The virus was initially determined as a reovirus strain (temporarily named JL-4). The SDS-PAGE results showed that JL-4 possessed 11 segments of dsRNA, which was the typical characteristic ofAquareovirusgenome. Cluster analysis for the sequences of the RT-PCR amplification product showed that S6 sequences from JL-4 and reovirus HZ08 had 99% similarity, confirming that JL-4 was reovirus. 【Conclusion】 One reovirus strain was isolated and identified from Gibel carp.
Carassiusauratusgibelio; reovirus; epithelial tumor cell; isolation and identification; SDS-PAGE
2016- 06- 07优先出版时间:2017-01-10
巴翠玉(1992—),女,硕士, E-mail:1030652998@qq.com; 通信作者:李月红(1968—),女,教授,博士,E-mail:liyhong@sina.com
国家自然科学基金(30972191);吉林省农业产业技术体系(201506);948计划(2014Z34)
S941
A
1001- 411X(2017)02- 0022- 05
优先出版网址:http://www.cnki.net/kcms/detail/44.1110.s.20170110.1423.006.html
巴翠玉, 张培军, 赵福广, 等.异育银鲫呼肠孤病毒的分离与鉴定[J].华南农业大学学报,2017,38(2):22- 26.

