草莓采后灰霉病生防菌Burkholderia contaminans培养基优化分析
施俊凤,孙常青,李静,3
(1山西省农业科学院农产品贮藏保鲜研究所,太原030031;2山西省农业科学院作物科学研究所,太原030031;3山西大学生命科学学院,太原030031)
草莓采后灰霉病生防菌Burkholderia contaminans培养基优化分析
施俊凤1,孙常青2,李静1,3
(1山西省农业科学院农产品贮藏保鲜研究所,太原030031;2山西省农业科学院作物科学研究所,太原030031;3山西大学生命科学学院,太原030031)
旨在研究洋葱伯克霍尔德菌Burkholderia contaminans在摇瓶条件下的生物量最大培养基配方。试验采用多因素二次通用旋转组合设计的方法,通过对不同碳源、氮源和无机盐种类和浓度对B. contaminans生长的影响,确定拮抗菌浓度最大的培养基配方。筛选出的最佳培养基配方为:麦芽浸粉2.11%、酵母提取物1.90%、磷酸二氢钾0.05%,硫酸锰0.05%。在该培养条件下,伯克氏菌Burkholderia contaminans B-1生物量达到最大值,且经过进一步验证,其优化效果较好。拮抗菌株B.contaminans培养条件的优化分析为该菌高产发酵工艺的建立奠定了基础,促进了该菌株在果蔬采后生物防治的应用与产业化开发。
Burkholderia contaminans B-1;培养基;二次通用旋转组合;优化分析
0 引言
草莓(Fragaria ananassa Duch.)属蔷薇科草莓属,果实颜色鲜艳,果肉酸甜适口,由于其组织娇嫩,外部缺乏保护皮层,在采后贮运中极易受损伤和病菌侵染,常温下1~3天即会腐烂变质,严重限制了其生产的产业化和规模化[1]。灰霉病是草莓采后常见病害,其病原菌灰葡萄孢霉(Botrytis cinerea)寄主范围广,耐低温,所以在果实贮藏环境中极易发生,直接影响其商品价值及食用价值[2-3]。用微生物进行采后病害的生物防治是近年来发展起来的一个新的研究领域。自从20世纪50年代Gutter等[4]首次报道枯草芽抱杆菌(Bacillus subtilis)对水果病原菌具有生防作用以来,国内外学者对其采后病害的生物防进行了广泛研究[5-6]。因此,生防菌剂的研发对于延长草莓货架期以及草莓的生产具有重要意义。
Burkholder在1950年首次报道一株细菌可以引起洋葱鳞茎发生腐烂,称为洋葱假单胞菌(Pseudomonas cepacia)[7]。近年来,随着细菌分类技术的发展,洋葱伯克霍尔德菌已不仅仅作为一个种,而是一组基因型不同、表型相近的复合物,称为洋葱霍尔德菌复合群(Burkholderia cepacia complex,简称Bcc)[8],目前洋葱伯克霍尔德菌复合群共包括17个其因型[9]。有文献报道,农业领域中洋葱伯克霍尔德菌具有生物防治、生物降解以及促进植物生长等多种功能,有广泛的应用前景。目前已有一些Bcc用于果实采后领域的相关报道,如Parke[10]发现Bcc不仅可以有效抑制梨青霉病、苹果灰霉病和桃褐腐病等采后病害,对其植株的茎叶病害的也有较强的抑制作作。范青等[11]发现Bcc对甜樱桃褐腐病表现出显著的抑制效果,谢关林等[12]发现在离体条件下Bcc菌株可显著抑制水稻纹枯病菌和恶苗病菌的生长。通过实验证明,生防菌的拮抗效力与其生物量浓度密切相关,浓度越大,生防效果越好。因此,研究不同碳源、氮源和无机盐对伯克氏菌Burkholderia contaminans B-1的发酵生物量的影响,并优化其配方,对于提高生防菌的拮抗效力和商业化应用具有重要意义。
1 材料与方法
1.1 实验材料
生防菌:B.contaminans B-1分离自杏果实表面,经纯化后进行分子和生理生化鉴定,保存于-80℃。供试病原菌:于草莓果实自然发病部位分离灰葡萄孢霉(Botrytis cinerea),纯化后PDA平板培养7天,刮取分生孢子,采用血球计数法配制成浓度为1.0×l05个/mL的霉菌孢子悬浮液。
草莓品种为‘红颜’,采自山西省太谷县东阳镇,达商品成熟度采收。
1.2 实验方法
1.2.1 不同浓度拮抗菌对草莓果实的抑制效果参照Bi等[13]的方法,挑选大小、成熟度一致、无机械伤的草莓果实,1.0%的次氯酸钠溶液中浸泡1 min,无菌风吹干,用无菌铁钉在其赤道部位刺直径3 mm深度约3 mm的伤口,在伤口处分别加30 μL B.contaminans B-1发酵原液、5倍发酵液、10倍发酵液和无菌水,以加无菌水处理作为对照,无菌风吹干2 h后各伤口处再加15 μL霉菌孢子悬浮液,将各处理果实于16℃培养箱中保湿培养5天后,检查其发病情况。
1.2.2 最佳碳源筛选、氮源和无机盐的筛选将生防菌株在LB固体培养基活化后,于LB液体培养基中接种一环B.contaminans B-1,于50/250mL三角瓶以28℃200 r/min摇瓶培养24 h制备种子液。以1%YNB为基础氮源,分别添加1%的不同碳源,28℃200 r/min进行筛选;以1%筛选出的最佳碳源为碳源,分别添加1%不同氮源进行氮源的筛选;再分别以1%最佳碳源和最佳氮源为基础培养基,添加0.05%的8种无机盐进行最佳无机盐的筛选。每处理重复3次。
1.2.3 最佳培养基成分优化分析采用二次通用旋转组合设计,试验因子有碳源、氮源、无机盐1和无机盐2,每因子5个水平[14]。以B.contaminans B-1生长稀释10倍液的OD600值作为响应值。试验因子水平与编码见表1。每处理3次重复。
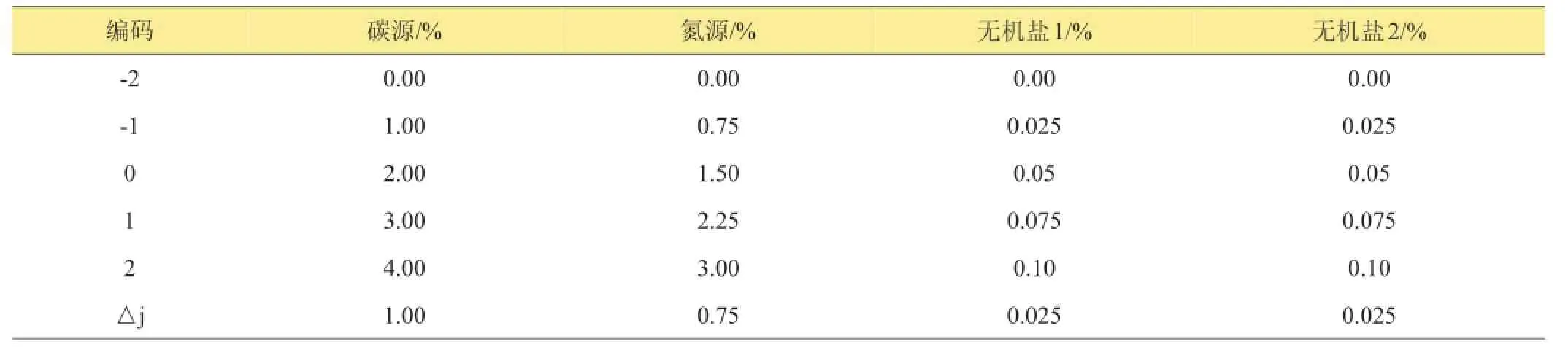
表1 试验因素水平与编码表
1.2.4 统计分析试验数据采用Desjgn-Expert 8.0.6统计软件进行统计分析,进行31组处理组合,每处理组合设3次重复。
2 结果与分析
2.1 B.contaminans B-1对草莓伤口接种抑制效果
采用不同处理液处理草莓果实见图1,对照果草莓高度腐烂,病害严重,基本整果腐败溃烂。而发酵原液和稀释5倍的发酵液接种草莓后,草莓果无腐烂现象,稀释10倍的发酵液处理可使草莓果实腐烂率下降14.63%,果实的病斑直径降低了63.63%(表2)。由此可见,生防菌株可有效抑制草莓采后灰霉病的发生,而且其抑制活性与其浓度呈正相关,浓度越大,抑制效果越好。

图1 B.contaminansB-1对草莓伤口接种灰霉病抑制效果(16℃5d)

表2 生防菌不同处理液对草莓果实灰霉病抑制作用(P<0.05)
2.2 生防菌对碳源和氮源的利用能力
B.contaminans B-1对不同碳源和氮源的利用能力见表3。由表3可知,在供试的11种碳源中,B.contaminans对麦芽浸粉利用能力最强,显著高于其他碳源,在氮源中对酵母提取物的利用能力最强,显著高于其他氮源。
2.3 拮抗菌对无机盐的利用能力
B.contaminans B-1对无机盐的利用如表4所示。从表中可知,在7种无机盐中,除了K2HPO4、MnSO4、KH2PO4外,其余4种无机盐对B.contaminans的生长均为负效应,其中K2HPO4和MnSO4正效应最强。因此,选取麦芽浸粉、酵母提取物、K2HPO4和MnSO4作为进行响应面设计的4个因素进行配方筛选。
2.4 回归模型的建立

表3 伯克氏菌B.contaminans B-1对各种碳源和氮源的利用能力
以决策变量麦芽浸粉为X1,酵母提取物为X2,磷酸二氢钾为X3,硫酸锰为X4,B.contaminans活菌数为目标函数Y,所得3次重复93组试验数据如表5。通过数据建立拮抗菌与培养条件的回归模型,回归方程为:Y=1.35+0.099 X1+0.12 X2-0.013 X3-0.002486 X4-0.12X1X2+0.013 X1X3+0.004729 X1X4+0.022 X2X3-0.002687X2X4+0.019X3X4-0.14 X12-0.1 X22-0.075X32-0.098 X42。
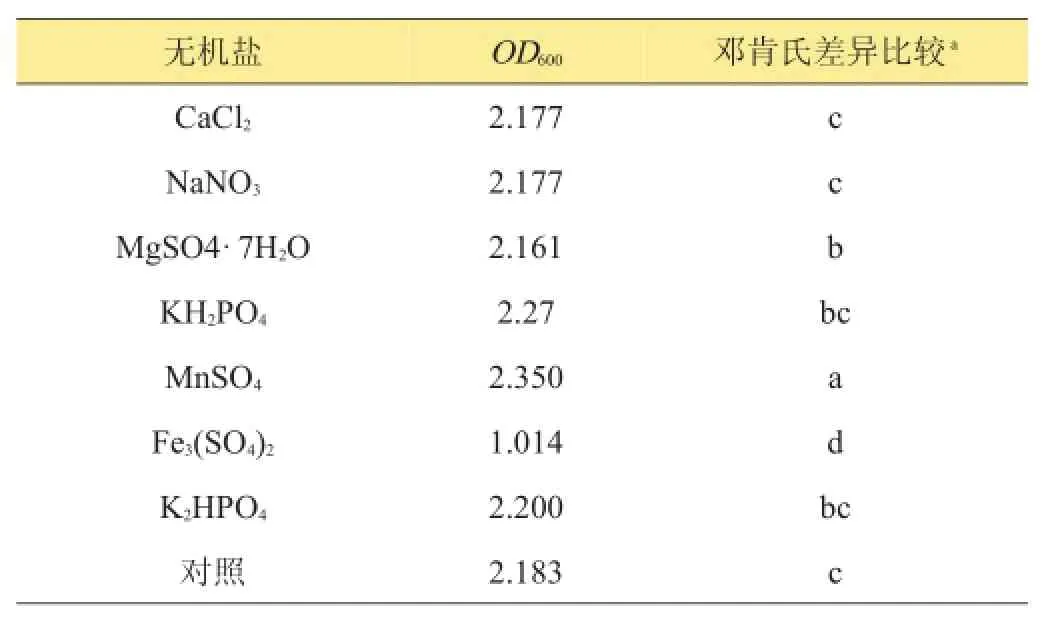
表4 B.contaminans B-1对7种无机盐的利用能力
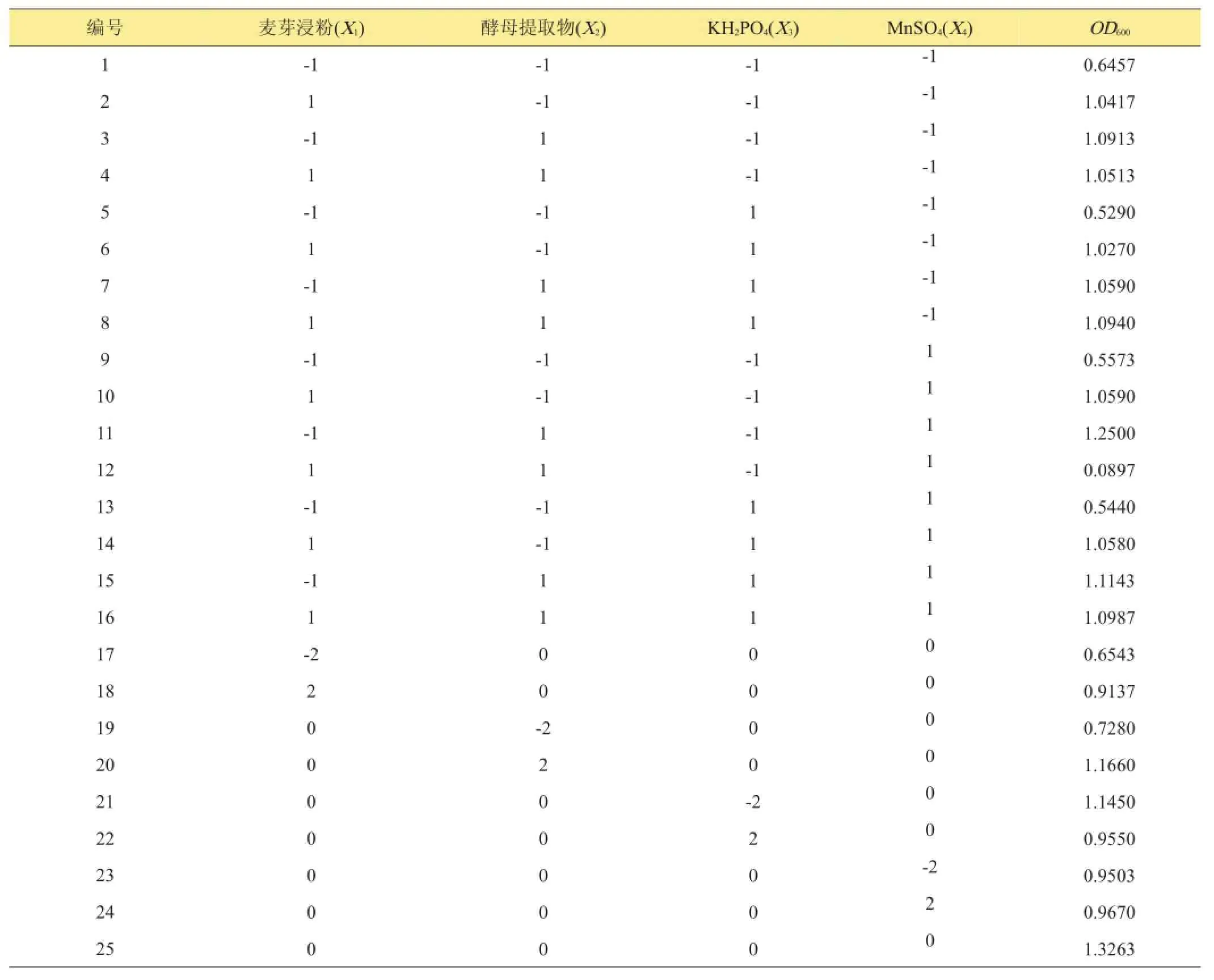
表5 二次通用旋转设计方案及结果
决定系数R2=0.9786,回归方程极显著(P<0.01),对各项回归系数检验后(表6)可知:麦芽浸粉X1、酵母提取物X2及两者二次项对B.contaminans的生长均有极显著的影响(P<0.01),磷酸二氢钾X3、硫酸锰X4的二次项和麦芽浸粉与酵母提取物交互作用也具有极显著影响(P<0.01),而2种无机盐和其交互作用影响不显著(P>0.05),由各因素F值可看出,对B.contaminans生长影响作用依次为酵母提取物、麦芽浸粉、磷酸二氢钾、硫酸锰。
2.5 单因子效应分析
由表7可知麦芽浸粉、酵母提取物对B. contaminans B-1生长均有极显著影响(P<0.01),2种无机盐则影响不显著。将4因素中的3个固定在零水平降维分析,可得出以一个因素为变量的偏回归模型,根据模型作单因素图(图2)。由图2可知contaminansB-1的生长随着麦芽浸粉、酵母提取物、磷酸二氢钾、硫酸锰浓度的增加表现出先增后减的趋势,表明这4个因素均具有最佳值,浓度过低或过高都影响菌株的生长。
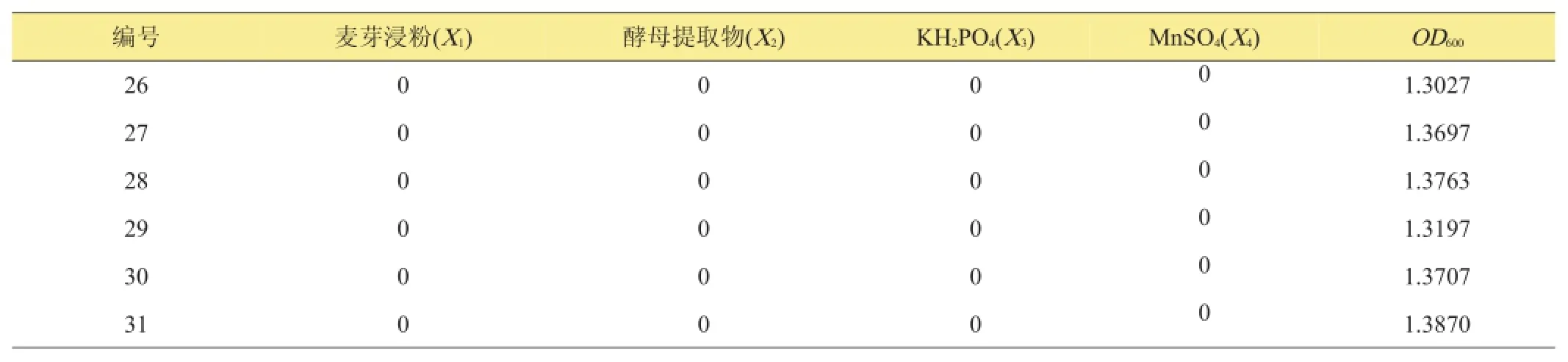
续表5

表6 回归方程各项回归系数显著性检验
2.6 培养条件分析
在回归模型中,将一个因素定在零水平,等高线图、曲面图则可体现两个因素的交互作用(图3)。图中,当麦芽浸粉固定在零水平时,B.contaminans B-1生长随酵母提取物浓度的升高,呈现先上升后下降的趋势;当酵母提取物固定在零水平时,拮抗菌的生长随麦芽浸粉含量的升高呈现先逐步上升而后慢慢下降的变化,曲面的最高点出现在X1∈[0.5%,4%],X2∈[0.75%,3%]区域。
2.7 培养条件的验证
利用Desjgn-Expert 8.0.6统计软件确定出各因素最佳水平为X1=0.115,X2=0.538,X3=-0.002,X4=-0.018,转化成编码前水平为:麦芽浸粉2.11%、酵母提取物1.9%、磷酸二氢钾0.05%,硫酸锰0.05%,对应Y值为1.38901。为验证此培养条件,用2.11%麦芽浸粉、1.9%酵母提取物、0.05%磷酸二氢钾,0.05%硫酸锰摇瓶培养B.contaminans B-1,得到的菌液稀释后OD600为1.31。误差为5.0%,与模型值接近,说明模型可用。
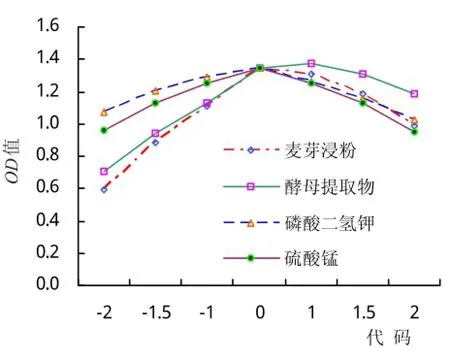
图2 各单因子与contaminans B-1生物量的关系
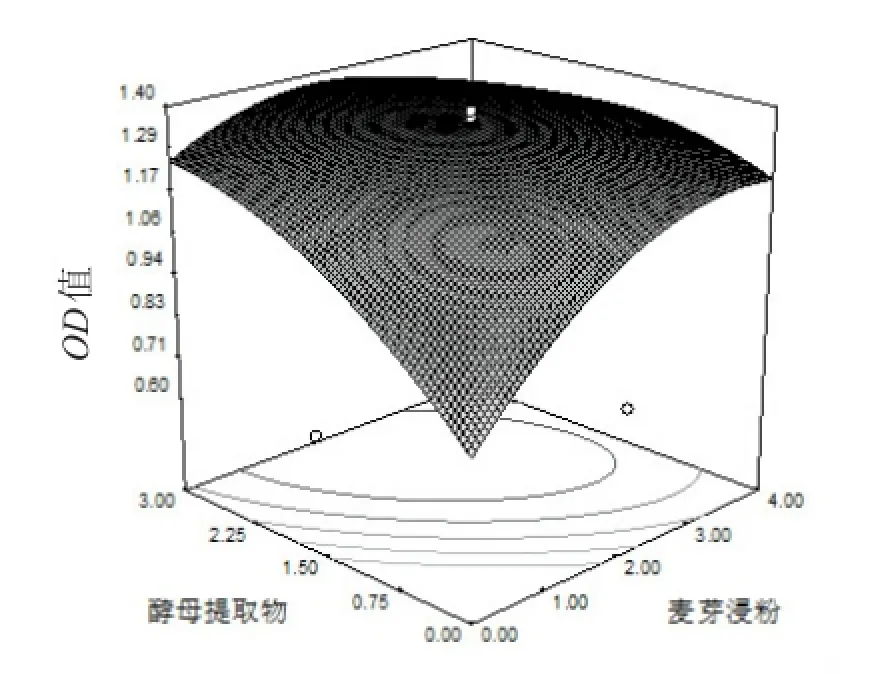
图3 麦芽浸粉与酵母提取物之间相互作用的等高线图和曲面图
3 讨论与结论
实验设计的优化方法应该能够正确构建考核指标与其各影响因子的关系,即建立合适的数学模拟方程[15-16]。使用响应面设计法克服了正交设计只能处理离散的水平值而无法找出整个区域上因素的最佳组合和响应值的最优值的缺陷,还可以分析几种因素间的交互作用,以达到较全面反映各因子水平的效果[17-20]。该方法可使实验次数大大减少,因此广泛应用于生产试验和科学研究[21-22]。
近年来微生物菌剂的研发应用受到广大研究者的普遍重视,其微生物制剂种类也较多,如枯草芽孢杆菌(Bacillus subtilis)、假单胞菌(Pseudomonas spp.)、哈茨木霉(Trichoderma harzianum)等。但是在生产应用中,常常存在发酵液活菌数量不高的问题,这样不仅限制了应用效果,也限制了产品推广[23]。关于洋葱伯克霍尔德菌的不同基因型近年也有一些研究,如吴义飞等[24]发现洋葱伯克霍尔德菌NSM-05的最适培养基为玉米粉、蛋白胨、氯化钠和硫酸镁,与本研究中筛选的碳源、氮源和无机盐不尽相同,其原因可能是由于2个菌株基因型不同,所以对其不同营养条件的需求有差异。本试验通过对拮抗菌株B.contaminans B-1培养基的优化筛选,其抑菌活性和活菌数量得到明显提高,对草莓采后灰霉病有很好的防治效果。由于本实验是在实验室摇瓶条件下进行,要实现工业化生产,还需进行发酵罐条件放大实验,在优化的发酵条件下随时检测pH变化、溶氧量变化、还原糖和氨基酸变化,在适当时满足生防菌的营养需求,以提高生防菌发酵菌量和抑菌物质产量[25-26]。
综上,本试验首先考察了不同碳源、氮源和无机盐等因素对伯克氏菌B.contaminans B-1生长的影响,根据筛选出的4个主要因素进一步进行二次通用旋转组合法,确定其最佳培养基配方为:麦芽浸粉2.11%、酵母提取物1.9%、磷酸二氢钾0.05%和硫酸锰0.05%,并对其可行性做了进一步验证,为B.contaminans B-1的产业化应用了提供理论依据。
[1]吕建华,周庆新,周沙沙,等.丁香提取液对草莓保鲜效果的影响[J].食品与生物技术学报,2009,05:633-636.
[2]李艳萍,郑服丛.草莓果实采后病害及保鲜技术[J].热带农业科学, 2002,22(2):64-69.
[3]孔秋莲,修德仁,胡文玉,等.葡萄贮藏中SO2伤害与膜脂过氧化的关系[J].果树学报,2008,25(3):322-326.
[4]Gutter Y,Littauer F.Antagonistic action of Bacillus subtilis against citrus fruit pathogens[J].Bulletin of the Research Council of lsrael, 1953,33(3):192-197.
[5]张红印,马龙传,姜松,等.臭氧结合拮抗酵母对草葛采后灰霉病的控制[J].农业工程学报,2009,25(5):258-263.
[6]张丽霞,黄开红,周剑忠,等.枯草芽抱杆菌FR4对采后草蓦的保鲜效果[J].江西农业学报,2009,21(9):124-127.
[7]Coenve T,Vandamme P,Govanjr W,et al.Taxonomy and identification of the Burkholderia cepacia complex[J].Journal of Clinical Microbiology,2001,39:3427-3436.
[8]Coenye T,Vandamme P.Diversity and significance of Burkholderia speciesoccupyingdiverseecologicalniches.Environmental Microbiology,2003,5:719-729.
[9]Elke Vanlaere,Adam Baldwin,Dirk Gevers,et al.Taxon K,a complex within the Burkholderia cepacia complex,comprises at least two novel species,Burkholderia contaminans sp.nov.and Burkholderia lata sp.nov.International Journal of Systematic and Evolutionary Microbiology,2009,59:102-111.
[10]Parke J L,Gurian-scherma D.Diversity of the Burkholderia cepacia complex and implications for risk assessment of biological control strains[J].Annual Review of Phytopathology,2001,39:225-258.
[11]范青,田世平,姜爱丽,等.采摘后果实病害生物防治拮抗菌的筛选和分离[J].中国环境科学,2001,21:313-316.
[12]谢关林,金扬秀,徐传雨,等.我国水稻纹枯病拮抗细菌种类研究[J].中国生物防治,2003,19(4):166-170.
[13]Bi Y,Tian S P,Zhao J,et al.Harpin induces local and systemic resistance against Trichothecium roseum in harvested Hami melons [J].Postharvest Biology Technology,2005,38:183-187.
[14]荣廷昭.田间试验与统计分析[M].北京:农业科学技术出版社, 1998:299-301.
[15]吴春海,郝玉有,王永红,等.统计学法优化必特螺旋霉素发酵培养基[J].中国抗生素杂志,2008,33(7):446-448.
[16]Srinivasulu B,Kim Y J,Chang Y K,et al.Construction of asm2 deletionmutantofActinosynnemapretiosumandmedium optimization for ansamitocin P-3 production using statistical approach[J].Journal of Microbiology and Biotechnology,2006,16 (9):1338-1346.
[17]海洪,汪坤,金文英,等.Box-Bchnkcn响应面法优化超声波提取蚕沙中叶绿素的工艺研究[J].食品工业科技,2009,30(3):207-211.
[18]王新雯,海洪,金文英,等.微波-超声波联合提取银杏叶黄酮工艺的响应面法分析[J].食品科技,2010,35(3):189-193.
[19]何庆元,吴萍,张晓红,等.不同秋眠性首蓓SRAP体系优化及遗传多样性分析[J].草业学报,2011,20(2):203-211.
[20]施俊凤,孙常青,王春生,等.响应面法优化采后生防菌梅奇酵母培养条件[J].中国食品学报,2015,15(1):80-84.
[21]王云飞,王成国.响应面法的理论及应用[J].中央民族大学学报:自然科学版,2005,14(3):236-240.
[22]花玉鹏,文才艺,刘伟成,等.响应曲面法优化利迪链霉菌A02发酵培养基[J].中国生物防治学报,2011,27(4):520-527.
[23]郭本恒.益生菌[M].北京:化学工业出版社,2004:27-29.
[24]吴义飞,吴小芹.新洋葱伯克霍尔德菌NSM-OS产抗菌物质的培养条件[J].林业科技开发,2014,28(4):83-86.
[25]李全阳,夏文水.乳酸菌胞外多糖的研究[J].食品与发酵工业,2003, 29(5):86-90.
[26]孙笑非,孙鸣.一株枯草芽孢杆菌发酵培养基的优化[J].饲料研究, 2009,1(2):68-69.
Medium Optimization Analysis of Biocontrol Bacteria Burkholderia contaminans B-1 Against Fruit Postharvest Grey Mould
Shi Junfeng1,Sun Changqing2,Li Jing1,3
(1Institute of Agricultural Product Storage and Fresh Keeping,Shanxi Academy of Agricultural Sciences,Taiyuan 030031,Shanxi, China;2Institute of Crop Sciences,Shanxi Academy of Agricultural Sciences,Taiyuan,030031,Shanxi,China;
3College of Life Science,Shanxi University,Taiyuan 030006,Shanxi,China)
This objective was to discover the culture medium formulation of Burkholderia contaminans with the biggest biomass yield under shake flask conditions.In this experiment,we used the multi-factor quadratic general rotary unitized design method to study the effects of varied carbon sources,nitrogen sources and inorganic salt types&concentrations on strain growth,and finally determined the proper formulation.The optimal medium formulation was as follows:malt powder 2.11%,yeast extract 1.90%,KH2PO40.05%and MnSO40.05%.It had been proved that the biomass of B.contaminans reached the maximum under this condition and showed better optimization effects by further detection.This optimization analysis will pave the way for establishing high yield fermentation process of B.contaminans,and facilitate its application in afterharvest biocontrol of fruits and vegetables,and industrialized development as well.
Burkholderia contaminans B-1;Culture Medium;Quadratic General Rotary Combination; Optimization Analysis
S476
A论文编号:cjas16060005
山西省科技攻关项目“拮抗菌Burkholderia contaminans对草莓采后生防技术的研究”(20140311025-2);山西省农业科学院博士基金“拮抗菌Burkholderia contaminans对草莓采后生防潜力研究”(YBSJJ1414);山西省农业科学院博士后基金“生防菌株对果实采后灰霉病防治机理研究”(BSH-2015JJ-003)。
施俊凤,女,1977年出生,山西代县人,副研究员,博士,主要从事果蔬采后病害及其生物防治研究。通信地址:030031山西省太原市小店区龙城大街79号省农科院保鲜所,Tel:0351-7126730,E-mail:sjfty@126.com。
2016-06-01,
2016-07-21。

