豆科植物多花木蓝抑菌活性成分研究
苏 生, 张 莉, 杜文林, 胡华林, 杨 华,沈 玲, 韩永芬, 李
(1.贵州省草业研究所, 贵阳 550006; 2. 贵州医科大学药学院, 贵阳 550025; 3. 贵州省中国科学院天然产物化学重点实验室, 贵阳 550002; 4. 延安大学化学化工学院, 延安 716000; 5.西安工程大学环境与化学工程学院, 西安 710048)
豆科植物多花木蓝抑菌活性成分研究

(1.贵州省草业研究所, 贵阳 550006; 2. 贵州医科大学药学院, 贵阳 550025; 3. 贵州省中国科学院天然产物化学重点实验室, 贵阳 550002; 4. 延安大学化学化工学院, 延安 716000; 5.西安工程大学环境与化学工程学院, 西安 710048)
活性追踪下,采用柱层析分离多花木蓝籽石油醚提取物中的抑菌活性物质。采用生长速率法和牛津杯法,选取稻瘟病菌、辣椒枯萎病菌、油菜菌核病菌、梨黑星病菌为测试真菌,青枯菌、大肠杆菌、金黄葡萄球菌、绿脓杆菌、枯草芽胞杆菌为测试细菌,测试了一级柱层析各流分的抑菌活性,测试结果显示:A-4和A-5流分对所有测试菌均具有一定的抑菌活性,对梨黑星病菌的抑制作用最好,抑制率分别达到77.66%和74.67%;对青枯菌的抑菌圈最大,分别为1.37 cm和1.66 cm。分离出2个活性化合物,经13C、1H NMR 波谱方法鉴定,为Balansenate Ⅰ、Ⅱ,为首次从该植物中分离得到。生测结果显示2个化合物具有较低的抑菌活性,其对金黄葡萄球菌活性最好,但最小抑菌浓度(MIC)和最小杀菌(MBC)浓度均只为250 mg/L和500 mg/L。
多花木蓝; 抑菌活性; 活性化合物
病虫草鼠害对农业生产造成的经济损失巨大,故农药已经成为农业生产中的重要生产资料,我国则已成为农药生产使用的世界第二大国。但是,随着化学合成农药的使用,农药的负面效应越来越严重,如环境污染、对人体健康的影响、“三R”问题等。从植物中提取的具有农用活性的化合物与环境相容性好、对非靶标生物安全,可用于解决农业生产中出现的病虫害等问题[1],故其研究与开发已经成为研发新农药的热点之一[2]。
多花木蓝IndigoferaamblyanthaCraib为豆科木蓝属植物,别名野蓝枝、马黄消、野绿豆树(罗田)等,广泛分布于我国南北方各省,生于海拔1 000 m以下山坡或灌丛中[3-4],对土壤要求不严,具有较强的抗逆性,且未发现有严重的病虫害,是边坡恢复的良好物种。本实验室报道了多花木蓝籽石油醚提取物具有良好的抑菌活性,并对其粗提物的化学成分进行了分析[5],但具体的抑菌活性物质一直未见报道。故本文在此基础上,采用活性追踪法,提取分离了多花木蓝籽中的抑菌活性物质,并鉴定了其化学结构,测试了其抑菌活性,以期为开发多花木蓝为植物源抑菌剂奠定理论基础。
1 材料与方法
1.1 试验材料
1.1.1 植物样品
多花木蓝于2013年10月采自贵州省草业研究所独山试验基地,经贵州省中国科学院天然产物化学重点实验室顾玮副研究员鉴定为本品,阴干备用。
1.1.2 供试菌株
真菌:稻瘟病菌Magnaporthegrisea(Hebert) Barrnov.、辣椒枯萎病菌Fusariumoxysporum、油菜菌核病菌Sclerotiniasclerotiorum(Lib.)de Bary、梨黑星病菌Venturiapyrina,均由贵州省中国科学院天然产物化学重点实验室提供。
细菌:青枯菌Ralstoniasolanacearum、大肠杆菌Escherichiacoli、金黄葡萄球菌Staphylococcusaureus、绿脓杆菌Pseudomonasaeruginosa、枯草芽胞杆菌Bacillussubtilis,均由贵州省中国科学院天然产物化学重点实验室提供。
1.1.3 培养基
马铃薯土豆培养基(PDA):20%马铃薯,2%蔗糖,2%琼脂,水100 mL,pH 6.0。
牛肉膏蛋白胨培养基(BPA):0.5%牛肉膏,1%蛋白胨,0.5%NaCl,水100 mL,pH 7.0~7.2,2%琼脂。
Mueller-Hinton 肉汤培养基(MHB):牛肉粉 2.0 g,可溶性淀粉 1.5 g, 酸水解酪蛋白 17.5 g,pH 7.4±0.2,水 1 000 mL。
1.2 仪器与试剂
1.2.1 仪器
RE 52-99型亚荣旋转蒸发仪(上海亚荣生化仪器厂);SW-CJ-2FD型超净工作台(苏州净化设备有限公司);BIC-250型人工气候箱(上海博讯实业有限公司);XH-C涡旋混合器(上海沪西分析仪器厂);FA2204B万分之一电子天平(上海精密科学仪器有限公司);Agilent-NMR-inova400超导核磁共振谱仪;HP6890/5975C GC/MS联用仪(美国安捷伦公司)。
1.2.2 试剂
石油醚(60~90℃)、甲醇、氯仿、乙酸乙酯、丙酮、二甲亚砜(DMSO)均为市售分析纯试剂,薄层层析硅胶、柱层析硅胶均为青岛海洋化工厂产品,重蒸水。
1.3 试验方法
1.3.1 提取分离方法
将多花木蓝籽1.0 kg粉碎(过20目筛),用5 000 mL石油醚超声提取2 h,过滤,滤渣重复用5 000 mL石油醚提取2次,合并提取液,回收溶剂后得浸膏153.0 g。称取150 g样品进行一级柱层析,硅胶(100~200目),柱层析(80 mm×1 200 mm),以石油醚∶二氯甲烷(10∶0,9∶1,8∶2,7∶3,6∶4,5∶5,0∶10)为流动相梯度洗脱,每300 mL收集1份,TLC检测,合并后得到A-1(1.345 2 g)、A-2(4.365 4 g)、A-3(14.368 4 g)、A-4(5.351 0 g)、A-5(6.315 2 g)、A-6(18.321 0 g)、A-7(33.234 1 g)、A-8(32.651 2 g)、A-9(5.324 6 g)、A-10(3.624 5 g)、A-11(2.369 4 g)、A-12(3.365 4 g)、A-13(1.365 2 g)。活性测试结果显示A-4和A-5具有抑菌活性,故采用二级柱层析分离A-4和A-5流分。准确称取A-4流分5.000 0 g,硅胶(200~300目),柱层析(20 mm×450 mm),以石油醚∶乙酸乙酯10∶1为流动相,每30 mL收集1份,TLC检测,得到化合物1(1.635 2 g)。准确称取A-5流分6.000 g,硅胶(200~300目),柱层析(20 mm×450 mm),以石油醚∶丙酮10∶2为流动相,每30 mL收集1份,TLC检测,得到化合物2(1.534 6 g)。测试化合物1和 2的抑菌活性。
1.3.2 抑菌活性测试方法
抑制真菌活性测试:将一级柱层析各流分样品用一定量的DMSO溶解,再以PDA灭菌培养基稀释成 2 000 mg/L的浓度,采用生长速率法测定其活性[6]。用十字交叉法测量菌落直径,计算菌丝生长抑制率。
菌落生长直径(mm)=3次直径平均值 -
菌饼直径(4.0 mm);
菌丝生长抑制率(%)=

抑制细菌活性测试:将一级柱层析各流分样品溶解在适量DMSO中,加入少许吐温-80,加水稀释使DMSO含量为2.5%,使各流分浓度为2 000 mg/L,采用牛津杯法测试各流分抑制细菌活性[7]。用十字交叉法测量抑菌圈直径。
采用96孔板微量稀释法测试纯品抑制细菌的活性[8-9]:将供试样品以DMSO溶解,再以水稀释至2 000 mg/L的质量浓度,MHB肉汤培养基进行2倍稀释,使得DMSO含量为2.5%,以无菌水为阴性对照。无菌培养液和2.5% DMSO溶液为空白对照。微孔板振荡混合后,置于37℃培养箱内培养18 h后观察结果,肉汤没有浑浊的孔中的最低药液质量浓度为样品对供试细菌的最低抑菌质量浓度(MIC),取没有浑浊的孔中的肉汤,接种于未加药的培养基平板上,37℃培养12 h后取出观察,没有细菌生长的最低药液质量浓度为样品对供试菌的最低杀菌质量浓度(MBC)。所有活性测定均重复3次。
2 结果与分析
2.1 一级柱层析各流分抑菌活性测试结果
一级柱层析各流分抑制真菌生长活性测试结果显示A-4、A-5对测试菌具有一定的抑制作用,其余流分均没有显示出抑制活性。A-4、A-5流分对真菌生长的抑制活性结果见表1。当样品浓度为2 000 mg/L时,2个样品在3 d 和7 d 后的抑菌活性没有明显的区别,其中对梨黑星病菌的活性最高,3 d 的抑制率分别为77.66%和75.29%,7 d 的抑制率分别为74.67%和73.41%,对其他植物病原菌的活性在不同时间段的活性均相当。
表1 A-4和A-5流分对真菌生长的抑制活性1)
Table 1 Fungistatic activity of A-4 and A-5 fractions of the chromatography
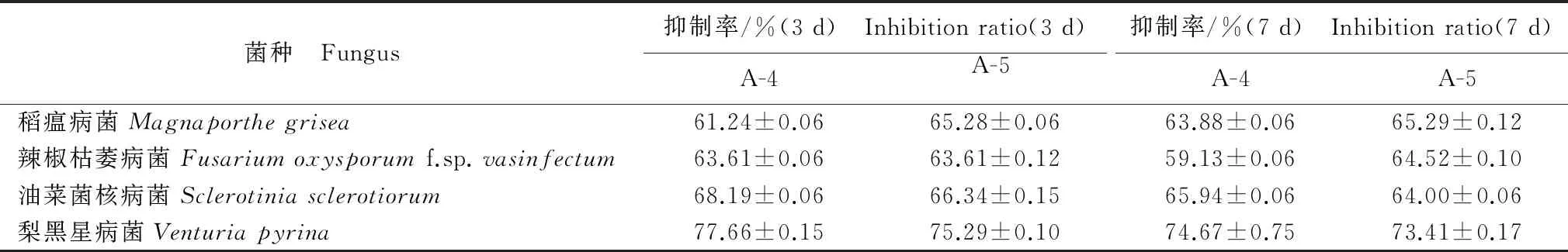
菌种 Fungus抑制率/%(3d) Inhibitionratio(3d)A-4A-5抑制率/%(7d) Inhibitionratio(7d)A-4A-5稻瘟病菌Magnaporthegrisea61.24±0.0665.28±0.0663.88±0.0665.29±0.12辣椒枯萎病菌Fusariumoxysporumf.sp.vasinfectum63.61±0.0663.61±0.1259.13±0.0664.52±0.10油菜菌核病菌Sclerotiniasclerotiorum68.19±0.0666.34±0.1565.94±0.0664.00±0.06梨黑星病菌Venturiapyrina77.66±0.1575.29±0.1074.67±0.7573.41±0.17
1) 表中数据为3次重复的平均值±标准误。 Data are mean±SE from 3 replications.
一级柱层析各流分抑制细菌活性测试结果与抑制真菌生长活性相似,A-4、A-5具有一定的抑菌活性,其余流分均没有显示出抑制活性。A-4、A-5流分对细菌的抑制活性见表2。当样品浓度为2 000 mg/L时,A-5流分对青枯菌的抑菌圈直径最大,为1.66 cm,A-4流分对金黄葡萄球菌的抑菌圈直径最小,为1.16 cm。
表2 A-4和A-5流分对细菌的抑制活性1)
Table 2 Antibacterial activity of A-4 and A-5 fractions of the chromatography
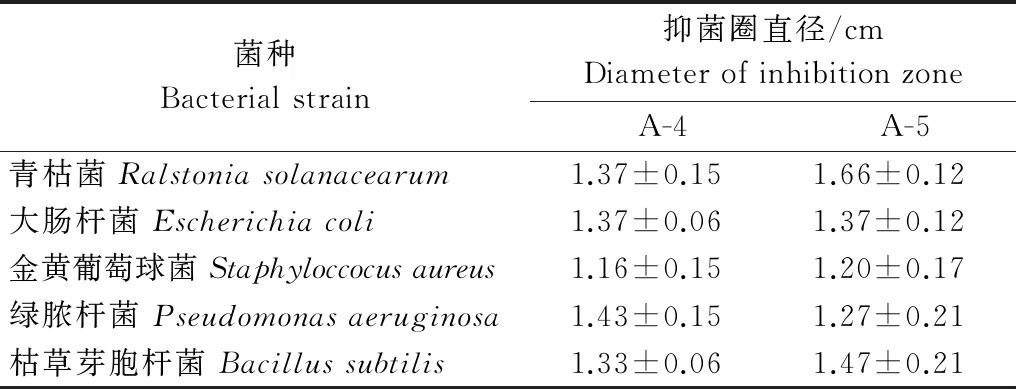
菌种Bacterialstrain抑菌圈直径/cmDiameterofinhibitionzoneA-4A-5青枯菌Ralstoniasolanacearum1.37±0.151.66±0.12大肠杆菌Escherichiacoli1.37±0.061.37±0.12金黄葡萄球菌Staphyloccocusaureus1.16±0.151.20±0.17绿脓杆菌Pseudomonasaeruginosa1.43±0.151.27±0.21枯草芽胞杆菌Bacillussubtilis1.33±0.061.47±0.21
1) 表中数据为3次重复之平均值±标准误。 Data are mean±SE of 3 replications.
2.2 化合物1和2抑制细菌活性测试结果
化合物1和2抑制细菌活性测试结果见表3,由表可知,化合物1和2均具有较弱的抑菌和杀菌活性。2个化合物对金黄葡萄球菌的活性均最好,MIC和MBC值均为250 mg/L和500 mg/L,对其他测试菌的MIC和MBC值均为500 mg/L和1 000 mg/L。
2.3 化合物1和2的结构
表3 化合物1和2对细菌的抑制活性测试结果
Table 3 The antibacterial activity of compound 1 and 2
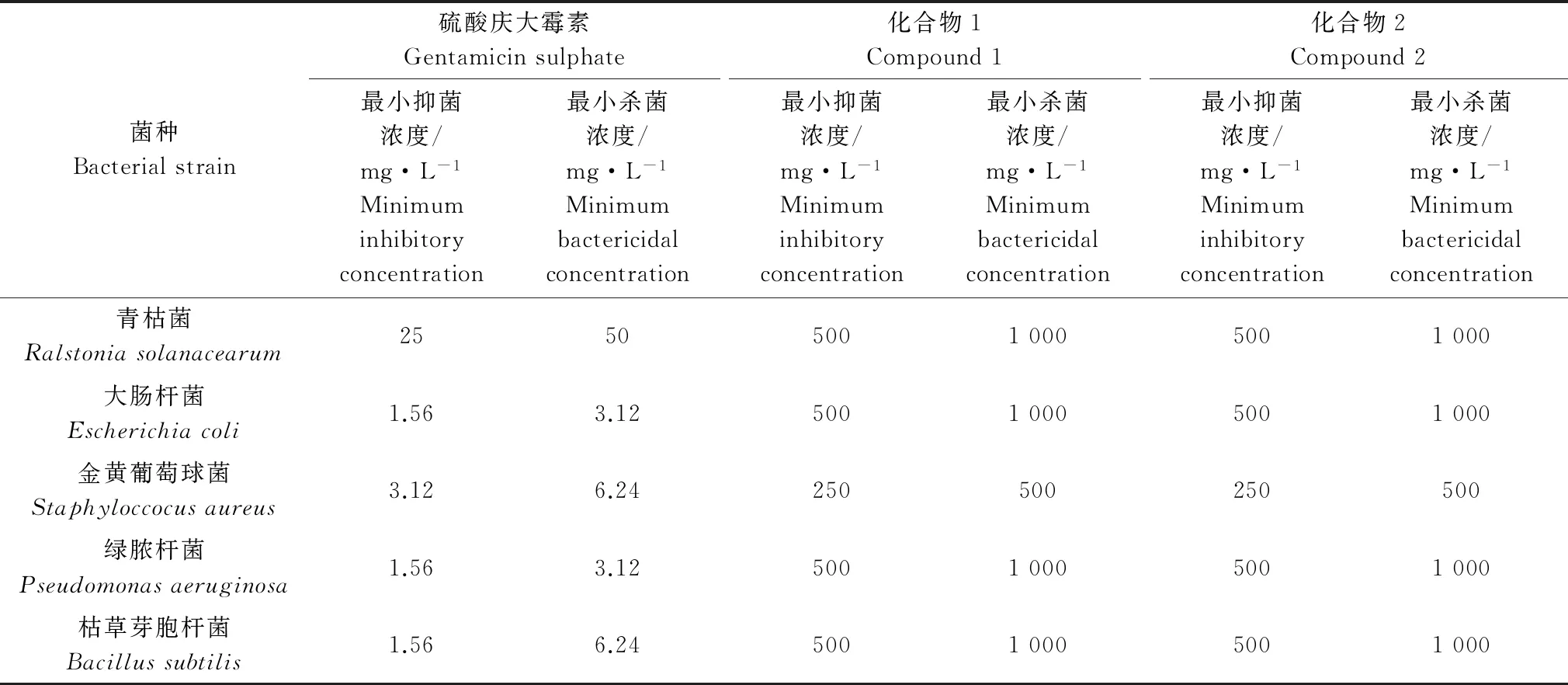
菌种Bacterialstrain硫酸庆大霉素Gentamicinsulphate最小抑菌浓度/mg·L-1Minimuminhibitoryconcentration最小杀菌浓度/mg·L-1Minimumbactericidalconcentration化合物1Compound1最小抑菌浓度/mg·L-1Minimuminhibitoryconcentration最小杀菌浓度/mg·L-1Minimumbactericidalconcentration化合物2Compound2最小抑菌浓度/mg·L-1Minimuminhibitoryconcentration最小杀菌浓度/mg·L-1Minimumbactericidalconcentration青枯菌Ralstoniasolanacearum255050010005001000大肠杆菌Escherichiacoli1.563.1250010005001000金黄葡萄球菌Staphyloccocusaureus3.126.24250500250500绿脓杆菌Pseudomonasaeruginosa1.563.1250010005001000枯草芽胞杆菌Bacillussubtilis1.566.2450010005001000
化合物1结构见图1,其波谱数据与文献一致[10], 名称为6,8,11-三甲基十二酸(2E)-3′-甲基-十六-2-烯酯,分子式为C32H62O2,该化合物首次从多花木蓝中分离得到。
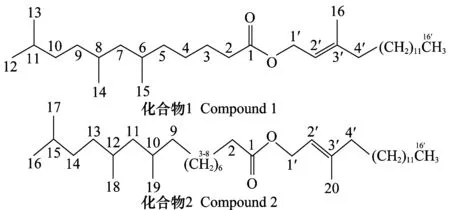
图1 化合物1和2的化学结构图Fig.1 Structures of compounds 1 and 2
化合物2结构见图1,其波谱数据与文献一致[10], 名称为17,18,19-三甲基十六酸(2E)-3′-甲基-十六-2-烯酯,分子式为C36H70O2,该化合物首次从多花木蓝中分离得到。
3 讨论
多花木蓝籽石油醚提取物浓度为4 000 mg/L时,其对多种植物病原真菌表现出较好的抑菌活性,抑制率均可达到70%以上[5]。一级柱层析后,当A-4、A-5流分浓度为2 000 mg/L时,除梨黑星病菌外,对其他测试菌的抑制率均低于70%。一级柱层析后,活性化合物集中于A-4和A-5流分,然而其活性并未有显著的提高。另外,2个酯类的活性化合物的MIC和MBC值也主要集中在500 mg/L和1 000 mg/L,其抑菌活性较弱。推测可能多花木蓝籽石油醚提取物中存在一些具有增效作用的化合物,随着分离程度的提高,增效物质的含量降低,故其抑菌活性也降低,但是其具体的原因还有待进一步验证。
本试验前期曾报道了豆科植物多花木蓝籽石油醚提取物具有一定的抑菌活性[5],在此基础上,本实验室在活性追踪下分离出2个酯类活性化合物,它们的化学结构较简单,但其表现出的抑菌活性较弱,故改造其化学结构,以期提高抑菌活性,是本课题组下一步将要研究的内容。
[1] 徐苏酩. 天然产物源农药和农药先导物[J]. 农药译丛,1994(2):18-24.
[2] 单承莺,马世宏,张卫明. 我国植物源农药研究进展[J]. 中国野生植物资源,2011, 30(6):14-23.
[3] 中国科学院西北植物研究所编著. 秦岭植物志[M].北京:科学出版社, 1981:34-35.
[4] 傅书遐. 湖北植物志[M]. 武汉:湖北科学技术出版社, 2002:276-280.
[5] 毛心莹,苏生,曹红旗,等. 多花木蓝抑菌活性及其化学成分研究[J]. 广东农业科学,2015(15):48-52.
[6] Li Yan, Shen Binbin, Li Jun, et al. Antimicrobial potential and chemical constituent ofMikaniamicranthaH.B.K.[J]. African Journal of Microbiology Reasearch, 2013, 7(20): 2409-2415.
[7] 刘冬梅, 李理, 杨晓泉, 等. 用牛津杯测定益生菌的抑菌活力[J]. 食品研究与开发杂志, 2006(3): 110-111.
[8] Jorgensen J H.Invitroactivity of daptomycin against vancomycin-resistant enterococci of various van types and comparison of susceptibility testing methods [J]. Antimicrobial Agents and Chemotherapy, 2003, 47(12): 3760-3763.
[9] 李健强, 李六金. 兽医微生物实验实习指导[M]. 西安: 陕西科学技术出版社, 1999: 29-30.
[10]Yeh-Hsin Tsai, Ih-Sheng Chen, Ian-Lih Tsai. New long-chain esters and adenine analogs from the leaves of formosanBrideliabalansae[J]. Helvetica Chimica Acta,2003,86:2452-2457.
(责任编辑:田 喆)
Antimicrobial constituents ofIndigoferaamblyantha
Su Sheng1, Zhang Li1, Du Wenlin2, Hu Hualin3, Yang Hua4, Shen Ling5, Han Yongfen1, Li Yan3
(1.GuizhouInstituteofPrataculture,Guiyang550006,China; 2.SchoolofPharmacyofGuizhouMedicalUniversity,Guiyang550025,China; 3.TheKeyLaboratoryofChemistryforNaturalProductsofGuizhouProvinceandChineseAcademyofSciences,Guiyang550002,China; 4.SchoolofChemical&ChemicalEngineering,Yan’anUniversity,Yan’an716000,China; 5.SchoolofEnvironmentalandChemicalEngineering,Xi’anPolytechnicUniversity,Xi’an710048,China)
Antimicrobial constituents of the seeds ofIndigoferaamblyanthaCraib were isolated by using bioactivity-guided fractionation. The antimicrobial activity assays were designed against the fungiMagnaporthegrisea,Fusariumoxysporum,SclerotiniasclerotiorumandVenturiapyrinaby using the hyphal growth inhibition method and the bacteriaRalstoniasolanacearum,Escherichiacoli,Staphyloccocusaureus,PseudomonasaeruginosaandBacillussubtilisby using the disc method. The results showed that A-4 and A-5 fractions had higher bioactivity than others. Their inhibition ratios againstV.pyrinawere 77.66% and 74.67 %, respectively. The diameters of inhibition zone againstR.solanacearumwere 1.37 cm and 1.66 cm, respectively. Two compounds with antimicrobial activity were isolated and elucidated as Balansenate Ⅰ and Ⅱ mainly by1H and13C NMR spectral data. The results of bioassay showed that the MIC values and the MBC values of the two compounds againstS.aureuswere 250 and 500 mg/L, respectively.
Indigoferaamblyantha; antimicrobial activity; antimicrobial compound
2016-02-22
2016-03-29
贵州省自然科学基金(黔科合J字[2013]2154号);西安工程大学博士科研启动项目(BS1310)
S482.2 92
A
10.3969/j.issn.0529-1542.2017.01.020
* 通信作者 E-mail:liyan1612@163.com

