对立统一规律在卤代烷亲核取代和消除反应机理中的教学思考

摘要:卤代烷的取代、消除反应机理类型复杂,影响因素众多,是有机化学教学和学习中的一大难点。采用对立统一规律指导和分析卤代烷亲核取代反应和消除反应的机理及其影响因素,有助于加深对有机化学反应规律的理解和学习,能起到事半功倍的效果。
关键词:卤代烷;亲核取代反应;消除反应
中图分类号:G642.0 文献标志码:A 文章编号:1674-9324(2017)02-0196-04
有机化学存在内容多、反应类型多样等特点,易使学生产生畏难情绪[1]。卤代烃一章,包含卤代烷的亲核取代反应、消除反应等内容,其反应机理是有机化学的重要基础知识,在整个教学体系中非常重要[2];但卤代烷的亲核取代和消除反应是一对竞争性反应,亲核取代反应中又存在SN1、SN2的竞争,消除反应中存在E1、E2的竞争,内容繁杂,属于有机化学的难点[3]。
一、卤代烷的亲核取代反应和消除反应
卤代烷中,与卤原子直接相连的碳原子易被亲核试剂进攻,结果是卤原子以X-的形式离去,原来与卤原子相连的碳原子结合了亲核试剂形成新的稳定化合物,表观看来,就是亲核试剂取代了原来卤代烷中的卤素,这就是卤代烷的亲核取代反应。卤代烷在强碱性试剂的进攻下,可以生成产物烯烃。这种从一个分子中脱去两个原子或基团的反应称为消除反应。
1.卤代烷的亲核取代反应与机理。卤代烷的亲核取代反应用一个通式(图1)表达如下:
式中,Nu表示亲核试剂,一般带有负电荷或未共用电子对,对正电中心有亲和力;L表示离去基团,在此类型反应中,通常是指被取代的卤原子,以X-形式离去。
在此反应中,旧键(R—L)的断裂与新键(R—Nu)的生成可能有两种情况:
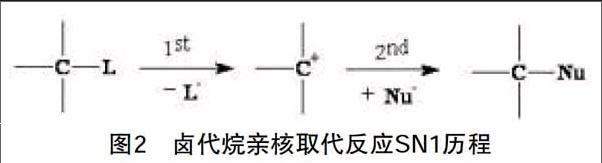
(1)旧键断裂后新键生成,即反应分两步进行(图2):
研究发现,这类反应的反应速率只与反应物的浓度有关,其反应速率表达式为v=k1[R—L]。进一步研究发现,这是因为反应式(图2)中,第二步反应是在第一步反应后进行的,第一步反应中,离去基团L的离去速率慢,是总反应的决速步,导致总反应速率只与第一步反应有关。这样的反应机理被称为SN1反应历程,即单分子反应历程。SN1反应历程,第一步产生了碳正离子中间体,其中心碳原子是sp2杂化,具有平面构型,使得第二步反应中亲核试剂从碳正离子平面的两侧进攻,导致取代产物中构型保持与构型转化几率相近;同时,碳正离子中间体受结构稳定性影响,常伴有重排现象。
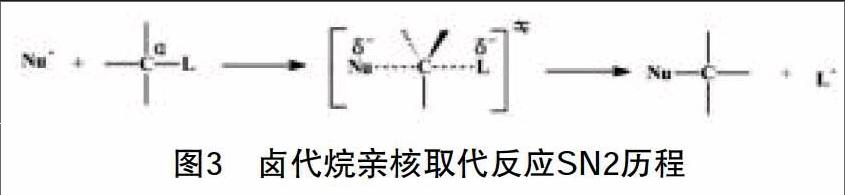
(2)旧键的断裂和新键的生成同时进行,即反应一步完成(图3):
这类反应的速率表达式是v=k2[R—L][Nu-],即反应速率与反应物浓度和亲核试剂浓度都有关系,被称为双分子反应历程,即SN2反应历程。SN2反应历程的特点是反应一步完成,旧键的断裂与新键的生成同时进行,过渡态的中心碳上连接有5个原子或基团,能量高,不稳定;反应的最终结果是Nu从另一侧“挤走”(取代)L基团,反应物分子发生Walden转化,即构型翻转。大多数同学反映:SN1、SN2历程容易理解,可一旦牵涉到具体反应,推测反应产物结构时,就乱成“一锅粥”。这主要是因为SN1、SN2反应历程间存在对立统一关系,同学们在学习时未能很好把握这对竞争历程的转化及其影响因素:烷基结构、离去基团、亲核试剂以及溶剂极性等条件的影响。
2.卤代烷的消除反应与机理。与取代反应类似,消除反应的机理也有两种:双分子消除反应(E2)和单分子消除反应(E1)。
(1)α-C—X键和β-C—H键同时断裂,反应一步完成,脱去HX形成烯烃。如图4所示,强碱OH-逐渐接近β-H,与之结合;同时,X带着一对键合电子逐渐离开中心碳原子(α-C),在此期间电子云逐渐重新分配,最后旧键完全断裂,新键完全生成,形成烯烃。这个反应是一步完成的,动力学研究表明,其反应速率与反应物的浓度和强碱的浓度都成正比,故称为双分子消除反应历程(E2)。实验表明,在按E2进行的消除反应中,一般发生反式消除。
(2)α-C—X键首先断裂生成活性中间体碳正离子,然后在碱的作用下,β-C—H键断裂生成烯烃,消除反应分两步完成。如图5所示,卤代烷在碱性水溶液中解离为碳正离子,随后OH-进攻:若进攻中心碳原子则生成取代产物,若进攻β-氢原子则发生消除反应生成烯烃。
第一步反应是慢步骤,第二步是快步骤,消除反应总速率由第一步决定,故称为单分子消除反应历程(E1)。由于存在碳正离子中间体过程,E1反应也常发生重排反应。至于E1、E2消除反应中多个β-氢原子的选择性问题,主要与最终产物烯烃的稳定性有关。但教学实践中发现,因影响E1、E2消除反应机理的因素与亲核取代反应类似,也包括:烷基结构、卤原子、进攻试剂以及溶剂极性等,容易造成混淆;再加上卤代烷的亲核取代(SN)反应与消除反应(E)之间还存在竞争,学生在学习时难以把握。要从根本上改变学生对卤代烷取代、消除反应机理的学习态度,有必要采用对立统一规律指导和分析各影响因素对卤代烷反应规律的影响,使学生明确取代反应(SN)和消除反应(E)的对立统一、取代反应中SN1与SN2的对立统一,消除反应中E1与E2的对立统一,总体把握卤代烷的化学反应规律,加深对具体条件下哪种机制占优的理解,达到掌握和运用化学反应规律解决实际问题的目的。
二、对立统一规律在亲核反应机理中的体现与应用
1.矛盾普遍性的体现。卤代烷发生亲核取代反应、消除反应而言,其中存在矛盾的普遍性是指卤代烷的结构。卤代烷分子与其他有机物一样,是典型的共价键分子,即原子间通过共用一对电子结合成键,成键电子为两个成键原子所共有。在卤代烷中,由于卤原子F、Cl、Br、I的电负性依次为4.0、3.0、2.8、2.6,皆大于碳原子的电负性2.5,使得C—X共价键中的共用电子对偏向于卤原子,从而使卤原子带部分负电荷,碳原子带部分正电荷,C—X共价键是一种极性共价键。正因为C—X键是极性共价键,断裂方式一般是异裂:成键的一对电子完全成为成键原子中的一个原子或基团所占有,异裂后形成负电性的X-离子和正电性的碳中心基团(图6)。
该正电性的碳中心基团恢复电中性的途径有两条:一条途径是X-离去的同时,与另一个负电性基团Nu-(即亲核试剂)结合,卤代烷分子维持了电中性,结果是卤代烷发生了亲核取代反应(图1)。另一条途径是继续失去一个正电性基团:由于卤原子电负性大,产生的静电诱导效应沿分子链的传递,使卤代烷中的β-氢原子表现出一定的正电性,即使β-氢原子表现出一定的活泼性,在强碱性试剂的进攻下容易离去,即在碳卤键断裂后形成的正电性的碳中心基团的基础上,再失去一个正电性基团(H+),形成电中性的烯烃产物,总的结果是卤代烷发生了消除反应(图7)。
上述反应历程说明,卤代烷分子中,碳卤键成键时电子对共用与断键时电子对独占的矛盾,即碳卤极性键的异裂是发生卤代烷亲核取代和消除反应的根本原因。在碳卤键异裂形成正电性的碳中心基团时,受到亲核试剂(Nu-)和强碱(B-)的进攻,由于亲核试剂和强碱都是带有未共用电子对的基团,都对正电性中心具有亲和作用:亲核试剂Nu-亲和卤代烷反应物分子中的部分正电性的α-碳中心,发生取代反应;或是强碱B-亲和卤代烷反应物分子中带微弱正电性的β-氢原子,发生消除反应,这也就导致了卤代烷的亲核取代反应和消除反应的竞争。
2.内部矛盾与外部矛盾特殊性的体现。在卤代烷的亲核取代反应及消除反应中,发生化学反应(碰撞)的两分子:反应物与进攻试剂的结构是内因,而反应条件,如温度、溶剂等因素是外因[1]。
(1)亲核取代与消除反应的竞争。如上所述,发生碰撞的两分子:反应物与进攻试剂的结构是内因,决定反应发展的趋势和方向;溶剂和反应温度是外因,通过对内因的作用而影响反应的取向。
①反应物结构。反应物结构依据卤素连接的碳原子不同而分为:伯、仲、叔卤代烷,就是卤代烷的α-碳原子上连有支链多少的不同:α-碳原子上连有支链越多,进攻试剂遇到的阻碍越大,难以发生亲核取代反应;反之,α-碳原子上连有支链,增加了消除时生成类似烯烃的过渡态双键碳原子上的烷基而相对稳定[2],有利于消除反应。简而言之,就是3°卤代烷易发生消除反应,1°卤代烷和卤代甲烷易发生亲核取代反应,也是金属炔化物进行烷基化合成高级炔烃、Williamson合成醚反应中采用伯卤代烷的原因。
②进攻试剂。如上节所述,不论是亲核试剂,还是强碱性进攻试剂,一般都是带有未成键电子对的基团。但是,若进攻试剂的碱性强,则有利于消除反应;若进攻试剂的碱性弱,亲核性强,C+的能力,则有利于取代反应。不同基团的亲核能力的比较详见上文。
③溶剂的极性。根据Hughes-Ingold的假定,溶剂对反应的影响可总结为[3-4]:如果中间体/过渡态比起始反应物分子具有更大的电荷密度,则溶剂极性的增加将使这些反应的速率加快,反之,溶剂极性的增加将使这些反应的速率降低。如果从反应物分子到中间体/过渡态的转变过程,电荷密度变化很小或者没有变化,则溶剂极性的改变对这类反应速率的影响可以忽略。对于双分子反应,SN2和E2反应历程的过渡态分别见图3和图4,虽然两种过渡态与反应物分子比较,负电荷比较分散,但SN2过渡态中负电荷分散于三原子中心,E2过渡态中负电荷分散于五原子中心,相对而言,消除反应E2历程过渡态电荷分散程度更大,故强极性溶剂不利于消除反应,弱极性溶剂对消除反应比对取代反应更有利。如2-溴丙烷和碱在乙醇和水的混合溶液中进行反应时,极性比乙醇强的水含量增加时,消除反应产物——烯烃的生成量减少。若反应按单分子历程进行,不论取代还是消除反应,第一步都是生成碳正离子(慢步骤),电荷密度更大,极性溶剂有利;再分析考察第二步反应,即由碳正离子生成产物时的过渡态的溶剂稳定化作用:与双分子反应类似,SN1过渡态电荷分散程度比E1过渡态小,故增加溶剂的极性更不利于E1反应。综合来看,溶剂极性这一外因主要是通过对中间体或过渡态结构稳定性这一内因的作用来影响反应历程的,这也解答了同学们在学习过程中对于卤代烷与强碱(如1-溴丁烷与氢氧化钠)反应,水溶液反应生成醇,而醇溶液反应生成烯烃的困惑。
④反应温度。温度对反应历程的影响主要体现在旧键断裂环节。反应就是旧键断裂和新键生成,旧键断裂需要能量,因此,升高温度都是有利的。但仔细比较两种反应就会发现:从反应总体来看,消除反应需要断裂C—X键和C—H键,取代反应只要断裂C—X键,消除反应需要的能量更多;或是从反应历程分析,不论是单分子历程,还是双分子历程,消除反应中旧键断裂或拉长所需的能量也必然高于取代反应,故升高温度对消除反应更有利。这也就是在进行取代反应操作时,要注意控制反应温度,避免温度过高产生过多的消除产物烯烃的原因。
(2)亲核取代反应中SN1和SN2历程的竞争。卤代烷亲核取代SN1和SN2历程的影响因素,也有内因外因之分,内因包括:烷基结构、离去基团、亲核试剂,外因主要是溶剂的影响。
①烷基结构。烷基结构对亲核取代历程的影响主要体现在中间体或过渡态的稳定性上。对SN1历程而言,反应分两步,第一步是慢步骤,生成碳正离子中间体(图2),中间体越稳定则越容易生成。对于碳正离子而言,其电荷分散程度决定其稳定性顺序是3°C+>2°C+>1°C+>CH■■,因此,发生SN1亲核取代的卤代烷的活性次序是:叔卤代烷>仲卤代烷>伯卤代烷>CH3X。对SN2历程(图3)而言,若α-碳原子上连接的氢原子被体积较大的基团(如R)取代,反应物和过渡态的拥挤程度都会增加,但连接5个原子/基团的过渡态显然比连接4个原子/基团的反应物的拥挤程度增大更多。也就是说,在CH3X→伯卤代烷→仲卤代烷→叔卤代烷的变化过程中,α-碳原子上连接的大体积基团(如R)越来越多,由此带来:a.亲核试剂进攻α-碳原子受到的阻碍越来越大;b.过渡态的拥挤程度越来越大,越来越不稳定。由此导致反应的活化能越来越高,即由CH3X→伯卤代烷→仲卤代烷→叔卤代烷,发生SN2历程亲核取代反应越来越困难。同理,β-碳原子上连接的大体积基团(如R)越多,发生SN2历程亲核取代反应也会越来越困难。由此可以看出,3°卤代烷容易发生SN1亲核取代反应,1°卤代烷和CH3X则容易发生SN2亲核取代反应,SN1和SN2的对立统一在仲卤代烷中表现得特别突出,具体历程还要分析其他条件,这充分体现了“一切矛盾着的东西,互相联系着,不但在一定条件下共处于一个统一体中,而且在一定条件下互相转化”。[5-6]
②离去基团。卤代烷发生亲核取代反应,旧键的断裂就是卤负离子的离去,故容易离去的卤负离子对卤代烷的亲核取代反应是有利的。卤负离子离去的难易可以从两方面来看,一是比较C—X键断裂的难易,即比较相应的键能大小,二是分析卤负离子的稳定性,即比较负电荷的分散程度。以卤代甲烷为例,碳卤键的键能依F、Cl、Br、I的顺序不断减小,碳卤键越来越容易断裂,这主要是卤原子半径和碳卤键键长增大的原因。也正是由于卤原子半径和体积的增大,使得相应的卤负离子电荷分散程度增大,卤负离子稳定性增加。综合地看,卤代烷发生亲核取代反应的活性顺序如下:RI>RBr>RCl>RF。进一步仔细分析,对SN2历程而言,其过渡态生成的难易不仅与C—X键拉长(断裂趋势)有关,还受到亲核试剂的影响;而SN1历程的碳正离子中间体形成的难易则只与C—X键断裂的难易程度有关。也就是说,卤负离子离去的难易程度对SN1历程的影响更大。
③亲核试剂。亲核取代反应中新键的生成就是亲核试剂与α-碳原子的结合,也就是说,亲核试剂的亲核能力强对卤代烷的亲核取代反应是有利的。亲核能力的体现就是亲核试剂的未共用电子对与α-碳正中心的结合成键能力,通俗地讲,就是未共用电子对“给出去”的难易程度,主要与原子的电负性和可极化性有关,可简单归纳为:①亲核原子相同时,在极性溶剂(如水、醇、酸等)中,试剂的碱性越强,亲核性越强。②亲核原子同族时,在极性质子溶剂中,试剂的可极化度越大,亲核性越强。③亲核原子同周期时,原子序数越大,电负性越强,亲核性越弱。
④溶剂。溶剂是影响亲核取代反应的外因之一,它对SN1和SN2历程的影响,通过对中间体、过渡态、离去基团、亲核试剂等溶剂化稳定作用体现出来。
结合SN1历程(图2)分析,极性溶剂有利于碳正离子和卤负离子的溶剂化,也就是有利于第一步反应中生成的碳正离子和卤负离子的稳定,促进第一步反应(慢反应)的进行,故极性溶剂有利于SN1历程,极性越强越有利。至于极性溶剂对亲核试剂Nu-的溶剂化稳定作用会导致其亲核能力的降低,与SN1历程中的第一步反应(慢反应)无关,故亲核能力降低不会影响SN1历程。溶剂极性变化对SN2历程中亲核试剂及反应过渡态的影响如下:SN2历程中体系的极性通常没有变化,只是发生了电荷的分散(图3),增加溶剂极性对过渡态的稳定化作用不明显,但对亲核试剂的稳定化作用大,也就是降低了亲核试剂的亲核能力(进攻能力),故溶剂极性增加不利于SN2历程。简单来说,极性小的溶剂或非极性溶剂有利于SN2反应,极性大的溶剂有利于SN1反应。值得注意的是,在极性溶剂中,质子溶剂与正离子通过离子-偶极作用溶剂化,与负离子通过氢键溶剂化;但在非质子溶剂中,正离子可通过离子-偶极作用溶剂化,负离子因不能形成氢键而被溶剂化的程度很小。也就是说,极性非质子溶剂对亲核试剂Nu-的溶剂化作用小,相对而言,极性非质子溶剂比极性质子溶剂对SN2反应有利。
(3)消除反应中E1和E2历程的竞争。对E1反应历程而言,由于反应的慢步骤是碳卤键断裂,生成碳正离子和卤负离子,因此,碳正离子和卤负离子的稳定性对E1的影响很大,而进攻试剂对E1基本无影响。而溶剂极性增加,有利于碳卤键的异裂和碳正离子、卤负离子的稳定,即极性溶剂对E1有利;对E2历程而言,虽然碳卤键的断裂对E2反应也有促进作用,但这只是影响E2反应历程的一个方面,另一主要影响因素是进攻试剂,其碱性越强或浓度越大就越有利于E2反应。即当使用浓的强碱进行消除反应时,通常按E2机理进行。相对而言,溶剂极性对E2消除影响不如E1。
三、结论
1.卤代烷的亲核取代反应和消除反应机理类型多,互相之间既有差别,又有联系,需要从总体把握,熟悉各种反应机理的具体过程。
2.卤代烷的亲核取代反应和消除反应是一对对立统一的反应机理,碳卤极性键的异裂是使卤代烷发生亲核取代和消除反应的根本原因。
3.卤代烷的亲核取代反应与消除反应的竞争,亲核取代反应中SN1和SN2反应历程的竞争,消除反应中E1和E2反应历程的竞争,都受到相关反应分子的结构这一内因的影响,而反应温度、溶剂等外因则是通过对内因的作用而影响反应规律。
掌握和运用对立统一规律来指导和分析卤代烷的亲核取代反应、消除反应的机理及其影响因素,有利于学生学习和理解相关化学反应规律,帮助他们将反应物结构、进攻试剂、离去基团、反应温度、溶剂等因素对不同反应机理的影响这些零散的知识归纳整理成线,连成面,编成知识网络,加深对有机化学反应规律的熟悉和应用,也有利于进一步培育和巩固学生的马克思主义世界观。
参考文献:
[1]傅晶.卤代烃在大学有机化学教学中重要性的探讨[J].化学工程与装备,2015,(7):291-292.
[2][美]韦德.有机化学[M].第5版.北京:北京工业出版社,2005:175-223.
[3]高鸿宾.有机化学[M].第4版.北京:高等教育出版社,2005:79-80.
[4]霍福广.马克思主义哲学原理[M].第2版.北京:中国人民大学出版社,2013:60.
[5]刘同舫.马克思主义哲学原理简明教程[M].广州:华南理工大学出版社,2012:84.
[6]刘钧,肖加余,邢素丽.有机化学教学中融入马克思主义哲学原理的教学实践[J].高教论坛,2014,(6):38-40.
Applying the Law of the Unity of Opposites in the Teaching of the Reaction Mechanisms of Nucleophilic Substitution and Elimination Reactions of Alkyl Halides
LIU Jun
(College of Aerospace Science and Engineering,National University of Defense Technology,Changsha,Hunan 410073,China)
Abstract:The mechanisms of nucleophilic substitution and elimination reactions of the alkyl halides is complicated,and can be affected by many factors. Hence,it is one of the most difficult problems in the teaching and learning of organic chemistry. Applying the law of the unity of opposites in the teaching of the reaction mechanisms and its influencing factors will be beneficial to the learning and understanding of the reaction rules in organic chemistry.
Key words:alkyl halides;nucleophilic substitution reactions;elimination reactions

