甘草总黄酮提取部位抗惊厥作用的研究
权洪峰 ,闫欣 ,彭晓东
1.宁夏医科大学药学院,宁夏银川 750004;2.银川市第一人民医院药剂科,宁夏银川 750004
天然黄酮类化合物具有广泛的中枢作用,且作用机制涉及调节GABA能神经在内多种神经功能的介入而发挥作用[1]。甘草始载于《神农本草经》,列为上品,因其味甘甜而得名。《中国药典》1977年版后历版药典均规定甘草为豆科植物甘草Glycyrrhiza uralensis Fisch.、胀果甘草Glycyrrhiza inflata Batal.或光果甘草Glycyrrhiza glabra L.的根及根茎。课题组前期研究结果表明,从宁夏栽培甘草中富集所得总黄酮部位(GF)可能通过多种机制改善实验动物的慢性应激抑郁行为[2-3]。从天然产物中获得具有抗癫痫(epilepsy)作用的活性成分而用于临床治疗由来已久,其中不乏大量的黄酮类化合物,且涉及甘草属药用植物中获得的生物活性成分[4-6]。该实验于2017年6—8月利用传统的电惊厥及药物致惊厥的方法,研究宁夏地区栽培甘草中获得的甘草总黄酮提取部位的抗惊厥作用。
1 材料与方法
1.1 实验动物
雄性ICR小鼠,体重为18~22 g。由宁夏医科大学实验动物中心提供 [SYXK (宁)2011-0001]。动物均在室温(22±2)℃,相对湿度 50%~60%,自然光照的条件下饲养。
1.2 实验材料与仪器
甘草总黄酮提取部位 (GF,实验室自制,批号:20150322)。戊四氮(批号:103065百灵威化学试剂)、匹鲁卡品(批号:P6503)、阿托品(国药准字:H20045048)、地西泮(批号:120118)、苯妥英钠(批号:H14020776)。 生理药理多用仪由蚌埠医学无线电二厂生产。
1.3 方法
1.3.1 实验分组及实验步骤 实验分为对照组、GF高剂量组 (400.0 mg/kg)、中 剂 量 组 (150.0 mg/kg)、低 剂 量 组(50.0 mg/kg)及阳性药物对照组,分别灌胃(ig)给药 1次/d。7 d后于末次给药后1 h实施实验。
1.3.2 GF对正常动物自主活动的影响实验 采用旷场实验(open field test,OFT)对动物自主活动的评估。实验采用自制敞箱(30 cm×30 cm×30 cm),内壁及底部涂黑,底部划分成 9个面积相等的方格(10 cm×10cm),摄像头垂直距敞箱 30 cm,四周避光。将小鼠放入中心格内,开始拍摄记录6 min,统计小鼠后 4 min内水平移动格数。小鼠每次被放入固定的中央格。旷场实验前30 min腹腔注射(ip)地西泮(4 mg/kg)为阳性对照[2-3]。
1.3.3 最大电休克惊厥试验 依照文献建立小鼠最大电休克惊厥模型 (maximal electroshock seizure model,MES)[7],小鼠筛选以35~40 V/0.5 s为参数,出现后肢强直症状者可用于实验。灌胃给药1 h后,同参数实验,以后肢强直症状不发生为抗MES的阳性反应。MES前 30 min腹腔注射苯妥英钠(50 mg/kg,ip)为阳性对照。
1.3.4 戊四氮致惊厥试验 小鼠灌胃给药 1 h后,皮下注射戊四氮 (100 mg/kg,sc),给药后观察并记录小鼠竖尾、阵孪以及强直各项症状出现的潜伏期。PTZ前30 min腹腔注射地西泮(7.5 mg/kg,ip)为阳性对照[7]。
1.3.5 匹鲁卡品致急性惊厥试验 灌胃给药 30 min后,首先皮下注射给予1 mg/kg剂量的阿托品,30 min后腹腔注射350 mg/kg剂量的匹鲁卡品诱发惊厥反应,观察 1 h内小鼠反应。依据 Racine分级进行评估[8],即 0级(无抽搐发作)、1 级(耳、面部抽搐)、2 级(肌阵挛,但无直立位)、3级(肌阵挛,伴直立位)、4级(全身强直阵挛发作)、5级(强直阵挛发作,并失去体位控制)。并实施记录。1 h后腹腔注射注射2.5 mg/kg剂量地西泮终止发作。
1.4 统计方法
采用GraphPad Prism绘图软件和SPSS 19.0统计学软件进行数据统计分析,计量资料以表示,组间比较采用 one-way ANOVA 的 Dunnett和 Dunnett’s T3(3)统计方法[9]。以P<0.05为差异有统计学意义。
2 结果
2.1 GF对小鼠正常自主活动的影响
GF 各剂量组(400.0、150.0、50.0 mg/kg)不能影响小鼠正常自主活动(P>0.05)。
表1 甘草总黄酮提取部位对PTZ诱导小鼠急性癫痫模型的影响[,n=15]

表1 甘草总黄酮提取部位对PTZ诱导小鼠急性癫痫模型的影响[,n=15]
注:aP<0.05,bP<0.01 vs对照组。
组别 剂量 行为异常潜伏期(s) 大发作潜伏期(min) 死亡时间(min) 强直数/实验总只数(只)强直百分率(%)对照组GF 30±15 27±15 33±13 30±15 4±2(17±5)b(13±5)a 7±2 6±4(25±13)b(14±5)a 5±3地西泮400.0 mg/kg 150.0 mg/kg 50.0 mg/kg 7.5 mg/kg 15/15 7/15 10/15 15/15 1/15 100.0(46.7)b(66.7)a 100.0 6.7b
表2 甘草总黄酮提取部位对PILO诱导小鼠急性癫痫模型的影响[,n=15]
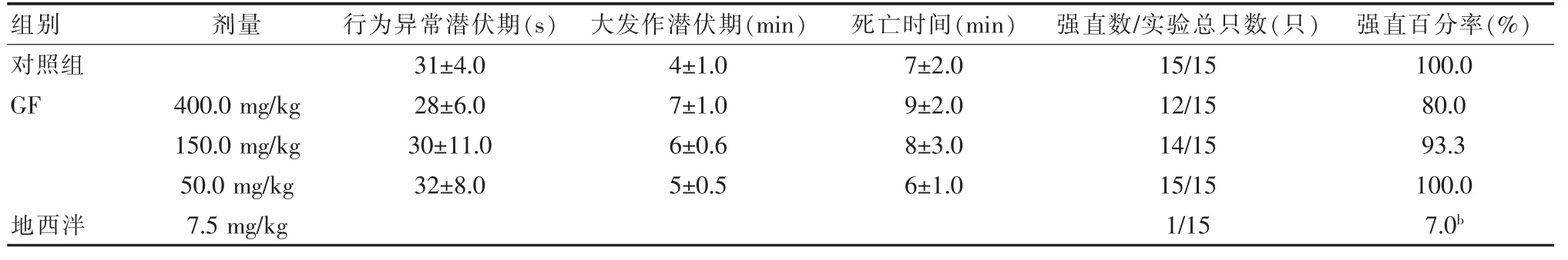
表2 甘草总黄酮提取部位对PILO诱导小鼠急性癫痫模型的影响[,n=15]
组别对照组GF地西泮剂量400.0 mg/kg 150.0 mg/kg 50.0 mg/kg 7.5 mg/kg行为异常潜伏期(s)31±4.0 28±6.0 30±11.0 32±8.0大发作潜伏期(min)4±1.0 7±1.0 6±0.6 5±0.5死亡时间(min)7±2.0 9±2.0 8±3.0 6±1.0强直数/实验总只数(只) 强直百分率(%)15/15 12/15 14/15 15/15 1/15 100.0 80.0 93.3 100.0 7.0b
2.2 GF对鼠
小鼠 MES惊厥试验的影响:GF各剂量组(400.0、150.0、50.0 mg/kg)不能拮抗小鼠实施最大电休克引发的惊厥,差异无统计学意义(P>0.05)。
2.3 GF对PTZ诱导小鼠急性癫痫模型的影响
如表1所示,与对照组比较,400.0 mg/kg剂量的GF能够显著延长PTZ诱导小鼠癫痫大发作的潜伏期,差异有统计学意义(P<0.01)、死亡时间,差异有统计学意义(P<0.01)和强制发作的百分率,差异有统计学意义(P<0.01)。150.0 mg/kg剂量的GF能够延长PTZ诱导小鼠癫痫大发作的潜伏期,差异有统计学意义(P<0.05)、死亡时间,差异有统计学意义(P<0.05)和强制发作的百分率,差异有统计学意义 (P<0.05)。而 50.0 mg/kg剂量的 GF对 PTZ诱导的癫痫发作各项参数没有影响,差异无统计学意义(P>0.05)。
2.4 GF对PILO
诱导小鼠急性癫痫模型 的影响:如表2所示,GF各剂量组(400、150、50 mg/kg)不能拮抗 PILO 诱导小鼠急性癫痫发作,差异无统计学意义(P>0.05)。
3 讨论
甘草为我国常用大宗中药材,在中药材中产量和销量均居于大宗药材的首位,同时也是食品加工、轻工业的重要原料。甘草的主要成分为黄酮类和三萜皂苷类化合物。课题组前期研究结果显示,从宁夏栽培甘草富集得到的的GF可能通过多种机制改善实验动物的慢性应激导致的抑郁行为[2-5]。
从天然产物中获得具有抗癫痫作用的活性成分而用于临床治疗由来已久[4-6],其中不乏姜黄素、木犀草素等黄酮类化合物。据报道[10]皮下注射PTZ可引起不同级别的抽搐如肌肉阵挛性抽搐、前/后肢体痉挛,最终死亡。光果甘草根水提物与空白组比较,对延长PTZ诱导小鼠癫痫发作的潜伏期以及减少阵发性惊厥持续时间无显著作用,而光果甘草根醇提物中(200.0 mg/kg)、高剂量(400.0 mg/kg)组显著延长了PTZ诱导小鼠癫痫发作的潜伏期并明显减少阵发性惊厥持续时间,且与阳性药物组(地西泮,2 mg/kg)高剂量(400.0 mg/kg)组阵发性痉挛的发作时间被推迟100%。
该实验结果表明,在实验剂量范围内,GF不能影响小鼠自主活动;对小鼠PILO及MES引起的惊厥表现没有拮抗作用。GF可以剂量依赖性的拮抗PTZ引起的小鼠惊厥。与对照组比较,400.0 mg/kg剂量的GF能够显著延长PTZ诱导小鼠癫痫大发作的潜伏期、死亡时间及降低强制发作的百分率(46.7%)。150.0 mg/kg剂量的GF能够延长PTZ诱导小鼠癫痫大发作的潜伏期、死亡时间及降低强制发作的百分率(66.7%)。
(
)
[1]Hanrahan JR,Chebib M,Johnston GA.Flavonoid modulation of GABA(A)receptors[J].Br J Pharmacol,2011,163(2):234-245.
[2]程瑞凤,华冰,景晶,等.甘草总黄酮抗大鼠应激抑郁行为作用及对海马脑区神经细胞凋亡调控相关蛋白表达的影响[J].中药药理与临床,2014,30(2):69-72.
[3]华冰,程瑞凤,景晶,等.甘草总黄酮抗大鼠应激抑郁作用及对突触可塑性关键蛋白SYP/PSD-95的调节作用[J].中国新药杂志,2014,23(10):1180-1187.
[4]Sucher NJ,Carles MC.A pharmacological basis of herbal medicines for epilepsy[J].Epilepsy Behav,2015,52(Pt B):308-318.
[5]Zhu W,Su J,Liu J,et al.The involvement of neuronal nitric oxide synthase in the anti-epileptic action of curcumin on pentylenetetrazol-kindled rats[J].Biomed Mater Eng,2015,26(Suppl 1):S841-S850.
[6]Shaikh MF,Tan KN,Borges K.Anticonvulsant screening of luteolin in four mouse seizure models[J].Neurosci Lett,2013(550):195-199.
[7]丁春晓,刘小虎,齐越,等.癫痫模型大鼠海马齿状回神经元凋亡及凋亡,诱导因子与胱天蛋白酶3联合表达的意义[J].华西医学,2017,32(4):550-553.
[8]彭晓东,陆钊罡,牟青春,等.槐定碱致癫痫样作用研究[J].中国中药杂志,2010,35(1):122-125.
[9]徐层林,许正浩,陈忠.小鼠匹鲁卡品癫痫模型潜伏期 CA3区后放电阈值及脑电频谱能量的变化 [J].中国药理学与毒理学杂志,2012,26(3):415.
[10]Chowdhury B,Bhattamisra SK,Das MC.Anti-convulsant action and amelioration of oxidative stress by Glycyrrhiza glabra root extract in pentylenetetrazole-induced seizure in albino rats[J].Indian J Pharmacol,2013,45(1):40-43.

