Serratia sp. NDW3 GADH小亚基基因ga2dh的克隆及表达分析
杨美英, 卢冬雪, 孙合美, 武志海, 岳胜天, 付 丽
(1 吉林农业大学 生命科学学院, 吉林 长春 130118; 2吉林农业大学 农学院, 吉林 长春 130118)
Serratia sp. NDW3 GADH小亚基基因ga2dh的克隆及表达分析
杨美英1, 卢冬雪1, 孙合美1, 武志海2, 岳胜天1, 付 丽1
(1 吉林农业大学 生命科学学院, 吉林 长春 130118; 2吉林农业大学 农学院, 吉林 长春 130118)
【目的】 克隆葡萄糖酸脱氢酶(GADH)小亚基基因ga2dh并进行鉴定。【方法】 研究水稻根际细菌Serratiasp.NDW3溶磷过程中菌株溶磷量、GADH活性与ga2dh基因表达量的变化,对ga2dh基因进行克隆和生物信息学分析,并检测ga2dh基因在大肠埃希菌BL21中的表达。【结果】Serratiasp.NDW3溶磷过程中ga2dh基因的相对表达量在12 h最大,GADH活性在24 h达到最大值,NDW3溶磷量在36 h后趋于稳定。从Serratiasp.NDW3菌株中克隆获得了781 bp的ga2dh基因序列,生物信息学分析发现该序列与Serratiasp. SCBI菌株的基因相似性为99.62%,编码的蛋白属于葡萄糖酸脱氢酶亚基3超家族,主要由3个α-螺旋构成,且氨基酸序列中包含有位于胞内、胞外和跨膜的区域。ga2dh基因在大肠埃希菌BL21体内表达,能够使得菌体GADH的活性显著增加。【结论】Serratiasp. NDW3菌株溶磷的主要机制依赖于直接氧化途径,ga2dh基因编码的小亚基不仅对GADH活性起重要作用,也是介导GADH跨膜结构的重要组成部分。
水稻; 溶磷菌; GADH;ga2dh; 基因表达; 酶活性
磷是继氮之后作物所需的第2大营养元素,在作物光合作用、能量转移、信号转导及大分子物质的生物合成中都起着关键的作用[1]。但根据资料调查显示,我国有74%的耕地土壤缺磷[2]。可溶性磷肥施入农田后,由于土壤的固定作用,大部分迅速转变为作物难以吸收的无效磷,无法被植物直接吸收利用,导致作物对磷肥的当季利用率不超过30%[3]。土壤中溶磷微生物能依靠自身的代谢或与其它生物协同作用[4],将不溶性磷转变成植物可吸收利用的磷。
溶磷菌可明显促进作物的株高、干质量[5]及产量的增加[6],也可以促进作物对磷素的吸收[7],增加土壤生物量。因此,越来越多的溶磷菌被分离,主要集中在假单胞菌属Pseudomonas、埃希氏菌属Escherichia、肠细菌属Enterbacter等[8]。不同的溶磷菌溶磷的形式不同。微生物分泌的有机酸可作为Ca2+的螯合剂,从而使磷从不溶性磷酸盐中释放出来。其中葡萄糖酮酸在土壤磷酸盐的风化和溶解过程中起着重要作用[9]。Arvind等[10]提出,参与直接氧化途径的葡萄糖脱氢酶(GDH)和葡萄糖酸脱氢酶(GADH)都定位在溶磷微生物的细胞膜外侧[8],当葡萄糖扩散至质膜时,在GDH的作用下被氧化成葡糖酸,葡糖酸进一步在GADH的作用下被直接氧化形成酸性特别强的葡糖酮酸[11],然后被分泌到细胞壁和细胞膜之间,使胞外处于酸性极高的环境,从而溶解不溶性磷酸钙[12]。
FAD(黄素腺嘌呤二核苷酸)-GADH由FAD-脱氢酶大亚基、含有血红素C的中间亚单位和1个小亚基组成,大亚基和中间亚单位的功能主要是参与氢及电子的传递,小亚基功能未知[13]。本研究以水稻根际土壤分离到的溶磷细菌—Serratiasp. NDW3为研究对象,对菌株NDW3 GADH小亚基基因ga2dh进行克隆与分析,旨在明确该基因的性质以及在菌株NDW3溶磷过程中的作用特点,进一步揭示溶磷菌的溶磷机制,为溶磷菌在农业生产上的应用提供理论基础。
1 材料与方法
1.1 材料
菌株Serratiasp. NDW3为吉林农业大学作物营养代谢与调控实验室于2014年分离于吉林农业大学水稻试验田、具有较好溶磷能力的溶磷菌。大肠埃希菌菌株DH5α、BL21(DE3)及载体pET28a(+) 均为该实验室保存。pMD18-T载体试剂盒、琼脂糖凝胶DNA回收试剂盒及限制性内切酶、Ex-Taq酶、T4 DNA连接酶、DNA Marker、蛋白质分子量标准均购于TaKaRa公司。细菌RNA提取试剂盒为天根生化科技(北京)有限公司产品,Easy Script TMFirst-strand cDNA Synthesis Super Mix反转录试剂盒为北京全式金生物技术有限公司产品,其它试剂均为国产分析纯。
NBRIP (National botanical research institute′s phosphate) 培养基及LB培养基的配制参照文献[14]。
1.2 菌株NDW3溶磷量的测定
采用钼蓝比色法测定菌株的溶磷量[15],以NBRIP为基础培养基,Ca3(PO4)2为唯一磷源,接种等量灭活菌液为对照。菌株NDW3接种在LB培养基中,当培养液细胞浓度为D600 nm=0.6时,菌液以φ为1%的接种量接入装有50 mL液体培养基的150 mL三角瓶中,30 ℃,150 r·min-1进行培养,重复3次。每隔12 h取样1次,将2 mL发酵液,10 000 r·min-1离心5 min,取1 mL上清液加水至3 mL,加入3 mL定磷试剂,测定上清液的含磷量,计算供试菌株的溶磷量;菌体用于RNA的提取。
1.3 GADH活性的测定
GADH活性测定参照Yang等[16]方法:通过铁氰化钾作为电子受体,取780 μL McIIvaine缓冲液放入25 mL离心管中,然后加入0.1 mol·L-1铁氰化钾和1 mol·L-1葡萄糖酸钠各100 μL,混匀后加入20~200 μL提取的粗酶液,再加入500 μL铁-Dupanol溶液终止反应,25 ℃温育20 min进行显色,最后加入3.5 mL去离子水,在波长为660 nm条件下测定光密度值,空白对照用去离子水代替酶液。GADH酶活力单位被定义为每分钟内催化1 μmol葡萄糖酸钠所需的酶量(4.0个光密度等于氧化1 μmol的葡萄糖酸),酶活性用每毫克蛋白的酶活力单位数表示。
1.4 荧光定量PCR
根据细菌总RNA试剂盒方法提取菌株NDW3的RNA,采用Easy ScriptTMFirst-strand cDNA Synthesis Super Mix反转录试剂盒合成cDNA。实时荧光定量PCR采用定量试剂SYBR Premix ExTaqTM进行扩增反应,用Primer 5.0软件设计目的基因引物,GA2DH-F:5′-CATCGTTTACAGCGTGGACTAC-3′, GA2DH-R:5′-TCCAGGTGTAGCGGTGAAATG-3′ ,内参基因为16S rRNA,引物16S-F: 5′-CCAACCGACCTTTTTCACCC-3′, 16S-R: 5′-TACGGCGTGTTCAT-CTGGC-3′。反应体系为20 μL,包括SYBR Premix ExTaqTMII (2×) 10 μL,上下游引物各0.8 μL,ROX Reference Dye (50×) 0.4 μL,cDNA模板1.0 μL,ddH2O 6.0 μL。PCR反应条件为:95 ℃预变性10 min;95 ℃变性15 s,60 ℃复性30 s,40个循环。每个反应设置3次重复。利用Step One 生物软件和Microsoft Excel 分析处理试验结果,参照ABI公司提供的ΔΔCt计算方法计算基因相对表达量。
1.5 ga2dh基因的克隆与序列分析
从GenBank上检索序列,根据同属菌ga2dh基因的序列设计引物。以菌株NDW3的基因组DNA为模板,分别以ga2dh-F: 5′-GACTATCTTTGGATGGAATGTG-3′和 ga2dh-R: 5′-GCGTCTACTTTTTTCA-TTACCG-3′为引物进行PCR扩增。PCR产物经10 g·L-1琼脂糖凝胶电泳检测,检测正确的DNA片段经凝胶试剂盒回收与pMD18-T载体连接,转化大肠埃希菌DH5α。经酶切及PCR验证为阳性的克隆送上海生工生物工程公司测序。将核苷酸序列转化成氨基酸序列后进行BLAST分析(http://blast.ncbi.nlm.nih.gov/Blast.cgi),并利用SWISS-MODLE网站进行结构预测,TMHMM-2.0软件进行蛋白质跨膜区域的预测。
1.6 原核表达载体pET-28a-ga2dh的构建与鉴定
以测序为阳性的重组质粒pMD18-T-ga2dh为模板,两端具有EcoR I/XhoI酶切位点的引物Ga2dh-F:5′-CCGGAATTCGACTATCTTTGGATGGAATGTG-3′和Ga2dh-R:5′-CCGCTCGAGGCGTCTACTTTTTTCATTACCG-3′(下滑线部分为酶切位点)进行PCR,获得两端分别带有EcoR I和XhoI酶切位点的目的片段。EcoR I和XhoI双酶切目的片段和pET28a(+),凝胶回收并于16 ℃金属浴内连接12 h。连接产物42 ℃热激转化大肠埃希菌BL21(DE3)感受态细胞。
1.7 重组质粒pET-28a-ga2dh在大肠埃希菌体内的诱导表达
将鉴定为阳性的BL21(pET-28a-ga2dh)挑取单菌落到含卡那霉素(Kan)的LB液体培养基中,37 ℃,160 r·min-1,过夜培养。以φ为1%的接种量将过夜培养的菌液转接到含有Kan抗性的 LB液体培养基中,37 ℃,160 r·min-1培养至D600 nm=0.6。加入IPTG使其终浓度为1.0 mmol·L-1,诱导2和4 h,各取1 mL菌液,10 000 r·min-1,离心10 min收集菌体。将收集到的菌体加入100 μL样品溶解液充分混匀。100 ℃处理10 min,裂解菌体细胞。12 000 r·min-1离心10 min,收集上清,上样20 μL,采用12%的分离胶和5%的浓缩胶进行SDS-PAGE电泳检测蛋白表达。
1.8 大肠埃希菌GADH活性的测定
菌体BL21(pET-28a-ga2dh)及BL21(pET-28a)GADH活性测定方法如下:将过夜培养的菌悬液,按φ为0.5% 接种于100 mL LB培养基,当培养液细胞浓度D600 nm=0.6时,继续培养4 h。每隔1 h取菌液20 mL,4 ℃,10 000 r·min-1离心10 min后,收集菌体。向菌体中加入含有1 mmol·L-1β-巯基乙醇的0.01 mol·L-1pH=6的磷酸盐缓冲液10 mL,超声破碎20 min(功率50%,10 s工作,20 s间歇),4 ℃浸提3 h。4 ℃,12 000 r·min-1离心10 min,去上清,向其中加入含有φ为1%的Triton-X 100的0.01 mol·L-1pH=6的磷酸盐缓冲液3 mL,0 ℃,80 r·min-13 h,之后4 ℃浸提过夜,12 000 r·min-1离心10 min后,上清即为粗酶液。酶活性的测定参照“1.3”, 数据采用Duncan’s新复极差法进行差异显著性分析。
2 结果与分析
2.1 NDW3溶磷量、GADH活性、ga2dh基因表达
为了明确GADH小亚基基因ga2dh的表达与GADH活性及溶磷之间的关系,测定了菌株NDW3在96 h内溶磷量的变化及GADH的活性。如图1所示,随培养时间的延长,溶磷量在36 h之前表现出不断增加的趋势,36~96 h内变化不明显。GADH活性在12 h时较小,24 h时达到峰值,然后逐渐降低。48 h内ga2dh表达量随着时间的增加而下降,12 h相对表达量远高于48 h。
2.2 ga2dh基因的克隆与鉴定
如图2所示,以Serratiasp. NDW3提取的基因组DNA为模板,PCR扩增出约780 bp左右清晰的目的片段。利用PCR和双酶切验证目的片段与pMD18-T载体的连接,PCR与酶切都获得清晰的目的条带,说明目的基因与载体连接成功。
2.3 ga2dh基因序列分析
利用BLAST对ga2dh基因序列及GenBank 核酸数据库进行分析。菌株NDW3的ga2dh基因序列与Serratiasp. SCBI (CP003424.1)相似性最高,为99.62%。ga2dh基因的生物信息学分析结果见图3。从图3A看出,ga2dh基因编码的蛋白属于葡萄糖酸脱氢酶亚基3超家族,结构主要由3个α-螺旋构成,且预测结果的局部相似性均超过0.6。利用TMHMM-2.0将蛋白质序列进行跨膜区的预测(图3B),结果发现蛋白质序列中前12个氨基酸位于胞内,36位氨基酸之后形成的蛋白质结构位于胞外,13~35氨基酸位点之间形成跨膜的区域。
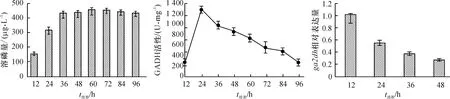
图1 菌株NDW3溶磷量、GADH活性及ga2dh基因表达量的变化
Fig.1 Changes in soluble phosphorus content, GADH activity andga2dhgene expression level during phosphate solubilizing by strain NDW3

M: DL2000 Marker; 1:NDW3 PCR扩增产物; 2:重组质粒的PCR鉴定; 3:重组质粒的酶切鉴定。
图2ga2dh基因的PCR扩增与鉴定
Fig.2 PCR amplification and verification ofga2dhgene

A: ga2dh蛋白保守结构域的三维结构模拟及可靠性检测 B: ga2dh蛋白跨膜区域预测
图3ga2dh基因序列的生物信息学分析
Fig.3 Bioinformatic analysis ofga2dhgene
2.4 ga2dh基因在大肠埃希菌中的表达
2.4.1 原核表达载体pET-28a-ga2dh的构建 利用测序结果正确的pMD18-T-ga2dh为模板进行PCR,获得两端带有EcoR I和XhoI酶切位点的目的片段,利用双酶切与载体pET-28a进行连接,并转化大肠埃希菌BL21。阳性克隆提取质粒,并进行双酶切验证。结果如图4所示,酶切后的基因片段及载体大小分别与目的基因及pET-28a载体的大小一致,说明原核表达载体pET-28a-ga2dh构建成功。
2.4.2 原核表达载体在大肠埃希菌中的诱导表达 将 BL21(pET-28a-ga2dh)进行诱导表达, SDS-PAGE电泳结果如图5所示,BL21(pET-28a-ga2dh)

M: DL5000 Marker;1:重组质粒的酶切片段。
在相对分子质量约27 000 处存在明显的蛋白表达条带,且含量远高于对照,说明该基因在大肠埃希菌BL21中可以表达。
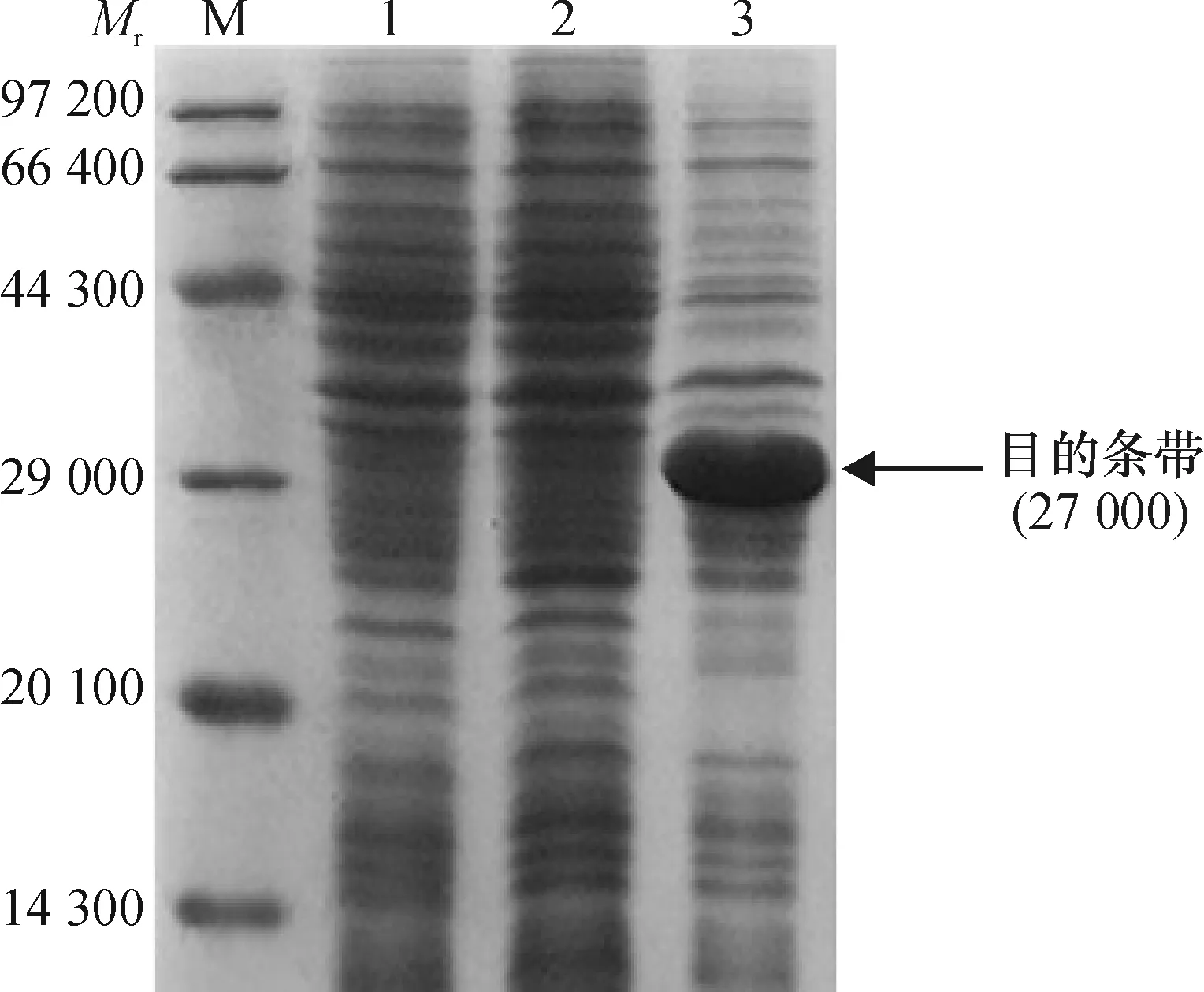
M:蛋白Marker;1: BL21(pET-28a);2:未诱导的BL21(pET-28a-ga2dh);3:诱导的BL21(pET-28a-ga2dh)。
图5ga2dh基因在BL21中的蛋白表达
Fig.5 Protein expression ofga2dhgene in bacterium BL21
2.4.3 大肠埃希菌BL21菌体GADH活性分析 利用LB培养基对带有不同质粒的BL21菌株进行培养,GADH活性如表1所示。结果表明:BL21(pET-28a-ga2dh)菌株GADH活性随着培养时间增加而逐渐增强,在4 h时菌株的酶活性为411.67 U·mg-1, 显著高于其他时间段 (P<0.05)。BL21(pET-28a) 菌株在4 h内GADH活性也随着时间的增加而增强,但同一时间内,酶活性都远低于BL21(pET-28a-ga2dh),且4 h时,酶活性仅为BL21(pET-28a-ga2dh)体内酶活性的20.65%。这说明GADH小亚基基因ga2dh的表达,能够使大肠埃希菌BL21 GADH的活性显著增加。
表1 GADH活性分析
Tab.1 The activity analysis of GADH

t培养/hGADH活性1)/(U·mg-1)BL21(pET⁃28a)BL21(pET⁃28a⁃ga2dh)144.67±2.52c124.00±16.09d247.33±2.53c165.67±21.00c371.67±5.69b294.67±24.44b485.00±3.06a411.67±24.18a
1) 同列数据后凡具有一个相同小写字母,表示酶活性差异不显著 (P>0.05, Duncan’s 法 )。
3 讨论与结论
Serratiasp.是1类具有溶磷能力的革兰阴性菌株,SerratiamarcescensGPS 5[17],Serratiasp. MSK1[18]等菌株已被分离并鉴定。本研究从水稻根际土壤中也分离到1株溶磷能力较好的菌株Serratiasp. NDW3。Goldstein等[19]认为菌株溶磷的特性受无机磷酸盐浓度的影响。本试验以NBRIP为培养基,不溶性磷酸钙为唯一磷源时,随培养时间的延长,菌株NDW3溶磷量表现出先增加,36 h后趋于稳定的趋势,这说明菌株NDW3溶磷可能同样受不溶性磷的调节,培养基中可溶性磷浓度达到一定值时,菌株溶磷特性受到抑制。
溶磷微生物的溶磷机理非常复杂,Sashidhar等[8]认为葡萄糖直接氧化成葡萄糖酸是细菌溶磷的主要机制,革兰阴性细菌由于能分泌大量的有机酸进入外膜空间,其溶磷效果要好于革兰阳性菌。研究发现参与直接氧化途径的酶GDH和GADH都锚定在内膜上,但催化结构域却朝向细胞质膜的外表面,直接氧化途径产生的葡萄糖酸和2-酮基葡糖酸被分泌到细胞壁和细胞膜之间,使胞外处于酸性极高的环境[8]。ga2dh基因编码GADH分子的1个小亚基,本试验发现ga2dh基因的相对表达量在12 h最大,GADH活性在24 h达到最大值,而溶磷量在36 h后趋于稳定,这种规律可能是因为菌体内ga2dh基因表达后,GADH蛋白的形成需要一定的时间,或在培养过程中随着时间的增加,pH会抑制葡萄糖酮酸的产生,从而对酶产生了反馈抑制作用。ga2dh基因表达量、酶活性与溶磷量三者表现出依次滞后的趋势与高度相关性,说明Serratiasp. NDW3菌株溶磷的主要机制可能仍是依赖于直接氧化途径。生物信息学分析发现ga2dh基因编码的蛋白质序列存在跨膜以及胞内和胞外的区域。在大肠埃希菌中表达该基因可以明显增加菌体GADH的活性。这说明ga2dh基因编码的小亚基不仅对GADH活性起重要作用,也是介导GADH的跨膜结构的重要组成部分。
[1] KHAN M S, ZAIDI A, AHEMAD M, et al. Plant growth promotion by phosphate solubilizing fungi-current perspective[J]. Arch Agron Soil Sci, 2010, 56(1):73-98.
[2] 史国英, 莫燕梅, 岑贞陆,等. 1株高效解无机磷细菌BS06的鉴定及其解磷能力分析[J]. 微生物学通报, 2015, 42(7):1271-1278.
[3] SHARMA S B, SAYYED R Z, TRIVEDI M H, et al. Phosphate solubilizing microbes: Sustainable approach for managing phosphorus deficiency in agricultural soils[J]. SpringerPlus, 2013, 2(1): 587-601.
[4] 刘聪, 林维, 孙珑,等. 黑土区林地土壤高效解磷细菌的分离、筛选及其解磷效果[J]. 东北林业大学学报, 2013, 41(11): 83-85.
[5] VYAS P, GULATI A. Organic acid production in vitro and plant growth promotion in maize under controlled environment by phosphate-solubilizing fluorescentPseudomonas[J]. BMC Microbiol, 2009, 9(1):174-189.
[6] HAMEEDA B, REDDY Y H, RUPELA O P. Effect of carbon substrates on rock phosphate solubilization by bacteria from composts and macrofauna [J]. Curr Microbiol, 2006, 53(4): 298-302.
[7] 张淑红. 兼溶5种难溶磷的溶磷细菌筛选及其对花生的促生作用[J]. 河南农业科学, 2015, 44(11):58-61.
[8] SASHIDHAR B, PODILE A R. Mineral phosphate solubilization by rhizosphere bacteria and scope for manipulation of the direct oxidation pathway involving glucose dehydrogenase[J]. J Appl Microbiol, 2010, 109(1): 1-12.
[9] DUFF R B, WEBLEY D M, SCOTT R O.Solubilization of minerals and related materials by 2-ketogluconic acid producing bacteria[J]. Soil Sci, 1963, 95(2):105-114.
[10]KUMAR A, RAI L C. Proteomic and biochemical basis for enhanced growth yield ofEnterobactersp. LCR1 on insoluble phosphate medium[J]. Microbiol Res, 2015, 170:195-204.
[11]ANTHONY C. The quinoprotein dehydrogenases for methanol and glucose [J]. Arch Biochem Biophys, 2004, 428(1): 2-9.
[12]KRISHNARAJ P U, GOLDSTEIN A H. Cloning of aSerratiamarcescensDNA fragment that induces quinoprotein glucose dehydrogenase-mediated gluconic acid production inEscherichiacoliin the presence of a stationary phaseSerratiamarcescens[J]. FEMS Microbiol Lett, 2001, 205(2): 215-220.
[13]TOYAMA H, FURUYA N, SAICHANA I, et al. Membrane-bound, 2-keto-D-gluconate-yielding D-gluconate dehydrogenase from “Gluconobacterdioxyacetonicus” IFO 3271: Molecular properties and gene disruption [J]. Appl Environ Microb, 2007, 73(20): 6551-6556.
[14]杨美英,王春红,武志海,等.不同条件下2株溶磷菌溶磷量及葡萄糖脱氢酶基因表达与酶活分析[J]. 微生物学报, 2016, 56(4): 651-663.
[15]李兴霖, 秦平, 葛菁萍,等.共培养提高解磷菌解无机磷能力及解无机磷基因(pqqE)的克隆[J]. 中国农学通报, 2015(23):47-52.
[16]YANG G F, WEI Z, SUN W J, et al. Purification and enzymatic characterization of membrane-bound D-gluconate dehydrogenase fromArthrobacterglobiformis[J]. J Mol Catal B-Enzym, 2015, 113:14-22.
[17]TRIPURA C B, SASHIDHAR B, PODILE A R. Ethyl methanesulfonate mutagenesis enhanced mineral phosphate solubilization by groundnut-associatedSerratiamarcescensGPS-5[J]. Curr Microbiol, 2007, 54(2): 79-84.
[18]SINGH M, TEJO PRAKASH N. Characterisation of phosphate solubilising bacteria in sandy loam soil under chickpea cropping system[J]. Indian J Microbiol, 2012, 52(2):167-173.
[19]GOLDSTEIN A H, LIU S T. Molecular cloning and regulation of a mineral phosphate-solubilizing gene fromErwiniaherbicola[J]. Nat Biotechnol, 1987, 5(1): 72-74.
【责任编辑 庄 延】
Cloning and expression analysis of GADH small subunit gene ga2dh from Serratia sp. NDW3
YANG Meiying1, LU Dongxue1, SUN Hemei1, WU Zhihai2, YUE Shengtian1, FU Li1
(1 College of Life Science, Jilin Agricultural University, Changchun, 130118 China;
2 Faculty of Agronomy, Jilin Agricultural University, Changchun, 130118 China)
【Objective】 To clone and identify GADH small subunit genega2dh. 【Method】 Changes in soluble phosphorus content, GADH activity andga2dhgene expression level during the phosphate solubilizing process ofSerratiasp. NDW3 from rice rhizosphere were studied. Thega2dhgene was cloned and expressed inEscherichiacoliBL21, and bioinformatic analysis was performed. 【Result】 The relative expression ofga2dhgene in the process of phosphate solubilizing bySerratiasp. NDW3 reached maximum at 12 h, GADH activity reached maximum at 24 h, and the soluble phosphorus content stabilized after 36 h. Thega2dhgene sequence of 781 bp was obtained fromSerratiasp.NDW3 by cloning. The similarity betweenga2dhgene andSerratiasp. SCBI sequences was 99.62% based on bioinformatic analysis. The protein encoded byga2dhbelonged to the superfamily of gluconate dehydrogenase subunit 3 and was composed of threeα-helices. The amino acid sequence was consisted of intracellular, extracellular and transmembrane regions. The expression ofga2dhgene inE.coliBL21 significantly increased GADH activity. 【Conclusion】 The main mechanism of phosphate solubilizing bySerratiasp. NDW3 is through the direct oxidation pathway. The small subunit encoded byga2dhgene not only plays an important role in GADH activation, but also is part of the transmembrane structure of GADH.
rice; phosphate solubilizing bacteria; GADH;ga2dh; gene expression; enzyme activity
2016- 06- 14优先出版时间:2017-01-10
杨美英(1974—),女,教授,博士,E-mail:jiaumeiying@163.com
国家自然科学基金(31201687)
S565.101
A
1001- 411X(2017)02- 0069- 06
优先出版网址:http://www.cnki.net/kcms/detail/44.1110.s.20170110.1423.024.html
杨美英, 卢冬雪, 孙合美, 等.Serratiasp. NDW3 GADH小亚基基因ga2dh的克隆及表达分析[J].华南农业大学学报,2017,38(2):69- 74.

