光纤分导微梁阵列生化传感装置研制及检测应用
张广平+李潮+马薇+吴尚犬+张青川
摘 要 研制了一套基于光杠杆原理的微悬臂梁阵列传感器平台,并通过使用设计制作的微悬臂梁阵列芯片展示其在生物化学方面的检测应用。传感器平台使用光导纤维束分别与激光器耦合作为悬臂梁阵列的扫描光源,具有良好的检测稳定性,检测信号噪声水平约为2 nm; 设计制作的微悬臂梁阵列芯片具有良好的平直度,温度响应均匀一致,各梁温度改变响应灵敏度偏差不超过5.0%。将整套传感系统被用于检测水溶液中的Hg2+,检测浓度范围为1~200 ng/mL; 同一浓度下微悬臂梁阵列检测结果曲线一致性良好,平均偏差小于15%。在研制仪器平台上,分别实现了自制和国外商品化芯片对1.0和0.2 ng/mL样品的检测,结果表明,制作的微悬臂梁阵列芯片的检测灵敏度相对较低,需进一步改进悬臂梁阵列制作工艺。
关键词 生物化学传感器; 光导纤维; 悬臂梁阵列; 汞离子; 定量检测
1 引 言
微悬臂梁传感技术是目前在生物化学检测领域具有广泛发展前景的传感技术手段。微悬臂梁传感器的设计使用起源于原子力显微镜探针技术[1],该传感技术将分子识别结合过程转化为可识别记录的机械信号。这项传感技术具有无需标记、高灵敏度、可实时原位检测等优点,已用于检测各类化学分子、离子[2~4],识别生物分子如蛋白质[5]、核酸[6]以及监测细胞[7,8]及微生物[9]的生长过程。
近年来,随着微制造工艺的发展,微悬臂梁芯片的制造技术越来越成熟,已经可以制作出包含多个微悬臂梁的阵列芯片,可轻松实现高通量检测以及设置平行对照实验。制作机械性能良好且一致的微悬臂梁阵列芯片以及稳定可靠的传感检测平台,是悬臂梁传感器检测应用的工作基础和重点。目前已经有很多实现微悬臂梁阵列检测的报道。最初, 垂直腔面发射激光器阵列被用于时序扫描检测阵列梁[10],但不方便进行温度控制,激光器输出不稳定引入噪声。 Martinez等[11]使用扫描的激光实现检测二维排布的微悬臂梁阵列,但这种方法无法避免移动误差带来的噪声。 邬林等[12]使用压电陶瓷管带动透镜移动使激光照射位置产生变化的方法, 实现了对包含2根悬臂梁的芯片的检测,这种方法一方面会有移动位移误差噪声,另一方面透镜的移动也会影响汇聚的激光光斑形状,造成不同梁检测信号噪声不同,影响检测精度。
本研究利用八束光导纤维分别耦合至8个激光器作为阵列梁探测光源, 搭建基于光杠杆原理的阵列悬臂梁传感平台,设计制作包含8个悬臂梁的微悬臂梁阵列芯片。初步分析制作的悬臂梁阵列的平直度以及在改变温度时各悬臂梁的响应,利用传感检测系统平台和制作的微悬臂梁阵列芯片定量检测水溶液中Hg2+,比较不同微悬臂梁阵列芯片对极低浓度的Hg2+检测的差异。
2 实验部分
2.1 微悬臂梁阵列芯片制作
悬臂梁阵列芯片是检测过程最重要的消耗部件,而且容易损坏,制作的目的是希望制作出价格经济、具有高灵敏度且悬臂梁性能一致的芯片。微梁阵列主要制作步骤如下[13]: (1)在清洗后的硅片(Nanoshift LLC. USA)上经低压化学气相沉积过程两面沉积1 μm厚氮化硅膜; (2)利用光刻得到掩膜,对氮化硅层的反应离子刻蚀过程在硅片正面形成微梁阵列的图形; (3)经等离子体增强化学气相沉积法在硅片正面沉积3 μm厚氧化层形成保护层; (4)该过程刻蚀出微梁芯片的侧壁以及芯片与硅片框架间的连接部分: 首先通过光刻及对氧化层的反应离子刻蚀过程在硅片正面形成需要刻蚀的轮廓,经深反应等离子刻蚀过程,刻蚀硅片深度为300 μm,最后湿法刻蚀去除表面剩余氧化层; (5)硅片正面热生长1 μm厚氧化层; (6)通过光刻及对氮化硅层的反应离子刻蚀过程在硅片的背面形成微梁阵列腐蚀图形; (7)各向异性腐蚀释放微悬臂梁阵列芯片,然后使用缓冲氧化物刻蚀去除正面氧化层; (8)蒸发过程,在悬臂梁表面依次沉积Ti层和Au层,厚度依次为3和20 nm。
2.2 微梁阵列传感系统设计
传感系统设计原理图如图2所示。悬臂梁阵列的偏转信号利用光杠杆方法由光电位置敏感探测器(Position Sensitive Detector, PSD)接收,微梁阵列的探测光源为与8个激光器(650 nm,北京华源世达激光技术有限公司)分别耦合的8束光导纤维,各光导纤维束末端汇集在间隔为250 μm的8个硅刻蚀制作V型槽结构内,使得光纤末端发出光束与各悬臂梁一一对应。通过对各激光器进行时序控制实现对微梁阵列芯片中各悬臂梁偏转的探测。每个激光器都被分别安置在半导体温控器上,温度设定为25.0℃以确保各激光器工作温度恒定,为激光器稳定输出提供保证。微梁阵列芯片被固定在体积为200 μL的反应池内,实验过程中溶液流动速度设定为1 μL/s。反应池底部距离悬臂梁芯片2 mm的位置安装有温控器(MAP6A, SHIMAX),温控精度达±0.05℃; 整个仪器安置在光学隔震台上,放置于温度稳定的室内。
3 结果与讨论
3.1 微悬臂梁阵列性能分析
微悬臂梁阵列芯片满足检测实验要求,一方面要保证具有较高的平直度,即较大的曲率半径,可以确保反射至PSD靶面的光斑不会过于弥散[14],避免因此降低检测灵敏度。根据购买的商品化微阵列悬臂梁芯片参数(Micromotive,Germany),通常悬臂梁曲率半径在20 mm左右完全满足该要求。使用三维轮廓仪(Wyko NT9100)测得的制作的阵列梁芯片各悬臂梁曲率半径均约为15 mm,在实验过程中初步满足对曲率半径的要求。
另一方面,微悬臂梁阵列的使用意义之一是在实验过程中对芯片中不同悬臂梁间的偏转信号结果进行比较,因此必须保证实验中使用的各悬臂梁性能一致或相近,即各悬臂梁在相同的激励下产生的响应一致,这里利用悬臂梁阵列对温度变化的响应进行验证。微悬臂梁阵列芯片安置在反应池中,池中充满水,反应池最初温度设定为28.0℃,温度稳定后,每15 min升高2.00℃。检测结果见图3A,由于双材料梁的温升效应,每次温度变化均使各悬臂梁产生方向一致的偏转。提取当温度稳定时各悬臂梁的稳定偏转值,生成稳定偏转值与温度关系曲线图,并进行线性拟合如图3B所示,拟合系数均大于0.99,说明每个悬臂梁偏转与温度成线性关系,证明各悬臂梁结构均匀。表1列出了芯片所有悬臂梁对温度响应灵敏度k值,即为图3B中各拟合直线斜率,利用温度响应灵敏度平均值分别计算相对偏差Δ,其绝对值最大为5.0%,各悬臂梁的温度响应灵敏度值非常接近,一定程度说明各悬臂梁的结构和尺寸均匀一致,适合用于微悬臂梁阵列检测应用。
3.2 传感系统检测Hg2+
将研制的微悬臂梁阵列传感系统以及微悬臂梁阵列芯片用于检测水溶液中Hg2+。汞是一种重金属,是剧毒的环境污染物,对人和动物有毒害作用。水溶液中的Hg2+可以在金表面沉积,当Hg2+在悬臂梁的金层表面沉积时,会使悬臂梁表面应力发生变化从而产生弯曲变形[15],但尚未有使用阵列梁检测进行比较验证的报道。
实验中使用的Hg2+样品原液为1 mg/mL Hg(NO3)2溶液(含2%~5% HNO3),实验中使用的溶液均通过加入HNO3(65%~68%)保持pH=6.0,以防止Hg(NO3)2水解沉淀。将清洗干净的微梁阵列芯片固定在传感平台的反应池中,浸泡在水溶液中。实验过程中溶液流速为1 μL/s,传感器反应池温度控制为(25.00±0.05)℃。
当采集得到的各悬臂梁偏转曲线均达到平衡状态后,将浓度为50 ng/mL Hg2+溶液加入检测样品入口,检测得到的偏转曲线结果如图4A所示。各悬臂梁产生的偏转方向一致,自加入样品开始出现偏转约1 h后,悬臂梁产生的偏转减缓并趋于稳定,各悬臂梁偏转结果一致性良好。忽略悬臂梁阵列中偏转最大及最小值,计算得该微悬臂梁阵列的平均偏转曲线结果如图4A内插图所示,100 min时各悬臂梁平均偏转约为 424.2 nm。其余各梁偏转值与平均值偏差为9.5%, 5.6%, 3.1%, 2.9%, 7.1%和14.0%。
图4B为使用微悬臂梁阵列依次检测浓度介于1~200 ng/mL的各浓度Hg2+溶液得到的各检测结果的平均偏转曲线。当检测含更高浓度Hg2+的溶液时,对应检测过程中悬臂梁偏转速率也随之变快,相同时刻下检测到的悬臂梁偏转量也更大。很明显,这是由于当Hg2+浓度升高时,Hg2+在金表面聚积速率变快,相同时刻下沉积的量也增多,导致悬臂梁表面应力变化改变速率更快、产生应力变化更大。同时可以看出在一定浓度下,最终在金层上最终聚积的汞总量也趋于稳定。
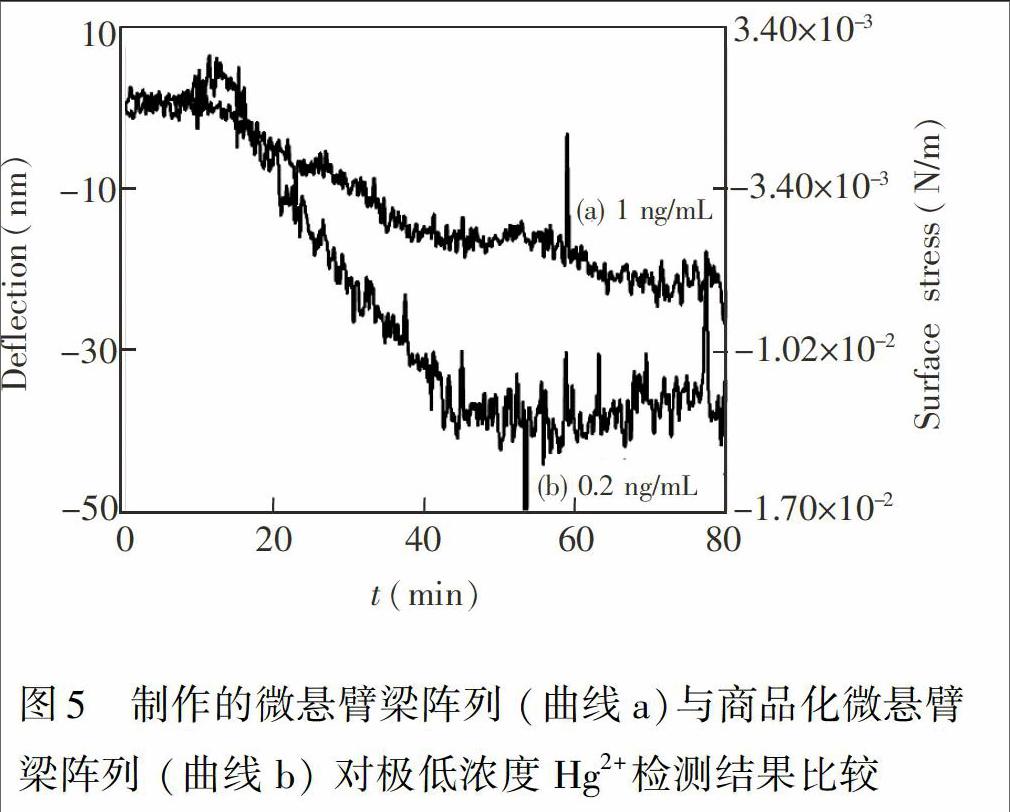
为了比较制作的微悬臂梁芯片在极低浓度样品的检测表现,分别使用制作的微悬臂梁阵列芯片和购买的商品化微悬臂梁阵列芯片(Micromotive, germany)对极低浓度的Hg2+进行检测,两种芯片悬臂梁尺寸相同.检测结果见图5。图5中曲线a为使用制作的阵列梁芯片对1 ng/mL Hg2+检测的平均结果曲线,达到的稳定偏转约为 21.0 nm,信号噪声约为±1 nm; 曲线b为使用购买的阵列梁芯片对0.2 ng/mL Hg2+检测的平均结果曲线,达到的稳定偏转约为 39.0 nm, 信号噪声约为±2 nm。可以明显看出,购买的阵列梁芯片检测灵敏度更高,这可能是由于制作的阵列梁芯片的悬臂梁弹性系数更大,与商品化的阵列梁芯片相比,要使悬臂梁产生相同的偏转,所需的悬臂梁表面应力更大,需要在更大浓度样品检测中才能达到,因此,本系统在检测低浓度样品表现较差。(m)曲线的噪声明显大于(s)曲线的噪声,说明弹性系数小的悬臂梁具有更高灵敏度的优势,但同时也更容易受外界噪声干扰。
4 结 论
构建了可以实时检测包含8根悬臂梁的微悬臂梁阵列的生化传感系统,此系统具有良好的性能。自行设计制作了包含8根悬臂梁的微悬臂梁阵列芯片,悬臂梁具有良好的平直度和温度响应一致性。此微悬臂梁阵列传感系统和制作的微悬臂梁阵列芯片被用于定量检测水溶液中Hg2+,检测最低浓度达1 ng/mL。制作的悬臂梁芯片检测灵敏度低于国外商品化的芯片,因此其制作工艺仍需改进。
References
1 Meyer G, Amer Nabil M. Appl. Phys. Lett., 1988, 53(12): 1045-1047
2 XU Ying.Ming, PAN Hong.Qing, WU San.Hua, ZHANG Bai.Lin. Chinese J. Anal. Chem., 2009, 37(6): 783-787
徐英明, 潘宏青, 伍三华, 张柏林. 分析化学, 2009, 37(6): 783-787
3 Zhao H W, Xue C G, Nan T G, Tan G Y, Li Z H, Li Q X, Zhang Q C, Wang B M. Anal. Chim. Acta, 2010, 676(1.2): 81-86
4 Zhou X R, Wu S Q, Liu H, Wu X P, Zhang Q C. Sens. Actuators B, 2016, 226: 24-29
5 Yue M, Stachowiak J C, Lin H, Datar R, Cote R, Majumdar A. Nano Lett., 2008, 8(2): 520-524
6 Mertens J, Rogero C, Calleja M, Ramos D, Martin.Gago J A, Briones C and Tamayo J. Nat. Nanotech., 2008, 3: 301-307
7 Wu S Q, Liu X L, Zhou X R, Liang X M, Gao D Y, Liu H, Zhao G, Zhang Q C, Wu X P. Biosens. Bioelectron., 2016, 77(15): 164-173
8 Chen X J, Pan Y G, Liu H Q, Bai X J, Wang N, Zhang B L. Biosens. Bioelectron., 2016, 79(15): 353-358
9 Maloney N, Lukacs G, Jenson J, Hegner M. Nanoscale, 2014, 6(14): 8242-8249
10 Battiston F M, Ramseyer J P, Lang H P, Baller M K, Gerber C, Gimzewski J K, Meyer E, Guntherodt H J. Sens. Actuators B, 2001, 77(1.2): 122-131
11 Martinez N F, Kosaka P M, Tamayo J, Ramirez J, Ahumada O, Mertens J, Hien T D, Rijn C V, Calleja M. Rev. Sci. Instrum., 2010, 81(12): 125109
12 WU Lin, ZHOU Xia.Rong, WU Shang.Quan, WANG Ping, ZHANG Qing.Chuan, WU Xiao.Ping. Chinese J. Anal. Chem., 2012, 40(4): 493-497
邬 林, 周夏荣, 吴尚犬, 王 萍, 张青川, 伍小平. 分析化学, 2012, 40(4): 493-497
13 Shi H T, Zhang Q C, Qian J, Mao L, Cheng T, Gao J, Wu X P, Chen D P, Jiao B B. Opt. Express, 2009, 17(6): 4367-4381
14 Miao Z Y, Zhang Q C, Guo Z Y, and Wu X P. Opt. Lett., 2007, 32(6): 594-596
15 Xu X H, Thundat T G, Brown G M, and Ji H F. Anal. Chem., 2002, 74(15): 3611-3615
Abstract A cantilever array sensor platform has been developed based on the optical lever method, the cantilever array chip is also fabricated to introduce its applications on biochemical detection. Optical fibers coupled to lasers are used as the scanning light source. This sensor system has good stability, and the noise of the detection signal is about 2 nm. Meanwhile, the cantilevers of the fabricated chip have good straightness and are consistent to temperature response, and the deviations of response sensitivity of cantilevers caused by temperature change are no more than 5.0%. This sensing system is used to detect Hg2+ in aqueous solution with a concentration range of 1-200 ng/mL. The deflections of one array chip are close in the same concentration, and the average deviation is less than 15%. Samples at the concentration levels of 1 ng/mL and 0.2 ng/mL are detected separately by the fabricated chip and a foreign commercial chip on the sensor platform. The result shows that it′s difficult for the fabricated chip to achieve a higher detection sensitivity and necessary to improve the cantilever array production process.
Keywords Biochemical sensor; Optical fiber; Cantilever array; Mercury; Quantitative detection