乳腺腺病与乳腺导管癌的MRI鉴别诊断及病理对照研究
朱丹,钱海珊,韩洪秀,梁茜子,赵江民*
乳腺腺病是一种女性常见的乳腺疾病,多见于20~50岁女性,腺病表现形式多样,部分病变临床、影像特点与乳腺肿瘤相似,特别是硬化性乳腺病(sclerosing adenosis,SA),其临床影像表现及病理检查与浸润性癌十分相似,术中冰冻切片往往不能准确诊断[1-2],SA的细针及粗针穿刺误诊率也高达12%[3]。虽然目前关于SA是否可作为癌前病变尚无定论,但其仍存在恶变风险[3-5]。临床研究表明,SA患者患乳腺癌的风险可增加1.5~2倍,这一危险度与其他伴/不伴有不典型增生的病变相似[6]。目前对部分乳腺腺病患者,特别是SA患者,尚缺乏有效的诊断手段,故需要更加有效的诊断措施,实现乳腺“同影异病”病变的早发现、早诊断及早治疗。因此,本研究通过分析乳腺腺病的临床、MRI表现征象,并与易误诊的乳腺导管癌进行鉴别诊断,同时与病理进行对照研究,旨在探讨两者MRI的表现差异,从而提高术前诊断准确性。
1 材料与方法
1.1 病例资料
本研究通过回顾性分析2013年10月至2016年5月上海交通大学医学院附属第九人民医院北部院区、上海交通大学医学院附属新华医院等乳腺外科收治的,经手术病理证实且手术前行动态增强MRI及扩散加权成像(diffusion weight imaging,DWI)检查的患者的临床、影像及病理资料。其中收集到乳腺腺病105例,首先根据研究组MRI形态特征初步分析,将其分为2种类型:1组为肿块样强化(mass-like enhancement,MLE)病变,即MLE病灶,其典型表现为具有三维立体结构的异常强化的占位性病变;2组为非肿块样强化(nonmasslike enhancement,NMLE)病变,即NMLE病灶,指比点状强化范围大但又无明显占位效应的强化。表现为局部腺体结构紊乱,信号不均,未见明确肿块形成。105例乳腺腺病MLE病变共50例,NMLE病变共55例。同期搜集的78例乳腺癌患者的MLE病变共52例,NMLE病变共26例。
1.2 图像采集
使用GE TWINSPEED HDx型1.5 T或3.0 T双梯度磁共振扫描仪,配备乳腺专用8通道相控表面线圈。扫描后,再通过计算机ADW 4.4工作站行后处理操作。检查参数包括:横断位短时间反转恢复序列(short time inversion recovery,STIR),TR/TE:6600/42 ms;矩阵:320×160;T1加权快速自旋回波,TR/TE:550/10 ms,矩阵:320×224;扩散加权成像采用单次激发自旋回波,TR/TE:5600/69 ms,矩阵:128×130,b=0、1000 s/mm2,以上横断位序列均采用FOV:33 cm×33 cm,层厚:6 mm;层距:7 mm。矢状位T2加权快速回波,TR/TE:3250/93 ms,矩阵:320×224,FOV:20 cm×20 cm,层厚:6 mm,层距7 mm。静脉注射钆喷酸葡胺(gadopentetate dimeglumine,Gd-DTPA)行增强扫描,剂量为0.1 mmol/kg,速率为2.0 mL/s。动态增强磁共振成像(dynamic contrast enhanced magnetic resonance imaging,DCE-MRI)应用针对乳腺优化的并行采集三维快速梯度回波序列(Vibrant技术)双侧乳腺矢状位同时成像技术,TR/TE:5.4/2.6 ms,矩阵:448×350,FOV:32 cm×32 cm,层厚:3.8 mm,层距:1.9 mm,动态增强前先扫蒙片,而后由高压注射器经手背静脉团注对比剂Gd-DTPA,剂量为 0.1 mmol/kg,流率为2.0 ml/s,同时注射等量的生理盐水,立即进行扫描,连续采集7个时相图像,单期扫描时间为58~62 s。第一次扫描结束后注入对比剂Gd-DTPA及生理盐水,注药的同时启动增强扫描,将增强扫描后的图像分别与第一次平扫图像进行减影,获得减影图像,然后再将减影获得的图像行最大信号强度投影法(maximum intensity projection,MIP)重建,获得三维增强图像,通过对减影图像与平扫及增强图像比较病灶的改变,可对腺体及病变的血供情况作出较准确的评价,同时还可以对病变进行进一步的分析、定性。
1.3 图像分析与处理
2名高年资的MRI诊断医师独立阅片,患者病灶位置、数目、大小、形态、皮肤改变、乳头内陷、腋下淋巴结肿大、内部强化方式等特征,采用GE ADW 4.4工作站中Functool软件完成相关后处理,以美国乳腺影像报告和数据系统磁共振成像标准为基础,随机在表观扩散系数(apparent diffusion coefficient,ADC)图或增强图上选择感兴趣区(region of interest,ROI)。每例患者选取病灶实质部分、信号明显增高的区域作为ROI,ROI选择尽量避开坏死、囊变区和血管,对边缘强化的病变以周边区域作为ROI,区域大小为15~30 mm2,具体ROI范围根据病变的大小进行选取。同时对其ADC值进行测量。
1.4 病理分析
由2名经验丰富的病理科医生进行独立诊断,观察病理切片并进行报告,报告需报告病变的位置及诊断结果。笔者将乳腺腺病标本进一步分析,根据腺病有无纤维囊性变及伴有其他良性病变等因素,将腺病分为单纯型腺病、复杂型腺病以及特殊类型腺病。
1.5 统计学分析
比较分析乳腺腺病MLE病变组与乳腺癌MLE病变组、乳腺腺病NMLE病变组与乳腺癌NMLE病变组患者病灶位置、数目、大小、形态、皮肤改变、乳头内陷等特征差异,采用χ2检验两个随机样本数据的独立样本比较病变的强化方式等特征,所有的理论频数T≥5并且总样本量n≥40,用卡方检验;若理论数T<5但T≥1,并且n≥40,用连续性校正的卡方检验;若理论数T<1或n<40,则用Fisher's检验;采用单因素方差分析比较乳腺腺病MLE病变组与乳腺癌MLE病变组、乳腺腺病NMLE病变组与乳腺癌NMLE病变组患者ADC值,组间比较采用LSD法。P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义。
2 结果
2.1 临床表现及病理结果
纳入研究的105例乳腺腺病中,5例(4.8%)患者曾有乳腺恶性肿瘤病史、家族史,患者平均年龄(42.1±9.2)岁,其中MLE病变50例(47.6%),NMLE病变55例(52.4%),全部病例均经手术病理证实。病理类型方面,MLE病变中单纯型腺病33例,特殊类型腺病2例,混合型腺病15例;NMLE病变中单纯型腺病51例,特殊类型腺病1例,混合型腺病3例。
所纳入研究的78例乳腺导管癌中,13例(16.7%)患者曾有乳腺恶性肿瘤病史、家族史,患者平均年龄(48.1±10.2)岁,其中MLE病变52例(66.7%),NMLE病变26例(33.3%),全部均为手术病理证实。
两组患者的病变组之间腺病患者的自觉疼痛(50/105,47.6%)比例远高于导管癌组(7/78,9.0%),导管癌组中触诊活动度差(31/78,39.7%)高于腺病(6/105,5.7%),此外腺病组中单纯型腺病具有自觉疼痛15例(15/33,45.5%)、触诊活动度差0例,混合型腺病分别为自觉疼痛5例(5/15,33.3%)、触诊活动度差5例(5/15,33.3%)。
2.2 增强MRI特征
乳腺腺病和乳腺导管癌患者的MLE病变、NMLE病变的病变形态、边界、强化方式、时间信号曲线的差异均具有统计学意义(表1),乳腺腺病中单纯型腺病与混合型腺病之间的动态增强的比较见表2,图1、2。
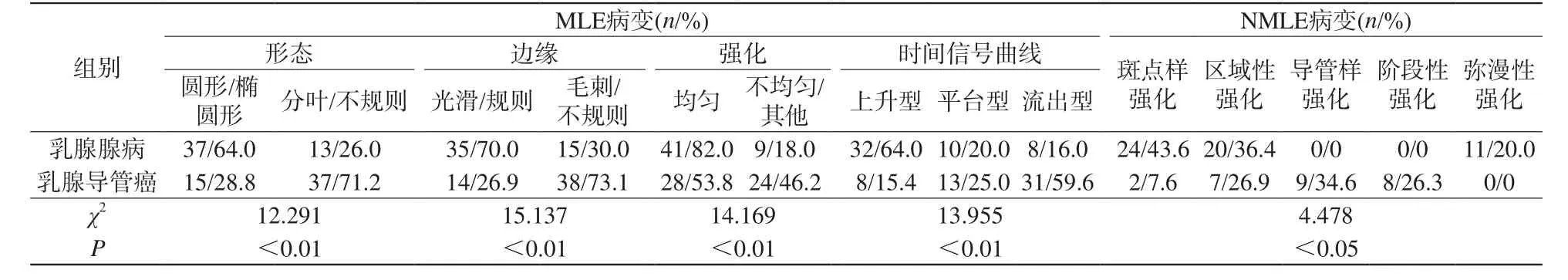
表1 乳腺腺病与乳腺导管癌的增强MRI特征比较Tab.1 Comparison of MRI characteristic between lesions of breast adenosis and breast ductal carcinoma
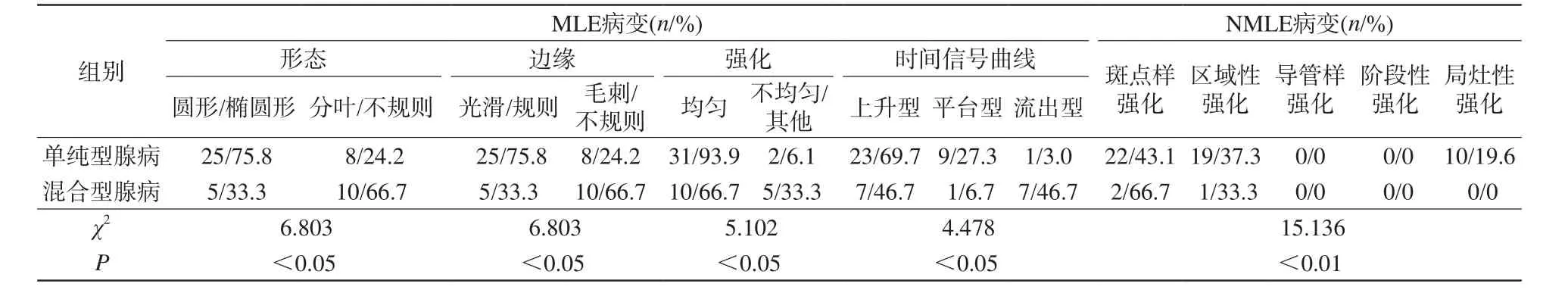
表2 乳腺腺病的单纯型腺病与混合型腺病MRI特征比较Tab.2 Characteristics of MRI in MLE lesions of pure adenosis and mixed adenosis
2.3 DWI
乳腺腺病MLE病变、NMLE病变的ADC值分别为(131.63±21.80)×10-3mm2/s、(136.23±14.80)×10-3mm2/s,分别高于乳腺癌的ADC值(104.21±18.54)×10-3mm2/s、(102.51±16.44)×10-3mm2/s,两组数据有显著的统计学意义(F=52.167、49.167,P<0.01),腺病组中单纯型腺病的ADC值为(136.73±11.79)×10-3mm2/s,混合型腺病的ADC值为(116.73±19.97)×10-3mm2/s,低于乳腺良恶性病变的ADC界值(120×10-3mm2/s)。
3 讨论
3.1 临床病理及形态特点
乳腺腺病是乳腺增生性疾病的一种常见病理类型,好发于中年女性,多与女性的内分泌失调有关[7]。临床上症状常表现为乳房月经周期相关的乳房疼痛、乳房肿块等。资料表明,临床表现常因病变分型不同而各异,其中早期的小叶增生期,周期性疼痛明显、肿块样病灶常质韧,纤维腺病期则疼痛减轻、肿块样病灶硬度中等,硬化性腺病期几乎无疼痛、硬度最大,常在临床触诊时误诊为乳腺癌[8]。小叶增生、纤维腺病、硬化性腺病的病理变化可在同一病例不同的小叶内同时出现,腺病的分期及各期之间相互转归可能造成了乳腺腺病的病理及临床影像多样性,三期往往交叉存在,不能在病理上对其进行明确分期,故本研究根据腺病有无纤维囊性病变及伴有其他良性病变等因素,将腺病分为单纯型腺病、复杂型腺病以及特殊类型腺病,其中SA常伴有小叶纤维化的腺上皮萎缩[9]等良性病变,归于复杂型腺病。
在本次研究中,单纯型腺病往往处于腺病早期,表现为乳腺小叶内导管、腺泡增生,呈病理性数目增加,但小叶内的间质增生轻,临床常伴有周期性疼痛(45.5%),表现为肿块型病变触诊时活动度好(100%),此期腺病的MRI多表现为区域性、弥漫性、对称性或局灶性的非肿块样强化,本研究组的84例(80%)病例表现为此期,强化方式可表现为均匀或不均匀强化,时间-信号强度曲线(time-signal intensity curve,TIC)多呈Ⅰ型或Ⅱ型。18例(17.1%)腺病患者的病变内有纤维组织增生明显,当纤维间质逐渐增生,胶原纤维变性,致部分腺体表现为团块状及条索状时MRI表现为良性结节型(图1);随着纤维组织增生,可向乳腺小叶内伸展,小叶边界逐渐消失,上皮和纤维组织混杂,腺体挤压变形,呈条索状、漩涡状结构,易形成类似浸润的征象,可表现为类似恶性结节的征象(图2)。本研究通过比较分析研究组的MRI影像特征,对比病理组织学发现,与肿瘤细胞向周围的浸润性生长造成毛刺征等周围间质反应征象不同,表现为形态不规则的腺病,与病灶内的间质增生有关,间质纤维化可向乳腺小叶内伸展,形成假浸润的征象,以晚期SA表现为著,病灶的腺体挤压和扭曲在病变中央区最为明显,乳腺导管的管腔可完全闭塞,导致腺体在纤维间质中呈实性条索样、漩涡样排列,纤维结缔组织或腺泡发生萎缩,致使不规则的形态改变。
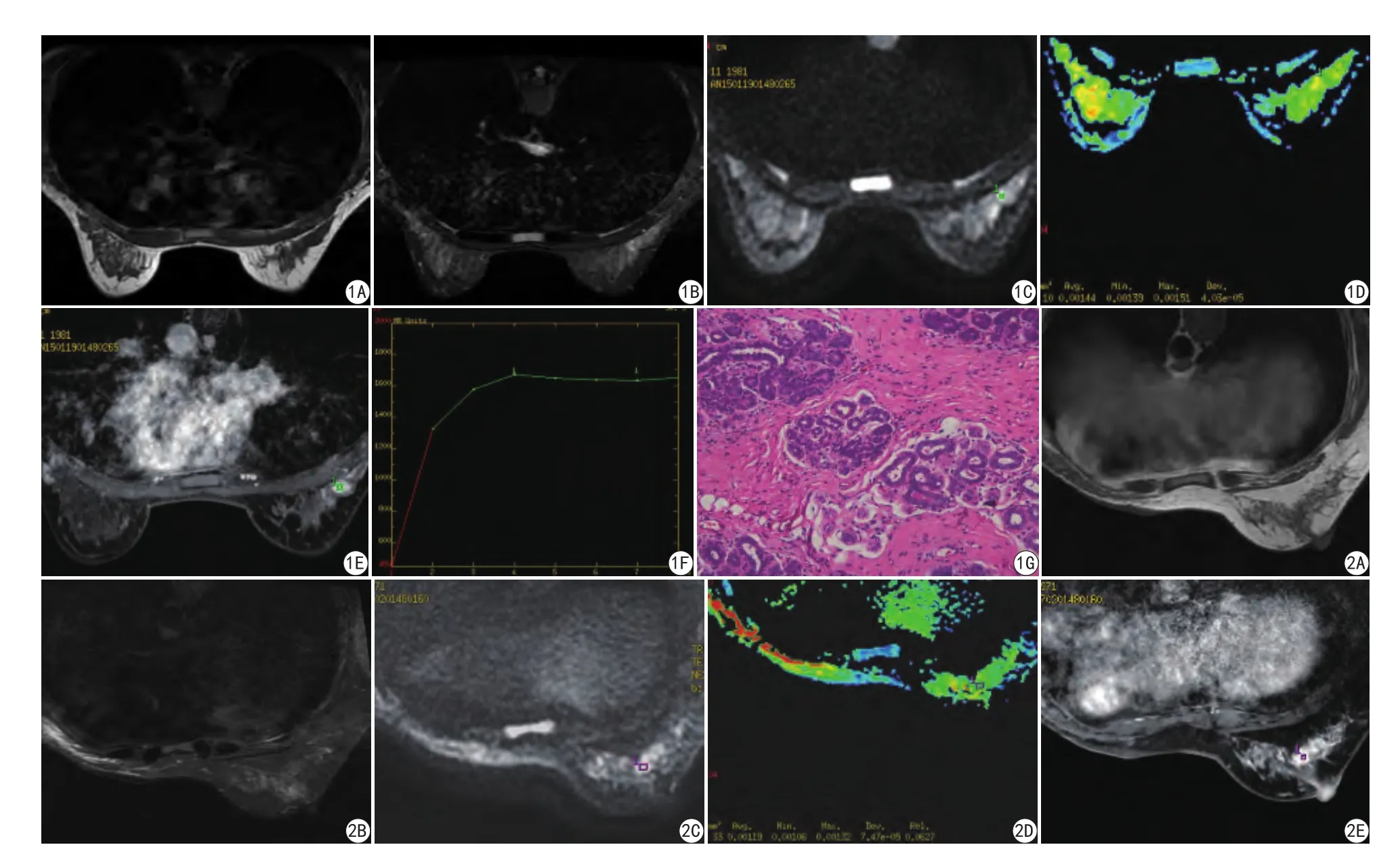

图1 乳腺单纯型腺病,女性患者,30岁,半年院前发现右乳肿块,同时可触及右乳外上象限肿物,大小约15 mm×8 mm,病理证实为单纯腺病。A:MRI横断位,T1WI病灶呈低信号;B:MRI横断位,STIR显示病灶呈稍高信号;C:MRI横断位,DWI显示病灶呈稍高信号;D:病灶ADC测值为0.00144 mm2/s,正常范围;E:动态增强显示病灶明显肿块样强化,强化尚均匀,边界尚清;F:时间-信号强度曲线图呈平台型曲线;G:镜下可见乳腺小叶腺泡数量的增加,但无小叶结构的异常扭曲(HE染色 ×200) 图2 乳腺复杂型腺病(硬化性腺病),女性患者,46岁,左乳癌改良根治术后1年,病理示:左乳浸润性导管癌1级,患者6个月前发现右乳肿块,大小约11 mm×10 mm。病理证实为硬化性乳腺病。A:MRI横断位,T1WI病灶呈稍低信号;B:MRI横断位,STIR显示病灶呈稍高信号;C:MRI横断位,DWI显示病灶呈稍高信号;D:病灶ADC测值为0.00110 mm2/s,低于正常范围;E:动态增强显示病灶明显肿块样强化,强化尚均匀,边界欠清;F:时间-信号强度曲线图平台型曲线;G:镜下可见乳腺小叶腺泡数量的增加,伴有腺体间质增生,腺体受到挤压变形(HE染色 ×200)Fig. 1 A 30-year-old female patient with a mass in the upper quadrant of right breast in the past six months, as the size of about 15 mm×8 mm. The lesions were pure adenosis confirmed by pathology. A: On axial T1WI, the lesions showed hypointense; B: On axial STIR, the lesions showed slightly hyperintense;C: On axial DWI, the lesions showed slightly hyperintense; D: The lesions of ADC value of 0.00144 mm2/s; E: The lesions showed the clear boundary and markly enhancement; F: The time signal intensity curve is a platform type curve; G: The lesions showed the increase of visible breast acini in quantity, but there is no abnormal distortion of the lobular structure (HE staining ×200). Fig. 2 A 46-year-old female patient underwent modified radical mastectomy of left breast 1 years ago, pathology showed that the left breast infiltrating ductal carcinoma grade 1. She found the right breast mass as the size of 11 mm×10 mm 6 months ago. The lesions were sclerosing adenosis confirmed by pathology. A: On axial T1WI, the lesions showed slightly hypointense; B: On axial STIR, the lesions showed slightly hyperintense; C: On axial DWI, the lesions showed slightly hyperintense; D: The lesions of ADC value of 0.00110 mm2/s,below normal range; E: The lesions showed the unclear boundary and markly enhancement; F: The time signal intensity curve is a platform type curve; G: The lesions showed the increase of visible breast acini in quantity, and there are glandular hyperplasia and abnormal distortion of the lobular structure(HE staining ×200).
3.2 MRI影像特征及与乳腺癌鉴别诊断
3.2.1 病灶周围征象
乳腺癌发生浸润时,肿瘤细胞阻塞淋巴管、侵犯乳腺皮肤或深层胸肌筋膜内韧带、或沿淋巴管、腺管或纤维组织浸润到皮肤内并生长或者侵犯乳腺内大导管,皮肤可出现“橘皮征”“酒窝征”、乳头继发性回缩凹陷等征象,乳房皮肤可出现增厚、水肿,乳腺腺病不会出现此明显浸润症状。
3.2.2 强化方式
乳腺腺病MLE病变的内部强化方式以均匀强化为主(82%),特别是在病灶直径≤10 mm,病灶常表现早期肿块中心显著强化,随后逐渐向周围强化,此强化方式常符合良性病变的改变,而乳腺癌MLE病变不均匀强化或其他强化方式(46.2%)比例大幅增加,其中肿块可表现为早期周围环形强化,并逐渐向中心扩展的强化方式,或者肿块内部出现强化的分隔,这些征象常提示恶性病变;乳腺腺病NMLE病变的节段性或斑点样的局域性分布强化方式、早期快速增强、流出型曲线等征象常常被误认为是可疑恶性征象[10-12]。本研究纳入的乳腺腺病NMLE病变表现结节样区域性强化、局灶性强化方式与乳腺癌节段样强化、区域性强化容易混淆,是造成乳腺影像报告及数据系统(breast imaging reporting and data system,BIRADS)分级出现误诊、漏诊的主要原因。
3.2.3 TIC
乳腺癌MLE病变组以早期快速增强为主(94.2%),曲线类型以流出型为主(59.6%),乳腺癌的主要动力学特征为信号强度在起始快速上升后出现下降,主要由于乳腺的肿瘤新生血管在肿瘤血管网中形成动静脉血管瘘,造成对比剂的快速廓清[13]。此外还与病变的微血管密度、血管通透性及对比剂进入组织细胞外间隙有关[14]。乳腺腺病病灶也可出现早期快速增强、晚期曲线呈流出型改变,特别是混合型腺病早期均快速增强,晚期以流出型为主,笔者推测这可能与腺病病变内间质纤维化有关,间质纤维化可造成对比剂进出细胞外间隙的数与量发生改变有关[15-16]。同MLE病变基本一致,NMLE病变的TIC在诊断乳腺疾病良恶性病变中,对于腺病形态不规则所带来的诊断困难给予有力补充。
3.2.4 DWI
乳腺腺病的MLE病变、NMLE病变的ADC值之间有显著的统计学意义,这与先前的文献报道一致[17-19],ADC值有利于良恶性的病变鉴别,而单纯型腺病的ADC值(136.73±11.79)×10-3mm2/s,远高于最佳诊断界值120×10-3mm2/s,混合型腺病的ADC值(116.73±19.97)×10-3mm2/s,接近于乳腺良恶性病变的ADC界值,笔者推测这是由于间质的纤维组织增生,可向乳腺小叶内伸展,造成上皮和纤维组织混杂,腺体挤压变形,细胞密度较大,抑制了水分子的表面扩散能力。
3.3 本研究的局限性
乳腺动态增强MRI联合DWI诊断乳腺腺病有很高的诊断价值,但由于病例限制,所收集的乳腺癌病例NMLE病变的局限性,造成本研究对腺病的NMLE病变的研究全面性受到影响。通过在实际工作中的体会,腺病和腺癌在影像表现上有较多重叠,特别在NMLE表现情况下,需要综合临床和影像考虑,甚至组织活检进一步检查。
综上所述,大多数的乳腺腺病形态上仍多呈良性病变特点,虽然部分与乳腺癌相似,但MRI及DWI相结合在鉴别诊断两者时存在较高的利用价值。通过对比分析病理学特点,乳腺腺病的病变形状不规则、边缘不清、不均匀强化、流出型曲线等可疑恶性征象,可能与病灶的间质纤维化有一定关联,通过结合特异性的强化方式、临床因素或其他影像学检查手段,有利于加深对于混合型腺病的诊断。
[References]
[1] Choi BB, Park KS. Radiologic findings of sclerosing adenosis.Ultrasound in Medicine & Biology, 2011, 37(8): 99.
[2] Baltatzis GE, Voloudakis GE, Arnogiannakis N, et al. Differential diagnosis between sclerosing adenosis and tubular carcinoma of the breast under transmission and scanning electron microscope.Ultrastructural Pathology, 2011, 35(5): 226-229.
[3] Kundu UR, Guo M, Landon G, et al. Fine-needle aspiration cytology of sclerosing adenosis of the breast. Am J Clin Pathol, 2012, 138(1):96-102.
[4] Shui R, Yang W. Invasive breast carcinoma arising in microglandular adenosis: a case report and review of the literature. Breast J, 2009,15(6): 653-656.
[5] Visscher DW, Nassar A, Degnim AC, et al. Sclerosing adenosis and risk of breast cancer. Breast Cancer Res Treat, 2014, 144(1):205-212.
[6] Pina L. Sclerosing adenosis, breast. Springer Berlin Heidelberg,2008: 1647-1648.
[7] Reynolds C. Pathology of the breast-human pathology. Human Pathology, 2000, 31(5): 624-625.
[8] Eby PR, DeMartini WB, Gutierrez RL, et al. Probably benign lesions detected on breast MR imaging. Magn Reson Imaging Clin N Am,2010, 18(2): 309-321.
[9] Chen ZN. Practical surgical pathology. Shanghai: Shanghai Medical University Press, 1997.陈忠年. 实用外科病理学. 上海: 上海医科大学出版社, 1997.
[10] Yamaguchi Y, Hayashi S. Estrogen-related cancer microenvironment of breast carcinoma. Endocr J, 2009, 56(1): 1-7.
[11] Gutierrez RL, DeMartini WB, Eby PR, et al. BI-RADS lesion characteristics predict likelihood of malignancy in breast MRI for masses but not for nonmasslike enhancement. AJR Am J Roentgenol,2009, 193(4): 994-1000.
[12] Baltzer PAT, Benndorf M, Dietzel M, et al. False-positive findings at contrast-enhanced breast MRI: a BI-RADS descriptor study. AJR Am J Roentgenol, 2010, 194(6): 1658-1663.
[13] Li M, Jin Z, Li GJ, et al. Correlation between angiogenesis and multiparameters of dynamic contrast enhancement MRI for assessments of benign and malignant breast lesions. Chin J Magn Reson Imaging,2010, 1(1): 36-42.李敏, 金真, 李功杰, 等. 乳腺动态增强MRI参数与肿瘤血管的相关性及其鉴别诊断价值. 磁共振成像, 2010, 1(1): 36-42.
[14] Siegmann KC, Xydeas T, Sinkus R, et al. Diagnostic value of MR elastography in addition to contrast-enhanced MR imaging of the breast-initial clinical results. Eur Radiol, 2010, 20(20):318-325.
[15] Lee SJ, Mahoney MC, Khan S. MRI features of stromal fibrosis of the breast with histopathologic correlation. AJR Am J Roentgenol,2011, 197(3): 755-762.
[16] Gity M, Arabkheradmand A, Taheri E, et al. Magnetic resonance imaging features of adenosis in the breast. J Breast Cancer, 2015,18(2): 187-194.
[17] Zhang Y, Mu XT, Zhong X, et al. Correlations between MR apparent diffusion coefficient values and prognostic factors of breast invasive ductal carcinoma. Chin J Magn Reson Imaging, 2015, 6(9):687-691.张雨, 穆学涛, 钟心, 等. 表观扩散系数与乳腺浸润性导管癌预后因素的相关性分析. 磁共振成像, 2015, 6(9): 687-691.
[18] Chen X, Li W, Zhang Y, et al. Meta-analysis of quantitative diffusionweighted MR imaging in the differential diagnosis of breast lesions.BMC cancer, 2010, 10(1): 1.
[19] Xu ML, Su DK, Xie D, et al. Correlation of MR apparent diffusion coeffi cient value with HER-2 expression in non-mass-like breast carcinoma. Chin J Magn Reson Imaging, 2015, 6(7): 513-517.徐茂林, 苏丹柯, 谢东, 等. 非肿块型强化的乳腺癌磁共振成像表观扩散系数值与HER-2表达的相关性分析. 磁共振成像, 2015,6(7): 513-517.

