[BMim][HSO4]-H2SO4二组分物系密度的测定及相关热力学性质的研究
张 帅,张 涛,唐盛伟
(四川大学 化学工程学院,四川 成都 610065)
[BMim][HSO4]-H2SO4二组分物系密度的测定及相关热力学性质的研究
张 帅,张 涛,唐盛伟
(四川大学 化学工程学院,四川 成都 610065)
在常压和283.15~313.15 K的温度范围内,测定了离子液体1-丁基-3-甲基咪唑硫酸氢盐([BMim][HSO4])与H2SO4二组分物系在全浓度范围内的密度,由密度数据计算了不同温度和浓度下混合物的超额摩尔体积(VE)和各组分的偏摩尔体积,基于半经验Zhang方程和NMSRK状态方程建立了二组分物系密度的预测模型。实验结果表明,两种模型的计算值与实验值具有较高的符合度,其平均绝对误差均不超过0.30%;在全浓度范围内二组分物系的VE均为正值,当xH2SO4=0.60时,物系的VE达到最大,最大值为2.462 80 cm3/mol(313.15 K);二组分物系中[BMim][HSO4]的偏摩尔体积随xH2SO4的增大而增大,H2SO4的偏摩尔体积随xH2SO4的增大而减小。
离子液体;硫酸;二组分物系;密度;热力学性质
离子液体是一类由有机阳离子、有机/无机阴离子构成的盐,具有蒸气压低、难挥发、化学稳定性和热稳定性好、可设计性等优点[1],已广泛应用于诸多化学过程中[2-7]。
离子液体作助催化剂是其一个重要的应用[8-13]。Tang等[11]将离子液体分别与H2SO4和三氟甲烷磺酸耦合,改善了C4烷基化目标产物的选择性和催化剂的寿命。Matuszek等[12]将离子液体与H2SO4耦合催化异丁醇与乙酸的酯化反应,提高了反应的转化率。这些研究认为离子液体与酸的耦合能有效调节体系的结构和性质,改善反应物与催化剂两相的传递与混合特性,从而促进目标反应的进行。但至今为止却很少研究离子液体的引入对酸体系密度、黏度、溶解性等基础特性的影响。
密度是一类重要的基础物性,在流体力学、传热、传质过程和相平衡的研究中是不可或缺的[13]。对于无机酸催化的烷基化、酯化反应等非均相反应,反应物与催化剂的密度差影响到两相的混合与传质性能,进而影响其催化效果。因此,研究离子液体与无机酸混合催化体系密度的变化规律对阐明离子液体的助催化机理具有重要的意义。
本工作在常压和283.15~313.15 K的温度范围内,测定了离子液体1-丁基-3-甲基咪唑硫酸氢盐([BMim][HSO4])与H2SO4二组分物系在全浓度范围内的密度,由密度数据计算了不同温度和浓度下混合物的超额摩尔体积(VE)和各组分的偏摩尔体积,基于半经验Zhang方程和NMSRK状态方程建立了二组分物系密度的预测模型。
1 实验部分
1.1 试剂
硫酸(纯度为95%~98%(w))、氢氧化钠(纯度大于99%(w)):AR,成都科龙试剂公司;发烟硫酸:50%(w),上海振泓化工有限公司;[BMim][HSO4]:纯度99%(w),上海成捷化学公司。
1.2 硫酸溶液的配制与标定
100%(w)硫酸按文献[14-15]报道的方法制备。先用0.50 mol/L的氢氧化钠标准溶液[16]标定分析纯试剂硫酸(纯度为95%~98%(w))[17],然后将标定的硫酸(纯度为95%~98%(w))与含量为50%(w)的发烟硫酸混合,获得纯度为100%(w)的硫酸,并再用氢氧化钠标准溶液标定。
1.3 酸性混合物的配制
将离子液体[BMim][HSO4]在80 ℃真空干燥箱(DZF-6050型,上海飞越实验仪器有限公司)中干燥12 h,用自动水分滴定仪(ZSD-2型,上海市安亭电子仪器厂)测定水含量,然后将离子液体加入到已知质量的10 mL试样瓶中并用分析天平(FA2004B型,上海精科天美科学仪器有限公司)称重计量。向试样瓶中滴加所需量的无机酸以配制预定浓度的二组分混合物,密封,磁力搅拌混合均匀后真空保存。
1.4 混合物密度的测量
采用奥地利Anton Paar公司DMA 4500型密度计测量液体的密度。每次实验前均需采用纯水对密度计进行校准,确保实验数据测量的可靠性。用微量进样器吸取约2 mL试样注入到测量池,待测量池温度达到设定温度时,开始测量试样的密度。测量完后用无水乙醇多次清洗测量池,确保测量池内试样无残留。密度测量的不确定度u(ρ) =5×10-5g/ cm3,温度的不确定度为u(T)=0.02 K。
1.5 密度的热力学模型
密度是一个重要的基础物性,但通过实验的方法测定所有离子液体混合物的密度是不切实际的。因此,通过关联式精确估算离子液体混合物的密度十分必要。文献[18-22]报道了很多关于预测或估算离子液体混合物密度的模型。这些模型主要可分为两类:一类是经验式,如Redlich-Ksiter多项式经验方程[18],需要众多的实验数据点来拟合实验参数;另一类是状态方程模型,如SAFT-Cubic状态方程[20],需要经过复杂的热力学计算。在本工作中选择如下两个热力学模型建立对该物系密度的预测模型。
1.5.1 半经验Zhang方程的热力学模型
Huang等[22]曾提出一个能预测离子液体与分子溶剂混合密度的半经验Zhang方程,本工作结合自身研究物系的密度数据,对Zhang方程进行了一定的修正,建立了方程式(1)和式(2):

式中,ρm,ρ1,ρ2分别为混合体系、组分1和组分2的密度,g/cm3;x1,x2分别为组分1和组分2的摩尔分数;δρ为纯混合物的实际密度与理想情况下混合物系密度的差值;α为物系组成的特征参数,对于特定组成的物系,α可视为恒定值;T为温度,K。
1.5.2 NMSRK状态方程
Nasrifar等[23]提出Predictive Soave-Redlich-Kwong(PSRK)状态方程来预测制冷剂流体的密度。最近Rabari等[24]用温度函数对PSRK方程进行了修正,建立了NMSRK状态方程,并应用于预测离子液体的密度。本工作通过混合规则,采用NMSRK状态方程,建立对研究物系的混合密度进行预测的计算模型,见式(3)~(9)。
NMSRK状态方程:

其中,密度系数(ρ0)为:

温度函数f(Tr):
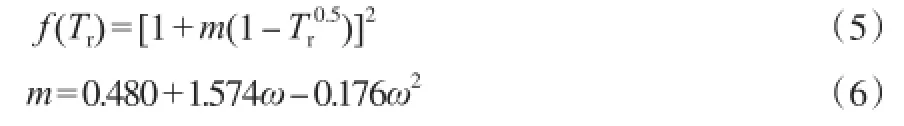
对于混合物则有:

式中,ρ0为密度系数;ρc为临界密度,g/cm3;ρci为组分i的临界密度,g/cm3;ρcm为混合物的临界密度,g/cm3;Tc为临界温度,可用改进的Lydersen-Joback-Reid(LJR)基团贡献法[25]进行计算,K;Tr为对应态温度,Tr=T/Tc;ω为偏心因子,通过Rudkin模型[25-26]计算;δ为一定组成的特征参数;d1~d4为系数,d1=1.168 8,d2=1.817 7,d3= -2.658 1,d4=2.161 3。
临界参数和偏心因子的计算方法见式(10)~(14)。

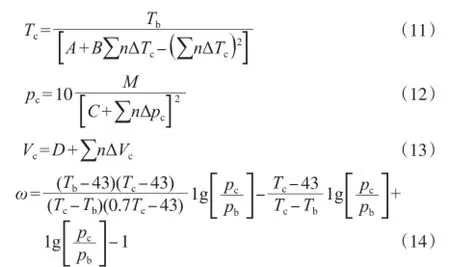
式中,Tb为物质的沸点温度,K;pb为大气压力,MPa;pc为临界压力,MPa;Vc为临界体积,cm3/ mol;n为物质结构中各拆分基团的个数;M为摩尔质量,kg/mol;A~D为常数,A=0.570 3,B=1.012 1,C=0.257 3,D=6.750 0。
2 结果与讨论
2.1 二组分物系密度的测定
采用密度计分别测定了离子液体[BMim]·[HSO4]与H2SO4二组分物系在全浓度范围内的密度,其结果见表1。
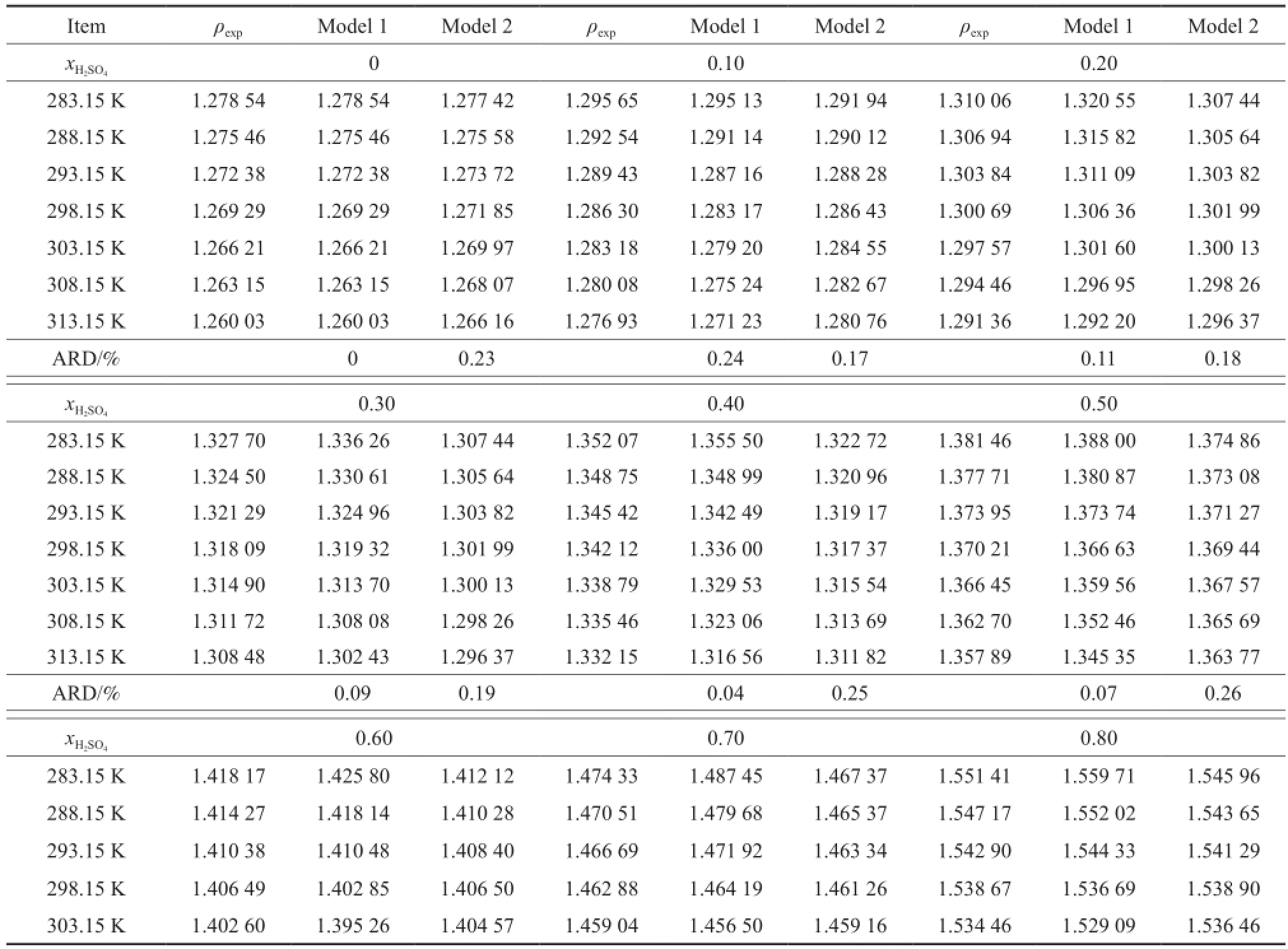
表1 [BMim][HSO4]-H2SO4二组分物系密度的实验值与计算值Table 1 Experimental and calculated densities of the binary[BMim][HSO4]-H2SO4system
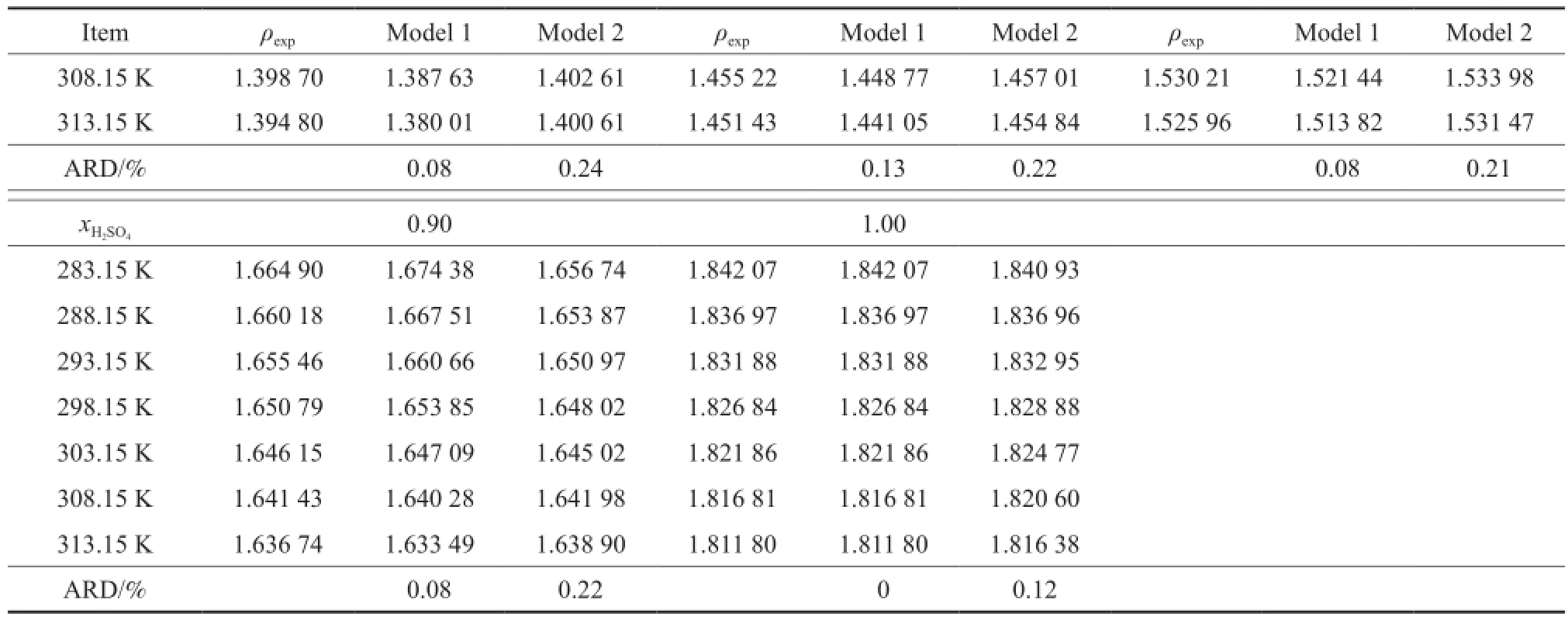
续表1
二组分物系的密度随温度和离子液体摩尔分数变化的趋势分别见图1和图2。
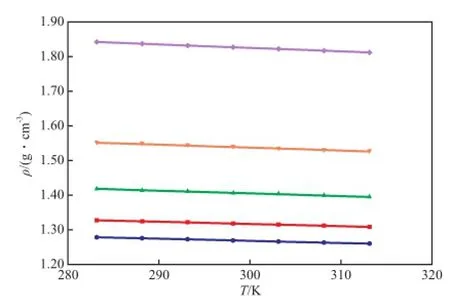
图1 [BMim][HSO4]-H2SO4二组分物系的密度随温度变化的趋势Fig.1 Density of the binary[BMim][HSO4]-H2SO4system as a function of temperature atxH2SO4.xH2SO4:◆ 1.0;▼ 0.8;▲ 0.6;■ 0.3;● 0
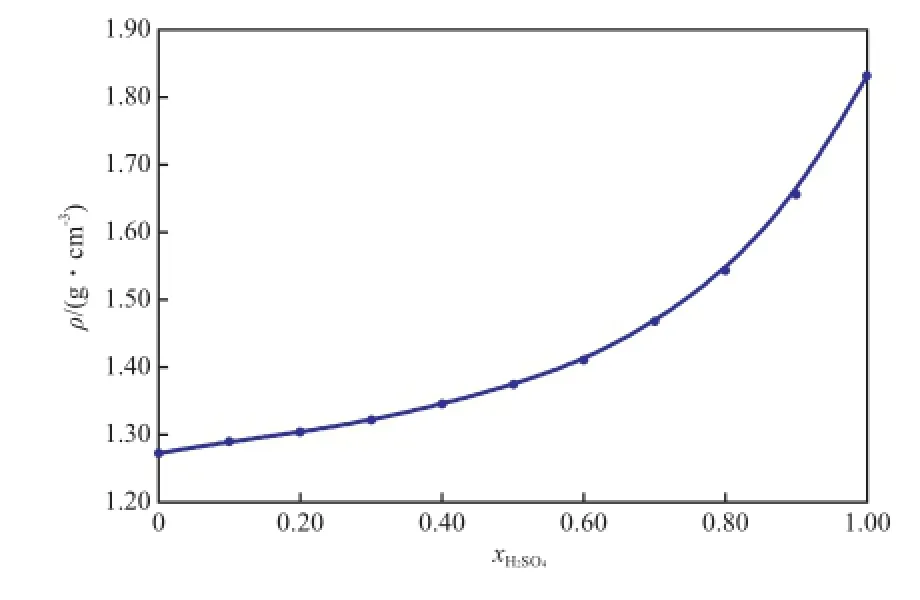
图2 [BMim][HSO4]-H2SO4二组分物系的密度随xH2SO4的变化趋势Fig.2 Density of the binary[BMim][HSO4]-H2SO4system as a function ofxH2SO4.Temperature:288.15 K.
由表1和图1可知,在283.15~313.15 K温度范围内,当物系的组成一定时,其密度随着温度的升高而呈线性下降趋势,降幅低于2.0%。由表1和图2可知,二组分物系的密度更易受H2SO4浓度的影响,这主要是由于相同温度下,纯H2SO4的密度约是[BMim][HSO4]密度的1.5倍,较大的密度差造成了二组分物系的密度更易受其组成变化的影响。向纯硫酸中加入微量的[BMim][HSO4]可有效地降低酸相的密度。如288.15 K下纯硫酸的密度是1.836 96 g/cm3,加入摩尔分数0.10的[BMim]·[HSO4]时,二组分物系的密度降为1.660 18 g/ cm3,降幅高达10%。而低酸相密度对促进烷基化、酯化等非均相反应的两相混合、提高产物的转化率十分有利。
Gardas等[27]曾采用改进的Ye-Shreeve方法[28]在温度为273.15~343.15 K、压力为0.10~100 MPa的范围内估算了纯离子液体的密度,见式(15)。
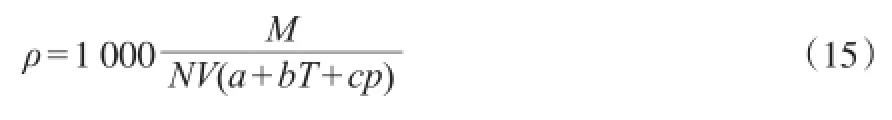
式中,N为阿伏加德罗常数;a,b,c为常数,a=0.800 5± 0.000 2,b=(6.652±0.007)×10-4K-1,c=(-5.919±0.024)× 10-4MPa-1。
本工作采用改进的Ye-Shreeve方法对于纯离子液体[BMim][HSO4]的密度在所测温度范围内进行了估算,并与实验测定值进行了比较,结果见图3。由图3可知,实验值与估算值的最大相对误差低于0.9%,说明[BMim][HSO4]密度的实验值具有较高的可信度。
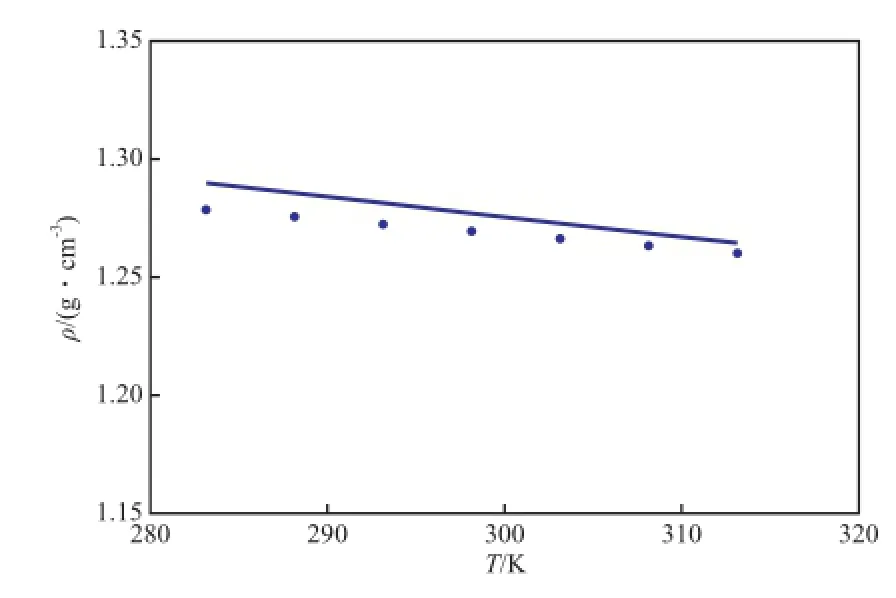
图3 [BMim][HSO4]密度的实验值与估算值随温度的变化Fig.3 Density of[BMim][HSO4]versus temperature.—— Calculated values with the Gardas and Coutinho model;● Experimental values
2.2 二组分物系密度的预测
对于特定组成的物系,半经验Zhang方程的特征参数α可以视为恒定值,可由同温度下的密度值求取。 对于NMSRK状态方程,其特征参数(δ)通过最小目标函数(OF)求得,见式(16)。
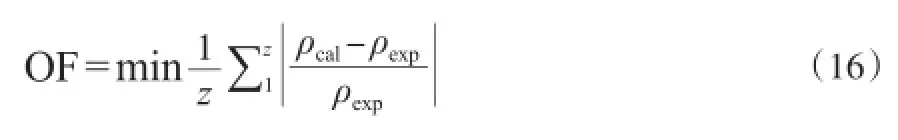
采用平均相对误差(ARD)来评价模型的精度和准确性,见式(17)。
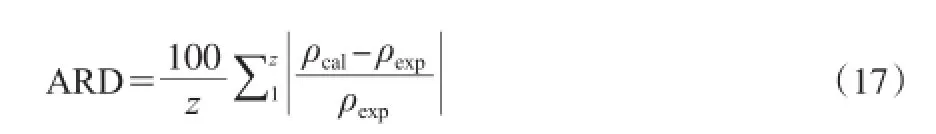
式中,ρcal为由方程计算得到的二组分物系的密度值,g/cm3;ρexp为实验测定的二组分物系的密度值,g/cm3;Z为同一浓度下的实验点的数目。
各个组成下半经验Zhang方程的特征参数和NMSRK状态方程特征参数见表2。
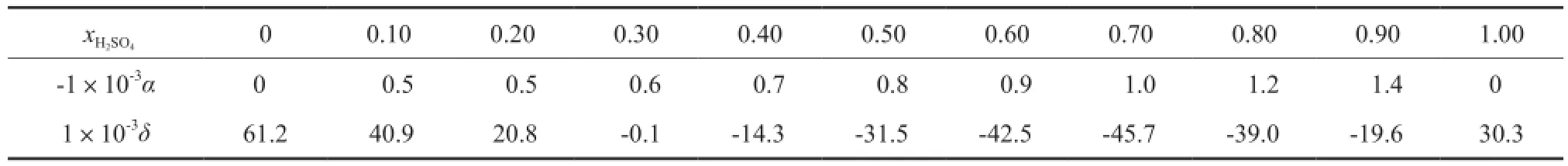
表2 半经验Zhang方程的特征参数α和NMSRK状态方程的特征参数δTable 2 Characteristic parameters of semi-empirical Zhang model(α) and NMSRK equation of state(δ)
由半经验Zhang方程和NMSRK状态方程求得的二组分物系的密度值见表1。由表1可知,半经验Zhang方程求得的密度值最大相对误差为0.93%,平均相对误差不超过0.24%;NMSRK状态方程求得的密度值的最大相对误差为0.58%,平均相对误差不超过0.26%,说明半经验Zhang方程和NMSRK状态方程对[BMim][HSO4]-H2SO4二组分物系的密度均具有较好的预测结果。
对于NMSRK状态方程,其特征参数与xH2SO4之间满足式(18)。
δ= 0.466 9x4- 0.506 9x3+ 0.248 5x2- 0.240 9x+ 0.061 8 (18)
2.3 二组分物系的超额摩尔体积
混合物的超额热力学性质反映了真实溶液的性质与相同温度、压力和组成下的理想溶液性质的差别。由[BMim][HSO4]-H2SO4的密度,根据式(19)计算二组分物系的VE[29],结果见表3。
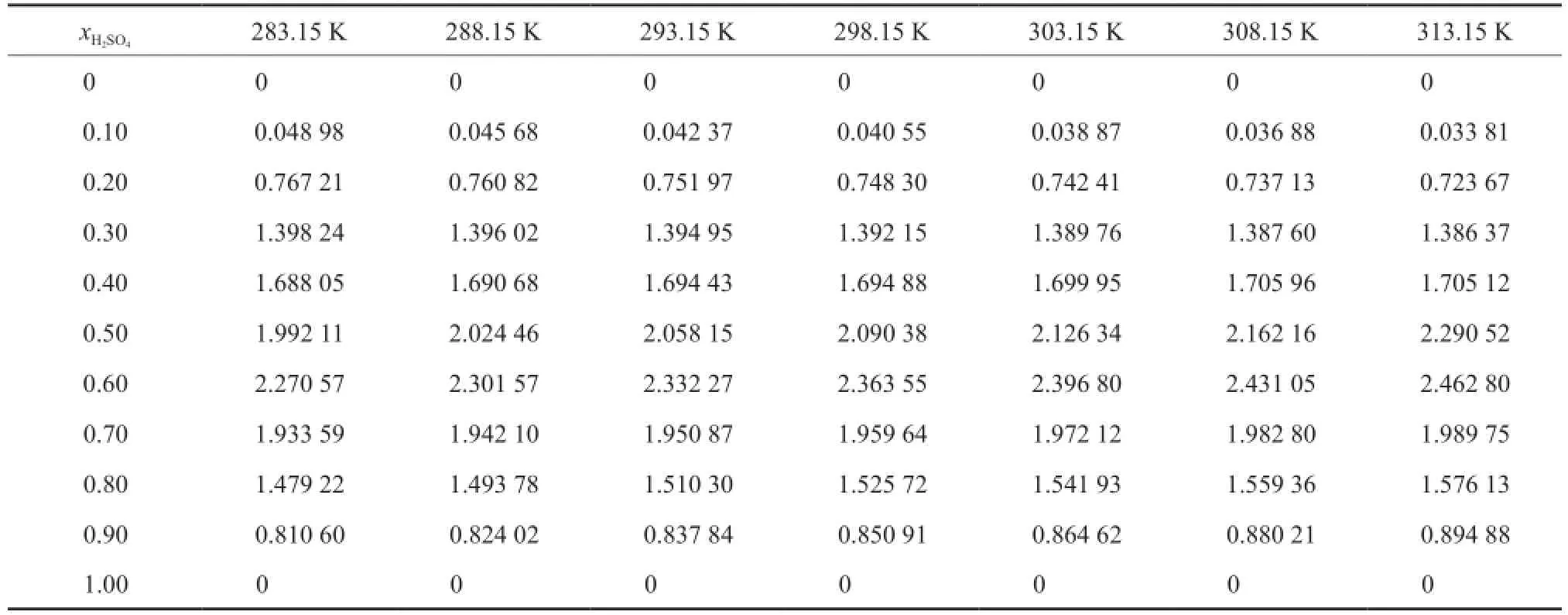
表3 [BMim][HSO4]-H2SO4二组分物系的VETable 3 Excess molar volumes(VE) of the binary[BMim][HSO4]-H2SO4system
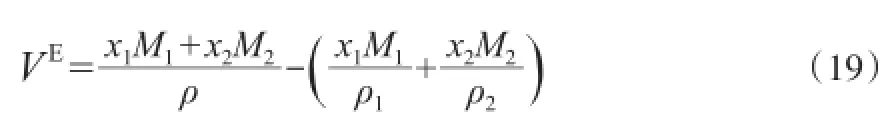
式中,VE为二组分物系的超额摩尔体积,cm3/mol。
由表3可知,在0.1 MPa下和所测温度范围内,二组分物系的VE均为正值;xH2SO4是影响物系VE的主要因素,同一温度下,二组分物系的VE随xH2SO4的增大先增加后减小,当xH2SO4=0.60时,物系的VE达到极大值 (313.15 K时为2.462 80 cm3/mol),即混合物系与理想物系之间的偏差达到最大。多元溶液混合物的VE主要与组分的物理性质、结构特性和化学作用力有关[30]。离子液体的阴阳离子结构不对称且存在很强的库仑力,离子液体之间还存在很强的氢键网络[31],H2SO4的加入,使离子液体这种原有的稳定的氢键结构被破坏,从而导致混合物系的VE出现正值;此外离子液体与H2SO4分子之间的离子-偶极作用也会在一定程度上使得混合物系的VE出现正值[32]。
图4为[BMim][HSO4]-H2SO4二组分物系VE随xH2SO4的变化趋势,图4中的曲线由三级Redlich-Kister(RK) 经验方程拟合得到,见式(20)。

式中,αi为RK方程中i次方的系数,i=0,1,2,3。
表4为[BMim][HSO4]-H2SO4二组分物系VE的RK方程拟合参数,其相关系数R2均大于0.985。
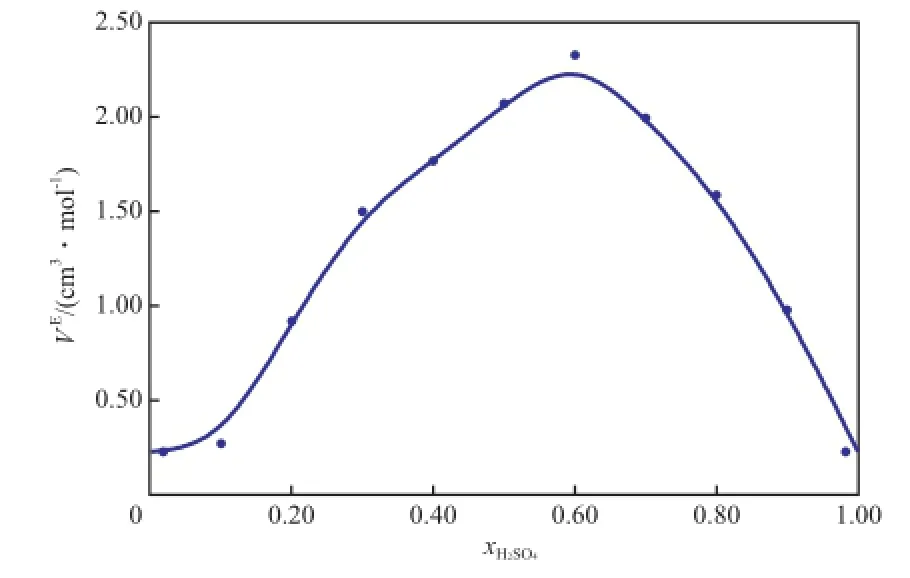
图4 [BMim][HSO4]-H2SO4二组分物系VE随xH2SO4的变化趋势Fig.4 Excess molar volume of the binary[BMim][HSO4]-H2SO4system as a function ofxH2SO4.Temperature:288.15 K.The line was calculated using the third order Redlich-Kister(RK) type polynomial.
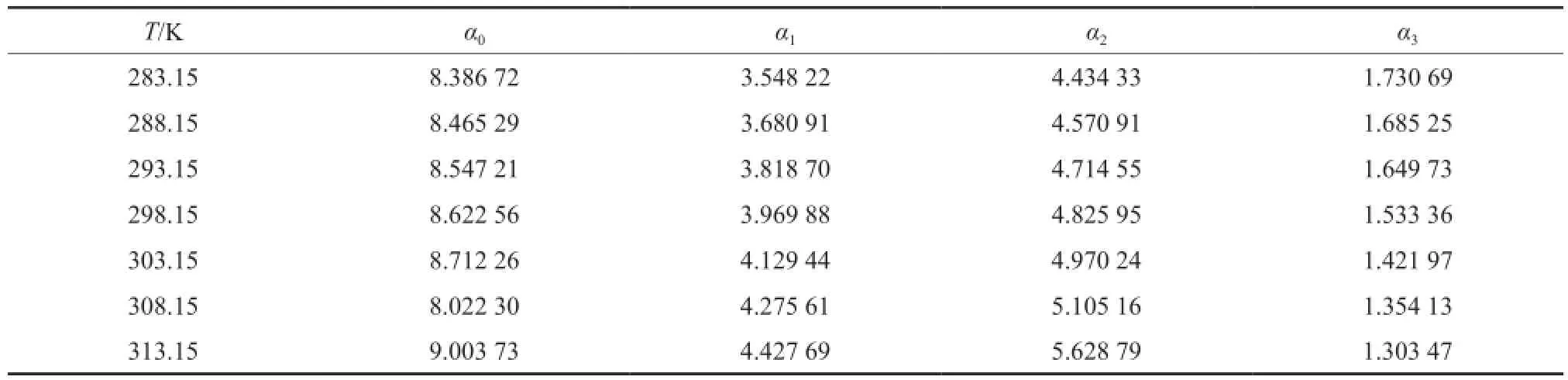
表4 [BMim][HSO4]-H2SO4二组分物系VE的RK方程拟合参数Table 4 Fitting parameters for excess molar volumes of the binary [BMim][HSO4]-H2SO4system with the RK model
2.4 二组分物系中各组分的偏摩尔体积
溶液的偏摩尔性质对研究溶液组成与物系分子间相互作用的影响具有重要意义。二组分物系中各组分的偏摩尔体积的计算见式(21)和式(22):
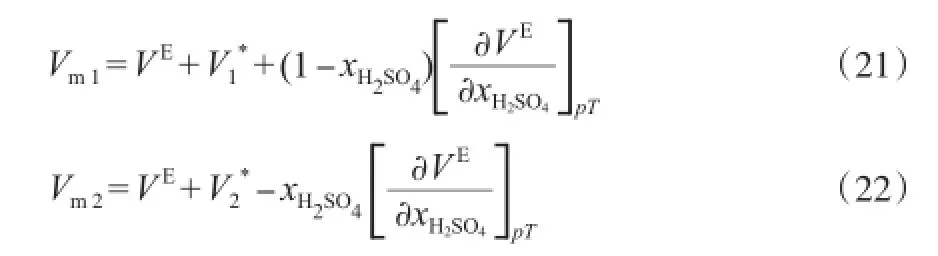
式中,Vm1,Vm2为混合物中H2SO4和[BMim][HSO4]的偏摩尔体积,cm3/mol;V*1,V*
2分别为纯组分的摩尔体积,cm3/mol;xH2SO4表示混合物系中H2SO4的摩尔分数。
将式(20)分别与式(21)和式(22)联合,可得式(23)和式(24):
将表4中的数据代入式(22)和式(23),所得拟合曲线见图5和图6。由图5和图6可知,0.1 MPa下,当二组分物系的组成一定时,在所研究的温度范围内,各组分的偏摩尔体积均随着温度的升高而增大。当温度一定时,[BMim][HSO4]的偏摩尔体积随xH2SO4的增大而增加,而H2SO4的偏摩尔体积随xH2SO4的增大而减小。这说明在混合过程中纯组分的化学和非化学的相互作用被破坏。随xH2SO4的增加,离子液体之间的氢键聚合体逐渐被加入的H2SO4破坏,而加入的H2SO4又占据原有离子液体之间的氢键空穴,从而导致离子液体的偏摩尔体积增大,H2SO4的偏摩尔体积减小。
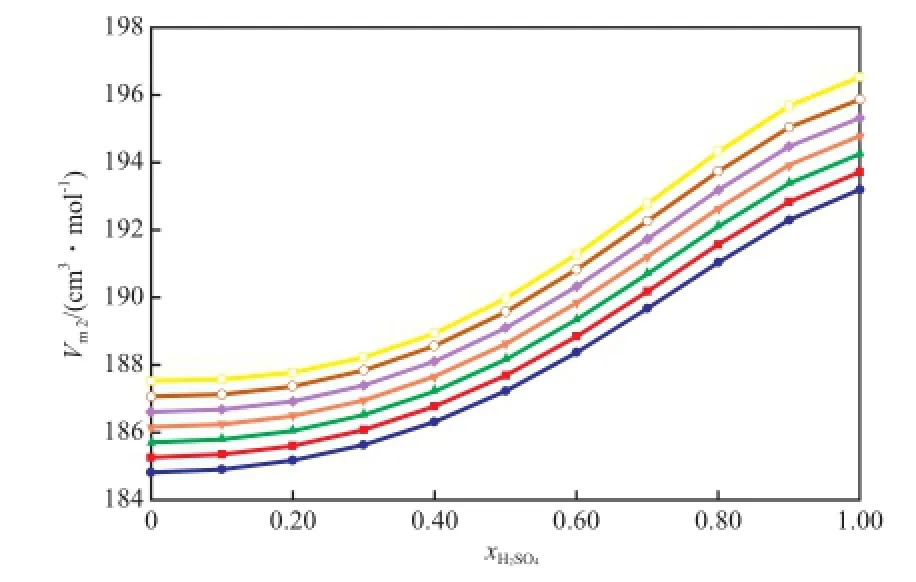
图5 [BMim][HSO4]-H2SO4二组分物系在不同温度下[BMim][HSO4]的偏摩尔体积(Vm2)随xH2SO4的变化趋势Fig.5 Changes of the partial molar volumes of[BMim][HSO4](Vm2) in the binary[BMim][HSO4]-H2SO4system withxH2SO4at diferent temperature.Pressure: 0.1 MPa.Temperature/K:● 283.15;■ 288.15;▲ 293.15;▼ 298.15;◆ 303.15;○ 308.15;□ 313.15
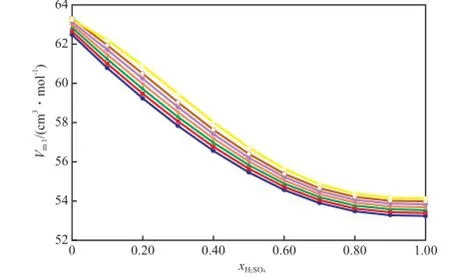
图6 [BMim][HSO4]-H2SO4二组分物系在不同温度下H2SO4的偏摩尔体积(Vm1)随xH2SO4的变化趋势.Fig.6 Changes of the partial molar volumes of H2SO4(Vm1) in the binary[BMim][HSO4]-H2SO4system withxH2SO4at diferent temperature.Pressure:0.1 MPa.Temperature/K:● 283.15;■ 288.15;▲ 293.15K;▼ 298.15;◆ 303.15;○ 308.15;□ 313.15
3 结论
1) 在283.15~313.15 K温度范围内,对于一定组成的[BMim][HSO4]-H2SO4二组分物系,其密度随着温度的升高呈线性下降趋势,但降幅均低于2.0%。
2) 半经验Zhang方程和NMSRK状态方程对[BMim][HSO4]-H2SO4二组分物系的密度均具有较好的预测功能,其平均绝对误差均不超过0.30%。
3) 在全浓度范围内[BMim][HSO4]-H2SO4二组分的VE均大于零,当xH2SO4=0.60时,物系的VE达到最大,最大值为2.462 80 cm3/mol(313.15 K)。
4) 在全浓度范围内,[BMim][HSO4]-H2SO4二组分物系中H2SO4的偏摩尔体积随xH2SO4的增大而减小,[BMim][HSO4]的偏摩尔体积随xH2SO4的增大而增大。
符 号 说 明


[1]Welton T. Room-temperature ionic liquids:Solvents for synthesis and catalysis[J]. Chem Rev,1999,99(8):2071 - 2084.
[2]Gebbie M A,Valtiner M,Banquy X,et al. Ionic liquids behave as dilute electrolyte solutions[J]. P Natl Acad Sci USA Sci,2013,110(24):9674 - 9679.
[3]邵晓楠,张运茂,王建红,等. 杂多酸型离子液体催化合成乙酸异戊酯的反应动力学[J]. 石油化工,2015,44(12):1480 - 1485.
[4]张圆,唐盛伟,张涛. 预测乙烷/离子液体系统溶解平衡的UNIFAC模型[J]. 石油化工,2015,44(10):1212 - 1217.
[5]王千里,朱京科,李中坚,等. 离子液体萃取燃料油深度脱硫的研究进展[J]. 石油化工,2013,42(10):1174 - 1178.
[6]Xing Xueqi,Zhao Guoying,Cui Jianzhong,et al. Isobutane alkylation using acidic ionic liquid catalysts[J]. Catal Commun,2012,26:68 - 71.
[7]徐新,罗国华,王莉. 氯铝酸离子液体催化苯与氯乙烷合成乙苯[J]. 石油化工,2012,41(1):33 - 36.
[8]Huang Qian,Zhao Guoying,Zhang Suojiang,et al. Improved catalytic lifetime of H2SO4for isobutane alkylation with trace amount of ionic liquids bufer[J]. Ind Eng Chem Res,2015,54(5):1464 - 1469.
[9]Liu Ying,Hu Ruisheng,Xu Chunming,et al. Alkylation of isobutene with 2-butene using composite ionic liquid catalysts[J]. Appl Catal,A,2008,346(1):189 - 193.
[10]Cui Jia,de With J,Klusener P A A,et al. Identifcation of acidic species in chloroaluminate ionic liquid catalysts[J]. J Catal,2014,320:26 - 32.
[11]Tang Shengwei,Scurto A M,Subramaniam B. Improved 1-butene/isobutane alkylation with acidic ionic liquids and tunable acid/ionic liquid mixtures[J]. J Catal,2009,268(2):243 - 250.
[12]Matuszek K,Chrobok A,Coleman F,et al. Tailoring ionic liquid catalysts:Structure,acidity and catalytic activity of protonic ionic liquids based on anionic clusters,[(HSO4)·(H2SO4)x]-(x=0,1or 2)[J]. Green Chem,2014,16(7):3463 - 3471.
[13]Wasserscheid P,Sesing M,Korth W. Hydrogensulfate and tetrakis(hydrogensulfato) borate ionic liquids:Synthesis and catalytic application in highly Brönsted-acidic systems for Friedel-Crafts alkylation[J]. Green Chem,2002,4(2):134 -138.
[14]Grasvik J,Hallett J P,To T Q,et al. A quick,simple,robust method to measure the acidity of ionic liquids[J]. Chem Commun,2014,50(55):7258 - 7261.
[15]Buncel E,Keum S R,Rajagopal S,et al. Rearrangement mechanisms for azoxypyridines and azoxypyridineN-oxides in the 100% H2SO4region:The Wallach rearrangement story comes full circle[J]. Can J Chem,2009,87(87):1127 -1134.
[16]国家质量监督检验检疫总局. GB/T 601—2002 化学试剂:标准标定溶液的制备[S]. 北京:中国标准出版社,2003.
[17]国家质量监督检验检疫总局,国家标准化管理委员会. GB/ T 625—2007 化学试剂:硫酸[S]. 北京:中国标准出版社,2008.
[18]Kim K S,Lee H. Densities,viscosities,and surface tensions of the trifluoroethanol+quinoline system[J]. J Chem Eng Data,2002,47(2):216 - 218.
[19]Singh S,Aznar M,Deenadayalu N. Densities,speeds of sound,and refractive indices for binary mixtures of 1-butyl-3-methylimidazolium methyl sulphate ionic liquid with alcohols atT=(298.15,303.15,308.15,and 313.15) K[J]. J Chem Therm,2013,57:238 - 247.
[20]Polishuk I I. Generalization of SAFT+ cubic equation of state for predicting and correlating thermodynamic properties of heavy organic substances[J]. J Super Fluid,2012,67:94 -107.
[21]Hosseini S M,Papari M M,Fadaei-Nobandegani F,et al. A simple equation for predicting the volumetric properties of mixtures involving ionic liquids[J]. J Solution Chem,2013,42(9):1854 - 1862.
[22]Huang Ying,Zhang Xiangping,Zhao Yongsheng,et al. New models for predicting thermophysical properties of ionic liquid mixtures[J]. Phys Chem Chem Phys,2015,17(40):26918 - 26929.
[23]Nasrifar K,Moshfeghian M. A saturated liquid density equation in conjunction with the Predictive-Soave-Redlich-Kwong equation of state for pure refrigerants and LNG multicomponent systems[J]. Fluid Phase Equilib,1998,153(2):231 - 242.
[24]Rabari D,Patel N,Joshipura M,et al. Densities of six commercial ionic liquids:Experiments and prediction using a cohesion based cubic equation of state[J]. J Chem Eng Data,2014,59(3):571 - 578.
[25]Valderrama J O,Forero L A,Rojas R E. Critical properties and normal boiling temperature of ionic liquids:Update and a new consistency test[J]. Ind Eng Chem Res,2012,51(22):7838 - 7844.
[26]Rudkin J. Equation predicts vapor pressures[J]. Chem Eng,1961,17(4):202 - 203.
[27]Gardas R L,Coutinho J A. Extension of the Ye and Shreeve group contribution method for density estimation of ionic liquids in a widerange of temperatures and pressures[J]. FluidPhase Equilib,2008,263(1):26 - 32.
[28]Ye C,Shreeve J M. Rapid and accurate estimation of densities of room-temperature ionic liquids and salts[J]. J Phys Chem A,2007,111(8):1456 - 1461.
[29]Abdulagatov I M,Tekin A,Safarov J,et al. Densities and excess,apparent,and partial molar volumes of binary mixtures of BMIMBF4+ Ethanol as a function of temperature,pressure,and concentration[J]. Int J Thermophys,2008,29(2):505 - 533.
[30]许映杰,黄钗英,李浩然. 离子液体[BPy]BF4和甲醇二元混合体系的超额摩尔体积、折射率和黏度[J]. 高校化学工程学报,2011,25(3):370 - 375.
[31]Hunt P A,Ashworth C R,Matthews R P. Hydrogen bonding in ionic liquids[J]. Chem Soc Rev,2015,44(5):1257 -1288.
[32]Ahluwalia R,Wanchoo R K,Sharma S K,et al. Density,viscosity,and surface tension of binary liquid systems:Ethanoic acid,propanoic acid,and butanoic acid with nitrobenzene[J]. J Solution Chem,1996,25(9):905 - 917.
(编辑 杨天予)
宁波材料所在CFRTP/金属激光连接技术的研究上取得进展
碳纤维热塑性复合材料(CFRTP)是一种高性能新型材料,具有比强度高、耐腐蚀、抗疲劳、耐热性好等特点,在汽车轻量化、无人机制造、航空航天、国防军工上有着良好的应用前景。CFRTP在应用过程中经常遇到与金属异质材料的连接问题。
宁波材料所与北京大学深圳研究院合作,针对CFRTP/金属异质结构的激光连接技术进行了研究。通过建立CFRTP-金属激光直接连接数学模型,实现了焊接过程热效应的仿真及熔宽、熔深及热损伤的预测;对连接接头组织表征分析,发现接头处气泡的存在导致应力集中并产生微裂纹,成为接头失效的主要原因,并对气泡的产生机理进行了研究;通过工艺创新,利用激光熔融填充树脂方法可提高CFRTP/金属异质结构件的连接强度。
我国生物燃料乙醇年产量已超2 Mt
中国科学院发布的《中国工业生物技术白皮书2015》显示,2014年我国生物燃料乙醇年产量约2.16 Mt,生物柴油年产量约1.21 Mt。
白皮书指出,中国是世界上第三大生物燃料乙醇生产国和应用国,仅次于美国和巴西。近年来,国际原油价格持续走低,在国家财税政策调节的引导下,中国燃料乙醇行业逐渐向非粮经济作物和纤维素原料综合利用方向转变,积极开展工艺和示范项目建设。作为生物能源的一个重要领域,白皮书还指出,中国生物柴油产业发展处于成长期,生物柴油总产能约为3~3.5 Mt,但由于受到原料供应的限制,生产装置开工率不足,尚无法满足巨大的市场需求。为此,生物柴油企业正在积极需求替代原料,开发和推广生物柴油新技术,加快建设工业装置。
生物降解塑料成研发热点
环保性塑料制品的生物降解塑料,成为全球瞩目的研发热点,亦蕴藏着巨大商机。CHINAPLAS国际橡塑展聚焦行业安全、环保、高效、轻量化、多功能化、智能化的发展趋势,助推包装企业持续创新发展。
ecovio®是巴斯夫推出的一种用途广泛的优质生物塑料,其主要应用领域为塑料薄膜,如有机餐厨垃圾袋、两用袋或农用薄膜,此外,ecovio®也可用于其他可堆肥包装解决方案,如收缩膜、泡沫包装及注塑成型产品等。NATUREWORKS, LLC.将展出Ingeo生物聚合物及其终端产品,Ingeo应用于包括一次性食品餐具、塑料袋、纤维纺织等。宏力生化科技股份有限公司将展示GRABIO 100%生物可分解/可堆肥淀粉塑胶,GRABIO采用可再生资源如玉米淀粉为原料,减少石油及树木资源消耗。
2015—2016年全球苯乙烯单体的需求情况
石油化学新报(日),2016(5006):5
2015年全球苯乙烯单体(SM)的需求比2014年增长了0.7%,达到27.7 Mt。随着占SM需求最大份额的中国发泡聚苯乙烯(EPS)对SM需求的持续低迷,预计2016年以后全球对SM的需求增长率持续走低,不到1%。
2015年全球对SM的需求情况极不稳定,1~3月受原油价格下落的影响,亚洲SM的市场价为900~1 000美元。接下来的4~6月份亚洲地区SM生产装置集中大修,加上日本环氧乙烷公司425 kt/a的SM装置停产,亚洲SM的市场价上升到1 300~1 400美元。但到7~9月,随着装置大修结束,供需情况缓和,亚洲SM的市场价又跌落到900美元。由于各种原因到10~12月份,亚洲SM的市场价仍维持在900美元。由于SM市场的混乱,2015年SM的信用交易(相对于石脑油的利润差)也扩大到450~800美元,但预计年均利差在550美元左右,这比2014年的平均利差高。
2016年亚洲地区SM装置的大修主要集中在日本国内,而且日本旭化成公司水岛工厂的320 kt/a SM装置停产,短期供需关系平衡。亚洲市场SM的价格上升到1 100美元左右,利差也扩大到700美元。但由于装置大修,供应能力降低1.5 Mt,比2015年降低的2.5 Mt要少。
从大的SM生产厂家状况看,今后5年对SM的需求增长累计达到2.0 Mt,增长率为3%。供应能力的增长预计能达到4.0~5.0 Mt。数字上能力增长大于需求,但新建装置是否能建成还不确定,且如果考虑每年装置发生事故等因素,供需关系还是基本平衡的。
Density and thermodynamic properties of binary [BMim][HSO4]-H2SO4system
Zhang Shuai,Zhang Tao,Tang Shengwei
(College of Chemical Engineering,Sichuan University,Chengdu Sichuan 610065,China)
Under the conditions of ambient pressure and 283.15-313.15 K,the density of binary[BMim][HSO4]-H2SO4systems with the molar fraction of H2SO4of 0-1 was measured. Based on the obtained density data,the excess molar volume of the systems and the partial molar volumes of the two components at diferent temperature were calculated. The models for predicting the density of the binary systems were established by means of the semi-empirical Zhang model and NMSRK equation of state separately. It was showed that,the two models predict the density of the binary systems well with an average deviation of less than 0.30%. The excess molar volumes of all the measured binary systems were greater than zero and the maximum value of 2.462 80 cm3/mol was obtained under the conditions of molar fracton of H2SO40.60 and 313.15 K. In the binary systems,with increasing the molar fraction of H2SO4,the partial molar volume of[BMim][HSO4]increased while the partial molar volume of H2SO4decreased.
ionic liquid;sulphuric acid;binary system;density;thermodynamic properties
1000 - 8144(2016)08 - 0957 - 09
TQ 013.1
A
10.3969/j.issn.1000-8144.2016.08.012
2016 - 02 - 01;[修改稿日期]2016 - 04 - 25。
张帅(1990—),男,湖北省天门市人,硕士生,电邮 Zhanga0117@163.com。联系人:唐盛伟,电话 028 - 85405201,电邮tangdynasty@scu.edu.cn。
国家自然科学基金项目(21276163;21576168)。

