12月龄伊犁马对维生素B1和维生素B2的需要量
陈俊宏 何雪曼 邓海峰 李晓斌 刘 振 马 军 甘建荣 唐雪梅 杨开伦
(新疆农业大学新疆肉乳用草食动物营养重点实验室,乌鲁木齐830052)
12月龄伊犁马对维生素B1和维生素B2的需要量
陈俊宏 何雪曼 邓海峰 李晓斌 刘 振 马 军 甘建荣 唐雪梅 杨开伦*
(新疆农业大学新疆肉乳用草食动物营养重点实验室,乌鲁木齐830052)
本试验旨在研究维生素B1、维生素B2不同摄入量对12月龄伊犁马血液、尿液相关指标的影响,以得到12月龄伊犁马对维生素B1、维生素B2的需要量。试验选取12月龄±5日龄、平均体重(245.28±18.36) kg的伊犁马公马35匹,随机分为5组,每组7匹,分别为试验Ⅰ组、试验Ⅱ组、试验Ⅲ组、试验Ⅳ组、试验Ⅴ组,马匹饲喂相同的基础饲粮,并分别添加0、16、32、48和64 mg/(匹·d)的维生素B1和0、10、20、30和40 mg/(匹·d)的维生素B2,进行为期20 d的饲养试验。试验Ⅰ组、试验Ⅱ组、试验Ⅲ组、试验Ⅳ组、试验Ⅴ组实际摄入维生素B1量分别为19.00、33.49、48.27、62.96、77.53 mg/(匹·d),实际摄入维生素B2量分别为21.95、31.68、41.77、51.53、61.26 mg/(匹·d)。结果表明:随着实际摄入维生素B1量的增加,伊犁马血浆维生素B1含量、红细胞转酮酶活性(E-TKA)、尿液维生素B1排出量逐渐升高,焦磷酸硫胺素(TPP)效应逐渐降低。试验Ⅰ组血浆维生素B1含量显著低于试验Ⅲ组(P<0.05),极显著低于试验Ⅳ组、试验Ⅴ组(P<0.01);试验Ⅰ组E-TKA极显著低于试验Ⅲ组、试验Ⅳ组和试验Ⅴ组(P<0.01);试验Ⅰ组TPP效应显著高于试验Ⅲ组(P<0.05),极显著高于试验Ⅳ组、试验Ⅴ组(P<0.01);试验Ⅰ组尿液维生素B1排出量极显著低于试验Ⅲ组、试验Ⅳ组、试验Ⅴ组(P<0.01)。随着实际摄入维生素B2量的增加,伊犁马血浆维生素B2含量出现波动变化,红细胞谷胱甘肽还原酶活性系数(E-GRAC)逐渐降低,尿液维生素B2排出量逐渐增加。试验Ⅰ组血浆维生素B2含量显著低于试验Ⅲ组、试验Ⅳ组(P<0.05),极显著低于试验Ⅱ组、试验Ⅴ组(P<0.01);试验Ⅰ组E-GRAC极显著高于试验Ⅱ组、试验Ⅲ组、试验Ⅳ组、试验Ⅴ组(P<0.01);试验Ⅰ组尿液维生素B2排出量极显著低于试验Ⅲ组、试验Ⅳ组、试验Ⅴ组(P<0.01)。综合评价各指标,得到12月龄伊犁马对维生素B1的需要量为48.27 mg/(匹·d),对维生素B2的需要量为31.68 mg/(匹·d)。
伊犁马;维生素B1;维生素B2;需要量
维生素B1、维生素B2是维持动物正常生理功能的一类微量有机物质[1]。维生素B1又称硫胺素,在动物体内主要以硫胺素单磷酸(thiamine monophosphate,TMP)、焦磷酸硫胺素(thiamine pyrophosphate,TPP)、硫胺素三磷酸(thiamine triphosphate,TTP)3种形式存在[2],维生素B1以TPP的形式存在并以辅酶的形式参与调节体内糖、脂肪和蛋白质的代谢[3];维生素B2又称核黄素,在体内主要以黄素单核苷酸(flavin mononucleotide,FMN)和黄素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD)的形式存在,它们是多种氧化酶的辅助因子,在生物氧化过程中参与氢的传递,在能量代谢中,促进碳水化合物、蛋白质、脂肪、核酸的代谢[4]。根据营养学研究,马匹长期缺乏维生素B1出现生长受阻现象、被毛光泽下降、痢疾、精神萎靡、神经错乱、运动失调等症状[5];马匹长期缺乏维生素B2出现眼睑炎、食欲不振、体重减轻等症状[6]。伊犁马是我国著名的培育品种之一,具有性情温顺、体质结实紧凑、遗传性能较稳定、力速兼备等特点。但是伊犁马对营养物质明确的需要量尚不完善,特别是对于维生素类营养物质的适宜需要量没有明确的参考依据。因此,本试验以12月龄伊犁马公马为研究对象,通过在饲粮中添加不同水平的维生素B1、维生素B2,综合评定维生素B1、维生素B2摄入量对血浆中维生素B1、维生素B2的含量,红细胞转酮酶活性(erythrocyte transketolase activity,E-TKA),TPP效应,红细胞谷胱甘肽还原酶活性系数(erythrocyte glutathione reductase activity coefficient,E-GRAC),尿液维生素B1、维生素B2排出量的影响,从而确定12月龄伊犁马对维生素B1、维生素B2的需要量,为今后对伊犁马科学饲养提供参考依据。
1 材料与方法
1.1 试验动物与试验设计
本试验选择12月龄±5日龄、平均体重为(245.28±18.36) kg的伊犁马公马35匹,随机分为5组,分别为试验Ⅰ组、试验Ⅱ组、试验Ⅲ组、试验Ⅳ组、试验Ⅴ组,每组7匹。每天每匹马饲喂2 kg精料补充料,自由采食粗饲料(苜蓿干草)。试验Ⅰ组、试验Ⅱ组、试验Ⅲ组、试验Ⅳ组、试验Ⅴ组每天每匹马分别添加0、16、32、48和64 mg的维生素B1(纯度为99.1%,购自江西天新药业有限公司)和0、10、20、30和40 mg的维生素B2(纯度为99%,购自广济药业有限公司),进行为期20 d的饲养试验。
1.2 饲养管理
在试验期所有试验马匹采用分槽分栏饲喂,自由采食粗饲料,自由饮水;将精料补充料平均分为4份,分别进行补喂;将每匹马需要添加的维生素B1、维生素B2分别装入胶囊,补喂精料补充料的同时进行添加。在试验第15~20天记录每匹马每天的采食量及收集每匹马每天的尿样,并在试验第20天采集血样。试验马匹的饲粮组成及营养水平见表1。
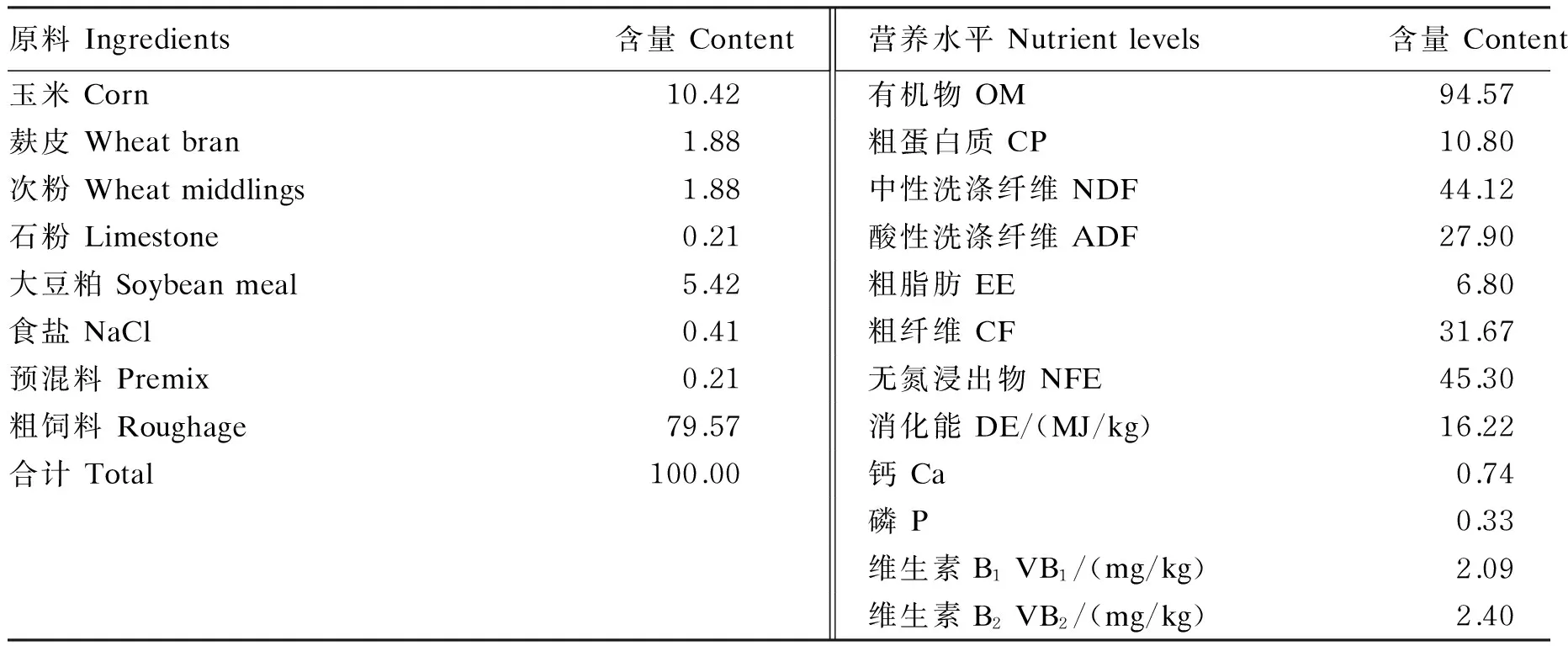
表1 饲粮组成及营养水平(干物质基础)
预混料为每千克饲粮提供The premix provided the following per kg of the diet:VA 480 IU,VB648.96 mg,VD 70.4 IU,VE 21 333.36 IU,泛酸 pantothenic acid 20.46 mg,烟酰胺 nicotinamide 484.85 mg,Cu (as copper sulfate) 10.58 mg,Fe (as ferrous sulfate) 35.56 mg,Mn (as manganese sulfate) 33.54 mg,Zn (as zinc sulfate) 30.92 mg,I (as potassium iodide) 2.46 mg,Se (as sodium selenite) 5.93 mg,Co (as cobalt chloride) 1.11 mg。
1.3 样品、数据的采集
1.3.1 数据的采集
在试验第15~20天,分别记录每天每匹马的采食量及排尿量。
1.3.2 样品的采集及保存
1.3.2.1 饲草料样品的采集及保存
在第14天采集马匹精料补充料样品及粗饲料样品各1 kg,将风干的样品经粉碎机40目粉碎,待测。
1.3.2.2 尿样的采集及保存
在试验第15~20天全天收集马匹尿液,将全天尿液充分混匀,量取尿液总体积的10%为待测样品,记录、-20 ℃冷冻保存。最终将同一匹马6 d的尿样全部混匀,于-20 ℃避光冷冻保存,待测。
1.3.2.3 血样的采集及保存
在试验第20天早晨空腹颈部静脉采用肝素钠抗凝管采集血样,将血样迅速以1 500×g离心15 min后分离血浆,于-20 ℃避光冷冻保存。
1.3.2.4 血红细胞样的采集及保存
在试验第20天早晨空腹颈部静脉采用肝素钠抗凝管采集血样,将血样迅速以1 500×g离心15 min后弃去血浆层,在管中加入10 mL生理盐水,用塑料滴管轻轻吹吸混匀,再以429×g离心10 min,弃上清液得到红细胞,以此方法重复2次后得到红细胞,于-20 ℃避光冷冻保存。
1.4 指标测定
1.4.1 维生素B1含量的测定
血浆的处理:取完全解冻、混匀后的血浆样品500 μL,加入100 μL 3 mol/L三氯乙酸溶液,充分混合均匀,4 286×g离心10 min后吸取上清液300 μL加入900 μL水饱和乙醚混匀,混匀后4 286×g离心5 min,吸取下层液200 μL进行衍生[7]。取室温解冻、充分混匀后的尿原液,用针头式过滤器过滤后稀释100倍,吸取200 μL进行衍生[8]。称取饲草料样品1.00 g置于50 mL棕色容量瓶中,加入0.1 mol/L盐酸溶液35 mL,超声波水浴中超声3 min,在高压灭菌锅内121 ℃保持30 min,取出后轻摇数次,加入混合酶液(淀粉酶和木瓜蛋白酶各3 g溶于100 mL 2 mol/L乙酸钠溶液中)37 ℃恒温培养箱中12 h,取出冷却至室温后加水定容至50 mL,样品经4 286×g离心3 min,取上清液200 μL进行衍生[9]。衍生时在处理液中加入40 μL 12 mmol/L的碱性铁氰化钾溶液,涡旋使其充分混匀15 s;加入8 μL 5 mol/L磷酸终止反应。色谱条件[7]:PRP-1反相柱(250 mm×4.6 mm,10 μm);流动相为15 mmol/L磷酸二氢钠∶四氢呋喃=90∶10(V/V);柱温25 ℃;流速0.5 mL/min;一元等梯度洗脱。检测波长:激发波长(λex)=365 nm,发射波长(λem)=435 nm。进样量10 μL。
1.4.2 E-TKA及TPP效应的测定
参照Takeuchi等[10]的方法,分别在540、510 nm的波长下比色,利用7-景天庚酮糖的含量表示E-TKA;TPP效应是通过体外试验测定加入TPP前后的E-TKA,两者之差占基础活性的百分率。
1.4.3 维生素B2含量的测定
取充分解冻、混匀后的血浆样品0.2 mL,加入等体积的15 mmol/L 10%乙酸镁,充分混匀静置5 min,65 ℃水浴15 min,加0.1 mL 10%三氯乙酸,4 286×g离心10 min后取上清液,避光放置于4 ℃冰箱,供高效液相色谱(HPLC)分析[11]。取室温解冻、充分混匀后的尿原液,用针头式过滤器过滤,滤液稀释5倍后进行HPLC分析[12]。色谱条件[11]:XB-C18(4.6 mm×100 mm,5 μm)色谱柱;流动相为10 mmol/L pH 3.4的磷酸钾缓冲液∶乙腈=85∶15(V/V);柱温25 ℃;流速1 mL/min;一元等梯度洗脱。检测波长:λex=445 nm,λem=530 nm。进样量10 μL。
1.4.4 E-GRAC的测定
参照李丽花[13]的方法进行。
1.5 数据处理
试验结果均以平均值±标准差(mean±SD)表示。试验数据采用SPSS 18.0软件的单因素方差分析(one-way ANOVA)进行方差分析,各组间的多重比较采用Duncan氏法进行。
2 结果与分析
2.1 维生素B1不同摄入量对12月龄伊犁马血浆维生素B1含量、E-TKA、TPP效应及尿液维生素B1排出量的影响
由表2可知,随着实际摄入维生素B1量的增加,12月龄伊犁马血浆维生素B1含量逐渐升高,以试验Ⅰ组血浆维生素B1含量(6.18 μg/L)最低,显著低于试验Ⅲ组(P<0.05),极显著低于试验Ⅳ组、试验Ⅴ组(P<0.01);当实际摄入维生素B1量达到或超过33.49 mg/d(试验Ⅱ组)时,血浆维生素B1含量达到较高水平(7.04~8.12 μg/L),试验Ⅱ组、试验Ⅲ组、试验Ⅳ组、试验Ⅴ组之间差异均不显著(P>0.05),即血浆维生素B1含量从试验Ⅱ组之后逐渐趋于稳定。以血浆维生素B1含量为评价指标,得到12月龄伊犁马对维生素B1的需要量为33.49 mg/(匹·d)。
随着实际摄入维生素B1量的增加,12月龄伊犁马E-TKA逐渐提高,以试验Ⅰ组E-TKA(10.20 U/mL红细胞)最低,极显著低于试验Ⅲ组、试验Ⅳ组和试验Ⅴ组(P<0.01);当实际摄入维生素B1达到或超过48.27 mg/d(试验Ⅲ组)时,E-TKA达到较高水平(17.43~21.29 U/mL红细胞),试验Ⅲ组、试验Ⅳ组、试验Ⅴ组之间差异不显著(P>0.05),即E-TKA从试验Ⅲ组之后逐渐趋于稳定。以E-TKA为评价指标,得到12月龄伊犁马对维生素B1的需要量为48.27 mg/(匹·d)。
随着实际摄入维生素B1量的增加,12月龄伊犁马TPP效应逐渐降低,以试验Ⅰ组TPP效应(53.83%)最高,显著高于试验Ⅲ组(P<0.05),极显著高于试验Ⅳ组、试验Ⅴ组(P<0.01);当实际摄入维生素B1量达到或超过48.27 mg/d(试验Ⅲ组)时,TPP效应达到较低水平(6.62%~30.05%)。以TPP效应为评价指标,得到12月龄伊犁马对维生素B1的需要量为48.27 mg/(匹·d)。
随着实际摄入维生素B1量的增加,12月龄伊犁马尿液维生素B1排出量逐渐增加,以试验Ⅰ组尿液维生素B1排出量(2.03 mg/d)最少,极显著低于试验Ⅲ组、试验Ⅳ组、试验Ⅴ组(P<0.01);当实际摄入维生素B1量达到或超过48.27 mg/d(试验Ⅲ组)时,尿液维生素B1排出量达到较高水平(6.41~7.34 mg/d)。以尿液维生素B1排出量为评价指标,得到12 月龄伊犁马对维生素B1的需要量为48.27 mg/(匹·d)。
表2 维生素B1不同摄入量对12月龄伊犁马血浆维生素B1含量、E-TKA、TPP效应以及尿液维生素B1排出量的影响
Table 2 Effects of different intakes of VB1on plasma VB1content, E-TKA, TPP-effect and urinary VB1content of 12-month-oldYilihorses

项目Items试验Ⅰ组TrialgroupⅠ试验Ⅱ组TrialgroupⅡ试验Ⅲ组TrialgroupⅢ试验Ⅳ组TrialgroupⅣ试验Ⅴ组TrialgroupⅤ维生素B1添加量VB1supplementation/[mg/(匹·d)]016324864干物质采食量DMI/(kg/d)9.22±0.879.04±0.899.10±0.789.10±0.378.99±0.42实际摄入维生素B1量PracticalintakeofVB1/[mg/(匹·d)]19.00±1.0833.49±1.1048.27±0.9762.96±0.4677.53±0.52血浆维生素B1含量PlasmaVB1content/(μg/L)6.18±0.26Bb7.04±0.68ABab7.59±0.83ABa8.39±1.08Aa8.12±1.51Aa红细胞转酮酶活性E-TKA/(U/mL红细胞)10.20±2.76Cb12.13±3.83CBb17.43±5.66ABa20.81±2.33Aa21.29±3.2AaTPP效应TPP-effect/%53.83±13.63Aa41.87±18.06Aab30.05±16.53ABbc12.25±11.9Bcd6.62±6.11Bd尿液维生素B1排出量UrinaryVB1output/(mg/d)2.03±0.30Bc3.07±0.49Bc6.41±1.21Ab6.53±2.00Ab7.34±1.77Aa
同行数据肩标不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),相同或无字母表示差异不显著(P>0.05)。下表同。
Values in the same row with different small letter superscripts mean significant difference (P<0.05), and with different capital letter superscripts mean extremely significant difference (P<0.01), while with the same or no letter superscripts mean no significant difference (P>0.05). The same as below.
2.2 维生素B2不同摄入量对12月龄伊犁马血浆维生素B2含量、E-GRAC及尿液维生素B2排出量的影响
由表3可知,随着实际摄入维生素B2量的增加,12月龄伊犁马血浆维生素B2含量出现波动变化,以试验Ⅰ组血浆维生素B2含量(11.79 μg/L)最低,显著低于试验Ⅲ组、试验Ⅳ组(P<0.05),极显著低于试验Ⅱ组、试验Ⅴ组(P<0.01);当实际摄入维生素B2量达到或超过31.68 mg/d(试验Ⅱ组)时,血浆维生素B2含量达到较高水平(14.12~15.19 μg/L),试验Ⅱ组、试验Ⅲ组、试验Ⅳ组和试验Ⅴ组之间差异均不显著(P>0.05),即血浆维生素B2含量从试验Ⅱ组之后逐渐趋于稳定。以血浆维生素B2含量为评价指标,得到12月龄伊犁马对维生素B2的需要量为31.68 mg/(匹·d)。
随着实际摄入维生素B2量的增加,12月龄伊犁马E-GRAC逐渐降低,以试验Ⅰ组E-GRAC(1.03)最高,极显著高于试验Ⅱ组、试验Ⅲ组、试验Ⅳ组、试验Ⅴ组(P<0.01);当实际摄入维生素B2量达到或超过31.68 mg/d(试验Ⅱ组)时,E-GRAC达到较低水平(0.68~0.72),试验Ⅱ组、试验Ⅲ组、试验Ⅳ组、试验Ⅴ组之间差异均不显著(P>0.05),即E-GRAC从试验Ⅱ组之后逐渐趋于稳定。以E-GRAC为评价指标,得到12月龄伊犁马对维生素B2的需要量为31.68 mg/(匹·d)。
随着实际摄入维生素B2量的增加,12月龄伊犁马尿液维生素B2排出量逐渐增加,以试验Ⅰ组尿液维生素B2排出量(3.6 mg/d)最少,极显著低于试验Ⅲ组、试验Ⅳ组、试验Ⅴ组(P<0.01);当实际摄入维生素B2量达到或超过31.68 mg/d(试验Ⅱ组)平时,尿液维生素B2排出量达到较高水平(5.23~7.10 mg/d),试验Ⅲ组、试验Ⅳ组、试验Ⅴ组之间差异均不显著(P>0.05),即尿液维生素B2排出量从试验Ⅱ组之后逐渐趋于稳定。以尿液维生素B2排出量为评价指标,得到12月龄伊犁马对维生素B2的需要量为31.68 mg/(匹·d)。
表3 维生素B2不同摄入量对12月龄伊犁马血浆维生素B2含量、E-GRAC及尿液维生素B2排出量的影响
Table 3 Effects of different intakes of VB2on plasma VB2content, E-GRAC and urinary VB2output of 12-month-oldYilihorses

项目Items试验Ⅰ组TrialgroupⅠ试验Ⅱ组TrialgroupⅡ试验Ⅲ组TrialgroupⅢ试验Ⅳ组TrialgroupⅣ试验Ⅴ组TrialgroupⅤ维生素B2添加量VB2supplementation/[mg/(匹·d)]010203040干物质采食量DMI/(kg/d)9.22±0.879.04±0.899.10±0.789.10±0.378.99±0.42实际摄入维生素B2量PracticalintakeofVB2/[mg/(匹·d)]21.95±1.3731.68±1.3941.77±1.2351.53±0.4861.26±0.12血浆维生素B2含量PlasmaVB2content/(μg/L)11.79±1.53Bb15.19±0.99Aa14.12±1.27ABa14.29±2.24ABa15.01±2.77Aa红细胞谷胱甘肽还原酶活性系数E-GRAC1.03±0.30Aa0.72±0.22Bb0.72±0.05Bb0.69±0.10Bb0.68±0.04Bb尿液维生素B2排出量UrinaryVB2output/(mg/d)3.60±0.39Bb5.23±0.71Bb6.39±1.42Aa6.72±0.64Aa7.10±1.79Aa
3 讨 论
3.1 维生素B1不同摄入量对血浆维生素B1含量、E-TKA、TPP效应以及尿液维生素B1排出量的影响
维生素B1是一种维持正常糖代谢以及保证神经、消化系统功能正常的物质,对维持动物的生长、健康、发育、繁殖、免疫均具有十分重要的意义。马属动物维生素B1缺乏的临床表现是食欲不振、心率降低,慢性症状表现为腹泻、厌食症、心搏过缓、肌肉松弛抽搐、感觉过敏、共济失调和痉挛等[14-15]。因此,维生素B1是马属动物维持机体正常代谢不可缺少的营养物质。维生素B1在机体的营养状况评价常用指标有血浆维生素B1含量、E-TKA、TPP效应及尿液维生素B1排出量等,根据不同维生素B1摄入量对血浆维生素B1含量、E-TKA、TPP效应及尿液维生素B1排出量等指标的影响,从而确定动物机体对维生素B1的适宜需要量。Tallaksen等[16]以血浆维生素B1含量为评价指标,得到30位酒精肝患者对维生素B1的需要量为52.50 mg/d;Reinken等[17]通过E-TKA和TPP效应评价了1月龄至14周岁儿童的维生素B1营养状况。Ziporin等[18]研究发现,当大量摄入维生素B1时,尿液中维生素B1的含量迅速增加,当维生素B1摄入量在0.6~2.0 mg/d时,根据维生素B1摄入量对尿液维生素B1排出量的影响,得到8位健康的男青年对维生素B1的需要量为0.81 mg/d。
本试验测得5组12月龄伊犁马血浆中维生素B1的含量分别为6.18、7.04、7.59、8.39、8.12 μg/L,Hünsche等[19]研究表明马匹血浆维生素B1的含量范围为5.05~23.8 μg/L,本试验中各组试验马匹血浆维生素B1含量均在此范围内,随着实际摄入维生素B1量的增加,血浆中维生素B1的含量先增加最后逐渐趋于稳定,因此,根据不同维生素B1摄入量对血浆维生素B1含量的影响,得到12月龄伊犁马对维生素B1的需要量为48.27 mg/(匹·d)。
转酮酶(transketolase,TK)是动物红细胞中的一种酶,其辅酶成分是维生素B1的磷酸衍生物TPP,维生素B1的满足程度将影响到红细胞中转酮酶活性的高低,因此,动物E-TKA经常用于判定动物机体的维生素B1营养状况;TPP效应是通过体外试验测定加入TPP前后的E-TKA的差值得到的,加入TPP后,E-TKA增加越多说明维生素B1缺乏越严重,TPP效应是目前评价维生素B1营养状况较为常用的指标[20]。在本试验中,增加维生素B1摄入量增加了E-TKA,降低了TPP效应,因此,根据不同维生素B1摄入量对E-TKA、TPP效应的影响,得到12月龄伊犁马对维生素B1的需要量为48.27 mg/(匹·d)。
饲粮中摄入的维生素B1经小肠吸收进入血液后主要从肾脏系统中排出,当额外添加大量的维生素B1时,可通过肾小球过滤作用将机体中多余的维生素B1随尿液排出体外[21]。由本试验结果可知,以尿液维生素B1排出量为评价指标,得到12月龄伊犁马对维生素B1的需要量为48.27 mg/(匹·d)。
3.2 维生素B2不同摄入量对血浆维生素B2含量、E-GRAC及尿液维生素B2排出量的影响
根据营养学研究,机体内长期缺乏维生素B2会影响机体基础代谢,出现生长受阻现象、严重缺乏会导致被毛粗乱、脱落,皮质溢性皮肤等症状。Mc Dowell[22]研究表明,瘤胃发育不全的犊牛和羔羊会发生维生素B2缺乏症,主要表现为口腔黏膜充血、口角发炎、流涎、流泪及厌食、腹泻及生长不良等非特异性症状。因此,维生素B2对于动物机体有至关重要的作用。对动物机体维生素B2营养状况的评价指标有血浆维生素B2、FAD、FMN的含量、红细胞中维生素B2、FAD、FMN的含量,E-GRAC以及尿液维生素B2排出量等指标[23],这些指标是评价动物机体维生素B2营养状况的敏感指标,已经被广泛用于评价畜禽维生素B2需要量的研究中。Hustad等[24]研究发现,以血浆维生素B2含量为评价指标,大于60岁的维生素B2缺乏的老人,补充维生素B2的量为16 mg/d。陈金文等[25]在肉用仔鸡维生素B2需要量研究中,以E-GRAC为评价指标得到肉用仔鸡维生素B2需要量为6.4 mg/d;Bates等[26]研究表明,以E-GRAC为评价指标,非洲哺乳期女性需额外添加2.0 mg/d。郭长江等[27]以尿液维生素B2排出量为评价标准,得到重度劳动军人对维生素B2的需要量为1.8 mg/d;Lo[28]研究报道,以尿液维生素B2排出量为评价指标,得到1~19岁青年对维生素B2的需要量为1.5~2.0 mg/d。
血浆中维生素B2的含量可以直接反映机体维生素B2的营养状况[29]。本试验中,随着实际摄入维生素B2量的增加,血浆中维生素B2含量出现了波动变化;以血浆维生素B2含量为评价指标,得到12月龄伊犁马对维生素B2的需要量为31.68 mg/(匹·d)。
谷胱甘肽还原酶(glutathione reductase,GR)主要存在于红细胞中,额外加入FAD,把未活化的GR激活,可测的GR的总活性。总的GR消耗烟酰胺腺嘌呤二核苷磷酸(NADPH)比活化型GR消耗的多,在反应体系中,将额外加入FAD的吸光度值和未加入FAD的吸光度值的比值称为E-GRAC[30]。在本试验中,随着实际摄入维生素B2量的增加,E-GRAC逐渐降低,以E-GRAC为评价指标,得到12月龄伊犁马对维生素B2的需要量为31.68 mg/(匹·d)。
尿液中维生素B2的排出量是评价动物机体较常用的指标,一般常用方法有4 h尿负荷试验、24 h尿液维生素B2排出量等方法,在本试验中利用24 h尿液维生素B2排出量测定12月龄伊犁马对维生素B2的需要量。以24 h尿液维生素B2排出量为评价指标,得到12月龄伊犁马对维生素B2的需要量为31.68 mg/(匹·d)。
3.3 伊犁马对维生素B1和维生素B2需要量的探讨
在本试验条件下,以血浆维生素B1含量、E-TKA、TPP效应以及尿液维生素B1排出量和,综合评价得到12月龄伊犁马对维生素B1的需要量为48.27 mg/(匹·d);以血浆维生素B2含量、E-GRAC以及尿液维生素B2排出量为评价指标,综合评价得到12月龄伊犁马对维生素B2的需要量为31.68 mg/(匹·d)。而NRC(2007)[31]标准中以成熟体重为400 kg计算,12月龄马匹对维生素B1的需要量为19.30 mg/(匹·d),对维生素B2的需要量为12.80 mg/(匹·d);以成熟体重为500 kg计算,12月龄马匹对维生素B1的需要量为24.10 mg/(匹·d),对维生素B2的需要量为16.1 mg/(匹·d),本试验结果比NRC(2007)标准需要量偏高。这可能与本试验马匹能量、蛋白质摄入量高有关。李丽花[13]研究发现,饲粮中糖类物质含量的增加显著提高动物对维生素B1的需要量。Ferraris等[32]研究发现,高糖、高蛋白质会增加机体对维生素B2的需要量。在本试验中,12月龄伊犁马粗蛋白质(CP)摄入量为970.0 g/d,无氮浸出物(NFE)为3 670 g/d、消化能(DE)摄入量为114.68 MJ/d,而NRC(2007)标准提供的成熟体重为400 kg的12月龄马匹对CP的需要量为677 g/d、DE为62.76 MJ/d,成熟体重为500 kg的12月龄马匹对CP的需要量为846 g/d、DE为78.66 MJ/d。本试验12月龄马匹摄入的是高能量、高蛋白质饲粮,提高了机体对维生素B1、维生素B2的需要量,这可能是导致本试验所得12月龄伊犁马维生素B1、维生素B2需要量高于NRC(2007)标准的主要原因。
4 结 论
在本试验条件下,以血浆维生素B1含量、E-TKA、TPP效应及尿液维生素B1排出量为评价指标,综合评价得到12月龄马对维生素B1的需要量为48.27 mg/(匹·d);以血浆维生素B2含量、E-GRAC及尿液维生素B2排出量为评价指标,综合评价得到12月龄伊犁马对维生素B2的需要量为31.68 mg/(匹·d)。
[1] 孙远明,余群力.食品营养学[M].北京:中国农业大学出版社,2002:95-100.
[2] MANZETTI S,ZHANG J,VAN DER SPOEL D.Thiamin function,metabolism,uptake,and transport[J].Biochemistry,2014,53(5):821-835.
[3] MAKARCHIKOV A F,LAKAYE B,GULYAI I E,et al.Thiamine triphosphate and thiamine triphosphatase activities:from bacteria to mammals[J].Cellular and Molecular Life Sciences CMLS,2003,60(7):1477-1488.
[4] MORIYAMA Y.Riboflavin transporter is finally identified[J].Journal of Biochemistry,2011,150(4):341-343.
[5] EVANS E T R,EVANS W C,ROBERTS H E,et al.The treatment of a naturally occurring outbreak of bracken staggers in ponies[J].British Veterinary Journal,1951,107:399-411.
[6] CARROLL F D,GROSS H,HOWELL C E.The synthesis of B vitamins in the horse[J].Journal of Animal Science,1949,8(2):290-299.
[7] TALLAKSEN C M E,BØHMER T,BELL H.Concomitant determination of thiamin and its phosphate esters in human blood and serum by high-performance liquid chromatography[J].Journal of Chromatography B:Biomedical Sciences and Applications,1991,564(1):127-136.
[8] ROSER R L,ANDRIST A H,HARRINGTON W H,et al.Determination of urinary thiamine by high-pressure liquid chromatography utilizing the thiochrome fluorescent method[J].Journal of Chromatography B:Biomedical Sciences and Applications,1978,146(1):43-53.
[9] 陈福华.饲料检验化验员手册[M].长沙:湖南科学技术出版社,2013:202-205.
[10] TAKEUCHI T,NISHINO K,ITOKAWA Y.Improved determination of transketolase activity in erythrocytes[J].Clinical Chemistry,1984,30(5):658-661.
[11] CAPO-CHICHI C D,GUÉANT J L,FEILLET F,et al.Analysis of riboflavin and riboflavin cofactor levels in plasma by high-performance liquid chromatography[J].Journal of Chromatography B:Biomedical Sciences and Applications,2000,739(1):219-224.
[12] SHIBATA K,SUGITA C,SANO M,et al.Urinary excretion of B-group vitamins reflects the nutritional status of B-group vitamins in rats[J].Journal of Nutritional Science,2013,2:e12.
[13] 李丽花.硫胺素、核黄素和烟酰胺对肥胖大鼠能量代谢和空间学习记忆能力的影响[D].硕士学论文.青岛:青岛大学,2014.
[14] CYMBALUK N F,FRETZ P B,LOEW F M.Amprolium-induced thiamine deficiency in horses:clinical features[J].American Journal of Veterinary Research,1978,39(2):255-261.
[15] 潘晓花,王梦芝,付聪,等.饲粮精粗比和添加硫胺素对奶牛体外瘤胃发酵参数及菌群结构的影响[J].动物营养学报,2013,25(1):88-99.
[16] TALLAKSEN C M E,BØHMER T,BELL H.Blood and serum thiamin and thiamin phosphate esters concentrations in patients with alcohol dependence syndrome before and after thiamin treatment[J].Alcoholism:Clinical and Experimental Research,1992,16(2):320-325.
[17] REINKEN L,STOLLEY H,DROESE W.Biochemical assessment of thiamine nutrition in childhood[J].European Journal of Pediatrics,1979,131(4):229-235.
[18] ZIPORIN Z Z,NUNES W T,POWELL R C,et al.Thiamine requirement in the adult human as measured by urinary excretion of thiamine metabolites[J].The Journal of Nutrition,1965,85(3):297-304.
[19] HÜNSCHE K,WOLF P,LANGE G,et al.Investigations on adverse effects of feeding dried marsh horsetail (Equisetumpalustre) to ruminants and horses[J].Proceedings of the Nutrition Society Physiol,2010,19(2):132-139.
[20] LONSDALE D.Red cell transketolase studies in a private practice specializing in nutritional correction[J].Journal of the American College of Nutrition,1988,7(1):61-67.
[21] FUKUWATARI T,YOSHIDA E,TAKAHASHI K,et al.Effect of fasting on the urinary excretion of water-soluble vitamins in humans and rats[J].Journal of Nutritional Science and Vitaminology,2010,56(1):19-26.
[22] MC DOWELL L R.Riboflavin[M]//MCDOWELL L R,CUNHA T J.Vitamins in animal nutrition:comparative aspects to human[M].Florida:Academic Press,1989:183-209.
[23] EUSSEN S J P M,VOLLSET S E,HUSTAD S,et al.Plasma vitamins B2,B6,and B12,and related genetic variants as predictors of colorectal cancer risk[J].Cancer Epidemiology Biomarkers & Prevention,2010,19(10):2549-2561.
[24] HUSTAD S,MCKINLEY M C,MCNULTY H,et al.Riboflavin,flavin mononucleotide,and flavin adenine dinucleotide in human plasma and erythrocytes at baseline and after low-dose riboflavin supplementation[J].Clinical Chemistry,2002,48(9):1571-1577.
[25] 陈金文,马振凯,顾景范.肉用仔鸡核黄素需要量的研究[J].营养学报,1990,12(4):349-354.
[26] BATES C J,PRENTICE A M,PAUL A A,et al.Riboflavin status in Gambian pregnant and lactating women and its implications for Recommended Dietary Allowances[J].The American Journal of Clinical Nutrition,1981,34(5):928-935.
[27] 郭长江,韦京豫,杨继军,等.我军重度劳动部队推荐的核黄素摄入量[J].解放军预防医学杂志,2010,28(4):238-241.
[28] LO C S.Riboflavin status of adolescent southern Chinese:riboflavin saturation studies[J].Human Nutrition Clinical Nutrition,1985,39(4):297-301.
[29] MADIGAN S M,TRACEY F,MCNULTY H,et al.Riboflavin and vitamin B6 intakes and status and biochemical response to riboflavin supplementation in free-living elderly people[J].The American Journal of Clinical Nutrition,1998,68(2):389-295.
[30] PRASAD A P,LAKSHMI A V,BAMJI M S.Interpretation of erythrocyte glutathione reductase activation test values for assessing riboflavin status[J].European Journal of Clinical Nutrition,1992,46(10):753-758.
[31] NRC.Nutrient requirements of horses[S].6th ed.WashingtonDC:National Academies Press,2007:296-299.
[32] FERRARIS R P,DIAMOND J.Crypt-villus site of glucose transporter induction by dietary carbohydrate in mouse intestine[J].The American Journal of Physiology,1992,262(61):1069-1073.
*Corresponding author, professor, E-mail: yangkailun2002@aliyun.com
(责任编辑 菅景颖)
Requirements of Vitamin B1and Vitamin B2of 12-Month-OldYiliHorses
CHEN Junhong HE Xueman DENG Haifeng LI Xiaobin LIU Zhen MA Jun GAN Jianrong TANG Xuemei YANG Kailun*
(XinjiangKeyLaboratoryofMeat&MilkProductionHerbivoreNutrition,XinjiangAgriculturalUniversity,Urumqi830052,China)
In order to get the vitamin B1and vitamin B2requirements ofYilihorses, the effects of different intakes of vitamin B1and vitamin B2on blood and urinary related indices of 12-month-oldYilihorses were studied. Thirty-five healthy maleYilihorses with the age of 12 months±5 days and the average body weight of (245.28±18.36) kg were randomly divided into 5 groups (trial groups Ⅰ, Ⅱ, Ⅲ, Ⅳ and Ⅴ), and each group had 7 horses. The horses in trail groups Ⅰ, Ⅱ, Ⅲ, Ⅳ and Ⅴ were fed the same basal diet added 0, 16, 32, 48 and 64 mg/(horse·d) of vitamin B1and 0, 10, 20, 30 and 40 mg/(horse·d) of vitamin B2for 20 days, respectively. The practical intakes of vitamin B1and vitamin B2in trail groups Ⅰ, Ⅱ, Ⅲ, Ⅳ and Ⅴ were 19.00, 33.49, 48.27, 62.96, 77.53 mg/(horse·d) and 21.95, 31.68, 41.77, 51.53, 61.26 mg/(horse·d), respectively. The results showed as follows: with the practical intake of vitamin B1increasing, plasma vitamin B1content, erythrocyte transketolase activity (E-TKA) and urinary vitamin B1output increased gradually, while the thiamin pyrophosphate effect (TPP-effect) decreased gradually. The plasma vitamin B1content in trail group Ⅰ was significantly lower than that in trail group Ⅲ (P<0.05), and extremely significantly lower than that in trail groups Ⅳ and Ⅴ (P<0.01). The E-TKA in trail group Ⅰ was extremely significantly lower than that in trail groups Ⅲ, Ⅳ and Ⅴ (P<0.01). The TPP-effect in trail group Ⅰ was significantly higher than that in trail group Ⅲ (P<0.05), and extremely significantly higher than that in trail groups Ⅳ and Ⅴ (P<0.01). The urinary vitamin B1output in trail group Ⅰ was extremely significantly lower than that in trail groups Ⅲ, Ⅳ and Ⅴ (P<0.01). With the practical intake of vitamin B2increasing, the plasma vitamin B2content showed a fluctuating change, the erythrocyte glutathione reductase activity coefficient (E-GRAC) decreased gradually, and the urinary vitamin B1output increased gradually. The plasma vitamin B2content in trail group Ⅰ was significantly lower than that in trail groups Ⅲ and Ⅳ (P<0.05), and extremely significantly lower than that in trail group Ⅴ (P<0.01). The E-GRAC in trail group Ⅰ was extremely significantly higher than that in trail groups Ⅱ, Ⅲ,Ⅳ and Ⅴ (P<0.01). The urinary vitamin B2output in trail group Ⅰ was extremely significantly lower than that in trail groups Ⅲ, Ⅳ and Ⅴ (P<0.01). Base on the results of this study, the optimal requirements of vitamin B1and vitamin B2are 48.27 and 31.68 mg/(horse·d) for 12-month-oldYilihorses, respectively.[ChineseJournalofAnimalNutrition, 2017, 29(1):118-126]
Yilihorses; vitamin B1; vitamin B2; requirement
10.3969/j.issn.1006-267x.2017.01.014
2016-07-12
“十二五”农村领域国家科技计划课题(2012BAD45B02)
陈俊宏(1991—),男,甘肃张掖人,硕士研究生,研究方向为草食动物动物营养代谢。E-mail: 63793760@qq.com
*通信作者:杨开伦,教授,博士生导师,E-mail: yangkailun2002@aliyun.com
S816
A
1006-267X(2017)01-0118-09

