相对湿度和间歇性偏热处理对肉仔鸡免疫功能的影响
张少帅 李 萌,2 李 香,3 周 莹 冯京海 张敏红*
(1.中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京100193;2.东北农业大学动物科技学院,哈尔滨150030;3.河北工程大学农学院,邯郸056021)
相对湿度和间歇性偏热处理对肉仔鸡免疫功能的影响
张少帅1李 萌1,2李 香1,3周 莹1冯京海1张敏红1*
(1.中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京100193;2.东北农业大学动物科技学院,哈尔滨150030;3.河北工程大学农学院,邯郸056021)
本试验旨在研究相对湿度(RH)和间歇性偏热处理对肉仔鸡免疫功能的影响。试验采用2个偏热水平(26和31 ℃)和3个RH水平(30%、60%和85%)的2×3因子设计,选取体重相近的22日龄健康爱拔益加(AA)肉仔鸡360只转入环境控制舱,随机分成6个组(Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ和Ⅵ组),每组6个重复,每个重复10只鸡(公母各占1/2)。预试期7 d,温度21 ℃,RH 60%。正试期14 d,从29日龄开始,每天10:00—16:00(6 h)将环境控制舱内Ⅰ、Ⅱ和Ⅲ组的温度调至26 ℃,RH分别调至30%、60%和85%;Ⅳ、Ⅴ和Ⅵ组的温度调至31 ℃,RH分别调至30%、60%和85%,其余时间环境控制舱内温度与RH均与预试期相同。结果表明:1)Ⅰ和Ⅴ组肉仔鸡的法氏囊指数显著高于Ⅱ和Ⅵ组(P<0.05);RH为30%和60%时肉仔鸡的法氏囊指数显著高于RH为85%时(P<0.05)。2)试验第7天,Ⅱ组肉仔鸡的血清球蛋白含量显著高于Ⅲ、Ⅳ和Ⅵ组(P<0.05);26 ℃时肉仔鸡的血清球蛋白含量显著高于31 ℃时(P<0.05)。3)试验第1天,Ⅱ组肉仔鸡的血清溶菌酶活性显著高于Ⅲ、Ⅳ和Ⅴ组(P<0.05);RH为60%时肉仔鸡的血清溶菌酶活性显著高于RH为30%和85%时(P<0.05)。试验第7天,Ⅱ组肉仔鸡的血清溶菌酶活性显著高于Ⅰ、Ⅴ和Ⅵ组(P<0.05)。试验第1和14天,26 ℃时肉仔鸡的血清溶菌酶活性显著高于31 ℃时(P<0.05)。4)试验第1和14天,Ⅵ组肉仔鸡的血清白细胞介素-1β(IL-1β)含量显著高于Ⅰ、Ⅱ、Ⅲ和Ⅴ组(P<0.05);31 ℃时肉仔鸡血清IL-1β和白细胞介素-6(IL-6)含量均显著高于26 ℃时(P<0.05)。试验第1、7和14天,Ⅲ、Ⅳ、Ⅴ和Ⅵ组肉仔鸡的血清IL-6含量显著高于Ⅰ和Ⅱ组(P<0.05);RH为85%时肉仔鸡的血清IL-6含量均显著高于RH为30%和60%时(P<0.05)。总之,RH和间歇性偏热处理以及两者的交互作用不同程度地影响肉仔鸡的免疫功能,其中较高偏热和较高湿度(31 ℃+85% RH)的影响最大。
相对湿度;间歇性偏热;肉仔鸡;免疫功能
相对湿度(relative humidity,RH)作为重要的温热环境因子之一,通过影响家禽的散热进而改变体热平衡状态,影响着家禽的健康与生产。当环境温度过高时,家禽蒸发散热的比例逐渐升高,成为主要的散热方式;当RH过高时,机体蒸发散热能力降低,引发过高热现象——体温升高、呼吸加快、机体失水,进而出现呼吸性碱中毒[1-3]。有关RH对家禽影响的研究多集中在对家禽生理指标和生长性能的研究。研究表明,不同环境高温(29.4、30.0、32.0和35.0 ℃)时,高湿(>70% RH)和低湿(35% RH)均会不同程度地影响家禽的体温和各部位的皮肤温度[4-8]。Yahav等[9]研究发现,4~8周肉仔鸡在35 ℃高温和60%~65% RH时的生长率和采食量最高。但Prince等[10]和Winn等[11]研究认为RH对鸡的生长率和采食量无显著影响。
目前,有关湿度对家禽免疫功能影响的研究较为少见。魏凤仙[12]研究湿度和氨暴露慢性应激对肉鸡免疫功能的影响发现,在25~26 ℃时,较高的氨气水平(30和70 mg/kg)和非适宜湿度(35% RH和80% RH)可降低肉鸡的免疫功能。家禽生产中偏热环境广泛存在,且已有研究表明偏热环境会对肉仔鸡的生长性能、生理指标、行为、体热调节和肠道菌群等产生不利的影响[13-16]。然而家禽生产中一天内偏热温度(26~32 ℃)并不会持续出现,一般情况下中午前后鸡舍内会间歇性达到偏热温度。
因此,本试验以肉仔鸡为试验动物,探究RH和间歇性偏热处理对肉仔鸡免疫功能的影响,以期为实际生产中环境调控以及精细化和舒适化养殖提供理论依据。
1 材料与方法
1.1 试验动物
试验选取体重相近的22日龄健康爱拔益加(AA)肉仔鸡360只,平均体重为(968±58) g,随机分为6个组(Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ和Ⅵ组),每组6个重复,每个重复10只鸡(公母各占1/2)。试验在中国农业科学院北京畜牧兽医研究所动物营养国家重点实验室昌平试验基地人工气候实验舱内进行,温度和湿度自动控制(精度:±1 ℃、±7%),光照时间为24 h。试验动物采用平养模式,所用笼具为本实验室研发的单层平养笼具[17],每8只试验鸡饲养面积为0.64 m2。所用饲粮参照NRC(1994)营养需要配制,基础饲粮组成及营养水平见表1。试验期间,肉仔鸡自由采食饮水。
1.2 试验设计
试验采用2个偏热水平(26和31 ℃)和3个RH水平(30%、60%和85%)的2×3因子设计。Ⅰ组为26 ℃+30% RH,Ⅱ组为26 ℃+60% RH,Ⅲ组为26 ℃+85% RH,Ⅳ组为31 ℃+30% RH,Ⅴ组为31 ℃+60% RH,Ⅵ组为31 ℃+85% RH。预试期7 d,温度21 ℃,RH 60%。正试期14 d,从29日龄开始将各组肉仔鸡分别转入6个环境控制舱,每天10:00—16:00(6 h)将环境控制舱内Ⅰ、Ⅱ和Ⅲ组的温度调至26 ℃,RH分别调至30%、60%和85%;Ⅳ、Ⅴ和Ⅵ组的温度调至31 ℃,RH分别调至30%、60%和85%,其余时间环境控制舱内温度与RH均与预试期相同。采用德图迷你型温湿度记录仪(型号:Testo 174 H;测量范围:-20~+70 ℃,0~100% RH;测量精度:±0.5 ℃,±3% RH;分辨率:0.1 ℃,0.1% RH)对试验期间温湿度进行实时监测。

表1 基础饲粮组成及营养水平(饲喂基础)
1)预混料为每千克饲粮提供 Premix provided the following per kg of the diet:VA 10 000 IU,VD33 400 IU,VE 16 IU,VK32.0 mg,VB12.0 mg,VB26.4 mg,VB62.0 mg,VB120.012 mg,泛酸钙 pantothenic acid calcium 10 mg,烟酸 nicotinic acid 26 mg,叶酸 folic acid 1 mg,生物素 biotin 0.1 mg,胆碱 choline 500 mg,Zn (ZnSO4·7H2O) 40 mg,Fe (FeSO4·7H2O) 80 mg,Cu (CuSO4·5H2O) 8 mg,Mn (MnSO4·H2O) 80 mg,I (KI) 0.35 mg,Se (Na2SeO3) 0.15 mg。
2)营养水平均为计算值。Nutrient levels were all calculated values.
1.3 测定指标与方法
1.3.1 免疫器官指数
于试验第14天末,每组随机选取6只肉仔鸡(每个重复选1只,公母各3只)进行称重,颈部放血处死后,取出脾脏、胸腺和法氏囊,滤纸吸去血液,手术剪剪去表面脂肪和系膜,电子天平称其重量。免疫器官指数计算公式如下:
免疫器官指数(g/kg)=免疫器官
重量(g)/体重(kg)。
1.3.2 血清蛋白和细胞因子含量以及溶菌酶活性
分别于试验第1、7和14天末,每组随机选取6只肉仔鸡(每个重复选1只,公母各3只),翅下静脉采血,3 000 r/min离心10 min分离血清,于-80 ℃冷冻保存,用于测定血清总蛋白、白蛋白、球蛋白、白细胞介素1β(intereleukin-1β,IL-1β)和白细胞介素6(intereleukin-6,IL-6)含量以及溶菌酶活性。血清总蛋白含量采用考马斯亮蓝法测定,白蛋白含量采用溴甲酚绿比色法测定,两者差值为球蛋白含量;血清溶菌酶活性采用光学法测定;细胞因子含量采用酶联免疫吸附法(ELISA)测定。以上指标测定所用试剂盒均购自南京建成生物工程研究所。
1.4 数据分析与统计
采用SAS 9.2统计软件中一般线性模型(GLM)对试验结果进行双因素方差分析,采用Duncan氏法进行多重比较检验,试验结果以平均值表示,P<0.05为差异显著。
2 结 果
2.1 RH和间歇性偏热处理对肉仔鸡免疫器官指数的影响
由表2可知,温度和RH对肉仔鸡法氏囊指数的影响有显著的交互作用(P<0.05),Ⅰ和Ⅴ组肉仔鸡的法氏囊指数显著高于Ⅱ和Ⅵ组(P<0.05)。RH对肉仔鸡的法氏囊指数有显著影响(P<0.05),RH为30%和60%时肉仔鸡的法氏囊指数显著高于RH为85%时(P<0.05)。温度对肉仔鸡的免疫器官指数均无显著影响(P>0.05),但26 ℃时肉仔鸡的免疫器官指数均高于31 ℃时(P>0.05)。

表2 RH和间歇性偏热处理对肉仔鸡免疫器官指数的影响
同行数据肩标不同小写字母表示差异显著(P<0.05),相同或无字母表示差异不显著(P>0.05)。下表同。
In the same column, values with different small letter superscripts mean significant difference (P<0.05), while with the same or no letter superscripts mean no significant difference (P>0.05). The same as below.
2.2 RH和间歇性偏热处理对肉仔鸡血清蛋白含量的影响
由表3可知,温度和RH对肉仔鸡血清蛋白含量的影响无显著交互作用(P>0.05),但试验第7天时Ⅱ组肉仔鸡血清球蛋白含量显著高于Ⅲ、Ⅳ和Ⅵ组(P<0.05)。RH对肉仔鸡的血清蛋白含量无显著影响(P>0.05)。温度对试验第7天肉仔鸡的血清球蛋白含量有显著影响(P<0.05),26 ℃时肉仔鸡的血清球蛋白含量显著高于31 ℃时(P<0.05)。
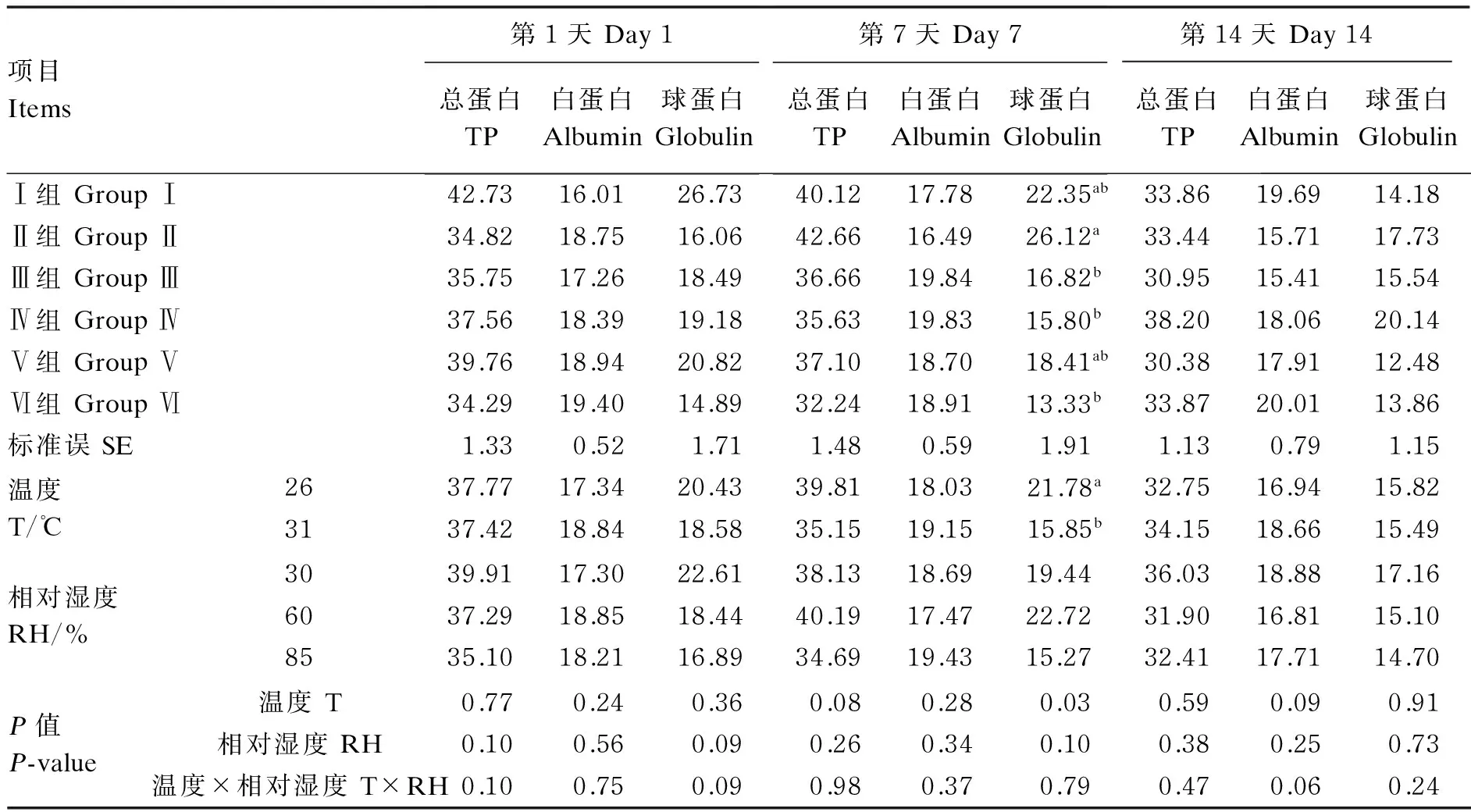
表3 RH和间歇式偏热处理对肉仔鸡血清总蛋白、白蛋白和球蛋白含量的影响
2.3 RH和间歇性偏热处理对肉仔鸡血清溶菌酶活性的影响
由表4可知,温度和RH对试验第1天和第7天肉仔鸡血清溶菌酶活性的影响有显著的交互作用(P<0.05);试验第1天,Ⅱ组肉仔鸡的血清溶菌酶活性显著高于Ⅲ、Ⅳ和Ⅴ组(P<0.05);试验第7天,Ⅱ组肉仔鸡的血清溶菌酶活性显著高于Ⅰ、Ⅴ和Ⅵ组(P<0.05)。温度对试验第1和14天肉仔鸡的血清溶菌酶活性有显著影响(P<0.05),26 ℃时肉仔鸡血清溶菌酶活性显著高于31 ℃时(P<0.05)。RH对试验第1天肉仔鸡的血清溶菌酶活性有显著影响(P<0.05),RH为60%时肉仔鸡的血清溶菌酶活性显著高于RH为30%和85%时(P<0.05)。
2.4 RH和间歇性偏热处理对肉仔鸡血清细胞因子含量的影响
由表5可知,温度和RH对试验第1天肉仔鸡血清IL-1β和IL-6含量、试验第7天IL-6含量和试验第14天IL-1β含量的影响有显著的交互作用(P<0.05);试验第1和14天,Ⅵ组肉仔鸡的血清IL-1β含量显著高于Ⅰ、Ⅱ、Ⅲ和Ⅴ组(P<0.05);试验第1、7和14天,Ⅲ、Ⅳ、Ⅴ和Ⅵ组肉仔鸡的血清IL-6含量显著高于Ⅰ和Ⅱ组(P<0.05)。RH对试验第1、7和14天肉仔鸡的血清IL-6含量均有显著影响(P<0.05),RH为85%时肉仔鸡的血清IL-6含量均显著高于RH为30%和60%时(P<0.05)。温度对试验1和14天肉仔鸡血清IL-1β和IL-6含量均有显著影响(P<0.05),31 ℃时肉仔鸡的血清IL-1β和IL-6含量均显著高于26 ℃时(P<0.05)。

表4 RH和间歇式偏热处理对肉仔鸡血清溶菌酶活性的影响

表5 RH和间歇式偏热处理对肉仔鸡血清IL-1β、IL-6含量的影响
3 讨 论
3.1 RH和间歇性偏热处理对肉仔鸡免疫器官指数的影响
免疫器官是机体体液免疫和细胞免疫效应细胞的来源,免疫器官重量和指数的高低可在一定程度上反映机体免疫水平的强弱,是评价机体免疫状态的常用指标[18]。有关湿度对免疫器官指数影响的报道并不多见。魏凤仙[12]在研究湿度和氨暴露慢性应激时发现,在氨气浓度为30和70 mg/kg时,低湿(30% RH)或高湿(85% RH)对试验第1和2周肉仔鸡的免疫器官指数无显著影响,但高湿显著降低试验第3周肉仔鸡的胸腺指数和法氏囊指数,即随着试验时间的延长,湿度对免疫器官的影响增加。本试验结果发现,试验第14天,温度和RH对肉仔鸡法氏囊指数的影响有显著的交互作用,Ⅰ和Ⅴ组肉仔鸡的法氏囊指数显著高于Ⅱ和Ⅵ组;RH对肉仔鸡的法氏囊指数有显著影响,RH为30%和60%时肉仔鸡的法氏囊指数显著高于RH为85%时。表明较高偏热温度与较高湿度对肉仔鸡法氏囊的发育具有不利作用。而温度和湿度对胸腺指数和脾脏指数无显著影响,表明肉仔鸡法氏囊这一中枢免疫器官对湿度的反应要比脾脏更加敏感。
3.2 RH和间歇性偏热处理对肉仔鸡血清蛋白含量和溶菌酶活性的影响
血清中的总蛋白和球蛋白含量是反映机体非特异性体液免疫及功能的重要指标。本试验结果表明,温度和RH的交互作用以及RH对肉仔鸡的血清蛋白含量均无显著影响;温度对试验第7天肉仔鸡的血清球蛋白含量有显著影响,26 ℃时肉仔鸡血清球蛋白含量显著高于31 ℃时。魏凤仙[12]研究发现,湿度对肉仔鸡的血清总蛋白、白蛋白和球蛋白含量无显著影响。本试验结果与持续性偏热处理[19]结果并不一致,这可能是由于温度的高低和热处理方式(间歇性偏热)等条件的不同。
溶菌酶主要作用于细菌的细胞壁,使其裂解并激发机体的免疫反应。溶菌酶是存在于机体体液和组织中常见的免疫因子之一,在机体防御及维持生理平衡方面发挥着重要的作用。血清中溶菌酶活性的高低可作为判定机体免疫功能的指标之一。本试验研究发现,温度和RH对试验第1和7天肉仔鸡血清溶菌酶活性的影响有显著的交互作用;温度对试验第1和14天肉仔鸡的血清溶菌酶活性有显著影响,26 ℃时肉仔鸡的血清溶菌酶活性显著高于31 ℃时;RH对试验第1天肉仔鸡的血清溶菌酶活性有显著影响,RH为60%时肉仔鸡的血清溶菌酶活性显著高于RH为30%和85%时。随着试验时间的延长,各组对溶菌酶活性的影响逐渐降低,表明机体可能产生了一定的适应性,对湿度和温度的敏感性降低。
3.3 RH和间歇性偏热处理对肉仔鸡血清细胞因子含量的影响
细胞因子作为细胞间的信号传递分子,主要介导和调节免疫应答及炎症反应,刺激造血功能,并参与组织修复等生命活动[18]。白细胞介素-1(IL-1)和IL-6是炎症起始阶段的重要致炎因子,在感染早期应答中发挥着重要作用[20]。其中,IL-1有3种活化形式,IL-1β是血浆和组织液中主要的分泌形式。本试验研究发现,温度和RH对试验第1天肉仔鸡血清IL-1β和IL-6含量、试验第7天IL-6含量和试验第14天IL-1β含量的影响有显著的交互作用;RH对试验第1、7和14天肉仔鸡的血清IL-6含量均有显著影响,RH为85%时血清IL-6含量均显著高于RH为30%和60%时;温度对试验1和14天肉仔鸡血清IL-1β和IL-6含量均有显著影响,31 ℃时血清IL-1β和IL-6含量均显著高于26 ℃时。这与持续性偏热处理中试验第14天IL-1β含量升高这一结果不一致[19],与魏凤仙[12]随湿度应激时间的延长IL-1β和IL-6含量表现为持续分泌增多的研究结果也并不一致。王诵涛[21]分别研究急性和持续热应激对肉仔鸡肝脏IL-6含量时发现,急性35 ℃热应激处理0.5 h后肝脏IL-6含量显著升高,1.5~2 h达到最高点,随后迅速降低,9~12 h逐渐恢复正常;持续35 ℃热应激处理显著升高试验第1至3天肝脏IL-6含量,达到最高水平后开始下降,到试验第5天恢复正常水平。可以看出,在应激状态下IL-6含量的变化随时间呈现“钟字形”趋势。
4 结 论
间歇性偏热处理和RH以及两者的交互作用不同程度地影响肉仔鸡的免疫功能,其中较高偏热和较高湿度(31 ℃+85% RH)的影响最大。
[1] MASKREY M.Metabolic and acid-base implications of thermal panting[M]//HALES J R S.Thermal physiology.New York:Raven,1984:347-352.
[2] MATHER F B,BARNAS G M,BURGER R E.The influence of alkalosis on panting[J].Comparative Biochemistry and Physiology Part A:Physiology,1980,67(2):265-268.
[3] MARDER J,ARAD Z.Panting and acid-base regulation in heat stressed birds[J].Comparative Biochemistry and Physiology Part A:Physiology,1989,94(3):395-400.
[4] 陶秀萍. 不同温湿风条件对肉鸡应激敏感生理生化指标影响的研究[D].博士学位论文.北京:中国农业科学院,2003.
[5] 顾宪红,杜荣,方路.高温条件下湿度对肉仔鸡直肠温度和血浆三碘甲腺原氨酸、胰岛素水平的影响[J].中国农业科学,1999,32(1):105-107.
[6] LIN H,ZHANG H F,DU R,et al.Thermoregulation responses of broiler chickens to humidity at different ambient temperatures.Ⅱ.Four weeks of age[J].Poultry Science,2005,84(8):1173-1178.
[7] 林海.肉鸡实感温度的系统模型分析及热应激下的营养生理反应[D].博士学位论文.北京:中国农业科学院,1996.
[8] KAMAR G A R,KHALIFA M A S.The effect of environmental conditions on body temperature of fowls[J].British Poultry Science,1964,5(3):235-244.
[9] YAHAV S,GOLDFELD S,PLAVNIK I,et al.Physiological responses of chickens and turkeys to relative humidity during exposure to high ambient temperature[J].Journal of Thermal Biology,1995,20(3):245-253.
[10] PRINCE R P,WHITAKER J H,MATTERSON L D,et al.Response of chickens to temperature and relative humidity environments[J].Poultry Science,1965,44(1):73-77.
[11] WINN P N,GODFREY E F.The effect of humidity on growth and feed conversion of broiler chickens[J].International Journal of Biometeorology,1967,11(1):39-50.
[12] 魏凤仙.湿度和氨暴露诱导的慢性应激对肉仔鸡生长性能、肉品质、生理机能的影响及其调控机制[D].博士学位论文.杨凌:西北农林科技大学,2012.
[13] 彭骞骞,王雪敏,张敏红,等.持续偏热环境对肉鸡盲肠菌群多样性的影响[J].中国农业科学,2016,49(1):186-194.
[14] 甄龙,石玉祥,张敏红,等.持续偏热环境对肉鸡生长性能、糖脂代谢及解偶联蛋白mRNA表达的影响[J].动物营养学报,2015,27(7):2060-2069.
[15] 胡春红,张敏红,冯京海,等.偏热刺激对肉鸡休息行为、生理及生产性能的影响[J].动物营养学报,2015,27(7):2070-2076.
[16] 周莹,彭骞骞,张敏红,等.相对湿度对间歇性偏热环境下肉鸡体温、酸碱平衡及生产性能的影响[J].动物营养学报,2015,27(12):3726-3735.
[17] 张敏红,苏红光,冯京海,等.采集用于建立肉鸡生活环境舒适性评价模型数据的方法和专用装置:中国,CN103404447A[P].2013-11-27.
[18] 刘建欣,郑昌学.现代免疫学:免疫的细胞和分子基础[M].北京:清华大学出版社,2002.
[19] 张少帅,甄龙,冯京海,等.持续偏热处理对肉仔鸡免疫器官指数、小肠形态结构和黏膜免疫指标的影响[J].动物营养学报,2015,27(12):3887-3894.
[20] 杨汉春.动物免疫学[M].2版.北京:中国农业大学出版社,2003.
[21] 王诵涛.热应激对肉仔鸡肝脏金属硫蛋白和白介素-6变化规律的影响[D].硕士学位论文.北京:中国农业科学院,2010.
*Corresponding author, professor, E-mail: zmh66@126.com
(责任编辑 李慧英)
Effects of Relative Humidity and Intermittent Partial Heat Temperatures on Immune Functions of Broilers
ZHANG Shaoshuai1LI Meng1,2LI Xiang1,3ZHOU Ying1FENG Jinghai1ZHANG Minhong1*
(1.StateKeyLaboratoryofAnimalNutrition,InstituteofAnimalSciences,ChineseAcademyofAgriculturalSciences,Beijing100193,China; 2.CollegeofAnimalScienceandTechnology,NortheastAgriculturalUniversity,Harbin150030,China; 3.CollegeofAgriculture,HebeiUniversityofEngineering,Handan056021,China)
This experiment was conducted to investigate the effects of relative humidity (RH) and intermittent partial heat temperatures on immune functions of broilers. According to 2 × 3 factorial design of two partial heat temperatures (26 and 31 ℃) and three RH levels (30%, 60% and 85%), three hundred and sixty 22-day-old healthy Arbor Acres (AA) broilers with similar body weight were allotted into environment chambers, and randomly divided into 6 groups (groups Ⅰ, Ⅱ, Ⅲ, Ⅳ, Ⅴ and Ⅵ), each group (chamber) contained six cages with ten birds per cage (male and female in half), and each cage as a replicate. The pre-test period lasted for 7 days and broilers were kept at 21 ℃ and 60% RH. The trial lasted for 14 days. When broilers were 29-day-old, the temperatures of groups Ⅰ, Ⅱ and Ⅲ were kept at 26 ℃, regulating the RH to 30%, 60% and 85%, respectively; the temperatures of groups Ⅳ, Ⅴ and Ⅵ were kept at 31 ℃, while regulating the RH to 30%, 60% and 85%, respectively. And the temperature and RH of groups were kept six hours each day, at 10:00 to 16:00, after the period, broilers were kept at 21 ℃ and 60% RH. The results showed as follows: 1) the index of bursa of broilers in groups Ⅰ and Ⅴ was significantly higher than that in groups Ⅱ and Ⅵ (P<0.05), and the index of bursa at 30% RH and 60% RH was significantly higher than that at 85% RH (P<0.05). 2) On day 7, the content of globulin in serum of broilers in group Ⅱ was significantly higher than that in groups Ⅲ, Ⅳ and Ⅵ (P<0.05), and the content of globulin in serum at 26 ℃ was significantly higher than that at 31 ℃ (P<0.05). 3) On day 1, the activity of lysozyme in serum of broilers in group Ⅱ was significantly higher than that in groups Ⅲ, Ⅳ and Ⅴ (P<0.05), and the activity of lysozyme in serum at 60% RH was significantly higher than that at 30% RH and 85% RH (P<0.05). On day 7, the activity of lysozyme in serum in group Ⅱ was significantly higher than that in groups Ⅰ, Ⅴ and Ⅵ (P<0.05). On days 1 and 14, the activity of lysozyme in serum at 26 ℃ was significantly higher than that at 31 ℃ (P<0.05). 4) On days 1 and 14, the content of interleukin-1β (IL-1β) in serum of broilers in group Ⅵ was significantly higher than that in groups Ⅰ, Ⅱ, Ⅲ and Ⅴ (P<0.05), and the contents of IL-1β and interleukin-6 (IL-6) in serum at 31 ℃ were significantly higher than those at 26 ℃ (P<0.05). On days 1, 7 and 14, the content of IL-6 in serum in groups Ⅲ, Ⅳ, Ⅴ and Ⅵ was significantly higher than that in groups Ⅰ and Ⅱ (P<0.05), and the content of IL-6 in serum at 85% RH was significantly higher than that at 30% RH and 60% RH (P<0.05). In conclusion, RH, intermittent partial heat temperatures and their interaction affect the immune function of broilers to varying extent, and the higher temperature and humidity (31 ℃+85% RH) have the most impact.[ChineseJournalofAnimalNutrition, 2017, 29(1):80-87]
relative humidity; intermittent partial heat temperatures; broilers; immune function
10.3969/j.issn.1006-267x.2017.01.010
2016-07-07
国家重点研发计划课题“肉禽舒适环境的适宜参数及限值研究”(2016YFD0500509);国家“十二五”科技支撑课题“畜禽健康养殖环境控制关键技术与集成”(2012BAD39B02);中国农业科学院科技创新工程(ASTIP-IAS07)
张少帅(1991—),男,河北沙河人,硕士研究生,研究方向为家禽营养与环境。E-mail: zss9587@126.com
*通信作者:张敏红,研究员,博士生导师,E-mail: zmh66@126.com
S831
A
1006-267X(2017)01-0080-08

