无颈动脉狭窄患者Wi l l is环形态特征与急性缺血性脑中风的相关性研究
1.徐州医科大学附属第三医院影像科 (江苏 徐州 221000)
2.徐州医科大学附属医院影像科(江苏 徐州 221000)
刘彩云1 李绍东2 苗新中1孟 冲1
无颈动脉狭窄患者Wi l l is环形态特征与急性缺血性脑中风的相关性研究
1.徐州医科大学附属第三医院影像科 (江苏 徐州 221000)
2.徐州医科大学附属医院影像科(江苏 徐州 221000)
刘彩云1李绍东2苗新中1孟 冲1
目的探讨无颈动脉重度狭窄或闭塞患者Wi l l is环形态学特征与急性缺血性脑中风的相关性。方法回顾性分析75 例AIS患者COW形态特征,根据有无CA狭窄分为CA重度狭窄或闭塞AIS 35例(Ⅰ组)和无CA重度狭窄或闭塞AIS 40例(Ⅱ组),并纳入35例无脑梗死患者(Ⅲ组)进行对照,采用χ2检验和Bonfer roni校正χ2检验对COW形态分型、血管发育情况、供血动脉病变进行分析,采用Pearson相关分析评估以上诸因素与AIS的关系,采用多变量logist ic回归分析影响AIS的危险因素。结果三组间COW形态分型及前交通动脉、大脑前动脉第一段、大脑后动脉第一段发育不良、颅内供血动脉病变数、供血动脉狭窄程度的差异均有统计学意义(χ2分别为15.84,79.24,16.19,64.19,P值均<0.05);Ⅰ组和Ⅱ组间以上诸因素的差异均无统计学意义(χ2分别为0.68、3.89、1.81、3.89,P值均>0.05);COW形态分型、COW血管发育状态与AIS相关系数r分别为-0.25、-0.16。多因素logistic回归分析显示不完整COW及ACoA、PCOA变异OR分别为0.01、6.55、3.19,95%CI:0.00-0.22、1.69-25.44、1.41-9.60。结论即使无CA重度狭窄或闭塞,不完整COW及ACOA、PCOA变异仍为AIS的危险因素。
Wil l is环;脑梗死;血管成像;体层摄影术
COW是颅内最重要的侧支循环途径,是调节颈内动脉系统与椎动脉系统血液供给的枢纽,与脑内血液供应密切相关,但其血管构成变异较大[1],其变异率达54.8%[2]。通过观察COW形态特征,评估潜在代偿能力,对降低AIS发病率,评价AIS预后有重要意义。既往研究多集中在CA狭窄或闭塞患者COW形态与AIS的关系[3-5],本研究利用MDCTA的多种重建方法[6],多角度观察无CA重度狭窄或闭塞AIS患者的COW形态,探讨不完整COW、ACoA和PCOA变异与AIS之间可能存在的相关关系。
1 资料和方法
1.1 一般资料2010年10月~2014年12月间由临床医师申请在本院影像科行头颈部CTA检查的956例患者中,筛选出图像质量好、临床资料保存完整、MRI诊断AIS 75例患者为本研究对象,根据有无CA重度狭窄或闭塞,分为CA狭窄型AIS(Ⅰ组,n=35,男23例,女12例,平均年龄(58.52±5.05)岁)和无CA狭窄型AIS(Ⅱ组,n=40,男25例,女15例,平均年龄(57.38±6.13)岁);同时纳入无CA狭窄或闭塞且颅内无梗死灶的患者(Ⅲ组,n=35,男21例,女14例,平均年龄(56.91±4.63)岁)进行对照。三组患者可能存在的危险因素包括高血压、高胆固醇血症、糖尿病、房颤、吸烟、其他心脏病等,Ⅲ组与Ⅰ组、Ⅱ组患者具有的危险因素比较无统计学差异。所有患者在发病72h内行头颅MRI检查。三组患者间年龄及性别差异均无统计学意义。
1.2 检查设备及技术采用Emot ion16排螺旋CT(德国、西门子公司)对所有患者行CTA检查,使用双筒高压注射器经肘前静脉注射碘海醇(350mg l/ml)50ml,随后注射50ml生理盐水,速度均为3.5ml/s;采用智能触发技术进行扫描,CT阈值:80HU,扫描范围:自主动脉弓至顶结节水平,管电压110KV,管电流150MAS,层厚、层间距均为5mm,同时行薄层重组(层厚1.5mm、重建增量0.7mm),通过PACS将原始数据传入CT工作站,利用图像后处理技术对COW行VR、MPR、CPR重建。采用1.5TMR (美国,GE公司)对所有患者行MR检查,层厚5mm,层间隔1mm,行横轴面、矢状面扫描,扫描参数:T1FLAIR(TR:500,TE: 17ms,FOV:24×24,256×256/2.00 NEX),T2FSE/PROP(TR:3500,TE:9 0ms,FOV:24×24,320×256/2.00N EX),T2FLIAR(TR:8402,TE:158ms, FOV:24×24,256×192/1.00NEX), DWI(TR:10000,TE:82.2ms,FOV:24 ×24,128×128/3.00NEX)。
1.3 图像分析方法两位经验丰富的影像科医师采用双盲法分析所有图像。结合临床症状和T1FLAIR、T2WI、T2FLAIR、DWI图像特征诊断AIS。对COW发育不全结果如有争议,经商讨达成共识。重点观察:ACoA、两侧ACA-A1段、大脑中动脉第1段(M1 segment of Middle cerebral ar tery,MCA-M1)、两侧颈内动脉(internal carotidar tery,ICA)末段、两侧后交通动脉(posterior cerebral communicating ar tery, PCoA)、胚胎性大脑后动脉(Fetal type posterior, FTP)、两侧PCA-P1、颈总-颈内动脉(common carotid artery -inernal carotid artery,CCA-ICA)、VBA及颅内供血动脉。
参照房文皓等[7]判断COW动脉发育状态标准:(1)发育正常,组成COW动脉两侧较对称;⑵发育不良,两侧同名动脉不对称,管径相差超过1倍;⑶缺如,即整条血管结构通过调节窗宽、窗位也不能显示。根据组成动脉发育情况将COW分为四型:Ⅰ型(对称型),组成COW各支动脉发育相对正常;Ⅱ型(前循环发育不良型),ACoA 和/或ACA发育不良或缺如,后循环动脉发育相对正常;Ⅲ型(后循环发育不良型),PCoA和/或PCA发育不良或缺如,前循环动脉发育相对正常;Ⅳ型(混合发育不良型),同时存在前、后循环多支动脉发育不良或缺如。
判定动脉狭窄程度标准:动脉狭窄程度=(正常动脉内径-狭窄部位最小内径)/正常动脉内径×100%,轻度(0-29%)、中度(30%-69%)、重度(70%-99%)及闭塞(100%)。
1.4 统计学方法采用SPSS20.0统计学软件包。计数资料采用例数和支数(比例)表示。对三组患者COW形态分型、COW发育情况、颅内动脉病变分布情况及狭窄程度的差异行χ2检验和Bonfer roni校正χ2检验。对COW形态分型、动脉发育情况与AIS的关系采用Pearson相关分析,对不完整COW(包括Ⅱ型、Ⅲ 型、Ⅳ型) 及ACOA、PCOA变异(包括发育不良和缺如)与AIS的关系采用多变量logistic回归分析。P<0.05认为差异有统计学意义。
2 结 果
2.1 比较三组COW形态分型的差异Ⅰ组、Ⅱ组仅有4例、5例(11.43%、12.50%)为Ⅰ型COW,明显低于Ⅲ组13例(37.14%),Ⅰ组、Ⅱ组为Ⅱ型、Ⅳ型COW的比例(17.14%、34.29%,15.00%、42.50%)明显高于Ⅲ组(2.86%、17.14%),Ⅰ组、Ⅱ组为Ⅲ型COW的比例稍低于Ⅲ组,Ⅰ组、Ⅱ组以Ⅲ型、Ⅳ型COW为主(37.14%、34.29%),见图1-6;而Ⅲ组则以Ⅰ型、Ⅲ型为主(37.14%、42.86%);三组之间COW形态分型的差异有统计学意义(χ2=15.84,P=0.02),Ⅰ组和Ⅲ组、Ⅱ组和Ⅲ组两两比较差异均有统计学意义(χ2=10.48、12.44,P=0.02、0.01),但Ⅰ组和Ⅱ组间差异无统计学意义(χ2=0.68,P=0.88),见表1。
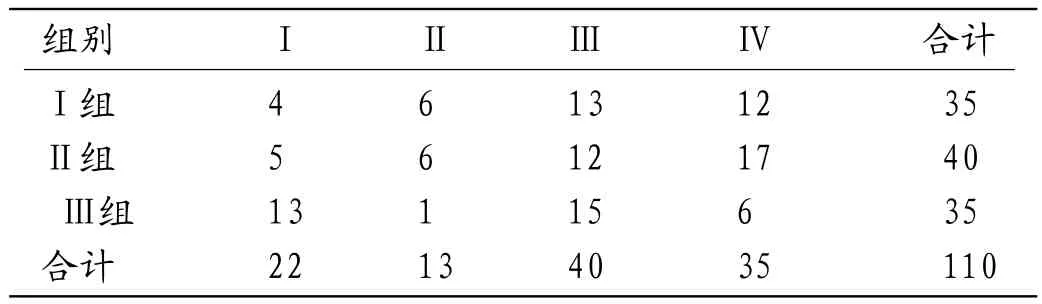
表1 三组间COW形态分类情况(例)
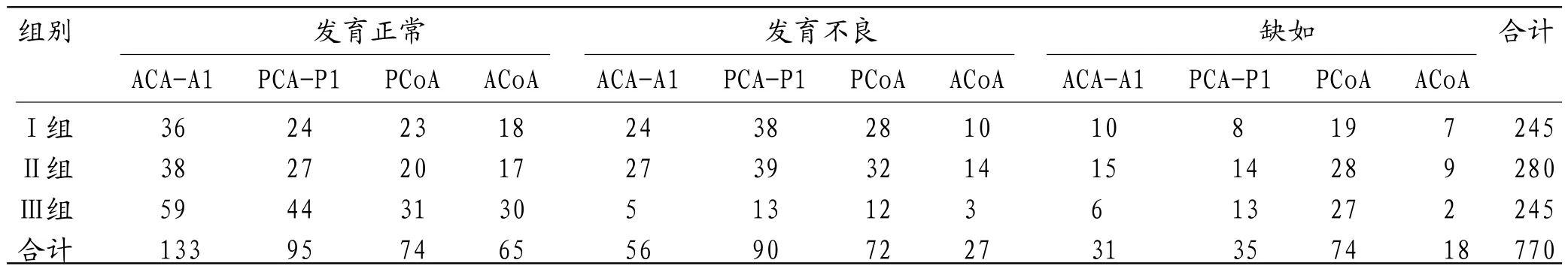
表2 三组间COW动脉发育情况(支)
2.2 三组间COW动脉发育情况Ⅰ组、Ⅱ组ACA-A1、PCAP1、ACOA发育正常比例(51.43%、34.29%、51.43%,47.50%、33.75%、42.50%)明显低于Ⅲ组(84.29%、62.86%、85.71%),而发育不良比例(34.29%、54.29%、28.57%,33.75%、48.75%、35.00%)和缺如比例(14.29%、11.43%、20.00%,18.75%、17.50%、22.50%)则较Ⅲ组明显增加(7.14%、18.57%、8.57%,8.57%、18.57%、5.71%),Ⅰ组、Ⅱ组PCOA发育正常(32.86%、25.00%)和缺如(27.14%、35.00%)比例均比Ⅲ组(44.28%、38.57%)少,发育不良比例(40.00%、40.00%)较Ⅲ组多(17.14%);三组间COW动脉均存在不同程度发育不良或缺如,三组间COW发育情况的差异有统计学意义(χ2=79.24,P=0.00),Ⅰ组和Ⅲ组、Ⅱ组和Ⅲ组两两比较均有统计学意义(χ2=55.40、66.53,P均<0.05),但Ⅰ组和Ⅱ组COW间差异无统计学意义(χ2=3.89,P =0.97)见表2。

表3 三组间颅内供血动脉病变分布情况(支)
2.3 三组间颅内供血动脉病变情况Ⅰ组、Ⅱ组颅内动脉病变明显比Ⅲ组严重,常常是多支动脉同时狭窄、一支动脉多处或弥漫性狭窄,且以中重度狭窄或闭塞为主,而Ⅲ组多为单支动脉狭窄,单支动脉多处狭窄或弥漫性狭窄较少见,且以轻中度狭窄为主,三组间颅内动脉狭窄数、狭窄程度差异均有统计学意义(χ2=16.19、64.19,P =0.04、0.00)。Ⅰ组和Ⅲ组、Ⅱ组和Ⅲ组两两比较差异均有统计学意义(χ2=14.13、12.28,55.26、48.20,P=0.01、0.02,0.00、0.00),但Ⅰ组和Ⅱ组两两比较差异均无统计学意义(χ2=1.81、3.88,P均>0.05)见表3、表4。
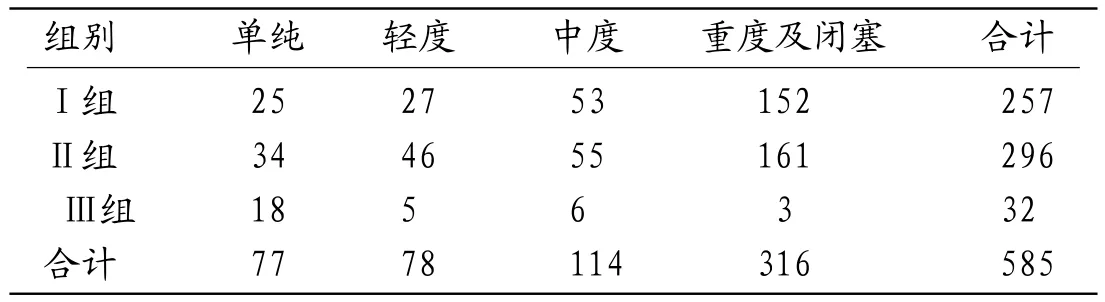
表4 三组间颅内供血动脉病变狭窄程度情况(处)
2.4 COW形态分型、发育状态与AIS的相关性COW形态分型、血管发育状态与AIS的相关系数r=-0.25、-0.16。logistic回归分析显示不完整性COW及ACOA、PCOA变异为AIS的危险因素(OR分别为0.01、6.55、3.19,95%CI:0.00~0.22、1.69~25.44、1.41~9.60),见图1-6。
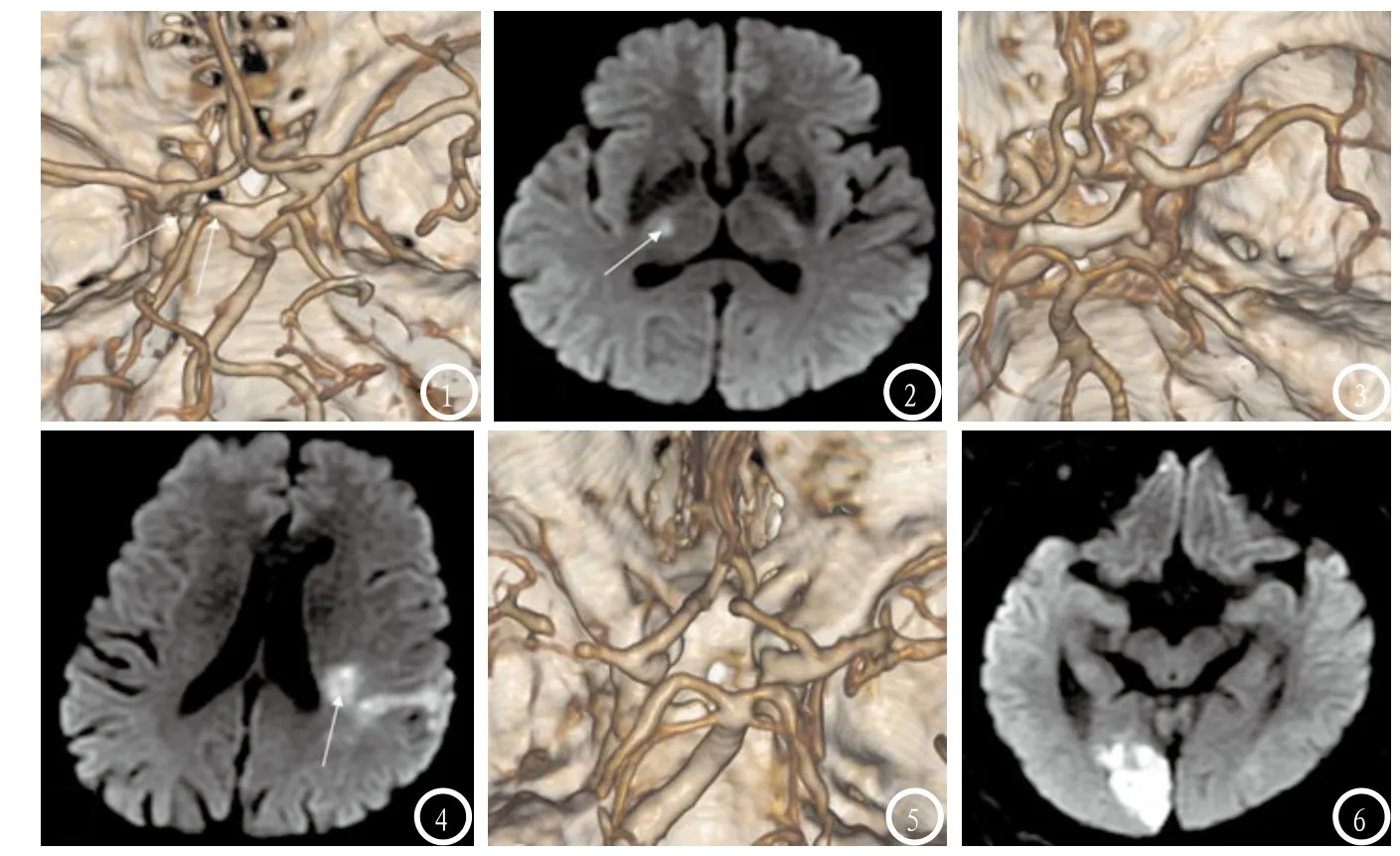
图1-2为同一患者,女性,64岁,因左侧肢体麻木,无力两天入院,图1为CTA显示Ⅲ型COW即右侧PCOA缺如致后循环不完整,右侧PCA-P1重度狭窄;图2为DWI显示:右侧丘脑AIS。图3-4为同一患者,男性,51岁,因右侧肢体无力三天入院,图3为CTA显示Ⅳ型COW即左侧ACA-A1和双侧PCOA缺如致前后循环均不完整,双侧PCA、左侧MCA多处弥漫性中重度狭窄;图4为DWI显示左侧分水岭AIS。图5-6为同一患者,男性,66岁,因左眼视力模糊一天入院,图5为Ⅳ型COW即ACOA、双侧PCOA均缺如致前后循环均不完整,右侧MCA、双侧PCA多处局限性重度狭窄;图6为DWI显示右侧枕叶AIS。
3 讨 论
CA重度狭窄或闭塞是导致AIS的重要危险因素之一[3],引起患侧大脑半球血流灌注压明显减低等血流动力学损伤表现,但能否造成该部位低灌注性脑梗死,很大程度上取决于侧支循环代偿能力。COW是颅内最重要侧支循环途径,通过ACOA、PCOA使对侧前循环、同侧后循环血流相交通,使脑内血流重新分布,增加狭窄远端脑组织血液供应,保持脑血流灌注压相对稳定,降低AIS风险,保护脑功能不受损伤,但COW良好代偿能力依赖于其完整性,即前循环及狭窄或闭塞同侧后循环完整[4],但COW形态除Ⅰ型外,其余三型均为不完整动脉环,本研究结果显示不完整COW发生率为80.0%,高于文献报道正常人群发生率54.8%的结果[2],考虑原因为样本选择和研究方法差异所致,本组大部分为AIS,而文献报道为正常人群。但有文献报道[5]不完整COW本身不引起症状,只有CA闭塞时才会出现各种临床症状,本组显示一些不完整COW即使无CA重度狭窄或闭塞,也表现为短暂性脑缺血症状,甚至表现为AIS症状,推测原因为此类患者虽无CA病变,但可能存在颅内重要动脉病变。
本结果示Ⅰ组、Ⅱ组患者Ⅰ型COW比例明显低于Ⅲ组,但Ⅰ组和Ⅱ组间差异不明显,说明无论有无CA重度狭窄或闭塞病变,不完整COW都可能成为AIS危险因素。
在对照分析本组研究对象的CTA和MRI图像时发现:(1)具有完整COW代偿功能患者,在CA或颅内重要血管发生病变时,临床症状轻,甚至无任何临床症状;(2)前循环完整比后循环完整的患者,尤其ACOA开放,发生AIS机率更小,出现灌注压异常情况更少,即使发生AIS,临床预后宜较好;说明完整COW可在短时间内提供良好侧支代偿血流,ACOA提供侧支血流发挥更重要作用[8],有效降低AIS发病率,改善预后。(3) PCA-P1,PCOA发育不良或缺如患者即后循环不完整,易发生丘脑或丘脑、枕叶或小动脉闭塞性AIS;这与文献报道PCOA发育不良与分水岭AIS有关的结果相仿[5];前后循环均不完整患者,伴大动脉闭塞更易发生责任血管区AIS,这与黄瑞庭研究结果相类似[9]。但本研究发现COW是否完整、血管发育情况与AIS的相关性仅为低度负相关,分析原因可能为完整COW能降低AIS发生率,但发生AIS这一病理过程可能同时存在多种危险因素,所以仅根据COW是否完整、ACOA及PCOA变异判断发生AIS的可能性有一定局限性,见图1。COW先天发育异常并脑供血动脉广泛狭窄是引起严重AIS的主要因素。本组结果显示不完整COW及ACOA、PCOA变异是AIS发生的危险因素,两组间比较无统计学差异,两组分别与对照组比较均有统计学差异,大部分AIS患者同时存在两支以上颅内动脉狭窄,以中重度为主,且存在责任动脉狭窄;对照组存在颅内动脉狭窄,以轻中度为主,且无明确责任动脉狭窄。推测原因为COW发育异常者,如前循环发育不良或缺如,若出现单侧大脑前、中动脉急性闭塞时,使脑血流不能在短时间内通过COW前循环代偿至闭塞血管侧,而来源于眼动脉、软脑膜动脉的次级侧支循环形成需要一定时间,短时间内责任动脉区血流再灌注减少,使脑细胞产生损伤级联反应,(此过程至少涉及4个不同机制:能量障碍和兴奋性氨基酸毒性、梗死周围去极化、炎症及程序性细胞死亡),最终导致闭塞动脉支配区AIS。
有学者认为PCOA发育不良可预测丘脑小血管闭塞性梗死,由于侧支循环代偿不足引起丘脑穿支动脉低血流量梗死[10],但也有学者认为单纯小血管急性闭塞引起丘脑腔隙性梗死[11]。本结果显示三组患者均存在不同程度PCOA发育不良或缺如,但Ⅰ组和Ⅱ组PCOA发育不良血管数明显多于Ⅲ组,Ⅰ组和Ⅱ组之间差异不明显,说明无论有无CA病变,PCOA发育不良均可能成为丘脑腔隙性梗死的危险因素。
综上所述通过CTA观察AIS患者COW形态特征,发现不完整COW 及ACOA、PCOA变异均可能成为AIS的危险因素。无论有无CA重度狭窄或闭塞,若颅内主要动脉闭塞、具有完整COW或前循环、同侧后循环完整对维持脑血流供应发挥重要代偿作用,能很好地保护闭塞动脉区脑组织,其中ACoA和同侧PCoA是最重要侧支血管,在一定程度上防止AIS发生。
[1] Li Q, Li J, Lv F, et al. A mul t idetec tor CT angiography study o f var iat ions in the circle of Wi l l is in a Chinese population[J]. J Cl in Neurosci, 2011,18(3):379-383.
[2] Kapoor K, Singh B, Dewan L I.Va r i a t i o n s i n t h e conf igurat ion of the ci rc le o f Wi l l i s[J]. Ana t Sc i Int,2008,83(2):96-106.
[3]唐健,常军,侯海燕,等.256层CT全脑灌注成像联合CTA评估单侧CA狭窄的脑血管储备能力的价值[J].实用放射学杂志,2012,28(10):1517-1521.
[4]Cheng XQ, Tian JM, Zuo CJ, et a l. Quant i tat ive per f usion c ompu t ed t omog r aphy meas u r eme n t s o f c e r e b r a l hemodynami c s co r r e l a t i on wi t h d i g i t a l sub t r ac t i on ang i og r a ph y i d en t i f i e d p r ima r y a n d s e c o n d a r y c e r eb r a l c o l l a t e r a l s i n internal cerebral col laterals occ l usive disease[J].Eur J Radiol,2012,81(6):1224-1230.
[5]Hoksbergen AW, Legemate DA, Cs i ba L,, e t a l. Ab sen t co l l ateral func t ion of the Ci r c l-e o f Wi l l i s as r isk factor for ischemic st roke[J]. Cerebrovasc Dis,2003,16(3):191-198.
[6]毛俊,王艳萍,彭秀斌,等.16层螺旋CT血管成像在颅内血管性病变的临床应用[J].中国CT和MRI杂志,2007,5(1):10-12.
[7]房文皓,吕发金,张丽娟,等.Wi l l is环解剖变异的64层容积CT数字减影血管造影研究[J].第三军医大学学报,2009,31(14):1384-1387.
[8]Chuang YM, Liu CY, Pan PJ, et al. Poster ior communicat ing ar tery hypop lasia as a r isk factor for AIS in the absence of CA occ lusion [J]. J Cl in Neu rosc i,2008,15(12):1376-1381.
[9]黄瑞庭,张德佳,黄海松.大面积脑梗塞的多层螺旋CT诊断价值[J].中国CT和MRI杂志,2013,11(2):10-12.
[10]Belden JR, Caplan LR, Pessin MS, et a l. Mechani sms and c l inical features of posterior border-zone infarcts [J]. Neu ro l ogy,1999,53(6):1312-1318.
[11]Sei tz RJ, Meisel S, Wel ler P, et a l. Ini t ia l ischemic even t: pe r f us ion-weigh t ed MR im-ag ing and ap pa r en t d i f f u s i o n c o e f f i c i e n t f o r s t r oke evo l u t ion[J]. Radio logy,2005,237(3):1020-1028.
(本文编辑: 汪兵)
The Correlation between Modality of the Circle of Willis and Acute Cerebral Stroke in the Absence of Carotid Artery Occlusion
LIU Cai-yun, LI Shao-dong, M IAO Xin-zhong, et al., Department of Radiology, The Third Affiliated Hospital of Xuzhou M edical University, Xuzhou 221000, Jiangsu Province, China
ObjectiveTo investigate the correlation between modality of the circle of W illis (COW)and acute cerebral stroke (AIS) in patients Without carotid artery(CA) stenosis or occlusion.MethodsThe modality of COW in 75 patients With AIS were retrospective analyzed and divided into 35 patients With AIS had severe CA stenosis (group I)and 45 Without (group II) according to CA stenosis, and 35 patients Without cerebral infarction patients (Group III) were compared. Variables including the state type of COW, vascular development, feeding artery disease were analyzed by χ2test and Bonferroni correction χ2test. The relationship between AIS and vascular development were analyzed by pearson correlation analysis. Logistic regression was used to estimate potential risk factors for AIS.ResultsThe differences of Three groups in COW state type and anterior communicating artery(ACoA), A1 segment of the anterior cerebral artery(ACA-AI), P1 segment of the posterior cerebral artery (PCA-PI) dysplasia ,and the number of intracranial artery stenosis were statistically significant (χ2=15.84, 79.24, 16.19, 64.19, P<0.05).There was no significant difference between group I and II in the factors (χ2=0.68, 3.89, 1.81, 3.89, P>0.05). OR in incomplete COW, ACoA and PCOA variation were 0.01, 6.55, 3.19;95%CI:0.00-0.22, 1.69-25.44, 1.41-9.60.ConclusionIn the absence of CA severe stenosis, the incomplete COW, the variation of ACoA and PCOA were still potential risk factors for AIS.
Circle of Willis; Ischem ia Cerebral Stroke; Angiography; Tomography
R445.3;R743
A
10.3969/j.i s sn.1672-5131.2016.11.008
苗新中
2016-09-21

