浙江渔山列岛海域大型底栖动物群落组成和结构研究
王晓波,江河,李伯康,韩庆喜
(1.国家海洋局宁波海洋环境监测中心站,浙江 宁波 315040;2.宁波大学 海洋学院,浙江 宁波 315211)
浙江渔山列岛海域大型底栖动物群落组成和结构研究
王晓波1,江河1,李伯康1,韩庆喜2
(1.国家海洋局宁波海洋环境监测中心站,浙江 宁波 315040;2.宁波大学 海洋学院,浙江 宁波 315211)
根据2010年8月至2014年8月对浙江渔山列岛附近海域6个站位的大型底栖动物调查,分析了渔山列岛附近海域大型底栖动物的群落结构特征,包括群落物种组成、优势种、丰度、生物量、群落的时空变化等,分析了大型底栖动物的群落结构,并使用AMBI和M-AMBI对大型底栖动物群落和环境质量进行了评估。结果表明:本次调查共鉴定出大型底栖动物60种,其中多毛类动物25种,软体动物13种,甲壳动物9种,棘皮动物4种,鱼类6种,其它动物3种(包括纽虫2种和扁形动物1种)。多毛类动物是该研究海域大型底栖动物群落的主要成分,占据了群落总种数的41.67%。在5个调查年份中,共出现了17种优势种,优势种年际变化很大,在5年内多次出现的优势种只有5种。在物种丰度方面,多毛类仍然是群落丰度的主要贡献者,但丰度的年际变化明显,从7.07%到40.89%不等。鱼类在生物量方面的重要性最高,主要是红狼牙鰕虎鱼Odontamblyopus rubicundus的多次出现所致。在环境因子中,悬浮物和盐度被证明是该海域对大型底栖动物群落影响最大的环境因子,这与该海域较高的悬浮物含量以及多变的盐度密切相关;在AMBI和M-AMBI进行的生态质量评价显示,该海域多数站位的生态质量状况较好,处于轻度扰动的影响之下,这些扰动来源于环境和底质状况不稳定引发的自然扰动而非人为污染。
大型底栖动物;渔山列岛;群落组成;群落结构;AMBI和M-AMBI;生态质量
渔山列岛位于浙江省宁波象山半岛东南35 km,三门湾以东50余km,是多种流系的交汇之处,地处浙江近海上升流的核心部位,又受黑潮的分支对马暖流以及东海沿岸流的影响(张泽凌等,2014),还有丰富的内陆径流,包括长江冲淡水以及钱塘江等内陆径流输入,温盐多变、营养盐丰富,加之星罗棋布的岛礁和纵横交错的水道所造就的丰富多样的栖息环境,为各种海洋生物的洄游、索饵、栖息、繁殖创造了良好的生态环境。鉴于该海域丰富的物种资源和生态价值,渔山列岛附近海域(122° 15'E,28°53'N)于2008年被列为国家级海洋生态特别保护区(王腾飞等,2013)。
大型底栖动物作为海岸带生态系统的重要组成部分以及次级生产力的主要贡献者,在底栖生态系统的物质循环和能量流动中起着重要作用(Herman et al,1999;沈国英等,2002)。大型底栖动物通常具有较长的寿命和有限的运动能力,因而其群落组成和结构能够反应自然或人为扰动对海洋环境变化的综合影响 (Borja et al,2000;Simboura et al,2002;Belan,2003;Dauvin et al,2007;Weise et al,2009)。因此,是监测海岸带环境的良好的指示生物 (Pearson et al,1978;Gesteira et al,2003),并被广泛应用于海洋环境扰动的监测以及海洋生态质量的评估(Shin et al,2004;Gaudêncio et al,2007;Han et al,2013)。
尽管渔山列岛自新中国解放后就进行了一系列的大型或专项调查,如“全国海洋综合调查”(1958-1960)、沿海主要岛屿调查(1974-1976)、宁波市海岛资源综合调查(1988-1992)、东海区海洋环境监测(1983-2005)等多次海洋调查,但仍缺乏专门的大型底栖动物研究报道,可公开查询的施慧雄等(2010)、焦海峰等(2011a,2011b,2011c,2011d)对于渔山列岛潮间带大型底栖动物的研究报道,而对于该海域的专门的海底大型底栖动物群落的研究则未见报道。有鉴于此,本研究选取渔山列岛附近海域的大型底栖动物群落为研究对象,进行了为期5 a的年度调查,通过年际变化的比较以及与环境条件的耦合,试图发现其群落演化和生态变迁规律,并利用水环境中比较流行的生物指数AMBI和M-AMBI进行了该海域的生态质量评价,为渔山列岛附近海域海洋生态环境的保护提供理论基础,为海洋特别保护区内资源的合理有序利用提供科学依据。
1 材料与方法
1.1研究区域简介
本研究的采样海域位于浙江省沿海中部的渔山列岛附近,隶属于宁波市象山县石浦镇。渔山列岛东侧的伏虎礁是我国领海基线的基点岛之一,地理位置十分重要。另外,由于远离大陆,受陆源排污和人类活动的影响较小,因此海洋环境质量相对较好、生态系统受到的人为污染扰动相对较少,渔业资源较丰富。本海域为正规半日浅海潮流区,涨落潮流速冬天较夏天为大;波浪受季风影响较大。冬季盛行偏北风,风浪以偏北向为主,夏季多偏南风,风浪以偏南向为主。渔山列岛的水温变化主要取决于太阳的辐射,其次是水系的影响,冬季受江浙沿岸流的影响,夏季则受台湾暖流水边缘的影响。冬季表层水温在9℃左右;夏季表层水温约28℃;而该海域的年度平均盐度则为33左右。本次调查选择了渔山列岛附近的6个站位,进行了为期5 a的连续野外调查采样,调查站位地理位置如图1所示。
1.2采样方法
本次调查于2010-2014年间夏季(除2012年为7月采样外,其他年份均为8月),进行了为期5 a的连续野外大型底栖动物样品采集,包括6个站位:A(122°13′29″E、28°50′56″N)、B(122°14′55″E、28°51′42″N)、C(122°16′1″E、28°52′24″N)、D(122°15′21″E、28°53′12″N)、E(122°15′32″E、28°54′53″N)、F(122°17′12″E、28°55′33″N)。采集的生物样品为大型底栖动物,每站用取样面积为0.1 m2的抓斗式采泥器重复成功取样2次,采得泥样用0.5 mm网目的筛网冲洗,获得底栖动物样品用95%酒精固定保存。在实验室用1%的虎红溶液对筛选所得的大型底栖动物标本和残渣进行染色挑选,最后进行鉴定、计数及称重。分类计数后的标本用精度为1 mg的电子天平称重,并换算求得各物种的优势度、丰度(ind·m-2)和生物量(g·m-2)。
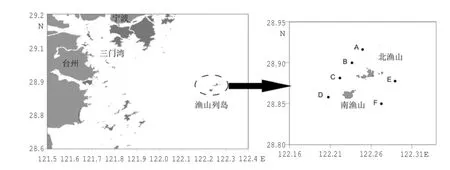
图1 2010-2014年渔山列岛附近海域大型底栖动物调查站位分布图
1.3数据处理
在采集该海域的大型底栖动物的同时,也进行了以下环境因子数据的采集和测定,包括底质有机碳和硫化物、海水透明度、水温、pH、盐度、悬浮物、溶解氧、化学耗氧量、活性磷酸盐、亚硝酸盐-氮、硝酸盐-氮、氨-氮、石油类和叶绿素a等。
底栖动物群落数据在标准化后采用单因子和多因子统计分析进行群落结构分析。大型底栖动物群落的生物特征包括丰度(A),物种数目(S),香农威纳指数(H′;log10),多样性指数(d)和均匀度指数(J’)。
优势种的计算:优势种的定义在不同资料、文献中有所区别,在应用研究中,对优势种主要通过一系列量化标准进行划分,本文采用优势度Y(徐兆礼等,1989)作为划分优势种的标准。大型底栖动物优势度计算公式为:
Y=(ni/N)×fi
式中,N为采泥样品中所有种类的总个体数目,ni为第i种的个体数;fi为该种在各站位出现的频率;当物种优势度Y>0.02时,该种即为优势种。
粒径采用Mastersizer 2000型(马尔文仪器有限公司,英国)激光粒度仪测定,粒径测量范围为0.02~2 000 μm,相对误差小于 1%。依据Gaudêncio等(1991)的粒径分析标准,按粒径大小将测得的沉积物粒径分为小于4 μm,4~16 μm和16~64 μm 3个等级,分别代表黏土、细砂、粗砂。
总有机碳的测定采用了元素分析仪,先用稀释的盐酸酸化去除无机碳,再用MilliQ水洗净酸液,最后采用元素分析仪进行有机碳的测定,仪器为MICRO CUBE元素分析仪(德国)。
数据分析主要利用各种数据处理和统计分析软件,包括Microsoft excel 2010,PRIMER(Plymouth Routines in Multivariate Ecological Research)6.0,PASW Statistics 18.0以及AMBI 5.0软件包等进行数据的处理和作分布图。运用普利茅斯海洋实验室开发的PRIMERTM 6.0软件包,进行群落组成及结构的统计分析,以研究分析物种丰度的时空变化。底栖丰度数据经过平方根转化之后,采用Bray-Curtis相似性矩阵进行转换,采用组平均排序和非度量多维测度进行等级聚类。采用AMBI 5.0软件包(下载于www.azti.es)中的AZTI’s Marine Biotic Index(AMBI)和multivariate-AMBI(m-AMBI)分析底栖生态状况(Borja et al,2005)。AMBI阀值如下:“无扰动”,0.0~1.2;“轻微扰动”,1.2~3.3;“中度扰动”,3.3~5.0;“剧烈扰动”,5.0~6.0和“极端扰动”以及“无生命”。m-AMBI的质量阀值如下:“高”>0.85;“良好”0.55~0.85;“中等”0.39~0.55;“差”0.20~0.39;和“恶劣”<0.20(Pinto et al,2009;AMBI 5.0)。利用PASW Statistics 18.0进行群落丰度和环境因子的相关性分析。
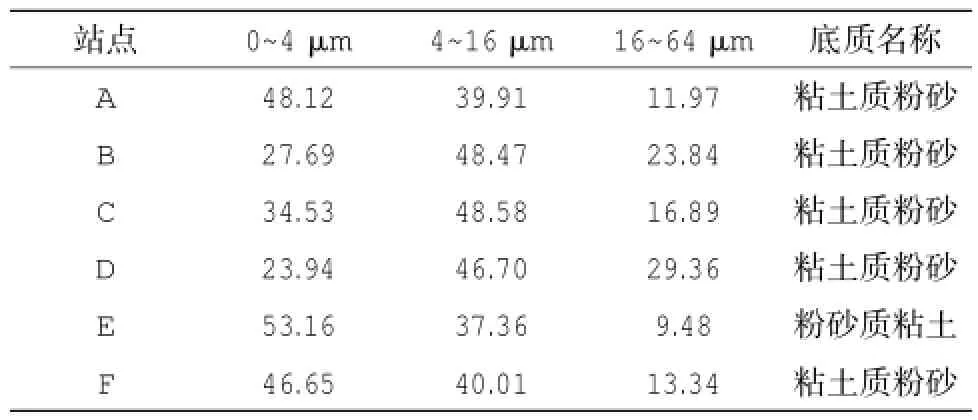
表1 渔山列岛附近海域各采样站位的底质粒径分布百分比
2 结果
2.1种类组成及优势种
对渔山列岛附近海域的表层沉积物进行了粒度测定后发现,该海域的表层沉积物以黏土和细砂为主,两者占据了总粒度的成分的70%以上;其中A、E和F站位的黏土含量较高,达到了总含量的约46.65%~53.16%;而B、C和D站位的细砂含量较高,为46.70%~48.58%,同时粗砂含量也较前面3个站位略高。在为期5年的周期性调查中,共获得浅海的大型底栖动物标本720号,分属60种,包括多毛类动物25种,甲壳动物9种,软体动物13种,棘皮动物4种,鱼类6种,其它动物3种(包括纽虫2种、扁形动物门1种)(见表2)。多毛类动物占据了研究区域大型底栖动物群落的主要组成成分,占据整个大型底栖动物群落总种数的41.67%,软体动物同样也是该区域潮间带大型底栖动物群落的重要组成部分,它占据了群落总种数的21.67%;节肢动物次之,占据了群落总种数的15.00%。从每年采样所获取的大型底栖动物种数来看,2011年该区域的大型底栖动物种数明显要高于另外4年(单样本T检验,P<0.01),这与该年度的多毛类动物远多于其它年度有关(单样本T检验,P<0.01);在总种数方面,2010年也处于较高水平,仅次于2011年,这要归功于该年度采得的较丰富的软体动物有关(单样本T检验,P<0.01)。
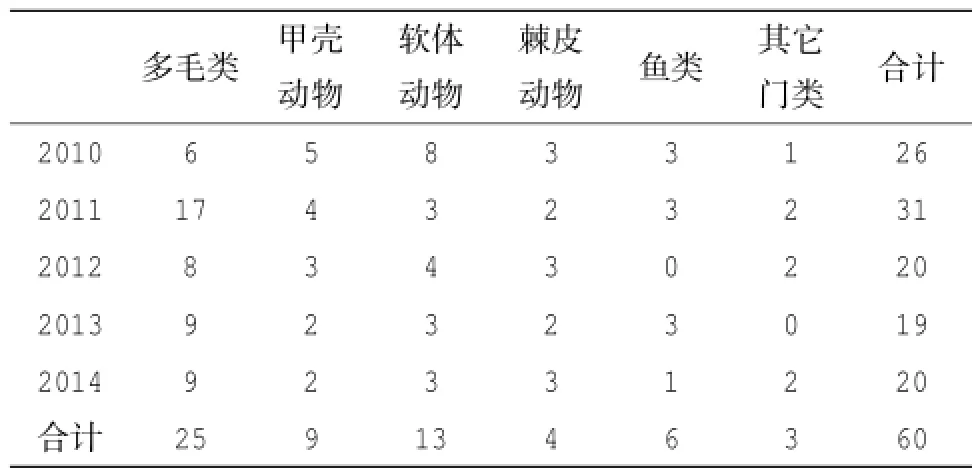
表2 2010-2014年渔山列岛附近海域大型底栖动物物种数分布
渔山列岛附近海域出现的大型底栖动物优势种共17种(见表3),包括8种多毛类,6种软体动物,2种棘皮动物和1种纽虫,但优势种的年际变化明显,多数优势种仅在某一年度出现,如:多毛类动物的扇栉虫Amphicteis gunneri、中华内卷齿蚕Aglaophamus sinensis,背蚓虫Notomastus latericeus和异足科索沙蚕Kuwaitaheteropoda,全部的软体动物的半褶织纹螺Nassarius sinarus、婆罗囊螺Retusa(Coelophysis)boenensis、薄云母蛤Yoldia similis,彩虹明樱蛤Moerella iridescens以及经氏壳蛞蝓Philine kinglipini;棘皮动物的金氏真蛇尾Ophiura kinbergi。在2010-2014年间,多次作为优势种出现且成为5年内的优势种的仅有5种,它们是双形拟单指虫 Cossura dimorpha,不倒翁虫 Sternaspis scutata,圆筒原核螺Cylichna cylindracea,棘刺锚参Protankyra bidentata和纽虫Nemertinea,其中优势度最大的为双形拟单指虫,优势度达到了0.12。
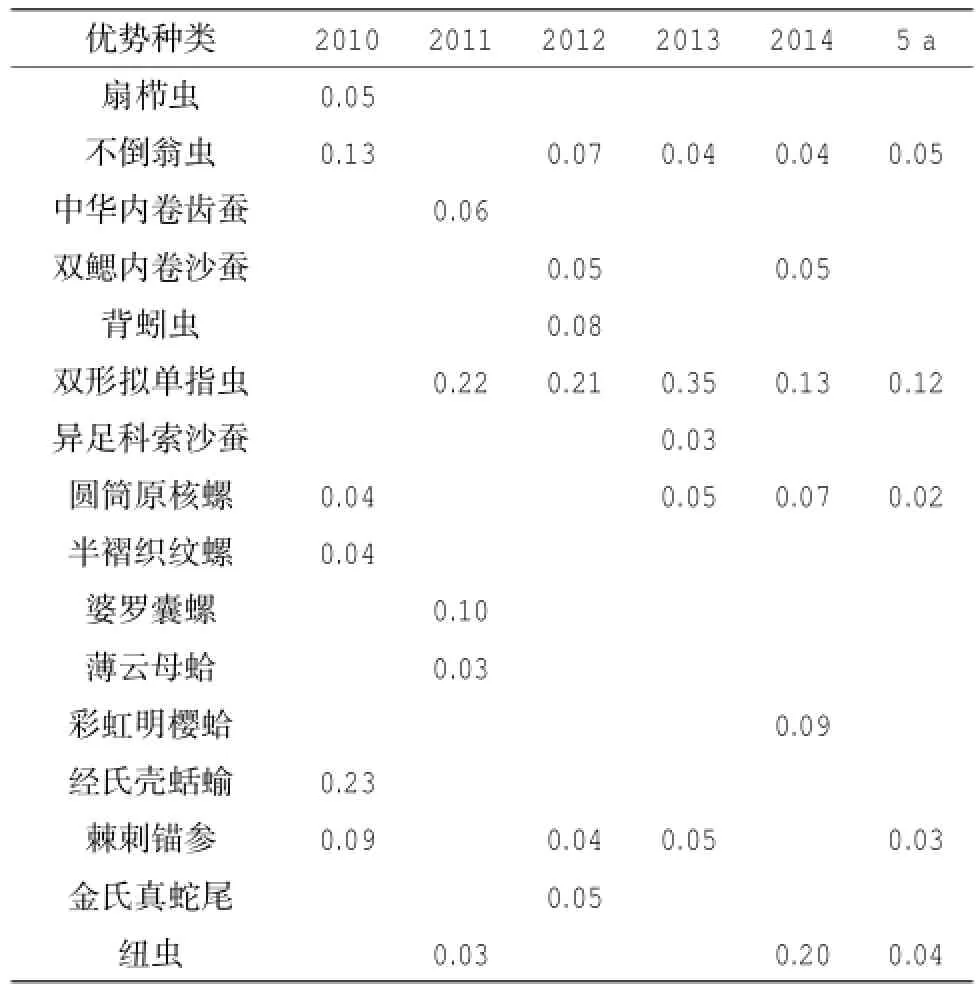
表3 2010-2014年渔山列岛附近海域大型底栖动物主要优势种及其优势度
2.2大型底栖动物的丰度与生物量
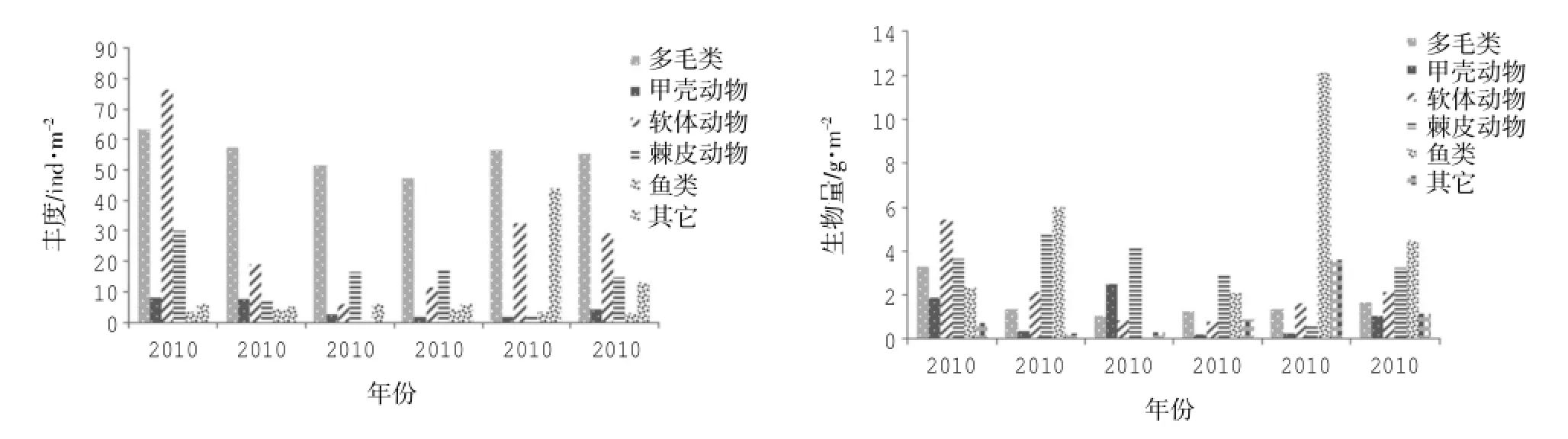
图2 2010-2014年渔山列岛海域大型底栖动物丰度(ind·m-2)和生物量(g·m-2)年际变化图
渔山列岛附近海域的大型底栖动物平均丰度值为120.00±39.41 ind·m-2,平均生物量为13.78± 4.58 g·m-2(如图2所示)。多毛类的丰度值在各年际间的变化并不显著,丰度值较为稳定,是该海域底栖动物丰度值的主要贡献者,占据了平均总丰度的46.11%;软体动物的重要性次之,占据了5 a总丰度的24.31%,但其丰度的年际变化明显,最高可达年丰度贡献量的40.89%,最低则为7.07%;鱼类和甲壳动物在整个丰度的中的比重较小,分别占比为3.61%和2.50%。不同动物类群生物量的贡献则与丰度有所不同,平均生物量以鱼类最高(占总生物量的32.73),棘皮动物(23.39%)和软体动物(15.74%)的贡献次之。这主要是由于各自类群中的高生物量个体的贡献所致,如鱼类的红狼牙鰕虎鱼Odontamblyopus rubicundus,其生物量占据了5年生物量的22.47%,棘皮动物的金氏真蛇尾 Ophiura kinbergi和棘刺锚参 Protankyra bidentata,软体动物由于贝壳的存在,生物量相对较高,多毛类和甲壳类对总生物量的贡献则相对有限,分别为12.08%和7.60%。
2.3群落结构分析
将所得到的大型底栖动物的数据进行二次方根转化之后,转化为Bray-Curtis矩阵,进行Cluster聚类,结果表明,渔山列岛海域的大型底栖动物群落的相似性不高(如图3所示),群落仅可在30%左右的相似性水平上分成7组,并且仅有2010年和2011年的群落具有较好的相似性;不同站位的群落结构相似性也不高,聚类也未能获得较好的结果。随后,通过对各采样站位和各年份的大型底栖动物群落进行了SIMPER分析,结果也与以上结果相符,群落的平均相似性只有23.16%。对各采样年份的SIMPER单因子分析显示,渔山列岛附近海域大型底栖动物不同年份的群落平均相似性维持在较低的水平,2010年平均相似性最高,也仅43.87%,最低的2014年平均相似性仅有22.92%。经氏壳蛞蝓Philine kinglipini和不倒翁虫Sternaspis scutata是2010年群落相似性的主要贡献者,贡献值达52.55%;同时,双形拟单指虫Cossura dimorpha则是除2010年之外其余年份的群落相似性的重要贡献者。各年间的群落不相似性很高,2011和2013年的群落平均不相似性为63.65%以及2013和2014年的平均不相似性为72.54%,其余3 a则在75%以上,2010年与2011年的两年群落的平均不相似性甚至高达 95.56%。在对采样站位的SIMPER分析结果显示,各站位的相似性也较低,站位D的相似性最高,也仅有26.47%,最低的则只有站位F的12.73%;双形拟单指虫仍是重要的贡献者,在除A站以外的各站位作为主要的相似性贡献种,其对相似性的贡献率为21.60%~48.92%。
2.4大型底栖动物群落与环境扰动
将群落丰度数据与环境因子数据进行标准化、转化以及矩阵之后,应用了BEST中的BIOENV(Biota and/or Environment matching)分析,控制影响因子在5个之内,结果显示透明度对群落丰度的影响最大,其相关性最大,盐度的重要性略逊。
在大型底栖动物群落物种丰度数据的基础上,采用软件包AMBI(版本:5.0)对丰度数据进行了计算处理,所有站的未分配的物种的丰度值所占的比例均在20%以下。AMBI和m-AMBI的计算结果见表4,对该海域每年的生态质量状况评价结果显示,AMBI值从2014年的1.589到2013年的2.672不等,均处于轻度扰动状态;m-AMBI结果则显示,在2010和2011年,该海域的生态质量状况为高,到了2012年到2014年,生态质量状况有所下降,显示为良好。除此之外,也针对每年的所有站位进行了相应的生态质量评估,结果显示仅2011年的E站点(AMBI=4.000)和2013年的B站点(AMBI=3.750)处于中度扰动状态,2014年的D站点(AMBI=1.150)和F站点(AMBI=0.519)处于无扰动状态,其余站位(约占总站位的86%)的大型底栖动物群落均处于轻度扰动状态。采用MAMBI对该海域生态质量状况的评估结果基本与AMBI的计算结果相符,无扰动和轻度扰动的站位多数站位的环境状况均为“良好”和“高”;中度扰动的站位,即2011年的E站点(M-AMBI= 0.405)和2013年的B站点(M-AMBI=0.326),其生态质量状况分别为中等和差。
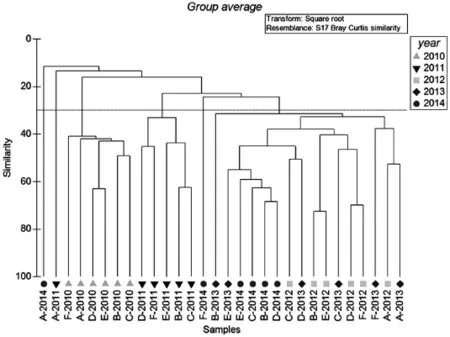
图3 2010-2014年渔山列岛大型底栖动物群落的聚类分析
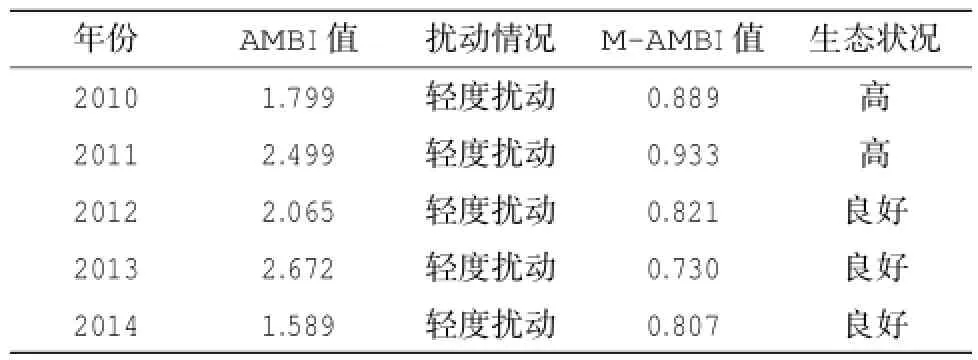
表4 采用AMBI和M-AMBI对渔山列岛海域的生态质量状况评估
3 讨论
浙江北部海域的大型底栖动物群落研究较多,但渔山列岛附近海域的大型底栖动物群落研究在潮间带有所涉及(施慧雄 等,2010;焦海峰等,2011a,b,c,d),而浅海的大型底栖动物群落研究仅有贾海波等(2012)关于拖网采集的浙江舟山海域大型底栖动物的研究报道。
与邻近的三门湾和象山港相比,渔山列岛海域的物种数量有60种,少于象山港的125种(顾晓英等,2010)和西南部三门湾的124种(廖一波等,2011)。象山港的大型底栖动物以软体动物为主,软体动物占据了总种数的38%~44%(顾晓英等,2010;董鹏等,2015),三门湾和渔山列岛的大型底栖动物均以多毛类为主要组成类群,但本研究海域的多毛类比例要高于三门湾的35.5%,达到了41.67%。本研究海域出现的部分优势种在三门湾和象山港均有出现,例如三门湾的不倒翁虫(Sternaspis scutata)和双鳃内卷齿蚕(Aglaophamu sdibranchis)(廖一波等,2011)以及象山港的不倒翁虫 (Sternaspis scutata) 和双鳃内卷齿蚕(Aglaophamus dibranchis),软体动物的半褶织纹螺(Nassarius sinarus)、薄云母蛤(Yoldia similis)以及棘皮动物的棘刺锚参(Protankyra bidentata)和金氏真蛇尾(Ophiura kinbergi)(董鹏等,2015)。
生物指数(biotic index)以Caswell(1978)的中度干扰模型和Pearson等(1978) 的有机质富集模型为理论基础,利用底栖生物的各种类群或特定类群对环境压力的不同响应,将底栖物种按污染耐受程度进行分组(Borja et al,2000),然后综合多样性指数等来计算其生物指数(Dauvin et al,2007),克服了生态指数的不可靠性和ABC曲线等的局限性(曲方圆等,2009),在世界多个海域均有良好的适应性(Borja et al,2005;Muxika et al,2005;Bigot et al,2008;Borja et al,2011)。国内学者将其应用于多个海域的生态质量评价,并展示出对于有机污染物、重金属污染、富营养化等环境压力梯度表现出较好的适应性(蔡文倩等,2012,2013;韩庆喜等,2014)。生物指数在该海域的应用结果显示,该海域受到了轻微的扰动,但同时群落结构显示出的巨大差异表明,该海域受到的扰动来源于不稳定的环境和底质状况,而非人为的有机质积累。
对该海域底栖生物优势种及丰度和生物量的分析可知,该海域底栖动物具有较强烈的年际变化和空间变化,多毛类占据了种类和丰度的绝对优势。这一群落组成特点,应该与该海域底质同质性较高而稳定性较差的底质条件紧密相联:该研究海域的底质以粒径较细的粉砂和粘土为主(表1),并且受到较强海流的影响,包括黑潮的分支对马暖流、浙江沿岸的东海沿岸流以及长江冲淡水等。本研究结果显示,透明度对群落丰度的影响最大,而悬浮物的含量则与透明度密切相关密切相关悬浮物在各个方面都对大型底栖动物群落产生了直接或间接的影响(贾海波等,2011;贾海波等,2012)。首先,在高悬浮物浓度的海域,光强成为初级生产力的主要限制因素之一(宁修仁等,2004),它间接影响了大型底栖动物多毛类等的生存(寿鹿等,2012);再次,过高的悬浮物含量也会限制多毛类(寿鹿等,2012)以及某些滤食性的双壳类动物(宋伦等,2012)。除此之外,该海域均匀而细微的颗粒组成特点也限制了大型底栖动物的多样性。首先,较细的底质粒径会降低微生境的多样性,直接影响底栖动物的空间可选择性;其次,较细的沉积物粒径也限制了一些在沉积物间隙活动的底栖生物的生存(如小型底栖生物),进而影响大型底栖动物中的肉食动物的丰度 (Muniz et al,1999),沉积物中的有机质含量有利于大型底栖动物的生存(刘晓收等,2014)。除悬浮物外,盐度也严重影响影响大型底栖动物的群落组成和结构(贾海波等,2011;贾海波等,2012),这一结论也在本研究中得到再次证实。以往的研究证实,盐度是影响底栖动物群落的主要环境因素之一(Laprise et al,1993;Ysebaert et al,2002;廖一波等,2011)它主要通过限制底栖动物的生理机能以及幼体附着(Thiyagarajan et al,2003;Anderson,2008),进而影响底栖动物群落结构的物种组成、数量特征分布(Cognetti et al,2000;Ritter et al,2005)和摄食功能群组成(Gaston et al,1998;Ysebaert et al,2003)。
Anderson M J,2008.Animal-sediment relationships revisited:characterizing species distributions along an environmental gradient using canonicalanalysis and quantileregressionsplines.Journal of Experimental Marine Biology and Ecology,366(1):16-27.
Belan T A,2003.Marine environmental quality assessment using polychaete taxocene characteristics in Vancouver Harbour.Marine Environmental Research,57(1-2):89-101.
Bigot L,Gréare A,Amouroux J M,et al,2008.Assessment of the ecological quality status of soft-bottoms in Reunion Island(tropical Southwest Indian Ocean)using AZTI marine biotic indices.Marine Pollution Bulletin,56(4):704-722.
Borja Á,Franco J,Pérez V,2000.A Marine Biotic Index to Establish the Ecological Quality of Soft-Bottom Benthos Within European Estuarine and Coastal Environments.Marine Pollution Bulletin,40(12): 1100-1114.
Borja Á,Muxika I,2005.Guidelines for the use of AMBI(AZTI's Marine Biotic Index)in the assessment of the benthic ecological quality. Marine Pollution Bulletin,50:787-789.
Borja Á,Tunberg B G,2011.Assessing benthic health in stressed subtropical estuaries,eastern Florida,USA using AMBI and M-AMBI. Ecological Indicators,11(2):295-303
Caswell H,1978.A general formula for the sensitivity of population growth rate to changes in life history parameters.Theoretical Population Biology,14:215-230.
Cognetti G,Maltagliati F,2000.Biodiversity and adaptive mechanisms in brackish water fauna.Marine Pollution Bulletin,40(1):7-14.
Dauvin J C,Ruellet T,2007.Polychaete/amphipod ratio revisited.Marine Pollution Bulletin,55(1-6):215-224.
Gaston G R,Rakocinski C F,Brown S S,et al,1998.Trophic function in estuaries:response of macrobenthos to natural and contaminant gradients.Marine and Freshwater Research,49(8):833-846.
Gaudêncio M J,Cabral H N,2007.Trophic structure of macrobenthos in the Tagus estuary and adjacent coastal shelf.Hydrobiologia,587: 241-251.
Gaudêncio M J,Guerra M T,Glémarec M,1991.Recherchesbiosédimentaires sur la zone maritime de l'estuairedu Tage,Portugal: donnéessédimentairespréliminaires.In:Elliot M&Ducrotoy J C (eds),Estuaries and Coasts:Spatial and Temporal Intercompar-isons.Olsen and Olsen,Fredensborg,Denmark,11-16.
Gesteira J L G,Dauvin J C,Fraga M S,2003.Taxonomic level for assessing oil spill effects on soft-bottom sublittoral benthic communities. Marine Pollution Bulletin,46:562-572.
Han Q X,Wang Y Q,Zhang Y,et al,2013.Effects of intensive scallop mariculture on macrobenthic assemblages in Sishili Bay,the northern Yellow Sea of China.Hydrobiologia,718(1):1-15.
Herman P M J,Middelburg J J,van de Koppel J,et al,1999.Ecology of estuarine macrobenthos.Advancesin Ecological Research,29:195-240.
Laprise R,Dodson J J,1993.Nature of environmental variability experienced by benthic and pelagic animals in the S t.Lawrence Estuary, Canada.Marine Ecology ProgressSeries,94:129-139.
Muniz P,Pires A M S,1999.Trophic structure of polychaetes in the SaÄo Sebastia Ä o Channel(southeastern Brazil).Marine Biology,134: 517-528.
Muxika I,Borja Á,Bonne W,2005.The suitability of the marine biotic index(AMBI)to new impact sources along European coasts.Ecological Indicators,5(1):19-31.
Pearson T H,Rosenberg R,1978.Macrobenthic succession in relation to organic enrichment and pollution of the marine environment.O-ceanographic Marine Biology Annual Review,16:229-311. Pinto R,Patrício J,Baeta A,et al,2009.Review and evaluation of estuarine biotic indices to assess benthic condition.Ecological Indicators,9(1):1-25.
Ritter C,Montagna P A,Applebaum S,2005.Short-term succession dynamics of macrobenthos in a salinity-stressed estuary.Journal of Experimental Marine Biology and Ecology,323(1):57-69.
Shin P K S,Huang Z G,Wu R S S,2004.An updated baseline of subtropical macrobenthic communities in Hong Kong.Marine Pollution Bulletin,49(1-2):128-135.
Simboura N,Zenetos A,2002.Benthic indicators to use in ecological quality classification of Mediterranean soft bottom marine ecosystems,including a new biotic index.Mediterranean Marine Science, 3(2):77-111.
Thiyagarajan V,Harder T,Quian P Y,2003.Combined effects of temperature and salinity on larval development and attachment of the subtidal barnacle Balanustrigonus Darwin.Journal of Experimental Marine Biology and Ecology,287(2):223-236.
Weise A M,Cromey C J,Callier M D,et al,2009.Shellfish-Depomod: Modelling the biodeposition from suspended shellfish aquaculture and assessing benthic effects.Aquaculture,288(3-4):239-253.
Ysebaert T,Herman P M J,2002.Spatial and temporal variation in benthic macrofauna and relationships with environmental variables in an estuarine,intertidal soft-sediment environment.Marine Ecology Progress Series,244:105-124.
Ysebaert T,Herman P M J,Meire P,et al,2003.Large-scale spatial patterns in estuaries:estuarine macrobenthic communities in the Scheldeestuary,N W Europe.Estuarine,CoastalandShelf Science, 57(1):335-356.
蔡文倩,刘录三,孟伟,等,2012.AMBI方法评价环渤海潮间带底栖生态质量的适用性.环境科学学报,32(4),992-1000.
蔡文倩,孟伟,刘录三,等,2013.长江口海域底栖生态环境质量评价-AMBI和M-AMBI法.环境科学,34(5):1725-1734.
董鹏,张海波,叶仙森,等,2015.象山港中部海域大型底栖动物群落组成及多样性特征.上海海洋大学学报,24(3):430-440.
顾晓英,陶磊,施慧雄,等,2010.象山港大型底栖动物生物多样性现状.应用生态学报,21(6):1551-1557.
韩庆喜,袁泽轶,陈丙见,等,2014.烟台潮间带大型底栖动物群落组成和结构研究.海洋科学,38(9):59-68.
贾海波,胡颢琰,唐静亮,等,2011.浙江南部近岸海域大型底栖生物生态.台湾海峡,30(4):577-582.
贾海波,胡颢琰,唐静亮,等,2012.2009年春季舟山海域大型底栖生物群落结构的生态特征.海洋学研究,30(1):27-33.
焦海峰,彭小明,尤仲杰,等,2011d.渔山岛岩石潮间带大型底栖动物物种多样性.生物多样性,19(5):511-518.
焦海峰,施慧雄,刘红丹,等,2011a.渔山列岛潮间带大型底栖动物的群落研究.水生态学杂志,32(3):48-52.
焦海峰,施慧雄,尤仲杰,等,2011b.浙江渔山列岛岩礁潮间带大型底栖动物次级生产力.应用生态学报,22(8):2173-2178.
焦海峰,施慧雄,尤仲杰,等,2011c.渔山岛岩礁基质潮间带大型底栖动物优势种生态位.生态学报,31(14):3928-3936.
廖一波,寿鹿,曾江宁,等,2011.三门湾大型底栖动物时空分布及其与环境因子的关系.应用生态学报,22(9):2424-2430.
刘晓收,赵瑞,华尔,路璐,等,2014.莱州湾夏季大型底栖动物群落结构特征及其与历史资料的比较.海洋通报,33(3):283-292.
宁修仁,史君贤,蔡昱明,等,2004.长江口和杭州湾海域生物生产力锋面及其生态学效应.海洋学报,6:96-106.
曲方圆,于子山,隋吉星,等,2009.丰度生物量比较法应用局限性.海洋科学,33(6):118-121.
沈国英,施并章,2002.海洋生态学.北京:科学出版社.446.
施慧雄,焦海峰,骆其君,等,2010.渔山列岛潮间带生物生态学初步研究.宁波大学学报(理工版),23(4):20-25.
寿鹿,曾江宁,廖一波,等,2012.杭州湾大型底栖动物季节分布及环境相关性分析.海洋学报,34(6):151-159.
宋伦,杨国军,王年斌,等,2012.悬浮物对海洋生物生态的影响.水产科学,31(7):444-448.
王腾飞,蒋霞敏,王稼瑞,等,2013.渔山列岛潮间带大型海藻的分布特征.海洋环境科学,32(6):836-840.
徐兆礼,陈亚瞿,1989.东黄海秋季浮游动物优势种聚集强度与鲐鲹渔场的关系.生态学杂志,8(4):13-15.
张泽凌,蒋霞敏,夏明月,等,2014.渔山列岛浮游动物的群落结构特征分析.生物学杂志,31(1):51-55.
(本文编辑:袁泽轶)
Community composition and structure of benthic macrofaunal assemblages in the adjacent area of Yushan Islands
WANG Xiao-bo1,JIANG He1,LI Bo-kang1,HAN Qing-xi2
(1.Marine Environmental Monitoring Center of Ningbo,SOA,Ningbo315040,China; 2.School of Marine Sciences,Ningbo University,Ningbo 315211,China)
This research was conducted annually in the adjacent area of the Yushan Islands,the East China Sea,and the benthic macrofauna composition and structure were analyzed.The community structure and distribution pattern of macrobenthos in the Yushan Islands were analyzed and evaluated,based on the data collected from the 6 sampling stations during August 2010 to August 2014.The community composition and structure were analyzed using CLUSTER,and ecological quality was also evaluated by benthic macrofauna indices AMBI and M-AMBI.A total of 60 benthic macrofauna species were collected and identified.Polychaeta was the most speciose group with 25 taxa(41.67%),followed by Mollusca with 13 taxa(21.67%).A total of 17 dominant species were identified,but only five species occurred repeatedly during the sampling period.Polycheate was the main contributor to the total abundance,with noteworthy annual variation from 7.07-40.89%.Fishes were the main contributors to the total biomass across all sampling years and stations,mainly because of the repeatedly occurrence of fish Odontamblyopus rubicundus.The content of suspended matter and salinity were the mostsignificant influencing factors on the composition of benthic macrofaunal communities,probably due to the high content and capricious salinity levels.The analyses of biotic indices showed that benthic macrofaunal communities had been slightly disturbed,meanwhile the ecological quality remained good or high.Combined analyses showed that this region was subject to the natural perturbation induced by instable environment and substrate instead of anthropogenic disturbance.
benthic macrofauna;Yushan Islands;community composition;community structure;AMBI and M-AMBI;ecological quality
P735
A
1001-6932(2016)06-0666-08
10.11840/j.issn.1001-6392.2016.06.009
2015-12-22;
2016-03-03
海洋公益性行业科研专项经费项目(201505006-6);国家自然科学基金(41676139);宁波市自然科学基金(2016A610082)。
王晓波(1978-),男,硕士,工程师,研究方向为海洋生态学,电子邮箱:oceaman@126.com。
韩庆喜,博士,助理研究员,电子邮箱:hanqingxi@nbu.edu.cn。

