2014—2015年深圳野生鸟类禽流感流行病学监测
曾志燎,邓清连,茹开卓
(1.深圳市野生动物救护中心,广东 深圳 440300;2.深圳市真和丽生态环境建设有限公司,广东 深圳 440300)
2014—2015年深圳野生鸟类禽流感流行病学监测
曾志燎1,邓清连2,茹开卓1
(1.深圳市野生动物救护中心,广东 深圳 440300;2.深圳市真和丽生态环境建设有限公司,广东 深圳 440300)
为调查深圳野生鸟类的禽流感感染情况,于2014年1月~2015年4月采集了678只野鸟的569份粪便,62份肛门拭子,26份咽肛拭子和21份血样。采用病原分离鉴定法、AIV-Ag(通用型)抗原速测卡胶体金法、荧光RT-PCR试验对样品拭子进行病原学检测。采用血凝抑制实验(HI)对血清样品进行H5N1(Re-4)、H5N1(Re-6)、H5N1(Re-7)、H7、H9等5种血清型AIV抗体检测。结果显示:26份咽肛拭子分离出1株H9N2亚型禽流感病毒,阳性率为3.85%;粪便和拭子样品的抗原检测全部阴性;血清样品中H5(Re-4)阳性数1份,阳性率为9.09%;H9阳性数7份,阳性率为63.64%;未检出H5(Re-6)、H5(Re-7)及H7阳性抗体。
野生鸟类;禽流感;流行病学
禽流行性感冒,简称禽流感(Avian Influenza,AI),是由禽流感病毒(Avian Influenza Virus,AIV)引起的一种急性高度接触性传染病,其宿主范围比较广,包括猪,人,马,猫科动物,海洋哺乳动物以及几乎所有的家禽和野生鸟类等[1]。21世纪初,泰国和中国等多个亚洲国家的不同种野生鸟类都曾因为感染禽流感而大批量死亡,并且经过病原的分离与鉴定[2],都为同一个亚型的高致病性禽流感(Highly pathogenic avain influenza,HPAI),而随后欧洲的部分国家和地区也相继爆发了同一亚型的高致病性禽流感[3]。目前有学者认为野生鸟类有可能是禽流感跨地域传播的病原携带者[4],因此,进一步了解野生鸟类的禽流感病毒流行情况,有利于禽流感的防控工作。
全球八条候鸟迁徙路线中有三条途径我国,而深圳正处于“东亚/澳大利亚迁徙线”上。每年的候鸟迁徙之际,深圳地区将会有成千上万只野生鸟途径或者停留补充食材。迄今为止,记录到的野生鸟类主要有鹭、鸥、雁等389种,分别占全国和全球鸟类的33.33%和3.33%。关于野生鸟类,我国依旧缺乏有效的免疫以及疫病监测措施,本研究于2014年1月-2015年4月对深圳地区3个鸟类疫病监测点(深圳湾公园、铁岗水库、海上田园)野鸟、救护基地的678只野鸟禽流感感染和带毒情况进行了检测,旨在掌握深圳地区野生鸟类感染禽流感的情况,进而对禽流感的预防和控制提供一定的理论依据。
1 材料与方法
1.1 材料
1.1.1 仪器 高速台式冷冻离心机、PCR仪、荧光PCR检测仪、微量加样器、96孔V型微量反应板、组织匀浆器。
1.1.2 实验试剂 75%乙醇;0.01 mol/L(pH 7.2)的PBS(磷酸盐缓冲生理盐水);H5、H7和H9亚型禽流感病毒荧光RT-PCR检测试剂盒购自北京世纪元亨动物防疫技术有限公司;阿氏(Alsevers)液;鸡红细胞悬液;AIV标准抗原购自中国农业科学院哈尔滨兽医研究所。
1.2 方法
1.2.1 样品采集 2014年1月至2015年4月从深圳湾公园、铁岗水库、海上田园、救护基地及缓冲区采集鸟粪569份、鸟肛拭子62份、鸟咽肛拭子26份、鸟血清21份(野鸟样品详细分类见表1)。
1.2.2 样品处理 采集的粪便样品用磷酸盐缓冲溶液(PBS)浸泡,4 000 r/min离心15 min后取上清备用。棉拭样品用含有抗菌素且pH为7.4~7.6的Hanks液浸泡,迅速送达实验室,通过反复在管壁挤压棉拭子将病毒液挤压出,将挤压后的棉拭子进行无害化处理,为了打碎黏液,应该用无菌的毛细吸管反复吹打挤压后的溶液。将黏液置于4 ℃待其自然沉淀5~10 min后离心取上清液备用。鸟血样用霍乱菌培养液等受体破坏酶(RDE)或高碘酸钠法去除待检血清中的非特异性凝集抑制因子,按照体积比为4:1加受体破坏酶和待检血清,37 ℃恒温水浴16~18 h,然后56 ℃水浴50 min(破坏残余RDE的活性),4 000 r/min离心后取上清,再加入终浓度为100 mL/L的测定用鸡红细胞悬液,摇匀,4 ℃过夜,1 000 r/min离心5 min,取上清置于-20 ℃冰箱冻存备用。
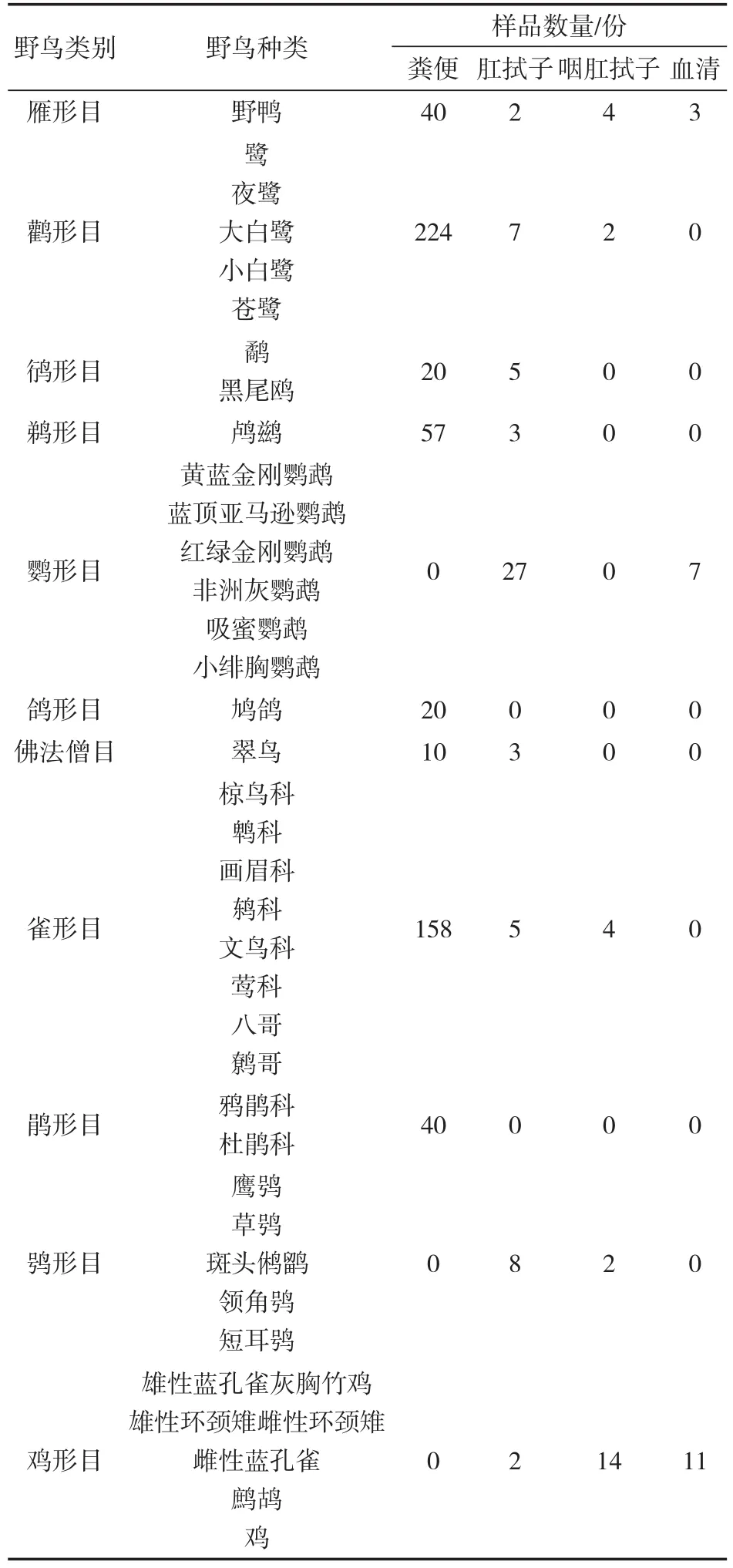
表1 野鸟样品详细分类
1.2.3 病毒的分离培养 采集的咽肛拭子先浸在灭菌生理盐水中,将咽肛拭子在管壁反复挤压后取出,充分振荡管中液体,加入适量抗生素,室温静置作用30 min,4 000 rpm离心5 min,取上清液,经尿囊腔接种9~11 d SPF鸡胚,0.2 mL/胚,37 ℃孵育,每天照蛋2次,连续观察6 d,弃去24 h污染死胚。将死亡或濒死鸡胚置4 ℃ 4 h以上,剖检,观察胚胎病变并收获尿囊液,用RNA提取试剂盒提取病毒RNA(步骤参照RNA提取试剂盒进行),所有剩余样品-70 ℃保存。
1.2.4 AIV-Ag禽流感(通用型)抗原速测卡胶体金法
将采集好的肛拭子样品插入装有试验稀释液的采样管中,不断搅拌拭子直至样品溶解到试验稀释液中;用试剂盒配的一次性滴管吸取采样管中的上清液;加4~5滴到速测卡上的样品孔中;20~30 min后读取检测结果。
1.2.5 H 5、H 7和H 9亚型禽流感病毒荧光R T-P C R和R T-P C R检测方法 将采集的5 6 9份粪便处理后样品参照G B/T 1 9 4 3 8.2-2004《H5亚型禽流感病毒RT-PCR检测方法》、GB/ T19438.3-2004《H7亚型禽流感病毒RT-PCR检测方法》和GB/T19438.4-2004《H9亚型禽流感病毒RT-PCR检测方法》进行RT-PCR和荧光RT-PCR检测。
1.2.6 血凝抑制试验 HI试验参照GB/T 18936—2003《高致病性禽流感诊断技术》进行。
2 结果
2.1 病毒的分离培养结果
通过对采集的26份咽肛拭子进行SPF鸡胚传代培养病毒分离试验分离病毒,结果分离出1株禽流感病毒,经HI及测序分析鉴定为H9N2亚型禽流感病毒。
2.2 AIV-Ag禽流感(通用型)抗原速测卡胶体金法检测结果
采集的野鸟肛拭子62份通过AIV-Ag禽流感(通用型)抗原速测卡快速检测方法检测,结果均为阴性。
2.3 H5、H7和H9亚型禽流感病毒荧光RT-PCR和RT-PCR检测结果
569份粪便处理后的样品进行荧光RT-PCR检测H5和H7亚型病毒核酸,结果均为阴性;通过RTPCR检测H9亚型病毒核酸,结果均为阴性。
2.4 野鸟血清中AIV抗体HI试验检测结果
2014年1月~2015年4月采集野鸟血清21份,经HI试验对不同亚型AIV抗体H5N1(Re-4)、H5N1(Re-6)、H5N1(Re-7)、H7、H9的检测,在受检的8种鸟类的21份血清中共检出两种不同亚型AIV阳性抗体共8份,阳性率为38.10%。其中,H5(Re-4)阳性数1份,阳性率为4.76%;H9阳性数7份,阳性率为33.33%;H5(Re-6)、H5(Re-7)、H7阳性数均为0。
3 讨论
一是禽流感的病原是A型流感病毒,其宿主范围特别广,几乎所有的家禽和野鸟都能感染,据报道,禽流感的血凝素亚型(H1-H16)和神经氨酸酶亚型(N1-N9)都可以在野生鸟类检测到[5],且大多数的HA/NA组合也都能在野生鸟类检测到。鸟类包括野生鸟类具有迁徙的习性,在迁徙的过程中,都有可能把自身携带的禽流感病毒带至迁徙途径之地,或者在迁徙逗留的地方携带上禽流感病毒,称为病毒携带者,在来年返程的过程中将禽流感病毒带回,这样循环往复的迁徙习性就导致了禽流感病毒的跨地域传播。而禽流感宿主范围广的原因导致了任何的野生鸟类都可以成为病原携带者,所以,野生鸟类在禽流感的传播方面有着不可忽视的作用。特别是深圳,深圳处于世界8大鸟类迁徙主要路线的第5条“东亚/澳大利亚迁徙线”上[6],每年都会有大量的野生鸟类途径深圳或停留深圳,给深圳地区的禽流感疫情带来了潜在的威胁。禽流感病毒的毒型较多,变异也比较迅速、频繁,低致病性的毒株可以变异为高致病性的毒株[7],每年给世界养禽业都会带来巨大的经济损失和精神折磨。
二是此调查研究对深圳地区的野鸟进行了禽流感疫情的监测,通过病毒分离法分离出了一株H9N2亚型的禽流感,说明野鸟中确实存在禽流感病毒。每年的迁徙季节,都有许多野生鸟类停留在深圳的湖泊,湿地,公园等地方,与湖泊和湿地上的水源以及公园的人群接触,极有可能成为病毒的传播者或者携带者。在对其进行病原检测时,检出率并不高,一方面或许是因为所调查的深圳地区的野生鸟类中确实还未存在禽流感病毒携带者;另一方面或许是因为这些野生鸟类虽然携带有禽流感病毒,但是其处于相对稳定的状态,还未向外界排毒,所以绝大多数野生鸟类还检测不出禽流感病毒,只有个别的野生鸟可以检测到,但是,即便如此,也不能放松警惕,要时刻做好对野生鸟类禽流感病毒的监测,建立一个更加完善的监测体系势在必行。
三是本研究对所采集的21份血样利用HI试验对不同亚型AIV抗体{H5N1(Re-4)、H5N1(Re-6)、H5N1(Re-7)、H7、H9}进行检测。其中有1份为H5N1(Re-4)亚型AIV抗体阳性,其宿主是红绿金刚鹦鹉;1份为H9亚型AIV抗体阳性,宿主为雄性环颈雉;有6份鸡血清H9亚型AIV抗体检测结果为阳性。利用RTPCR方法检测相同个体红绿金刚鹦鹉肛拭子、雄性环颈雉咽肛拭子及鸡咽肛拭子H5、H7、和H9亚型禽流感病毒,结果均为阴性。分析这些血清中检测出AIV阳性抗体的原因,经查实,这些鸟类并不是完全意义上的野生鸟类,有些是深圳海关查获的非法入境的野生动物,有些事在国外经人工光饲养出来的,随着大群的野生鸟类而迁徙,因此,有可能是这些人工饲养的鸟类接种了禽流感疫苗。而禽流感病毒血清抗体检出率高于病毒检出率的原因,有可能是因为相比较而言抗体在体内存留的时间比病毒存留时间长,所以在血清中检出禽流感抗体的几率比在咽肛拭子、粪便中检出病毒的几率大。
四是分离出禽流感病毒拭子样品,用RT-PCR方法检测结果是阴性,用鸡胚传代培养病毒分离方法检测阳性,说明在样品病毒含量较低的情况下,病毒分离传统法比RT-PCR方法更灵敏,缺点是实验周期较长。RT-PCR方法检测时间短,可批量检测样品,适合应用于禽流感样品日常监测。
五是尽管近几年来从野生鸟类中可分离到高致病力的禽流感病毒,但毕竟甚少,绝大多数野生鸟类源的流感病毒分离株为无致病力或低致病力病毒亚型,多呈无症状隐性感染,长期以来野生鸟类与禽流感病毒形成了相对稳定的寄生关系,因此野生鸟类成为禽流感病毒持续感染、持续存在的主要储存宿主。同国外一些国家相比,国内关于野鸟的禽流感的监测与检测工作起步较晚,野鸟的疫病监测体系不够完善,我国目前迫切需要建立一个完整野鸟禽流感预警预报监测体系。
[1]成进,沙依兰古丽,夏俊,等.2009年~2011年新疆雁形目野生鸟类禽流感血清流行病学调查与分析[J].中国兽医杂志,2012,(12):3-6.
[2]何维明,高玉鹏,姜艳芬,等.禽流感流行病学调查及病原分离鉴定初报[J].西北农业学报,2001,(3):16-19.
[3]孙泉云,王天厚,刘佩红,等.上海地区野鸟中禽流感的流行病学监测[J].动物医学进展,2007,(6):19-23.
[4]Chen H,Smith G J,Zhang S Y,et al.Avian flu:H5N1 virus outbreak in migratory waterfowl[J].Nature.2005,436(7048):191-192.
[5]Fouchier R A,Olsen B,Bestebroer T M,et al.Influenza A virus surveillance in wild birds in Northern Europe in 1999 and 2000[J].Avian Dis.2003,47(3 Suppl):857-860.
[6]Tollis M,Di Trani L.Recent developments in avian influenza research:epidemiology and immunoprophylaxis[J].Vet J.2002,164(3):202-215.
[7]Wang X,Basler C F,Williams B R,et al.Functional replacement of the carboxy-terminal two-thirds of the influenza A virus NS1 protein with short heterologous dimerization domains[J].J Virol.2002,76(24):12951-12962.
(编辑:李善祥)
S858.9
B
1006-799X(2016)20-0087-03
曾志燎(1985-),男,广东河源人,兽医师,主要从事野生动物救护及野生动物疫源疫病监测工作。

