原发乳腺弥漫大B细胞淋巴瘤13例临床分析
林丽,陆滢,刘旭辉,陈冬,曹俊杰,陈列光,裴仁治
原发乳腺弥漫大B细胞淋巴瘤13例临床分析
林丽,陆滢,刘旭辉,陈冬,曹俊杰,陈列光,裴仁治
目的探讨原发乳腺弥漫大B细胞淋巴瘤(PB-DLBCL)的临床特点及预后因素。方法回顾性分析13例PB-DLBCL的临床表现、病理特征及治疗方法等,并分析其预后因素。结果13例患者均以乳腺肿块为临床表现,其中女12例,男1例;发病年龄34~92岁;行手术治疗9例,全身化疗12例,放弃治疗1例,9例患者联合放疗。随访时间8~114个月。复发6例;死亡5例,死于淋巴瘤播散4例,3年生存率67.3%,5年生存率33.7%。结论PB-DLBCL多见于老年女性,预后与肿瘤分期、国际预后指数、乳酸脱氢酶及肿块大小有关,治疗方法建议采取含蒽环类的化疗联合放疗的综合治疗模式,对高危患者需行中枢神经系统预防性鞘内化疗。
乳腺肿瘤;淋巴瘤,弥漫大B细胞;化疗;预后因素
原发乳腺淋巴瘤(PBL)是一种少见的原发于结外淋巴组织的恶性肿瘤,占乳腺恶性肿瘤的0.5%,占非霍奇金淋巴瘤(NHL)的1%,占结外淋巴瘤的0.85%~2.2%[1]。原发乳腺弥漫大B细胞淋巴瘤(PB-DLBCL)是其主要的病理类型,占56%~84%,其他少见的病理类型包括黏膜相关淋巴瘤、滤泡淋巴瘤、伯基特淋巴瘤及T细胞淋巴瘤等[2-3]。本病临床发病率低,目前尚无统一的治疗策略,本文总结了13例PB-DLBCL患者的临床资料,探讨其临床特点及预后因素,为临床诊治工作提供参考。报道如下。
1 资料与方法
1.1 一般资料选择2003年1月至
2015年11月宁波市鄞州人民医院收治的PB-DLBCL患者13例,均经乳腺病理学检查,符合1972年Wiseman提出的PBL诊断标准[4];除外妊娠或哺乳者。其中女12例,男1例;年龄34~92岁,中位年龄56岁。
1.2 临床表现患者均有乳腺肿块,其中左乳2例,右乳10例,双乳1例;伴同侧腋下淋巴结受累3例,伴有B症状2例,血乳酸脱氢酶(LDH)升高3例。肿块直径1.3~8.0cm,平均3.4 cm。根据Ann Arbor分期标准[5],IE期8例,IIE期 4例,IVE期1例。国际预后指数(IPI)评分0~1分10例,≥2分3例。
1.3 病理检查来源于乳腺肿块切除9例,粗针穿刺活检3例,全乳切除1例。根据Hans等[6]提出的分型标准分为生发中心型(GCB)3例,非生发中心型(non-GCB)10例。
1.4 治疗方法行手术治疗9例,其中行根治术1例,肿块切除术8例。行全身化疗12例,放弃治疗1例。7例患者行CHOP方案化疗(环磷酰胺+多柔比星+长春新碱+地塞米松),疗程4~8周期;5例患者行利妥昔单抗联合CHOP方案(R-CHOP),疗程4~6周期。联合放疗9例,放疗剂量30~45Gy,放疗野包括患侧乳腺、同侧腋下及锁骨上淋巴结引流区。行预防性鞘内化疗4例,疗程2~4次,1例患者行自体造血干细胞移植。患者均获随访,随访时间8~114个月,中位时间49个月。
1.5 统计方法采用SPSS18.0统计软件进行分析,单因素生存分析采用Kaplan-Meier法,因素间比较采用Log-rank检验。<0.05为差异有统计学意义。
2 结果
12例患者中,复发6例,同侧乳腺复发3例,对侧乳腺复发1例,胃肠道复发1例,中枢神经系统复发1例。死亡5例,死于淋巴瘤播撒4例,死于非肿瘤相关疾病1例。3年生存率67.3%,5年生存率33.7%。手术治疗者10例,5年生存率26.9%,7例行CHOP方案化疗,5年生存率14.8%,5例行R-CHOP方案化疗,5年生存率62.5%。见图1。肿块大小、肿瘤分期、IPI评分、LDH水平与预后有关(均<0.05),B症状、年龄、病变部位、病理类型、手术方式、是否联合利妥昔单抗化疗及是否放疗与预后无关(均>0.05),见表1。
3 讨论
PB-DLBCL多见于老年女性,中位发病年龄62~64岁[7],男性极罕见,但性别并不影响疾病预后[3]。PBL右乳的发病率高于左乳,B症状发生率小于5%,在IV期患者中B症状更常见[8]。本文显示,B症状与预后无关。
文献报道约70%PBL患者为IE期,30%为IIE期,双侧乳腺受累罕见[3]。鉴于双乳受累预后极差,多数文献将其定义为Ⅳ期,本组1例双乳受累患者,预后差。本文显示IE期患者生存期较IIE期患者明显延长,提示分期对预后有影响。

图1 生存曲线
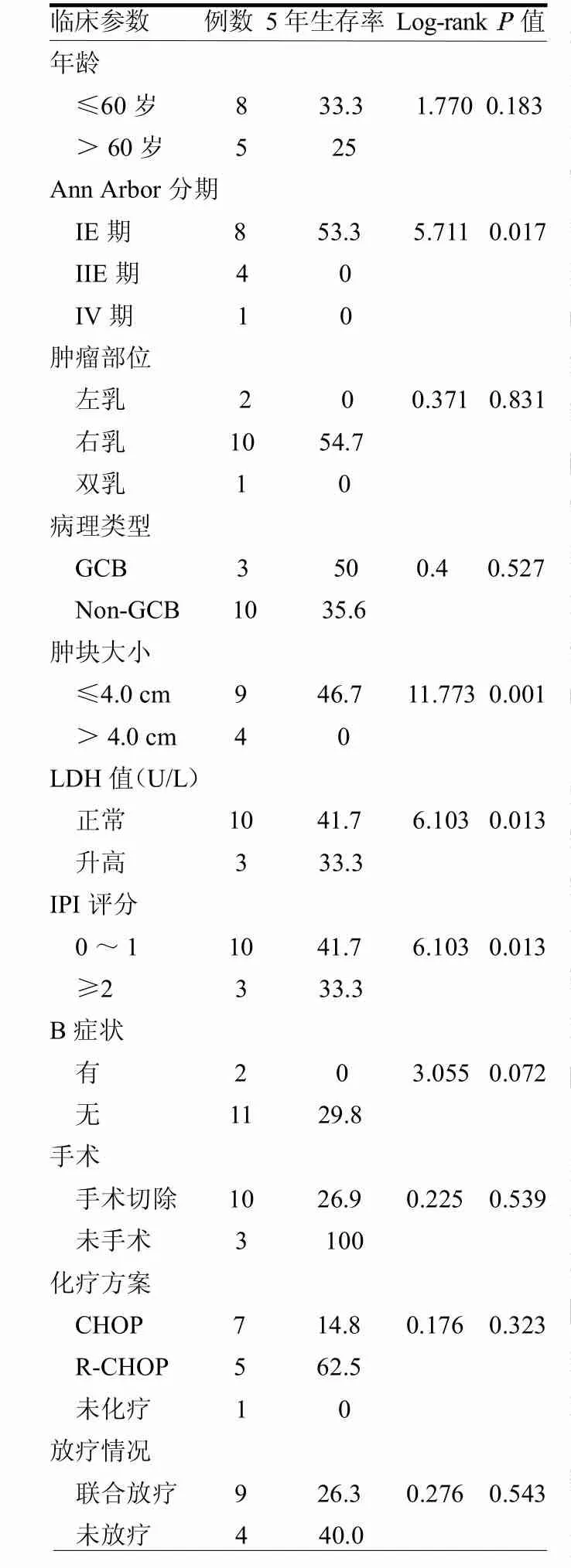
表1 原发乳腺弥漫大B细胞性淋巴瘤患者预后单因素分析
PB-DLBCL临床发病率低,目前尚无统一的治疗策略,多主张含蒽环类的化疗方案联合放疗的综合治疗模式[3,7]。虽然本病以单纯乳腺及区域淋巴结受累为主要表现,但单纯手术切除肿块无法有效控制乳腺淋巴瘤,单纯行手术治疗,患者预后差[3]。本组R-CHOP化疗生存率高于CHOP化疗。目前对R-CHOP方案是否优于CHOP方案尚无定论,但鉴于利妥昔单抗在DLBCL中的明确价值及近年国外部分研究发现通过不少于4周期的R-CHOP方案联合放疗,能提高患者的总生存率[3,7-8],2016年欧洲肿瘤内科学会(ESMO)建议对于PB-DLBCL患者行6周期R-CHOP方案化疗[9]。目前没有数据支持更强烈的化疗方案作为乳腺DLBCL的初始治疗。本文联合放疗组5年生存率与未放疗组差异无统计学意义(>0.05),与目前研究不符,可能与病例数少有关。国际结外淋巴瘤协作组研究发现化疗后行全乳放疗能提高患者生存时间[3]。ESMO亦建议化疗后联合全乳及受累淋巴结放疗(30~36 Gy)[9]。但仍有一些专家认为仅行受累部位放疗能够减少局部复发[10],最佳放疗野仍需进一步研究。
与结内DLBCL比较,PB-DLBCL更易侵犯中枢神经系统、肺、胃肠道等结外器官[9,11-12]。本组6例复发患者均为结外复发,复发患者预后差,中位生存期15个月。由于研究规模局限,中枢神经系统复发率较难估算,有研究报道复发率为5%~16%[9],目前建议对存在预后不良因素的患者行预防性鞘内化疗。
PB-DLBCL的预后与IPI指数、局部肿块直径大于4~5cm及双侧乳腺受累有关[13],本文结果与之相似。PB-DLBCL发病率低,目前在治疗上尚缺乏大型、随机、前瞻性的研究,有争议的问题仍然很多,本研究病例数少,未来仍需大量的循证医学证据进一步证实。
[1] Aviv A, Tadmor T, Polliack A. Primary diffuselarge B-cell lymphomaof the breast: lookingat pathogenesis,clinical issues and therapeuticoptions[J].AnnOncol,2013,24(9):2236,2244.
[2] Caon J, Wai ES, Hart J, et al. Treatmentand outcomes of primarybreastlymphoma[J].ClinBreastCancer,2012,12(6):412-419.
[3] Ryan G, Martinelli G, Kuper-Hommel M,et al. Primary diffuse largeB-cell lymphoma of the breast: prognostic factors and outcomesof astudy by the International ExtranodalLymphoma Study Group [J].Ann Oncol,2008,19(2):233-241.
[4] Wiseman C, Liao KT. Primary lymphomaof the breast[J].Cancer,1972,29(6):1705-1712.
[5] Mouna B, Saber B, Tijani EH, et al. Primarymalignant non-Hodgkin's lymphoma of thebreast: a study of seven cases and literaturereview [J].World J surg Oncol,2012,10(1):151-156.
[6] Hans CP, Weisenburger DD, Greiner TC,et al. Confirmation of the molecular classificationof diffuse large B-cell lymphomaby immunohistochemistry using a tissuemicroarray[J].Blood,2004,103(1):275-282.
[7] Yhim HY, Kang HJ, Cho YH, et al. Clinicaloutcomes and prognostic factors in patientswithbreastdiffuselargeBcelllymphoma;Consortium for Improving Survival of Lymphoma(CISL) study[J].BMC Cancer,2010,10:321.
[8] Hosein PJ, Maragulia JC, Salzberg MP, etal. A multicentre study of primary breastdiffuse large B-cell lymphoma inthe rituximabera[J].Br J Hematol,2014,164:358-363.
[9] Vitolo U, Seymour JF, Martelli M, et al. Extranodaldiffuse large B-cell lymphoma(DLBCL) and primary mediastinal B-cell lymphoma:ESMO clinical Practice Guidelines fordiagnosis, treatment and follow-up[J].Annalsof Oncology,2016,23(suppl 7):vii78-vii82.
[10] Yahalom J, Lllidge T, Specht L, et al. Modernradiation therapy for extranodal lymphomas:field and dose guidelines from InternationalRatiation Oncology Group[J].Int JRadiat Oncol Biol Phys,2015,92:11-31.
[11] Cheah CY, Wirth A, Seymour JF. Primarytesticular lymphoma[J]. Blood,2014,123:486-493.
[12] Seung PJ, Minkuk K, Kang MH, et al. Primarybreast lymphoma: a single institution'sexperience[J].J Korean Surg Soc, 2013,84(5): 267-272.
[13] Fukuhara S, Watanabe T, Munakata W, etal. Bulky disease has an impact on outcomesin primary diffuse large B-cell lymphomaof the breast: a retrospective analysis at asingle institution [J]. Eur J Haematol,2011,87:434-440.
10.3969/j.issn.1671-0800.2016.12.005
R733.4;R737.9
A
1671-0800(2016)12-1558-02
2016-09-15
(本文编辑:孙海儿)
315000宁波,宁波市鄞州人民医院
陆滢,Email:luying741107@qq.com

