例析热化学中焓变计算的常见题型
钟舜方●
福建省沙县第一中学(365050)
例析热化学中焓变计算的常见题型
钟舜方●
福建省沙县第一中学(365050)
焓变计算是近年来高考对热化学有关基础知识的重要考查题型之一,现把几种常见的考查题型例析如下.
一、利用能量变化图像求焓变
例1 氮气与氢气化学反应的能量变化图如图所示,写出N2(g)和H2(g)反应生成NH3(l)的热化学方程式____.
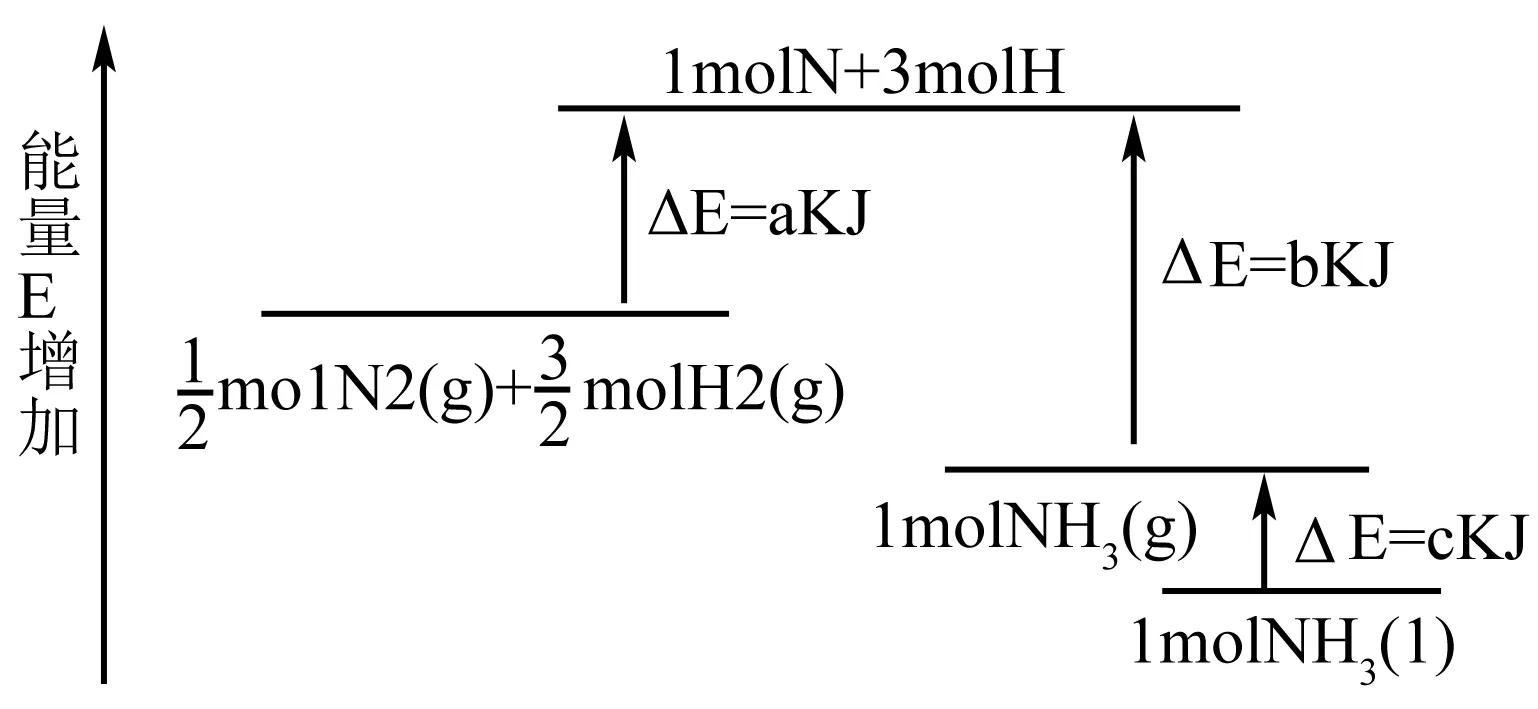
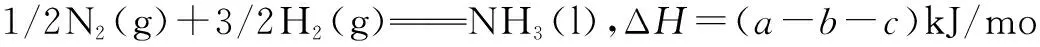
二、利用“直接法”求焓变
②甲醇制烯烃反应2CH3OH(g)=C2H4(g)+H2O(g),ΔH2=-29.1 kJ·mol-1
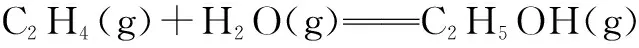
三、利用化学键键能求焓变
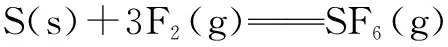
A. -1780 kJ/mol B. -1220 kJ/mol
C. -450 kJ/mol D. +430 kJ/mol
解析 由题意的1 mol S(s)和3 mol F2(g)形成S原子和F原子共需要吸收能量是280 kJ+3×160 kJ=760 kJ.而生成1 mol SF6(g)时需形成6 mol S-F键,共放出6×330 kJ=1980 kJ,因此该反应共放出的热量为1980 kJ-760 kJ=1220 kJ,所以该反应的反应热ΔH=-1220 kJ/mol,选项B正确.
四、利用燃烧热求焓变
例4 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH的燃烧热ΔH分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1,则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为____;
解析 燃烧热是在101 kPa时,1 mol物质完全燃烧生成稳定的氧化物时所放出的热量.由题可知,先写出燃烧热的热化学方程式如下:
ΔH=-283.0 kJ·mol-1
①
ΔH=-726.5 kJ·mol-1
②
五、利用中和热求焓变
例5 分别取100 mL 0.50 mol/L盐酸与100 mL 0.55 mol/L NaOH溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃).实验时,测得反应前盐酸与NaOH溶液的平均温度为21.5℃,反应后混合溶液的温度为24.9℃.则实验测得的中和热ΔH=____(保留1位小数).
解析 中和热是指在稀溶液中,强酸跟强碱发生中和反应生成1 mol液态H2O时的反应热.先根据Q=m·c·ΔT计算反应放出的热量,然后根据ΔH=Q/nkJ·mol-1计算出反应热.
n(H2O)=0.1 L×0.5 mol/L=0.05 mol,m(aq)=200 mL×1 g/ mL=200 g
ΔT=24.9℃-21.5℃=3.4℃,Q=m·c·ΔT=200 g×4.18 J/(g·℃)×3.4℃=2842.4 J=2.842 kJ,ΔH=Q/n=-2.842 kJ/0.05 mol= -56.8 kJ·mol-1.
六、利用多种能量综合求焓变

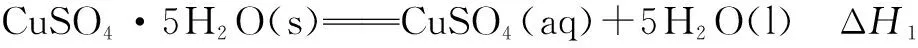
因此,通过以上几种常见题型的例析,考生对热化学中焓变的有关计算有更清楚地认识,更熟悉其中的解题方法和策略,从而做到事半功倍.
G632
B
1008-0333(2016)34-0081-01

