超声辅助双水相提取石榴皮多酚
张艳霞,朱彩平,邓红,张晓,李云,张扬,翟希川
(陕西师范大学 食品工程与营养科学学院,陕西 西安,710119)
超声辅助双水相提取石榴皮多酚
张艳霞,朱彩平*,邓红,张晓,李云,张扬,翟希川
(陕西师范大学 食品工程与营养科学学院,陕西 西安,710119)
采用超声辅助双水相法提取石榴皮多酚,在单因素试验的基础上,选取超声时间、超声温度、(NH4)2SO4用量和液料比为自变量,石榴皮多酚得率为响应值,通过Box-Behnken试验设计及响应面分析法,研究各单因素及其交互作用对多酚得率的影响,优化石榴皮多酚的提取工艺条件。研究结果表明:最佳的提取工艺参数为,超声时间32 min、超声温度40 ℃、(NH4)2SO4用量0.36 g/mL、液料比为37∶1(mL∶g),在此条件下提取,多酚的得率为(10.63±0.28)%(n=3),与模型的预测值10.708 6%有较好的拟合性,表明超声辅助双水相提取石榴皮多酚的方法可行。
石榴皮;多酚;超声辅助双水相;响应面分析
石榴,又名安石榴,是传统的药食同源食品,其药用和食用价值的发掘日益受到全球相关领域的重视[1]。据记载,石榴皮作为我国传统的中药材,具有涩肠止泻、止血、驱虫的功效,可以用于治疗久泻、久痢、便血、脱肛、崩漏、带下、虫积腹痛等疾病[2]。随着中国果汁加工产业的快速发展,每年会产生大量的石榴皮副产物,其中除去一小部分用作中药材之外,剩余的或作为牛的饲料,或直接被废弃[3]。
石榴皮中含有大量的多酚类物质,是其发挥药理作用的主要活性成分,目前对石榴皮多酚提取的方法有多种[4]。近几年,随着“绿色化学”概念的提出,环境友好型的提取工艺备受青睐[5]。超声辅助提取是目前应用最广泛的一种提取技术,不仅可以提高产品的得率,缩短提取时间,还可以减少化学与物理危害[6];双水相提取是根据被分离物质在上下相中的分配系数不同,从而实现分离的一种方法[7],近年来,醇-盐双水相体系已经被广泛用于提取和分离草本植物中的天然小分子物质[8-9],其优点为形成双水相的溶剂成本低,而且有利于醇类的回收和目标物的分离[10]。在本研究中,选择室温溶解度高、温度效应低的(NH4)2SO4为盐析相,依据其水化作用与乙醇形成稳定的双水相体系,并首次将超声辅助与双水相2种方法相结合进行石榴皮多酚的提取,并采用响应面分析法进行工艺参数的优化。
1 材料与方法
1.1 材料、试剂和仪器
石榴:产自临潼,净皮甜品种,购于西安水果市场,要求新鲜无斑,除去病果和裂果,洗净,进行手工剥皮;石榴皮经自然干燥,粉碎过40~60目筛,避光保存,备用。
试剂:无水乙醇,(NH4)2SO4,福林酚试剂,无水Na2CO3,以上均为分析纯;没食子酸(标品)。
仪器:高速万能粉碎机,BS 224 S电子分析天平,北京赛多利斯仪器系统有限公司;KQ5200DE数控超声清洗器,昆山市超声仪器有限公司;RE-52AA旋转蒸发器,上海亚荣生化仪器厂;SHB-Ⅲ循环水多用真空泵,郑州长城科工贸有限公司;Multiskan Go全波长酶标仪,美国热电公司。
1.2 实验方法
1.2.1 乙醇-硫酸铵双水相体系的建立与石榴皮多酚提取
称取1.00 g的石榴皮粉末于100 mL锥形瓶中,分别加入25 mL体积分数为30%~70%的乙醇溶液,然后分别加入用量为0.2~0.5 g/mL (NH4)2SO4(每毫升水加入硫酸铵的质量),摇匀静置30 min,在超声温度60 ℃、功率150 W条件下提取30 min,抽滤,将溶液移入分液漏斗中静置分层,研究发现,当乙醇体积分数为40%时能较好地形成双水相体系,(NH4)2SO4量在0.325~0.45 g/mL内形成的双水相体系较稳定,因此,本试验将固定乙醇的体积分数在40%进行后续研究。取上层溶液1 mL于100 mL的容量瓶中,用蒸馏水定容至刻度,即石榴皮粗多酚稀释溶液,备用。
1.2.2 没食子酸标准溶液的配制
准确称取0.100 0 g没食子酸标准品,用蒸馏水溶解,定容至100 mL,摇匀,制备成1 000 mg/L的没食子酸标准溶液。用移液枪分别移取0、0.5、1.0、1.5、2.0、2.5、3.0 mL标准液于50 mL容量瓶中,加蒸馏水定容,得到浓度分别为0、10、20、30、40、50、60 mg/L的没食子酸标准溶液。
1.2.3 最佳测定波长的确定
分别吸取上述浓度为20 mg/L的没食子酸标准溶液和石榴皮粗多酚稀释溶液1 mL于10 mL离心管中,分别加入蒸馏水5 mL,Folin-Ciocalteu试剂(加水稀释10倍)1 mL,摇匀,再加入7.5% Na2CO3溶液3 mL,充分混合后在室温下避光静置2 h,用酶标仪分别对没食子酸及石榴皮多酚反应液在波长400~900 nm内进行光谱扫描,最终得出在750 nm处有最大吸收峰,如图1所示。
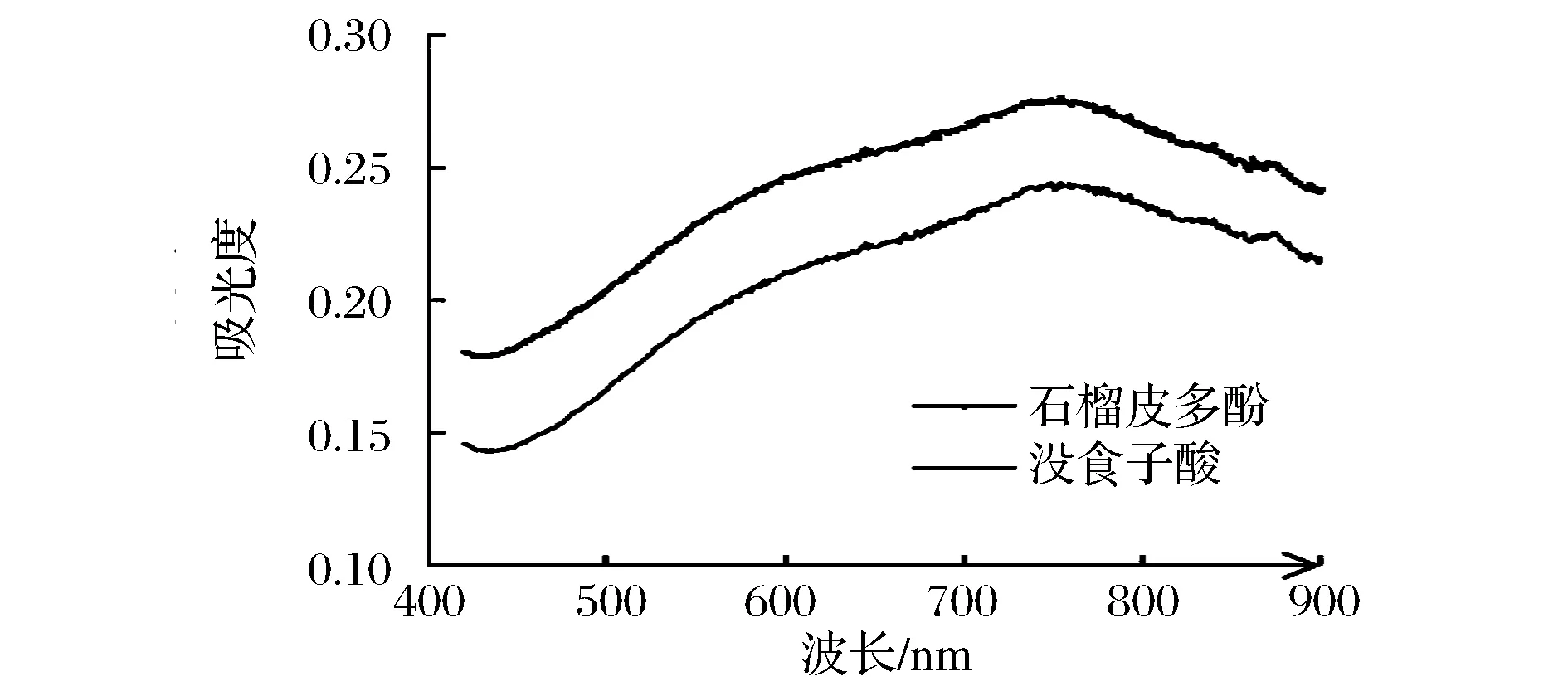
图1 没食子酸反应液与石榴皮多酚反应液光谱扫描Fig.1 Scanning spectra of pyrogallic acid and pomegranate peel polyphenols
1.2.4 标准曲线的绘制
分别取不同浓度的没食子酸溶液1 mL于10 mL的离心管中,按上述1.2.3方法操作,在750 nm处测其吸光值,重复3次,取平均值。以没食子酸标准溶液质量浓度为横坐标,吸光度为纵坐标绘制标准曲线,得回归方程:y=0.004 4x+0.007 0,R2=0.996 0,式中:y,吸光度;x,没食子酸标准溶液质量浓度(mg/L)。
1.2.5 石榴皮多酚含量的测定
称取2.00 g石榴皮粉末于100 mL锥形瓶中,加入硫酸铵试剂,再按一定的液料比加入一定体积的双水相溶液,在超声辅助提取。抽滤,静置分层,记录上层溶液体积,按1.2.4操作,得出吸光值,根据回归方程得出多酚的质量浓度,由公式(1)计算多酚得率:
(1)
式中:c,由回归方程中算得的多酚质量浓度,mg/L;V,乙醇层提取液总体积mL;n,稀释倍数,100;m,称取石榴皮粉末质量,g。
1.2.6 试验因素的确定
影响超声辅助双水相提取石榴皮多酚的因素很多,如超声时间、(NH4)2SO4用量、超声温度及液料比等。因此本试验固定石榴皮粉末2.00g,选择双水相体系中乙醇的体积分数为40%,超声功率150W。通过改变超声时间(10、20、30、40、50、60min),超声温度(20、30、40、50、60、70 ℃),(NH4)2SO4用量(0.30、0.325、0.35、0.375、0.40、0.425g/mL)和液料比[20、25、30、35、40、45)∶1(mL∶g)]来研究各单因素对多酚得率的影响。
1.2.7 响应面试验
在单因素的基础上,综合考虑各单因素对石榴皮多酚得率的影响,根据Box-Behnken试验设计原理,选择超声时间、超声温度、硫酸铵用量、液料比进行4因素3水平的响应面分析,来确定石榴皮多酚最佳提取条件,因素水平表见表1。
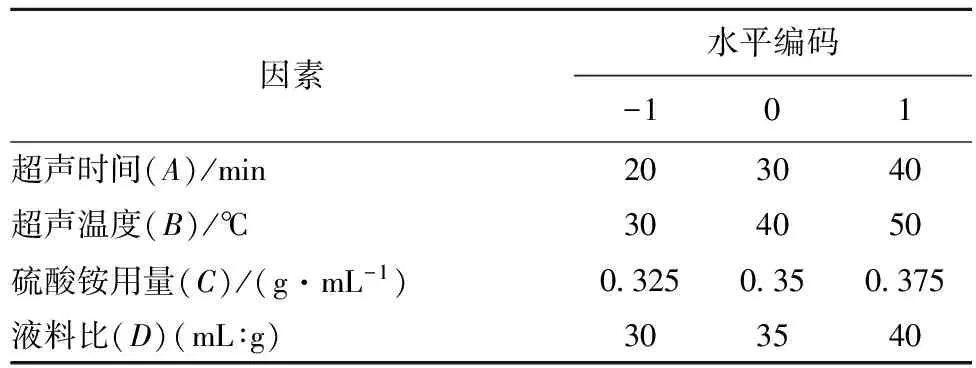
表1 Box-Behnken设计试验因素水平及编码
2 结果与讨论
2.1 单因素试验结果
2.1.1 超声时间对多酚得率的影响
由图2可看出,在超声时间低于30 min时,石榴皮多酚得率随着时间的延长而迅速增大。这是因为随着时间的延长,可以使多酚充分的溶解到乙醇中,当到达30 min时得率达到最大,说明已完全溶解,再延长超声时间,多酚得率反而下降,可能是由于多酚的不稳定,在氧气和光照条件下发生氧化、聚合等反应才导致得率的下降,因此,超声提取的时间不宜过长。
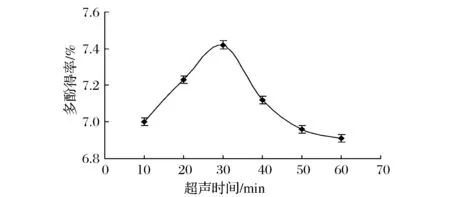
图2 超声时间对多酚得率的影响Fig.2 The effect of ultrasonic time on the yield of polyphenols
2.1.2 超声温度对多酚得率的影响
图3显示,随着温度的增加多酚得率增大,当温度升高到40 ℃时,石榴皮多酚得率最高,但继续升高温度多酚得率迅速下降。因为温度升高,分子内能增大,分子运动加快,有利于分子渗透进入细胞内破坏疏水键,同时,也有利于被提取物向溶液中扩散,多酚得率增大,但随着温度升高使能量消耗增大、成本增加,同时较高的温度使多酚的化学结构遭到破坏,此外在高温条件下也会导致乙醇挥发,使液料比改变,从而影响多酚的得率[11-12],并且当温度高于40 ℃,双水相体系稳定性变差,导致多酚物质的氧化加快,因此,多酚得率下降。
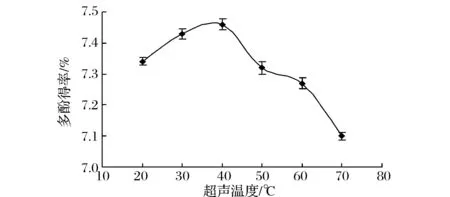
图3 超声温度对多酚得率的影响Fig.3 The effect of ultrasonic temperature on the yield of polyphenols
2.1.3 (NH4)2SO4用量对多酚得率的影响
从图4可看出,当(NH4)2SO4用量较小时,多酚得率随着(NH4)2SO4用量的增大迅速上升,当用量为0.35 g/mL时,多酚得率最高,再增大浓度得率反而下降。因为随着(NH4)2SO4用量的增加,(NH4)2SO4对水的束缚能力增强,乙醇从(NH4)2SO4水相中游离出来,而水分子也离开乙醇相。其结果是上相中乙醇的相对体积分数增加,下相中乙醇的相对体积分数则减少。因此,(NH4)2SO4用量的改变可影响到上相的极性,最终影响到多酚在其中的分配[13]。
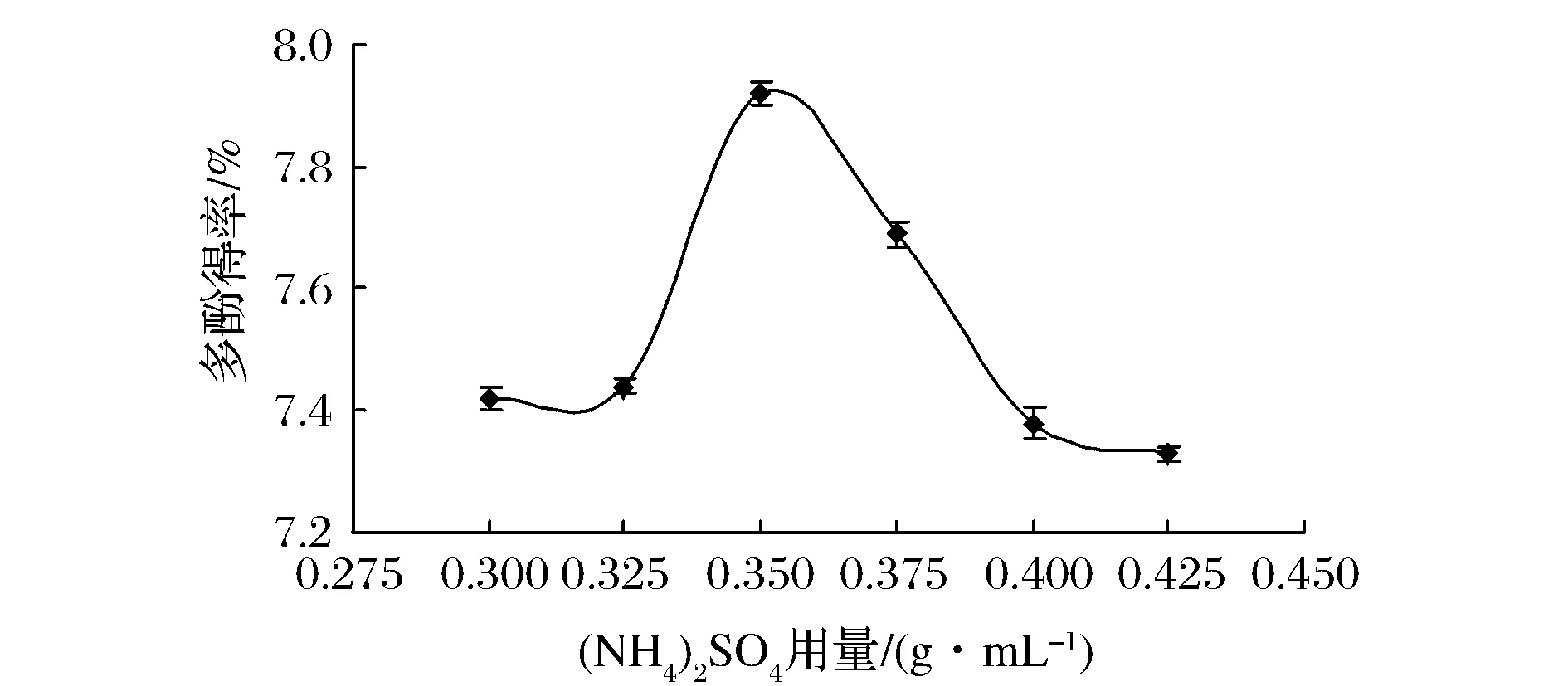
图4 硫酸铵用量对多酚得率的影响Fig.4 The effect of ammonium sulfate dosage on the yield of polyphenols
2.1.4 液料比对多酚得率的影响
由图5可知,在液料比较小时,石榴皮多酚得率随着液料比的增大而迅速增大,当液料比大于35∶1(mL∶g)时,多酚得率增加速度明显降低。主要原因可能是,溶剂用量越多,传质动力越大,扩散到溶剂里的多酚类化合物就越多[14]。但是在固液两相之间,除了扩散溶解平衡外,还存在吸附平衡,低温有利于吸附。由于液料比的增大,在产生相同热量的条件下,提取液温度下降,吸附作用增强导致得率下降[15]。
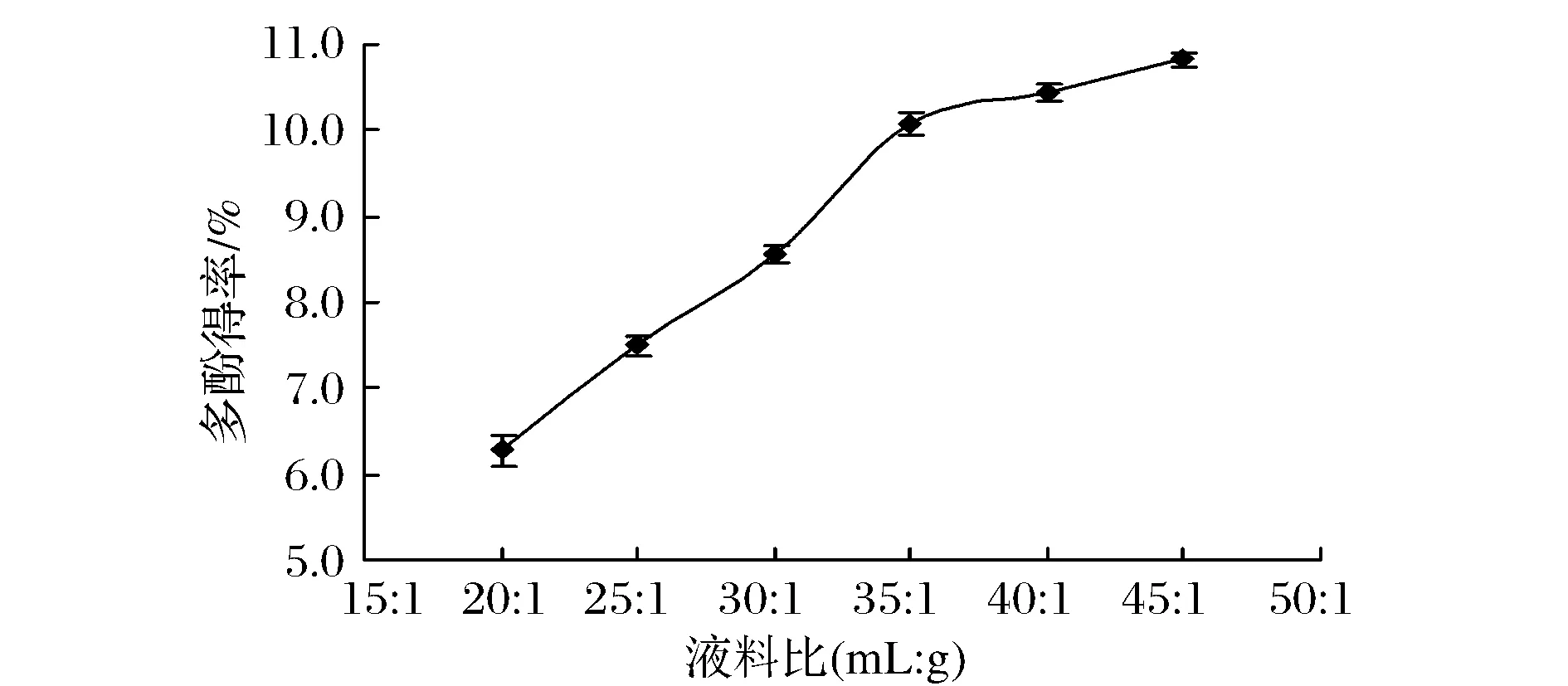
图5 液料比对多酚得率的影响Fig.5 The effect of solid-liquid ratio on the yield ofpolyphenols
2.2 响应面试验结果与分析
2.2.1 试验结果
响应面结果见表2。
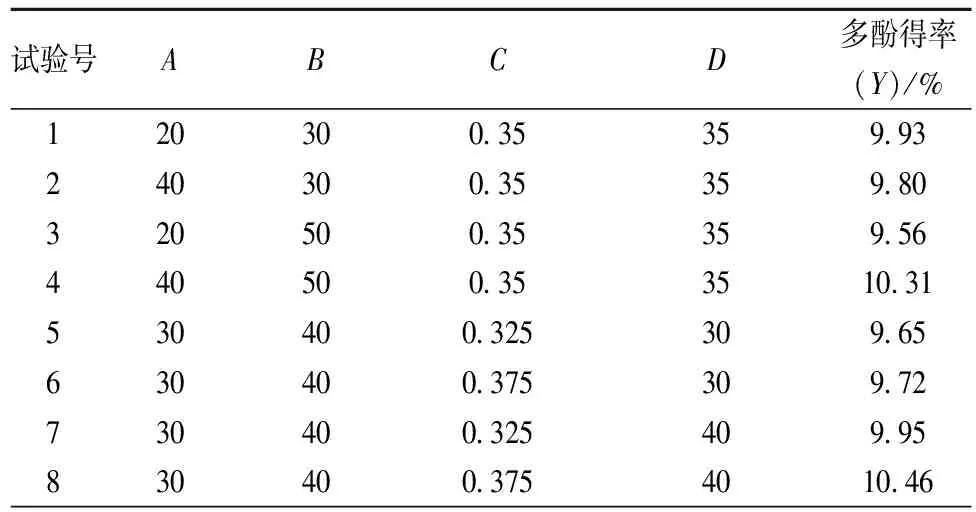
表2 响应面试验结果
续表2
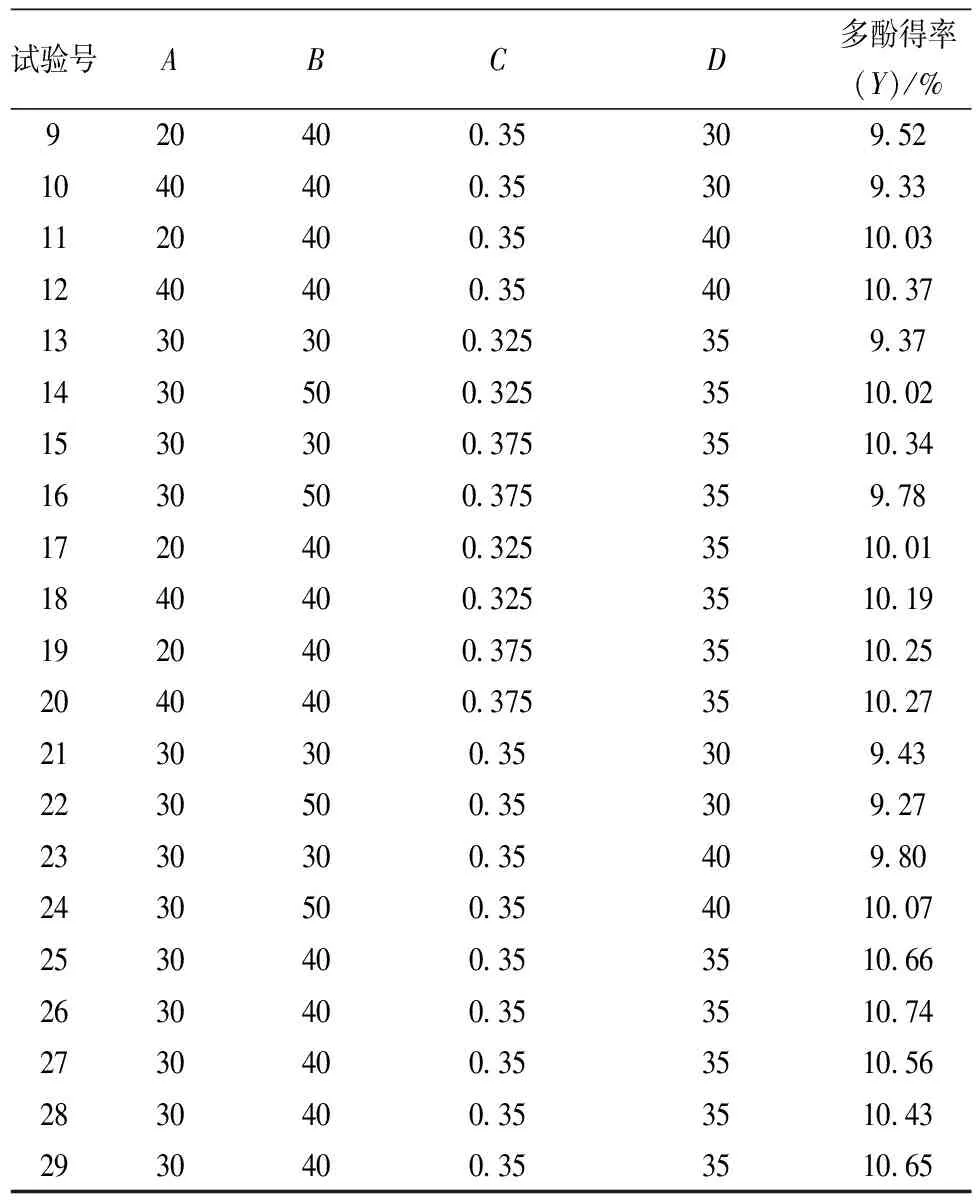
试验号ABCD多酚得率(Y)/%920400353095210404003530933112040035401003124040035401037133030032535937143050032535100215303003753510341630500375359781720400325351001184040032535101919204003753510252040400375351027213030035309432230500353092723303003540980243050035401007253040035351066263040035351074273040035351056283040035351043293040035351065
注:表2中多酚得率数据为3 次重复试验的平均值。
如表2所示,共29个试验点,其中24个为析因点,5个为零点,析因点为自变量取值在A、B、C、D所构成的三维顶点;零点为区域的中心点,其中零点试验重复5次,用以估算试验误差。
2.2.2 模型的建立及其显著性检验
将表2所得的试验数据采用Design-Expert 8.0软件进行多元回归分析,得到石榴皮多酚得率(Y)对超声时间(A)、超声温度(B)、(NH4)2SO4用量(C)和液料比(D)的二次多项回归模型如下:
Y=10.61+0.081A+0.028B+0.14C+0.31D+0.22AB-0.040AC+0.13AD-0.30BC+0.11BD+0.11CD-0.25A2-0.49B2-0.20C2-0.50D2
(2)
对回归模型进行方差分析,得到结果如表3。
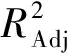
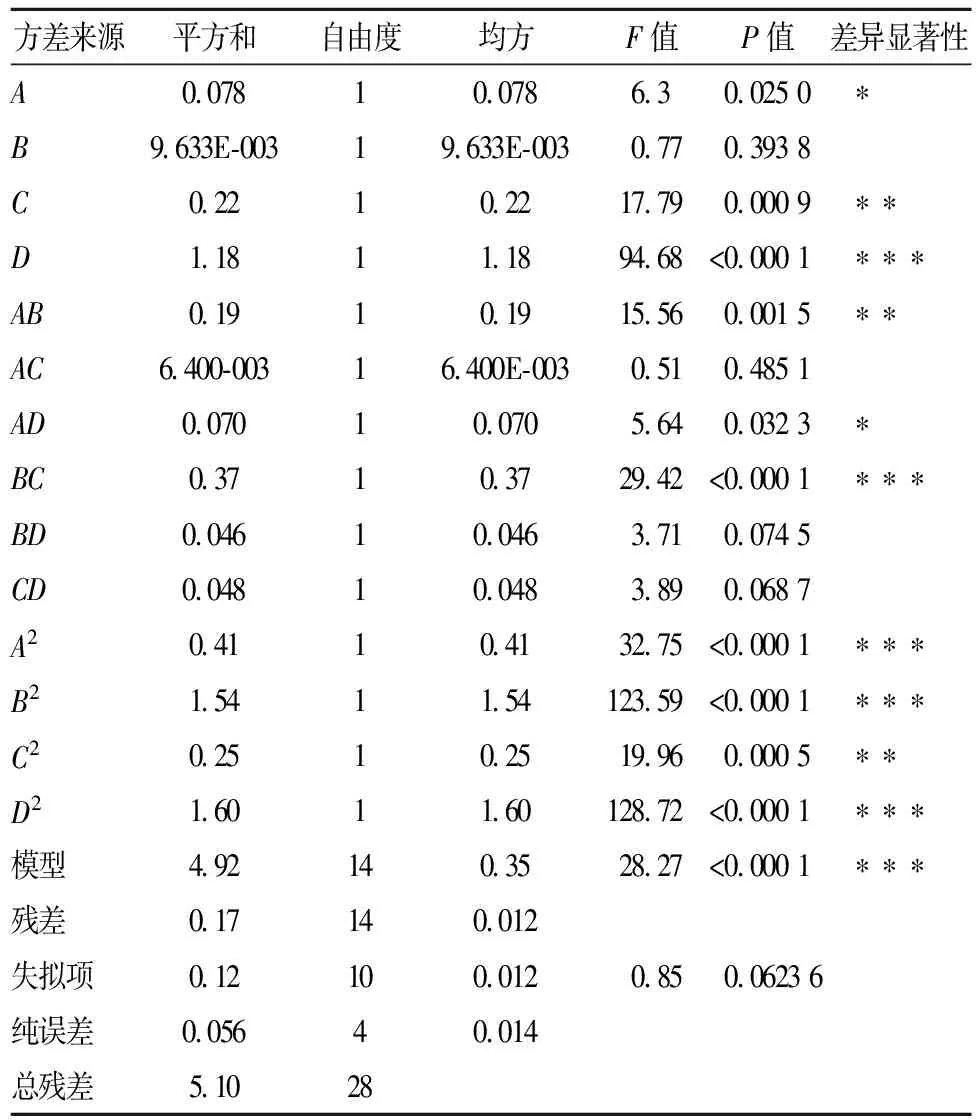
表3 响应面试验方差分析
注:*为差异显著(P<0.05),**为差异高度显著(P<0.01),***为差异极度显著(P<0.000 1)。
2.2.3 石榴皮多酚提取工艺的响应面分析
对响应面方差分析结果做响应曲面及等值线图(图6~图11),响应曲面图是任意2个变量在零水平时,其余2个变量对多酚得率交互作用的影响。可以看出,任意2个单因素之间都存在交互作用,最佳落点均在试验考察的区域内。等值线图越圆,说明对多酚得率的影响越小,等值线图越扁平,表示因素间的相互影响越大。
图6为(NH4)2SO4用量0.35 g/mL,液料比35∶1(mL∶g)时,超声时间与超声温度交互作用对石榴皮多酚得率影响的响应面图和等值线图。由图6可看出,当超声时间一定时,随着超声温度的增加,多酚得率呈现先增大后减小的趋势,而当超声温度一定时,随着超声时间的增大,多酚得率也呈现先增大后减小的趋势,但是变化幅度较超声温度小,因此,等值线呈现椭圆形状,超声时间与超声温度交互作用对多酚得率影响高度显著。
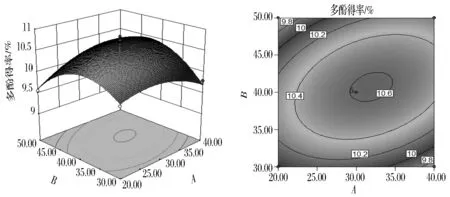
图6 超声时间与超声温度交互影响多酚得率的响应面图与等值线图Fig.6 Response surface and contour plots for the effects of ultrasonic time and ultrasonic temperature on the yield of polyphenols
图7为超声温度40 ℃、液料比35∶1(mL∶g)时,超声时间与(NH4)2SO4用量交互作用对石榴皮多酚得率影响的响应面图与等值线图。由图7可知,当超声时间一定时,多酚得率随着硫酸铵用量的增加呈现先增大后减小的趋势;当(NH4)2SO4用量一定时,随着超声时间的增大,石榴皮多酚的得率呈现先上升后下降的趋势,但变化不显著;由表3可知,超声时间与硫酸铵用量交互作用对石榴皮多酚得率影响不显著。在超声时间为30~35 min,(NH4)2SO4用量0.35~0.36 g/mL时,响应值最大。
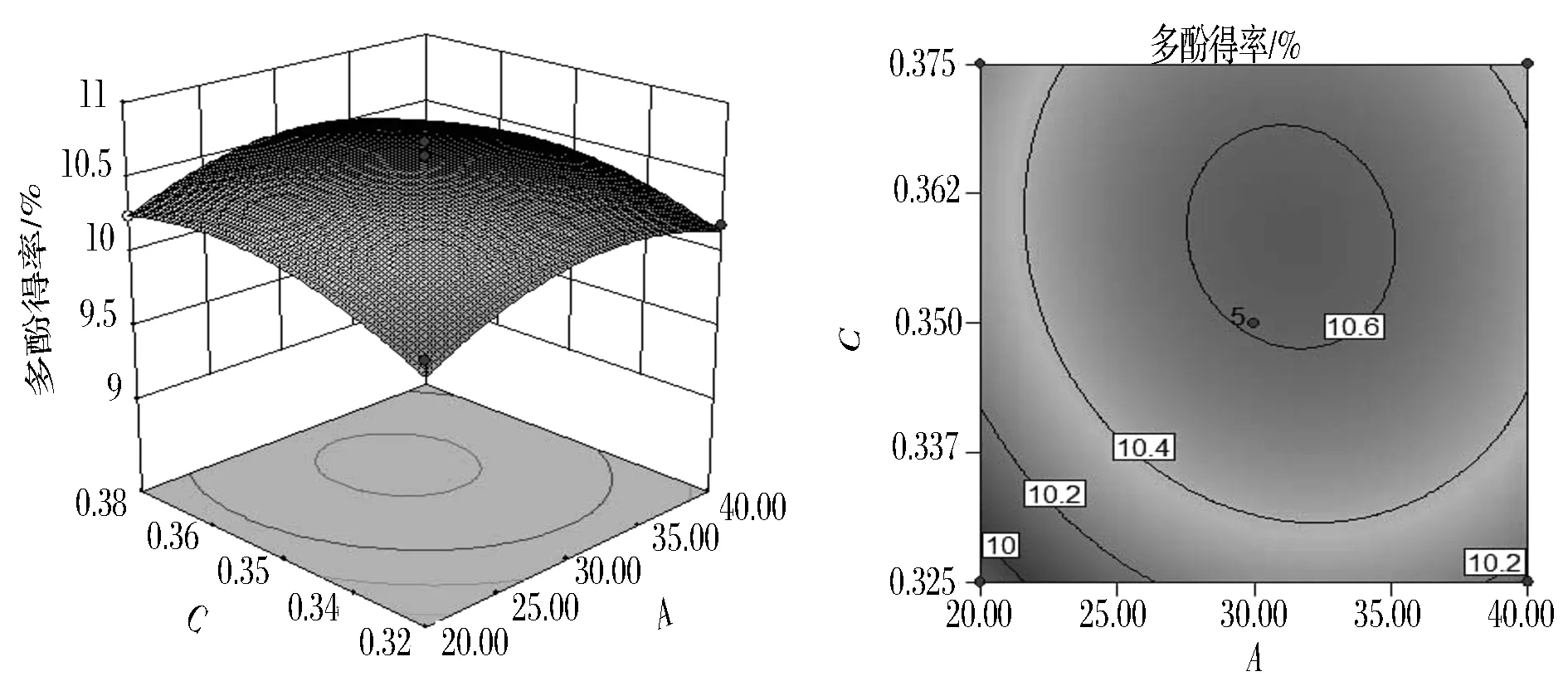
图7 超声时间与(NH4)2SO4用量交互影响多酚得率的响应面图与等值线图Fig.7 Response surface and contour plots for the effects of ultrasonic time and ammonium sulfate dosage on the yield of polyphenols
图8为超声温度40 ℃,(NH4)2SO4用量0.35 g/mL时,超声时间与液料比交互作用对石榴皮多酚得率影响的响应面图与等值线图。由图8可看出,当超声时间一定时,随着液料比的增加,多酚得率呈现先增加后降低的趋势,变化较明显;当液料比一定时,多酚得率随着超声时间的增加先增大后减小,变化幅度较小;当超声时间在30~35 min时,液料比为(35~38)∶1(mL∶g)时,响应值最高,即多酚得率最高。
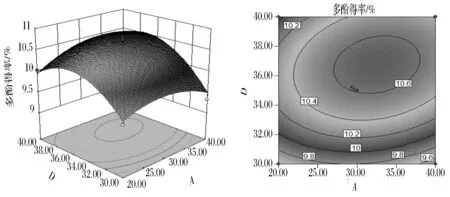
图8 超声时间与液料比交互影响多酚得率的响应面图与等值线图Fig.8 Response surface and contour plots for the effects of ultrasonic time and material/liquid ratio on the yield of polyphenols
图9为超声时间30 min,液料比35∶1(mL∶g)时,超声温度与(NH4)2SO4用量交互作用对石榴皮多酚得率影响的响应面图与等值线图。从图9中可看出,当超声温度一定时,多酚得率随着(NH4)2SO4用量的增加而呈线性增大,最终趋于平稳,而当(NH4)2SO4用量一定时,随着超声温度的增加多酚得率呈现先迅速增加后缓慢降低,当(NH4)2SO4用量处于较低水平时,超声温度的响应抛物曲线的最高点也处于较低水平,而随着(NH4)2SO4用量的增大,超声温度的响应抛物曲线最高点也向高水平移动,等值线呈椭圆形;同时由表3可知,超声温度与(NH4)2SO4用量交互作用对多酚得率影响极显著;响应值在超声温度为40 ℃左右,(NH4)2SO4用量为0.36 g/mL左右,响应值最高。
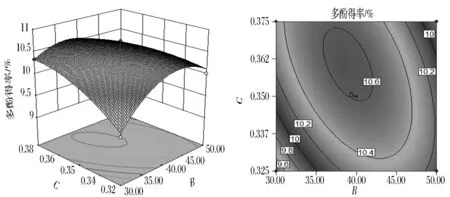
图9 超声温度与(NH4)2SO4用量交互影响多酚得率的响应面图与等值线图Fig.9 Response surface and contour plots for the effects of ultrasonic temperature and ammonium sulfate dosage on the yield of polyphenols
图10为超声时间30 min,(NH4)2SO4用量0.35 g/mL时,超声温度与液料比交互作用对多酚得率影响的响应面图与等值线图。由图10可知,当超声温度一定时,液料比处于低水平时,多酚得率呈现线性增加,当液料比一定时,随着超声温度的增加,多酚得率呈现先增后降的趋势,但变化不明显,且变化幅度稍低于液料比;由表3可知,超声温度与液料比交互作用对多酚得率影响不显著。超声温度为40 ℃左右,液料比为(36~38)∶1(mL∶g)时,多酚得率最大。
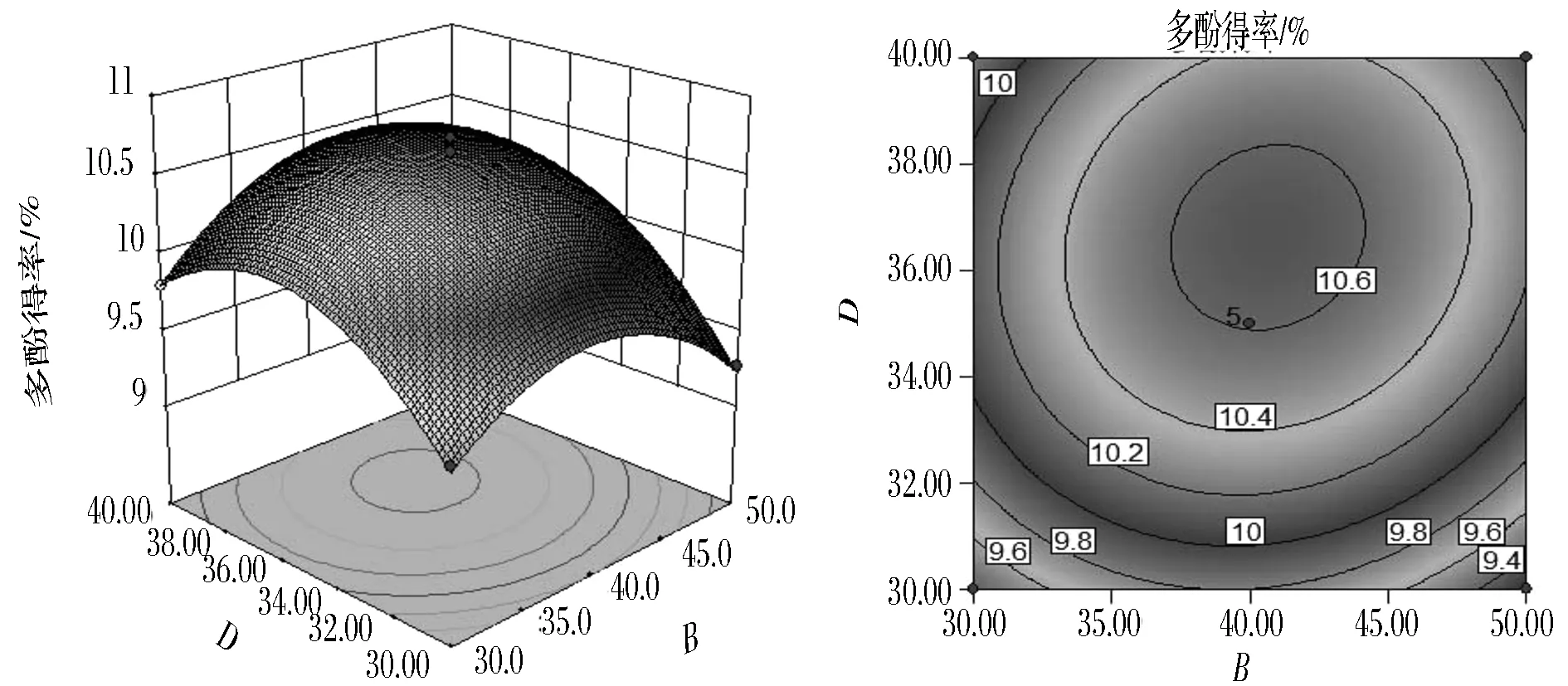
图10 超声温度与液料比交互影响多酚得率的响应面图与等值线图Fig.10 Response surface and contour plots for the effects of ultrasonic temperature and material/liquid ratio on the yield of polyphenols
图11为超声时间30 min,超声温度40 ℃时,(NH4)2SO4用量与液料比交互作用对多酚得率影响的响应面图与等值线图。从图11可知,当(NH4)2SO4用量一定时,随着液料比的增加,多酚得率先呈线性增加后缓慢降低。由表3可知,(NH4)2SO4用量与液料比交互作用对多酚得率的影响不显著;响应值在(NH4)2SO4用量为0.36 g/mL左右,液料比为37∶1(mL∶g)左右,响应值最大。
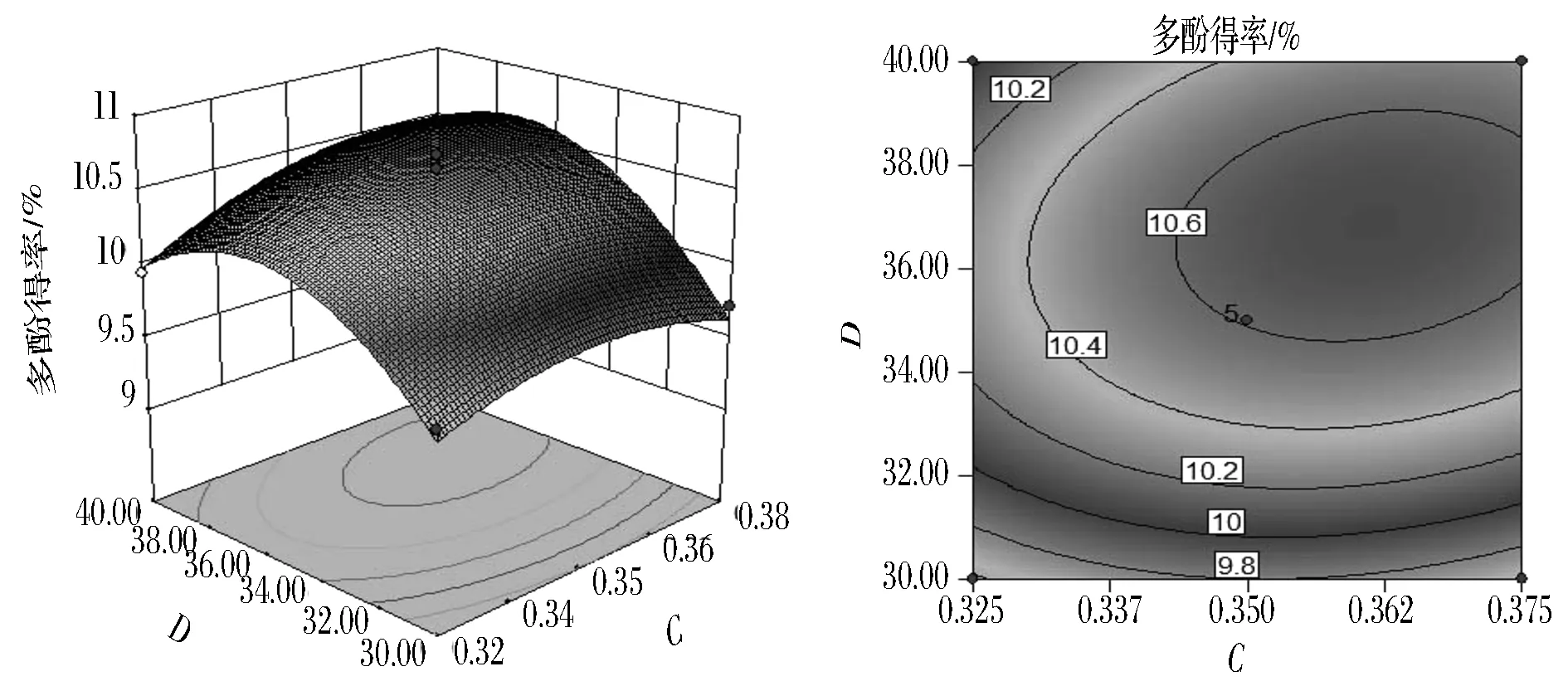
图11 (NH4)2SO4用量与液料比交互影响多酚得率的响应面图与等值线图Fig.11 Response surface and contour plots for the effects of ammonium sulfate dosage and material/liquid ratio on the yield of polyphenols
2.3 工艺优化及验证实验
根据所建立的模型进行参数最优化分析,得到石榴皮多酚得率最高的工艺参数为:超声时间32.22 min,超声温度39.83 ℃,(NH4)2SO4用量0.36 g/mL,液料比36.97∶1(mL∶g),在此条件下,石榴皮多酚得率的预测值为10.708 6%,为方便试验操作,将工艺参数修正为:超声时间32 min,超声温度40 ℃,(NH4)2SO4用量0.36 g/mL,液料比37∶1(mL∶g),此时,多酚的得率为(10.63±0.28)%(n=3),与模型预测值误差0.73%。
3 结论
本文选取超声辅助双水相法提取石榴皮多酚,通过试验确定了形成稳定双水相的乙醇体积分数为40%,以石榴皮多酚得率为考察指标,在单因素试验的基础上,通过响应面法对超声辅助双水相提取石榴皮多酚的工艺进行优化,得出最佳工艺参数为:超声时间32 min、超声温度为40 ℃、(NH4)2SO4用量为0.36 g/mL(每毫升水(NH4)2SO4用量为0.36 g)、液料比37∶1(mL∶g),在此条件下,石榴皮多酚得率为(10.63±0.28)%(n=3),与模型预测值误差0.73%,说明该模型是可靠的,能较好地预测石榴皮多酚的实际得率。
[1] 畅静,田莉.石榴多酚的提取工艺和检测方法研究进展[J].中国中医药信息杂志,2014,12(21):133-136.
[2] 国家药典委员会.中华人民共和国药典(2010年版)[S].北京:中国医药科技出版社,2010:87.
[3] ZHU Cai-ping,ZHAI Xi-chuan,LI Lin-qiang,et al.Response surface optimization of ultrasound-assisted polysaccharides extraction from pomegranate peel[J].Food Chemistry,2015,177:139-146.
[4] 朱彩平,张艳霞,张晓,等.石榴皮多酚提取方法研究进展[J].食品与发酵工业,2015,41(11):243-248 .
[5] TABARAKI R,NATEGHIA.Optimization of ultrasonic-assisted extraction of natural antioxidants from rice bran using response surface methodology[J].Ultrasonics Sonochemistry,2011,18:1 279-1 286.
[6] CHEMATF,HUMA Zill,KHAN M K.Applications of ultrasound in food technology: Processing, preservation and extraction[J]. Ultrasonics Sonochemistry,2011,18(4):813-835.
[7] KWON Y J,KAUL R,MATTIASSONB.Extractive lactic fermentation in poly(ethleneimice)-based aqueous-phase system[J]. Biotechnology and Bioengineering,1996,50:280-290.
[8] ZHI Wen-bo,DENG Qiu-yun.Purification of salvianolic acid B from the crude extract of Salvia miltiorrhiza with hydrophilic organic/salt-containing aqueous twophase system by counter-current chromatography[J].Journal of Chromatography,2006,16(11): 149-152.
[9] SHEN S F,CHANG Z D,LIU J,et al.Separation of glycyrrhizic acid and liquiritin fromGlycyrrhizauralensisFisch extract by three-liquid phase extraction systems[J].Separation and Purification Technology,2007,53:216-223.
[10] GUO Y X,HAN J,ZHANG D Y,et al.Aqueous two-phase system coupled with ultrasound for the extraction of lignans from seeds ofSchisandrachinensis(turcz.) Baill[J].Ultrasonics Sonochemistry,2013,20(1):125-132.
[11] 令博,王捷,吴洪斌.葡萄皮渣多酚超声波辅助提取工艺响应面法优化及抗氧化活性研究[J].食品科学,2011,32(18):24-29.
[12] PRASAD K N,YANG E,YI C, et al.Effects of high pressure extraction on the extraction yield,total phenolic content and antioxidant activity of longan fruit pericarp[J].Innovative Food Science and Emerging Technologies,2009,10:155-159.
[13] 周安存,喻祖文,冯务群,等.乙醇-硫酸铵双水相体系与微波集成提取石榴皮多酚的实验研究[J].光明中医,2011,26 (4):689-692.
[14] BENDAHOU A,DUFRESNE A,KADDAMIH,et al.Isolation and structural characterization of hemicelluloses from palm of Phoenix dactylifera L.[J].Carbohydrate Polymers,2007,68(3):601-608.
[15] 冯年平,郁威.中药提取分离技术原理与应用[M].北京:中国医药科技出版社,2005.
Optimization of ultrasound assisted aqueous two-phase extraction of polyphenols from pomegranate peel by response surface methodology
ZHANG Yan-xia, ZHU Cai-ping*, DENG Hong, ZHANG Xiao, LI Yun, ZHANG Yang, ZHAI Xi-chuan
(College of Food Engineering and Nutritional Science, Shaanxi Normal University, Xi’an 710119, China)
The method of ultrasonic assisted aqueous two-phase system was used to extract polyphenols from pomegranate peel. On the basis of single-factor experiment, the best extraction technology was optimized by selecting ultrasonic time, ultrasonic temperature, ammonium sulfate dosage and liquid/material ratio as independent variables, and the yield of pomegranate peel polyphenols as the response value. Box-Behnken design and response surface analysis method were applied to evaluate the effects of each single-factor and its interaction on the polyphenols yield. The results showed that the best extraction conditions were ultrasonic time 32 min, ultrasonic temperature 40 ℃, the dosage of ammonium sulfate 0.36 g/mL (ammonium sulfate dosage 0.36 g per milliliters of water), liquid/material ratio 37(mL/g). Under these conditions, the polyphenol yield was (10.63±0.28)%(n=3), which fitted well to the predicted value of 10.708 6%. So the technology of ultrasonic assisted aqueous two-phase extract polyphenols from pomegranate peel is feasible.
pomegranate peel; polyphenols; ultrasonic assisted aqueous two-phase system; response surface analysis
10.13995/j.cnki.11-1802/ts.201612027
硕士研究生(朱彩平副教授为通讯作者,E-mail:zcaiping@snnu.edu.cn)。
国家自然科学基金项目(31301598);陕西省自然科学基金项目(2012JQ3014);中央高校基本科研业务费专项资金项目(GK201402042);国家留学基金项目(201406875010)
2016-04-21,改回日期:2016-05-17

